miR-495通过抑制RNF113A的表达调控食管鳞癌细胞恶性表型
2023-06-08于海叶
付 静,刘 清,于海叶,王 磊
(新疆医科大学第一附属医院消化内科,新疆乌鲁木齐 830011)
中国是食管癌发病率最高的国家,食管癌患者的5年总生存率通常低于20%,晚期食管癌患者的5年总生存率低于10%[1-2],预后较差。环境和遗传因素均可导致食管癌的发生。有特殊饮食和生活方式的人,如经常食用腌制食品、热食品,长期饮酒和大量吸烟,更容易患食管癌[3-4];携带某些突变基因的人对肿瘤的易感性更高[5-6]。外科手术是食管癌的常用治疗方法,但治疗效果欠佳[7],因此,寻求早期食管癌特异性的诊断和治疗靶点具有重要意义[8-9]。
微小RNA(miRNA,miR)是一种能与靶基因mRNA的3′-非翻译区(3′-untranslated region,3′-UTR)结合的内源性单链小分子RNA,长度约为22 nt 且不编码蛋白质,其通过在转录后水平降解mRNA 或抑制翻译来调节基因的表达[10]。miRNAs影响癌细胞的生物学行为,包括增殖、迁移、侵袭、细胞周期和凋亡,并在肿瘤的发生和发展中发挥作用[11-13]。miR-495作为较常见的miRNA,在多种肿瘤中异常表达,在食管癌中miR-495 表达下调,发挥抑癌基因的作用。目前,miR-495与其靶基因RNF113A在食管癌中的作用及调控机制尚不清楚。因此,本文将miR-495转染入人食管鳞癌细胞Eca109,探讨miR-495对食管鳞癌细胞恶性表型的影响及其分子机制。
1 材料与方法
1.1 细胞系及试剂
人食管鳞癌细胞系Eca109购自武汉大学细胞典藏中心,DMEM(高糖)培养基、胰酶、青霉素-链霉素双抗购于Gibco 公司,胎牛血清(FBS)购于Excell Bio公司,CCK-8 细胞增殖/毒性检测试剂盒和BCA 蛋白定量试剂盒购于全式金生物公司,miRNA 荧光定量PCR 试剂盒和蛋白预染Marker 购于上海生工公司,Lipofectamin RNAiMAX 购于Thermo Fisher 公司,TRIzolTMReagent 购于Ambion 公司,Transwell 小室购于Corning 公司,RIPA 裂解液和蛋白酶抑制剂购于博士德公司,β-actin Loading Control Antibody购于义翘神州,Anti-RNF113A购于Abcam公司。miR-495模拟物(miR-495 mimics) 和miR-49 抑制剂(miR-495 inhibitor)购于通用生物公司。
1.2 细胞分组处理
Eca109 采用DMEM 培养基添加10%胎牛血清和1%青-链霉素双抗溶液置于37 ℃、饱和湿度、CO2体积分数为5%的培养箱中培养,待细胞汇合率达70%时使用Lipofectamin RNAiMAX试剂进行转染。细胞分为模拟物对照组(mimics NC)、miR-495 模拟物组、抑制剂对照组、miR-495 抑制剂组,具体操作按照试剂说明书进行。
1.3 实时荧光定量PCR 检测细胞中miR-495 的表达水平
提取各组细胞中总RNA,将RNA 逆转录为cDNA,根据实时荧光定量PCR(quantitative real-time PCR,qPCR)试剂盒说明书的操作步骤进行扩增检测miRNA 的表达,miR-495 以U6 为内参,采用2-ΔΔCT法计算miR-495的相对表达量。
1.4 CCK-8试剂盒检测细胞增殖
将各组Eca109 细胞按照5×104个/mL 的浓度分别接种至96 孔板,每孔100 μL,于37 ℃、CO2体积分数为5%的培养箱中培养48 h,每孔加入100 μL浓度为10%的CCK-8 溶液,在培养箱中孵育1 h 后,采用酶标仪测定各孔450 nm处吸光度值。
1.5 流式细胞术检测细胞周期和细胞凋亡
将Eca109 细胞调整为1×105个/mL 的单细胞悬液,接种至6 孔板中,每孔2 mL,然后胰酶消化细胞,PBS 冲洗,用预冷PBS 重悬细胞,将一部分细胞悬液加入到3.5 mL 预冷的80%乙醇中,4 ℃固定过夜,离心、沉淀细胞。用预冷的PBS 洗涤,加入500 μL PI/RNase 染色缓冲液(staining buffer)重悬细胞并获得单细胞悬液。4 ℃避光孵育30 min 后流式细胞术(flow cytometry,FCM)检测细胞周期变化。另一部分细胞悬液,每管加入10 μL 的7-氨基放线菌素D(7-aminoactinomycin D,7-AAD)和5 μL 膜联蛋白V-PE(Annexin V-PE),4 ℃避光孵育5 min,在30 min 内检测细胞凋亡率。
1.6 Transwell实验检测细胞迁移与侵袭
将基质胶稀释后加入Transwell 小室的上层,37 ℃温育5 h,用无血清培养基悬浮细胞,调整浓度为3×105个/mL,取100 μL 细胞悬液加入到Transwell小室的上层,将600 μL DMEM 完全培养基加入到Transwell下层,培养72 h,PBS冲洗,用4%甲醛固定20 min,结晶紫染色后于显微镜(×100)下随机取5个视野统计细胞侵袭的数量。细胞迁移实验无需预铺基质胶,将无血清细胞悬液接种到Transwell小室,其余步骤同上。
1.7 下游靶基因RNF113A mRNA 和蛋白表达的检测
RNF113A 以β-actin 为内参,采用qPCR 检测RNF113A mRNA 的表达,方法同1.3。采用Western blot 检测RNF113A 蛋白的表达。蛋白提取步骤:待培养皿中细胞汇合度达到80%~90%时,向细胞样本加入200 μL RIPA 裂解液(已按1∶100 比例加入蛋白酶抑制剂和广谱磷酸酶抑制剂),充分混匀,4 ℃环境下设5 min 涡旋振荡1 次,连续5 次后,以12000 r/min、4 ℃离心15 min 收集上清。加入1/3 体积的4×上样缓冲液(loading buffer),100 ℃金属浴加热处理10 min,使蛋白充分变性,-20 ℃冻存备用。用聚丙烯酰胺凝胶电泳(SDS-PAGE)分离提取的总蛋白,后进行电泳、转膜和封闭,在4 ℃的环境中一抗孵育过夜。抗体β-actin(1∶3000)和RNF113A(1∶1000)稀释。TBST漂洗,加入稀释后的二抗,山羊抗鼠IgG H&L(HRP)(1∶15000 稀释)和山羊抗兔IgG H&L(HRP)(1∶5000稀释)室温孵育1 h,TBST漂洗,采用化学发光仪进行检测、拍照。
1.8 统计学方法
应用SPSS 19.0 软件进行统计学分析,数据采用xˉ±s表示,组间比较采用单因素方差分析,P<0.05 表示差异具有统计学意义。
2 结 果
2.1 各组细胞中miR-495的表达水平
空白对照组、模拟物对照组、miR-495 模拟物组、抑制剂对照组和miR-495 抑制剂组细胞miR-495的相对表达水平分别为1.013±0.186、1.030±0.212、1.423±0.231、1.055±0.158和0.602±0.157。与模拟物对照组相比,转染miR-495模拟物组miR-495 mRNA水平显著升高;与抑制剂对照组相比,转染miR-495抑制剂组miR-495 mRNA水平显著降低,差异均有统计学意义(P<0.05),见图1。
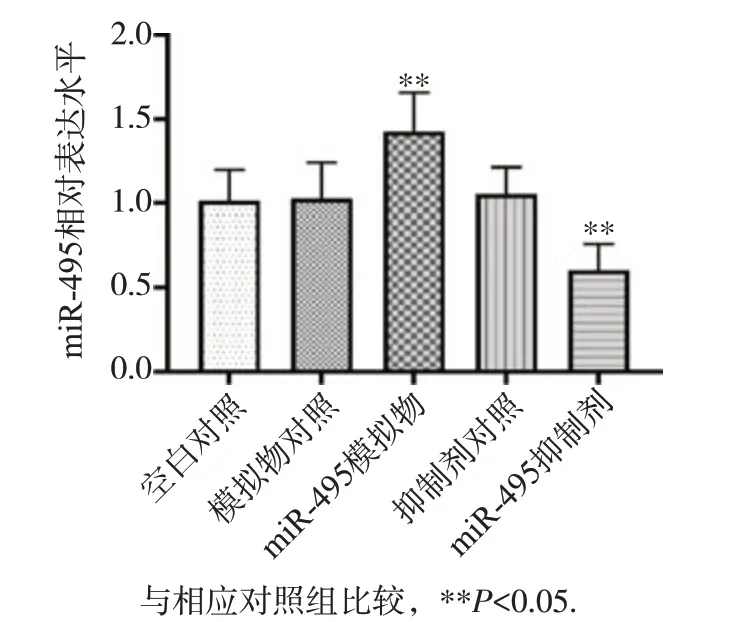
图1 各组细胞中miR-495的表达水平
2.2 miR-495对Eca109细胞增殖的影响
模拟物对照组、miR-495 模拟物组、抑制剂对照组和miR-495 抑制剂组培养48 h 后的D(450)值分别为0.871±0.046、0.831±0.050、0.866±0.060 和0.884±0.026,miR-495过表达或抑制剂干扰对食管癌Eca109细胞增殖均无显著影响。各组细胞间增殖能力均无显著变化(F=1.962,P=0.139),见图2。

图2 miR-495对Eca109细胞增殖的影响
2.3 miR-495对Eca109细胞周期和细胞凋亡的影响
模拟物对照组、miR-495 模拟物组、抑制剂对照组、miR-495 抑制剂组G0/G1 期细胞比例分别为(48.073±0.665)%、(56.280±0.563)%、(48.950±1.470)%和(50.413±0.437)%;S 期细胞比例分别为(25.850±1.296)% 、 (15.223 ± 0.754)% 、 (26.123 ± 2.456)% 和(31.150±1.532)%;细胞凋亡率分别为(3.300±0.854)%、(5.800±1.136)%、(3.433±0.577)%和(2.733±0.513)%,与模拟物对照组相比,转染miR-495 模拟物后G0/G1 期细胞显著增多、S期减少、G2/M期增多、细胞凋亡显著增多(P<0.01),说明miR-495 阻滞细胞分裂停留在G0/G1期;与抑制剂对照组相比,转染抑制剂后S期显著增多、G2/M期显著减少。凋亡细胞显著减少,差异均具有统计学意义(P<0.01),说明抑制miR-495后细胞DNA合成活跃,大量细胞进入S期,见图3和图4。
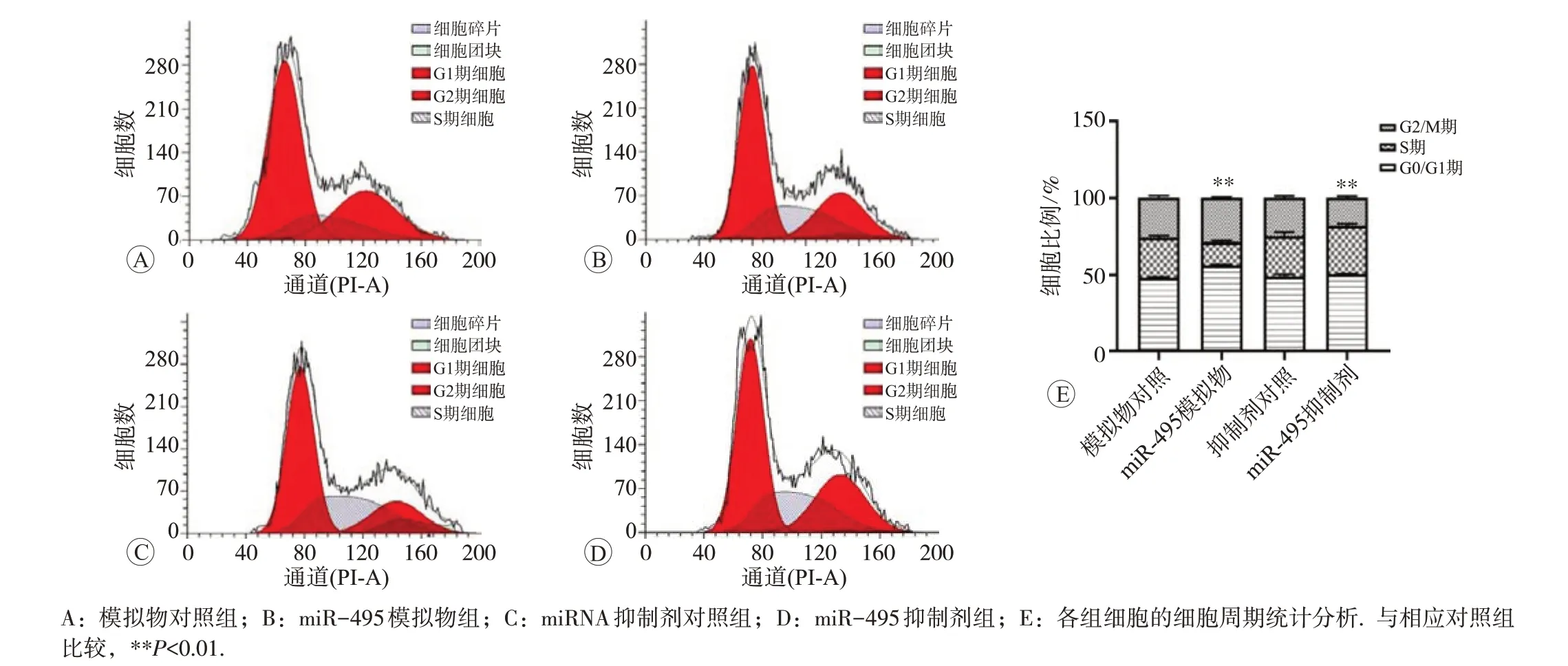
图3 miR-495对Eca109细胞周期的影响
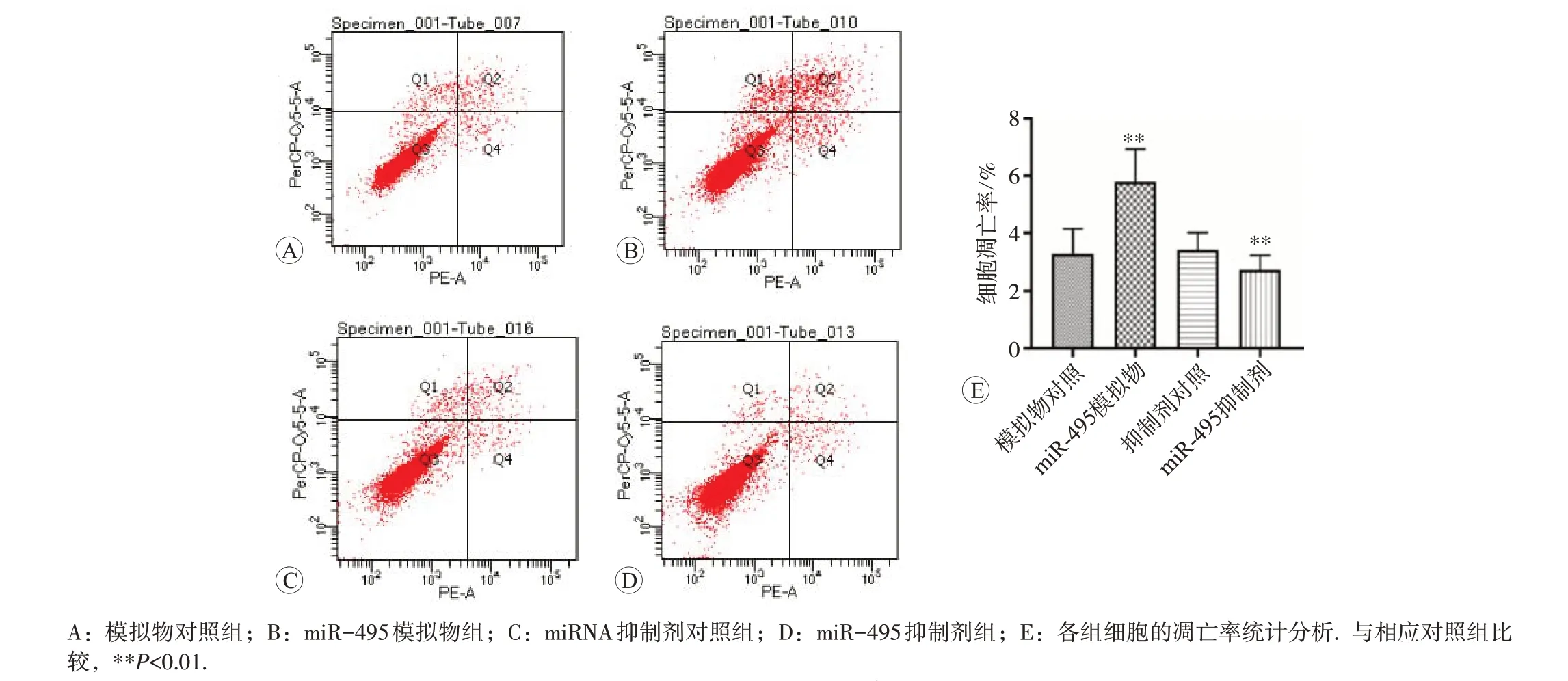
图4 miR-495对Eca109细胞凋亡的影响
2.4 miR-495对Eca109细胞迁移和侵袭能力的影响
模拟物对照组、miR-495 模拟物组、抑制剂对照组和miR-495 抑制剂组细胞迁移数量分别为(95.3±6.3)、(63.8±5.2)、(96.9±4.9)和(104.9±5.3)个;侵袭数量分别为(93.6±6.4)、(63.7±6.1)、(94.3±5.8)和(105.8±7.1)个。与模拟物对照组比较,转染模拟物后迁移和侵袭细胞数均显著减少(P<0.01);与抑制剂对照组相比,转染抑制剂后迁移和侵袭细胞数均显著增多,差异均具有统计学意义(P<0.01),见图5和图6。
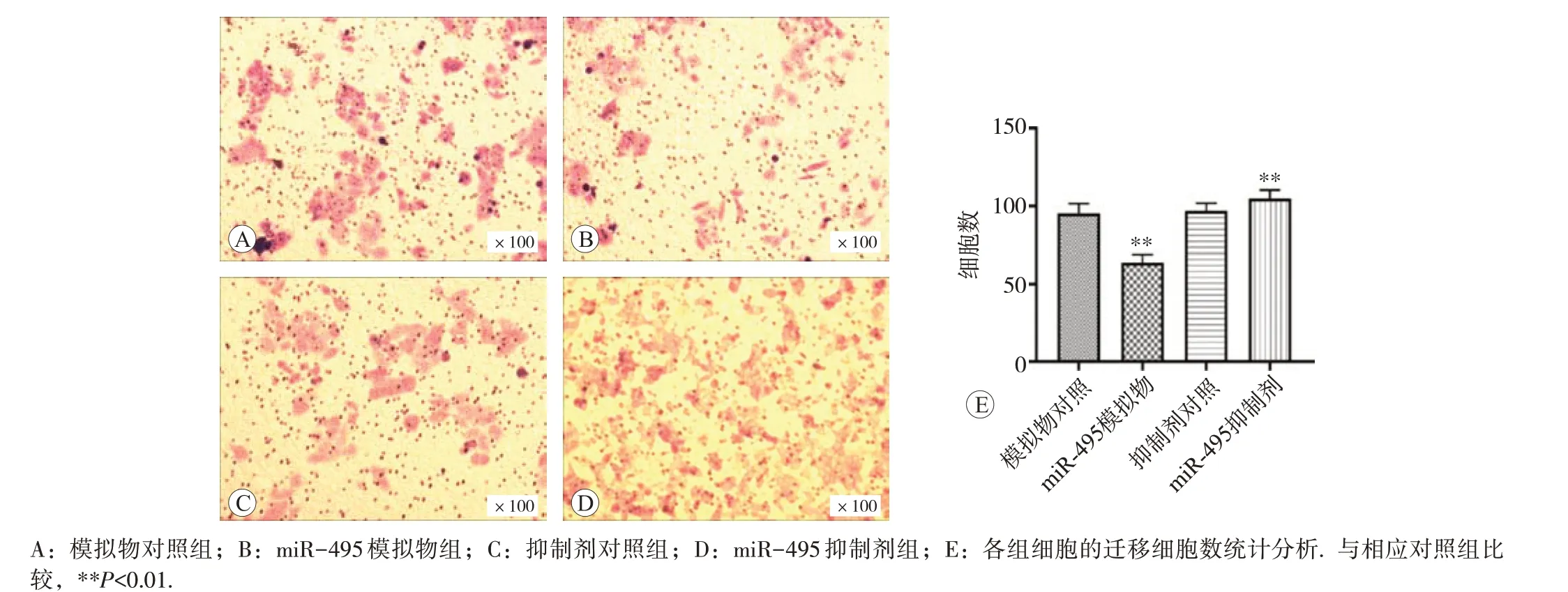
图5 miR-495对细胞迁移能力的影响
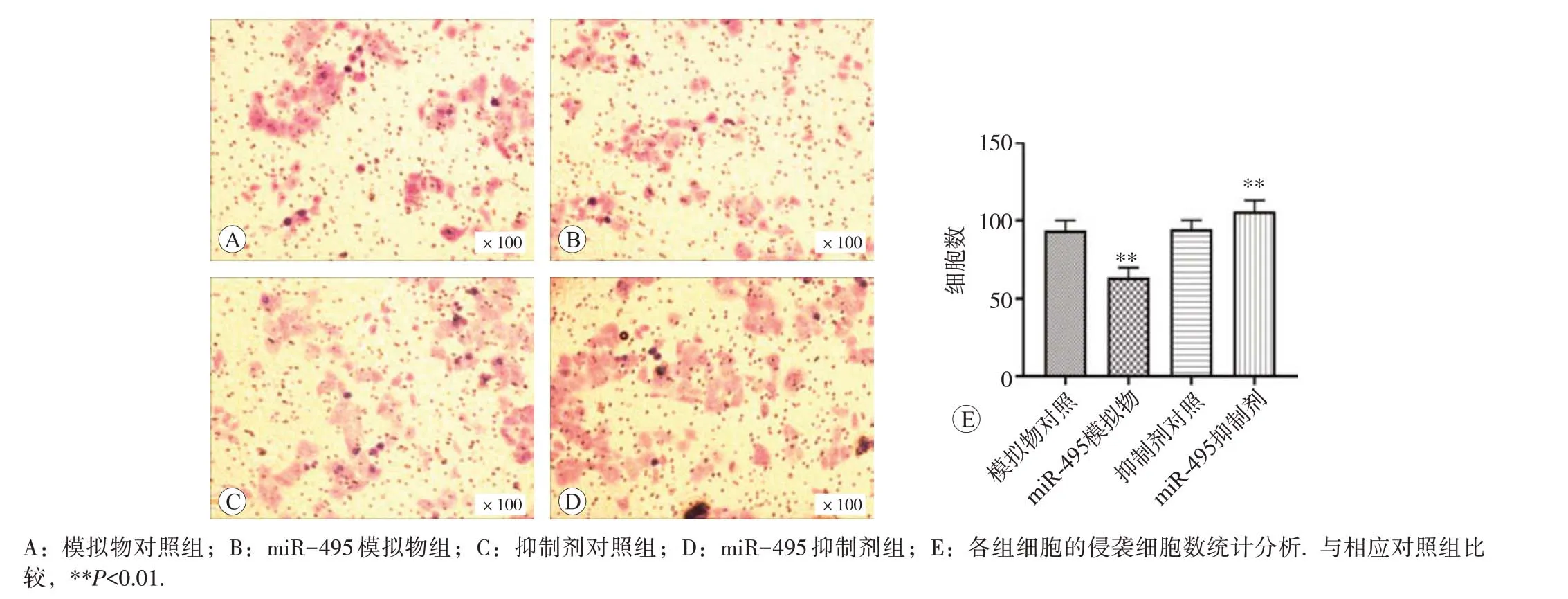
图6 miR-495对细胞侵袭能力的影响
2.5 miR-495 对细胞中RNF113A mRNA 和蛋白表达的影响
模拟物对照组、miR-495模拟物组、抑制剂对照组和miR-495抑制剂组RNF113A mRNA相对表达水平分别为1.126±0.219、0.967±0.142、1.084±0.222和1.202±0.291;RNF113A 蛋白相对表达水平分别为0.600±0.010、0.380±0.050、0.700±0.010 和0.810±0.040。转染miR-495模拟物和抑制剂后,RNF113A mRNA表达水平无明显变化(F=0.833,P=0.520);而转染模拟物后,RNF113A 蛋白表达水平较对照组下降(P<0.05);转染抑制剂后RNF113A 蛋白表达水平较对照组升高,差异具有统计学意义(P<0.05),见图7和图8。
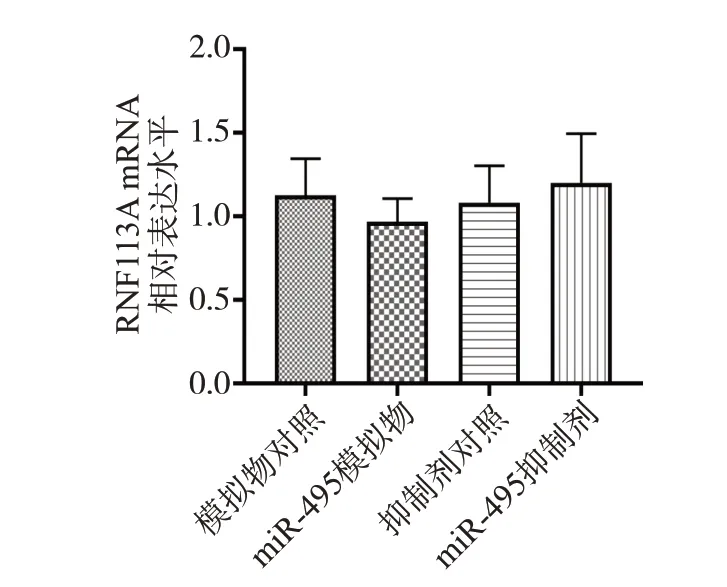
图7 miR-495对细胞中RNF113A mRNA相对表达水平的影响
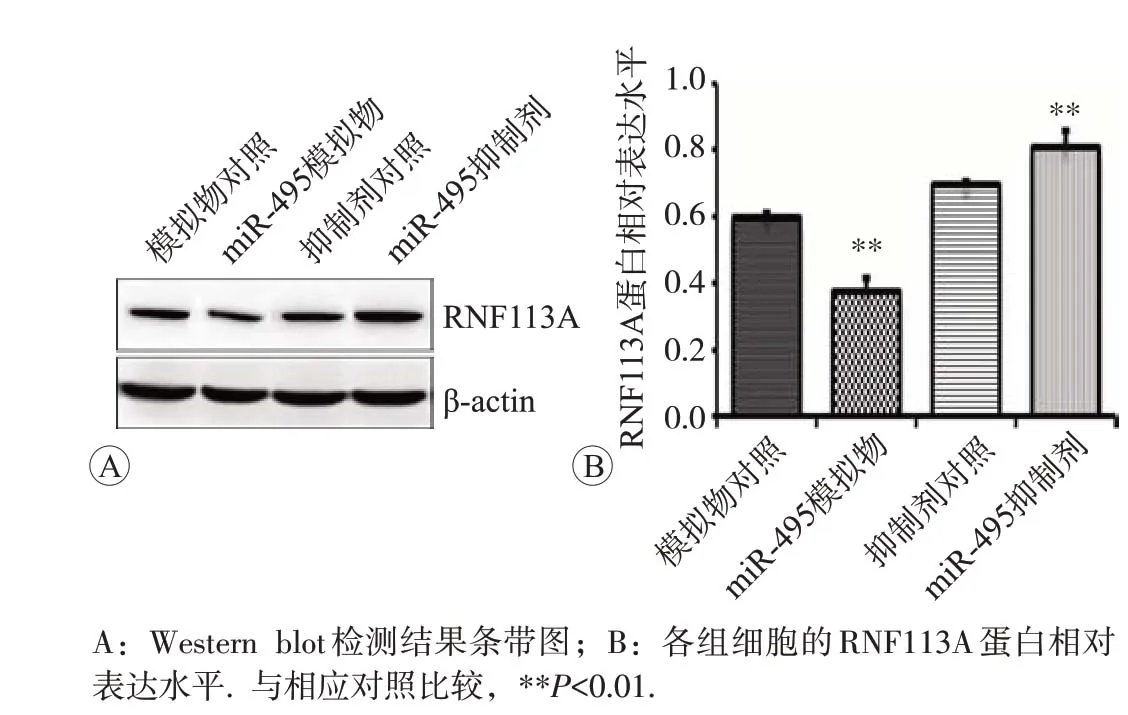
图8 miR-495对细胞中RNF113A蛋白相对表达水平的影响
3 讨论
miR-495 位于14 号染色体14q32.31 上[14],参与实体肿瘤和血液肿瘤细胞的增殖、侵袭、转移和化学敏感性的变化[15]。已有研究证实miR-495 在多种恶性肿瘤中表达失调,包括非小细胞肺癌[16]、胰腺癌[17]、卵巢癌[18]、肾癌[[19]、胃癌[20]、肝细胞癌[21]、胆囊癌[22]。miR-495 作为抑癌基因或癌基因在不同类型的肿瘤中发挥不同的作用[23-24]。例如miR-495 在乳腺癌干细胞中高表达,可直接抑制E-cadherin 的表达从而促进肿瘤发展[25]。而在大多数实体肿瘤中,miR-495 发挥抑癌基因的作用,例如miR-495可抑制神经胶质瘤细胞的增殖、凋亡和侵袭[26];在胃癌组织中,miR-495 的表达与磷酸酶-3(PRL-3)的上调有关,PRL-3 是miR-495 的下游靶点,转染miR-495 模拟物可抑制胃癌细胞的侵袭和转移[27]。本研究显示miR-495 在食管鳞癌细胞中表达下调,转染miR-495模拟物可抑制食管鳞癌细胞的侵袭和迁移,促进食管鳞癌细胞凋亡,发挥抑癌基因的作用。
miR-495 在食管癌中的研究较少,在食管鳞癌进展中的具体功能及分子机制仍不清楚。Mao 等[28]在食管鳞癌的研究中发现,与正常食管组织相比,miR-495 在食管鳞癌组织中表达水平降低,miR-495可通过调控上皮间质转化(epithelial-mesenchymal transition,EMT)及RACα 丝氨酸/苏氨酸蛋白激酶(RAC-alpha serine/threonine-protein kinase)信号通路影响细胞周期来抑制食管癌细胞增殖、侵袭和迁移,同时miR-495的异常表达与食管癌患者的预后、淋巴结转移和TNM分期有关。miR-495通过靶向ATP酶铜转运α(ATPase copper transporting alpha,ATP7A)基因抑制食管癌细胞的顺铂耐药和血管生成[29-30]。
在本研究中,miR-495 过表达或抑制干扰对食管鳞癌Eca109 细胞增殖无显著影响,Mao 等[28]的研究结果与此不同,他们通过集落形成实验发现miR-495过表达可抑制Eca109和TE-1细胞系的增殖,因此miR-495 对食管癌细胞增殖的影响尚需进一步验证。本研究发现过表达miR-495抑制了Eca109细胞迁移和侵袭能力,并促进了细胞凋亡,相反抑制miR-495后促进了细胞的侵袭和迁移能力,并抑制了细胞凋亡,改变了食管鳞癌细胞周期的分布。环指蛋白113A(ring finger protein 113A,RNF113A)作为RING 家族的一员,具有泛素连接酶功能,其主要位于Xq24-q25 号染色体上,可编码一种蛋白质,其中包含两个与DNA烷基化修复和精子RNA拼接有关锌指域[31]。RNF113A在结构上具有特异性,主要依靠其结构特征来发挥作用,其结构主要由两个锌离子整合形成特征性的环形结构,形似一把钳子,可以钳住相应的靶蛋白,从而参与调解许多靶蛋白的周转和活性[27]。miR-495 和很多环指蛋白密切相关,环指蛋白的结构组具有高度的保守性,而RNF113A作为其中的一员,因此我们推测miR-495与RNF113A之间可能存在某种关系。为进一步确认miR-495 对RNF113A 的调控,我们进行了qPCR 及Western blot 实验,结果显示与对照组比较,转染miR-495 模拟物组RNF113A 蛋白表达水平下调,转染miR-495 抑制剂组RNF113A 蛋白表达水平上调,但RNA水平未见显著变化,说明miR-495可能通过转录后修饰以负向调控RNF113A蛋白的表达。既往研究显示miR-495可与多种靶基因结合,通过调控靶基因的表达进而调控肿瘤细胞的生物学行为。例如miR-495 作为肿瘤抑制因子,在非小细胞肺癌中被下调,肿瘤转移基因3(MTA3)是公认的非小细胞肺癌淋巴结转移的危险因素。miR-495 可以通过靶向MTA3 mRNA 降解影响非小细胞肺癌的转移[32]。miR-495 在结肠癌中表达下调,miR-495通过调控膜联蛋白A3基因抑制结肠癌细胞的增殖和侵袭[33]。有研究发现,miR-495通过靶向Akt1抑制细胞周期转换和EMT信号通路,从而抑制食管癌细胞增殖、迁移和侵袭[26]。本研究结果显示,Eca109细胞过表达miR-495后,细胞凋亡增加,侵袭和迁移能力下降,与上述研究结果一致,但该研究未进行miR-495 与RNF113A 关系的探讨,本研究首次发现miR-495可以负向调控RNF113A的蛋白表达,从而调控食管鳞癌细胞恶性表型。
综上,miR-495对Eca109细胞增殖能力无显著影响,但可促进细胞凋亡,抑制其迁移和侵袭能力,并调控细胞周期分布,同时miR-495 可通过抑制RNF113A 的蛋白表达调控Eca109 细胞恶性表型。本研究表明miR-495在食管鳞癌发生发展中起着关键作用,有望成为食管鳞癌诊断及治疗的新靶点。然而,由于靶基因调控具有多样性,miRNA-495调控食管癌细胞恶性表型是否通过与其他靶基因的相互作用,还需要进一步探索。
