液滴式数字PCR检测尿路上皮癌患者尿cfDNA中FGFR3基因S249C突变的临床应用价值
2023-06-08祖丽胡马尔艾孜木阿吉王雅茹
祖丽胡马尔·艾孜木阿吉,赵 焕,马 晟,高 苒,王雅茹,肖 汀,
(1.国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院,分子肿瘤学国家重点实验室,癌发生及预防分子机理北京市重点实验室,北京 100021;2.国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院,病理科,北京100021;3.中国医学科学院医学实验动物研究所,北京 100021)
尿路上皮癌(urothelial carcinoma,UC)是起源于尿路上皮的一种多源性恶性肿瘤,包括膀胱癌(bladder cancer,BC)和上尿路上皮癌(upper tract urothelial carcinoma,UTUC),是泌尿生殖系统最常见的恶性肿瘤之一[1-3]。目前膀胱镜和尿脱落细胞学检查是监测UC的金标准。但膀胱镜的局限性在于对UTUC和原位癌难以活检,且有创不适合作为常规监测的方法[4]。尿脱落细胞学虽属于特异度高的无创检查,但因其灵敏度有限从而容易漏诊[5-6]。寻找可辅助尿脱落细胞学检查并提高UC检出率的非侵入性生物标志物是UC诊治的研究重点。
随着“精准医学”概念的普及,液体活检作为无创诊疗是肿瘤精准医学的发展方向之一。在泌尿生殖系统恶性肿瘤中,由于尿液与肿瘤直接接触,使得尿游离DNA(cell-free DNA,cfDNA)检测成为最常用的一种液体活检方法[7]。cfDNA的检测可以独立于细胞形态学,甚至早于细胞形态的改变检测出靶基因的突变状态。有研究表明接受过膀胱切除术的患者尿cfDNA 中拷贝数水平预示着肿瘤复发的可能,而且在与循环肿瘤DNA(circulating tumor DNA,ctDNA)关联时其预测结果更为明显[8]。但由于尿cfDNA 浓度低DNA 含量较少,已有的传统基因检测手段如Sanger 测序等无法精准检测DNA含量低的样本,所以另一种灵敏度更高的检测方法成为了检测尿cfDNA 的重要手段。液滴数字PCR(droplet digital PCR,ddPCR)是近年来发展起来的一种突破性定量的分析技术,这种高灵敏的技术已经证明了其在绝对定量、稀有事件检测、拷贝数变异、基因表达和定量miRNA等应用中的可靠性[9]。
成纤维细胞生长因子受体3(fibroblast growth factor receptor 3,FGFR3)基因被认为是膀胱癌患者尿液细胞中具有潜能的生物标志物[10]。位于FGFR3第7号外显子上的S249C 位点是最常见的突变位点(TCC→TGC)[11],S249C 突变型受体中的半胱氨酸残基可以使突变型单体在胞外形成二硫键从而触发激酶的激活[12],这会持续激活下游细胞的增殖途径并减少细胞凋亡[13],有研究表明该突变会导致乳头状膀胱癌的形成[14]。Montalbo等[15]对尿脱落细胞学诊断不明确的样本通过多重PCR与SNapShot的方法联用检测FGFR3基因突变,结果发现由于检测突变率较低无法评估其对于尿脱落细胞学诊断不明确样本的临床意义。Christensen 等[16]利用ddPCR 方法检测尿cfDNA 和血浆ctDNA中FGFR3和PIK3CA突变位点,结果表明UC患者尿cfDNA 突变拷贝数水平与肿瘤阶段、等级和大小呈正相关,尿cfDNA中高拷贝数能提示疾病的进展。
本研究采用ddPCR 方法检测UC 患者尿cfDNA 中FGFR3S249C突变情况,以辅助提高尿脱落细胞学诊断不明确的样本对于UC的诊断效能。
1 材料与方法
1.1 材料
1.1.1 样本来源 选取2020年11月—2021年7月在中国医学科学院肿瘤医院就诊的泌尿系统疾病患者。前瞻性收集临床怀疑有尿路上皮病变患者尿液(送检尿量>200 mL),纳入分析的实验组标准:经膀胱镜或术后组织病理结果确诊为尿路上皮癌;纳入分析的对照组标准:经膀胱镜或术后组织病理结果确诊为良性。排除标准:非尿路上皮病变,或有其他系统的恶性肿瘤史。
1.1.2 样本量估算 引用公式n=Uα2P(1-P)/δ2。n=预估样本量;Uα=正态分布中累积概率为α/2 的U值;U0.05=1.96;P值分别为:预估FGFR3用于诊断尿路上皮癌的灵敏度(0.80)和诊断尿路皮癌的特异度(0.90);δ=允许误差(通常定为0.05~0.10)。计算得出预估所需样本量为30。
1.1.3 实验试剂 提取尿cfDNA 所需试剂Quick-DNA Urine Kit(含尿液稳定剂)购于Zymo research 公司;QubitTMdsDNA HS and BR Assay Kits 购于Invitrogen 公司。ddPCR 所需ddPCRTMSupermix for Probes(No dUTP)、微滴生成油、ddPCRTM微滴读取油、DG8TMCartridges and Gaskets、DG8 Cartridge Holder、Pierceable Foil Heat Seal、PCR 半裙边96 孔板和探针FGFR3 pS249C_dHsaMDV2516760(20×)均购自Bio-Rad 公司;UltraPureTMDNase/RNase-Free 双蒸水购于Invitrogen公司。
1.1.4 实验仪器 QX200TMDroplet reader、QX200TMDroplet Generator、PX1 PCR Plate Sealer 和T100热循环仪均购于Bio-Rad公司;DRAGON LAB MX-F涡旋仪购于Dragon公司;恒温水浴锅购于北京医疗器械公司;Qubit 3.0购于Thermo Fisher公司。
1.2 实验方法
1.2.1 尿cfDNA 提取 选择送检尿量大于200 mL者,混匀后留取40 mL,2500 g/min离心后留上清液加入尿液稳定剂(每1 mL 尿加入70 μL 尿液稳定剂),以备DNA 提取。另外150 mL 尿用于尿脱落细胞学诊断制片。
尿cfDNA 提取分为3 个步骤:总DNA(游离)沉淀、蛋白消化、DNA 纯化。①将已加入尿液稳定剂的40 mL 尿液转移到合适的离心管内,并加入20 μL 纯化珠,3000 g 离心15 min,收集细胞沉淀。②弃去上清后不搅动细胞沉淀,保留大约100-400 μL 细胞沉淀,并向其中加入等体积的尿液细胞消化液,重悬。将5%的蛋白酶K加到重悬的细胞沉淀中,涡旋混匀,在55 ℃下孵育30 min。③添加1倍体积的基因组裂解液到消化完后的混合液中,并涡旋混匀。将全部样品转移到Zymo-SpinTMIC-S 柱中,Zymo-SpinTMIC-S 柱套在一个收集管后16000 g离心(下同)1 min,去除滤出液后,重复上述步骤。将Zymo-SpinTMIC-S柱套在新的收集管中,加入200 μL Urine DNA Prep Buffer 到离心柱中,离心1 min,弃去滤出液。将700 μL Urine DNA Wash Buffer 放置到离心柱中离心1 min,弃去滤出液。再用200 μL Urine DNA Wash Buffer重复上步骤。将离心柱转移到不含DNase/RNase-free 的EP管中,加入10 μL DNA 洗脱液到基质上,室温下放置3~5 min,全速离心1 min 来洗脱DNA。cfDNA 浓度采用Qubit 3.0 荧光定量仪测定,选取浓度>0.3 ng/μL的cfDNA样本进行ddPCR检测。
1.2.2 ddPCR 检测尿cfDNA 中FGFR3S249C 突变进行ddPCR 检测的流程有配制反应液、制备微滴、PCR扩增、读取微滴、分析数据。①配置反应液:探针1 μL,ddPCRTMSupermix for Probes(No dUTP)11 μL,模板1 μL,UltraPuretm DNase/RNase-Free 双蒸水加至终体积为20 μL。②制备油滴:在DG8 cartridge中间的8个孔内分别加入20 μL配置好的反应液,加样时需避免引入气泡。将70 μL微滴生成油加入到DG8 cartridge 最下方的8 个孔中盖上DG8TMGaskets,并钩牢两边小孔。制备好的DG8 Cartridge Holder 轻放于QX200TMDroplet Generator 中并生成微滴。③PCR 扩增:DG8TMcartridge 最上排孔内为已生成的微滴,在96 孔板内缓慢打入已生成的微滴,将PX1热封仪提前预热对已铺好微滴液的96孔板进行封膜,运行热封仪的程序为180 ℃,5 s。PCR反应需在封膜后的30 min内进行:95 ℃、 10 min;39个循环94 ℃、30 s,55 ℃、1 min;98 ℃、10 min,16 ℃保存(升降温速度2.5 ℃/s)。④读取微滴,分析数据:在plate holder 中放入已完成PCR 的96 孔板组装好后放入到QX200TMDroplet reader 中,使用QuantaSoft 软件进行检测并对数据进行分析,ddPCR 反应总微滴数>10000 的样本纳入后续分析。按下式计算突变等位基因频率(mutation allele frequency,MAF),MAF 是ddPCR 读出的突变型拷贝数占总拷贝数的比例,是判定该样本是否有突变的重要标准[17-18]。
以往研究报道使用与本研究相一致的BioRad QX200 系统和实验试剂去检测尿cfDNA 中FGFR3S249C突变位点[19-20],对突变结果进行判读的统一标准为:MAF>0.1%;突变阳性微滴≥3。
1.3 统计学方法
使用SPSS 23.0 进行统计学分析。本研究中对MAF 和cfDNA 浓度等计量资料进行Shapiro-Wilk 正态性检验后,不符合正态分布故该计量资料以M(P25,P75)表示,组间比较采用非参数Mann-WhitneyU检验。分类变量使用Fisher 精准检验进行比较。金标准是以膀胱镜检查或经尿道膀胱肿瘤电切术病理诊断结果为准。绘制受试者工作特征曲线(receiver operating characteristic curve,ROC),以尿脱落细胞学SHGUC 且病理结果诊断为UC 的患者作为实验组,以尿脱落细胞学结果是NHGUC且病理结果中未见肿瘤的患者为对照组,使用R语言中的pROC、ROCit 包分别计算出个截点上FGFR3S249C 突变对于诊断UC 的灵敏度和特异度,绘制出ROC曲线;曲线下的面积在0.5和1之间,AUC越接近于1,说明诊断效果越好,AUC在0.5~0.7时有较低准确性,AUC在0.7~0.9时有一定准确性,AUC 在0.9 以上时有较高准确性。作图使用GraphPad Prism 9.0.2。P<0.05为差异具有统计学意义。
2 结 果
2.1 一般临床资料
符合纳入和排除标准且ddPCR下机数据可纳入分析(总微滴数大于10000)的样本例数共27例UC。男性19 例,女性8 例;年龄范围36~77 岁,年龄中位数64岁。按照尿液细胞学巴黎报告系统(the Paris system for reporting urinary cytology,TPS)将纳入的27例患者分为16 例高级别尿路上皮癌(high-grade urothelial carcinoma,HGUC),8 例可疑高级别尿路上皮癌(suspicious for high-grade urothelial carcinoma,SHGUC),3 例未见高级别尿路上皮癌(negative for high-grade urothelial carcinoma,NHGUC)。27例UC 患者中26例患者接受了手术治疗,其组织病理结果按照2016年《WHO 泌尿系统及男性生殖器官肿瘤分类》标准(第4版)进行分类,高级别UC 19 例,低级别UC 5 例,未见肿瘤2 例,未做手术1 例。按照2017年第8 版美国癌症分期联合委员会(AJCC)制订的TNM分期系统进行分期:3 例Ta,2 例T0,8 例T1,5 例T2,7 例T3,2例无T分期;浸润性UC 19例,非浸润性UC 4例。
2.2 尿cfDNA中FGFR3 S249C突变情况
采用ddPCR检测尿cfDNA中FGFR3S249C突变情况,结果见表1。从纳入研究的UC患者尿液中提取的DNA 浓度最低为0.348 ng/μL,通过ddPCR 可检测到该浓度样本的突变拷贝数MAF 值为39.6%,说明本研究中ddPCR 可检测到cfDNA 浓度低样本的突变基因。SHGUC组cfDNA中位浓度为17.05 ng/μL,高于HGUC组中的中位浓度16.65 ng/μL;HGUC 组cfDNA 浓度整体相比于SHGUC 组有上升趋势;NHGUC 组中cfDNA中位浓度均低于HGUC 和SHGUC 组。SHGUC 组中MAF 中位值为0.24%,高于HGUC 组中的中位MAF 值0.01%。
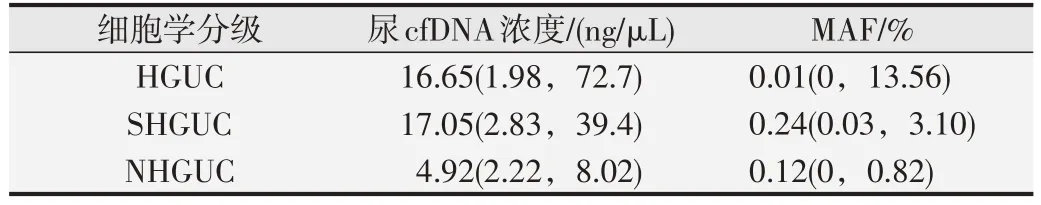
表1 各尿脱落细胞学不同分级中尿cfDNA 浓度和ddPCR 检测后的MAF值[M(P25,P75)]
通过ddPCR 检测方法在患者尿cfDNA 中检测到的微滴荧光信号以二维荧光增量图的形式展示,在阴、阳性液滴可以做最佳区分的位置上设定阴、阳性截断值,从而得出样本野生型拷贝数和突变型拷贝数,结果见图1。
2.3 FGFR3 S249C在不同尿脱落细胞学和病理分型中的突变率分析结果
27 例UC 患者尿cfDNA 样本中有7 例为FGFR3S249C 突变阳性,检出率为25.9%(7/27)。在T 分期的T1 中FGFR3S249C 突变率为37.5%(3/8)。按病理结果分类FGFR3S249C 在高级别中突变率为26.3%(5/19),低级别中为40.0%(2/5),未见肿瘤类型中为0(0/2)。按尿脱落细胞结果分类FGFR3S249C在HGUC中突变率为18.8%(3/16),SHGUC中为50%(4/8),NHGUC中为0(0/3)。在浸润性UC中FGFR3S249C的突变率为31.6%(6/19),在非浸润性UC 中其突变率为25%(1/4)。见表2。
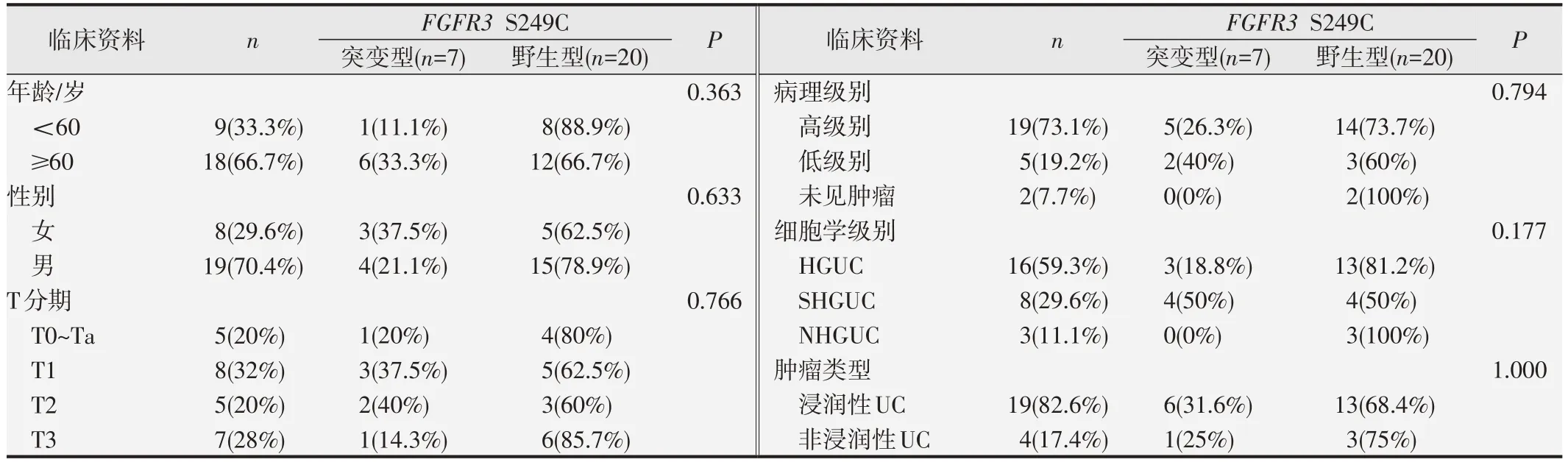
表2 FGFR3突变与临床病理相关指标的关系[例数(百分比)]
FGFR3S249C 在病理分级及细胞学均为高级别UC 的样本中突变率为23.1%(3/13),在病理分级为高级别UC、细胞学为可疑高级别UC 的样本中突变率为40%(2/5),在病理分级为低级别UC、细胞学为可疑高级别UC的样本中突变率为66.7%(2/3)。见图2。

图2 按病理分类概述ddPCR检测FGFR3 S249C的突变结果
2.4 ddPCR 检测FGFR3 突变对尿脱落细胞学SHGUC的诊断效能
8例尿脱落细胞学诊断为SHGUC的样本其病理均诊断为UC,使用ddPCR 检测这8 例SHGUC 中FGFR3S249C 突变阳性的样本可提高50%(4/8)的UC 检出率。在SHGUC 样本中使用ddPCR 检测FGFR3S249C 突变,绘制ROC 并进行分析,结果显示AUC=0.781,95% CI(0.407,1.000);灵敏度为62.5%,特异度为100%,阳性预测值100%,阴性预测值40%,约登指数0.625。证明使用ddPCR 检测FGFR3S249C 可辅助尿脱落细胞学提高对UC的诊断效能。见表3和图3。
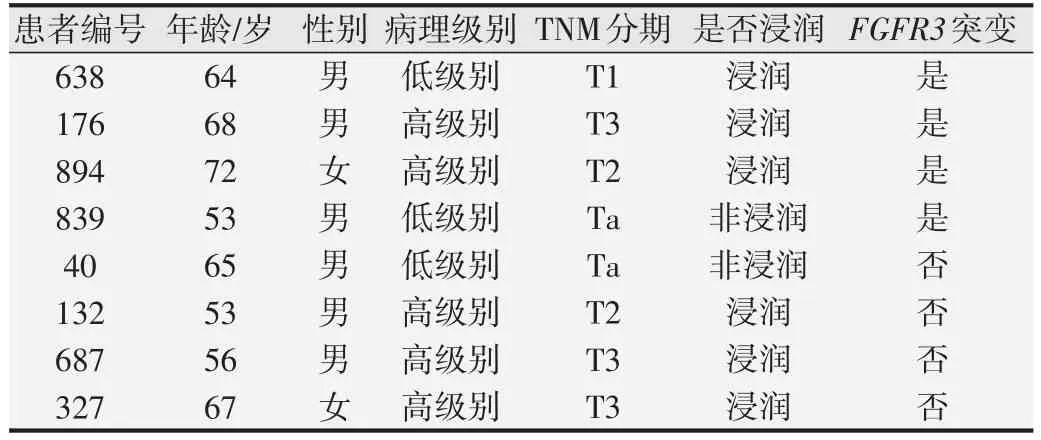
表3 尿脱落细胞学检测结果为SHGUC的患者FGFR3突变情况与临床资料
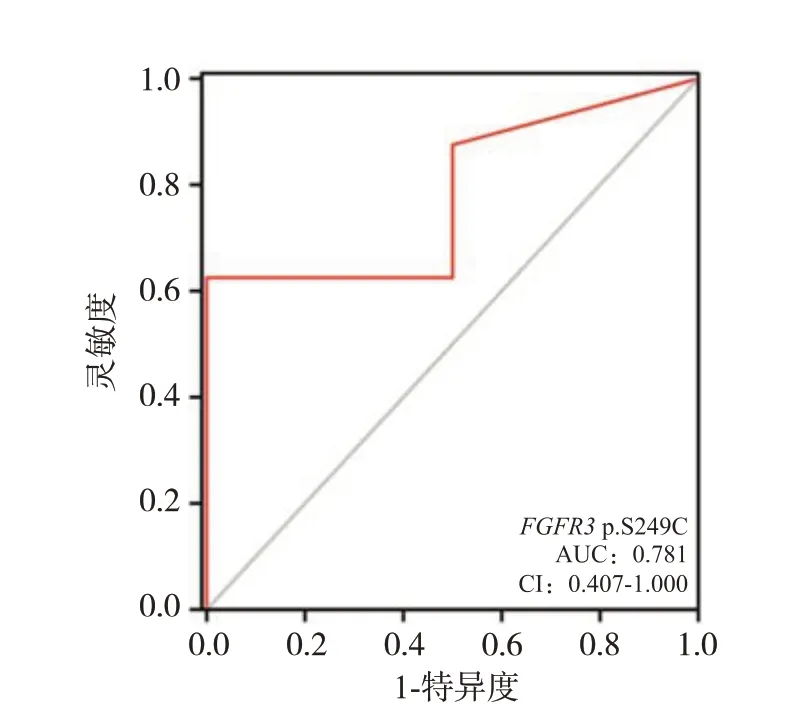
图3 FGFR3突变预测UC的诊断效能
3 讨论
尿脱落细胞学检查是诊断UC 特异度高的非侵入性检测方式,但其灵敏度较低且细胞学结果为可疑的患者会有被漏诊的风险。ddPCR 对于体液活检中像cfDNA 这类DNA 含量少的样本具有高灵敏度和特异度,且理论上ddPCR 可检测出突变频率远低于1%的基因[21]。本研究中使用ddPCR 可检测出cfDNA 浓度0.348 ng/μL 样本中的突变拷贝数且MAF 值为39.6%,这进一步体现ddPCR对于样本中DNA含量少所具有的检出效能。Montalbo 等[15]采用多重PCR 与SNapShot 的方法联用检测FGFR3基因突变,在29 例细胞学诊断为非典型尿路上皮癌的样本中仅有1 例为FGFR3S249C 突变,其检出率较低。SNaPshot 虽然可以快速分析大量的SNP位点,但因为SNapShot灵敏度低存在假阳性或假阴性结果的风险;而ddPCR 相比于SNaPshot 灵敏度更高,可以减少这种风险并提供更精准的检测结果[22]。在实验方法上SNapShot的DNA上样量需要5 ng,与此相比之下,进行ddPCR检测时DNA上样量仅需1 ng也可有效扩增出DNA片段[23]。故在本研究中应用高灵敏度和特异度的ddPCR 检测UC 患者中FGFR3S249C 突变情况,旨在辅助提高对于UC 的检出率。
本研究中ddPCR 反应后进行数据分析将MAF>0.1%且阳性微滴数>3 的样本定义为FGFR3突变阳性,该突变对于UC 的检出率为25.9%(7/27)。Hayashi等[20]研究者利用ddPCR 方法从153 名患者(含56 名UTUC 患者)尿上清中提取cfDNA 检测TERT和FGFR3热突变位点,UTUC患者cfDNA中TERTC228T突变率为39.3%,TERTC250T 突变率为7.1%,FGFR3S249C 突变率为16.1%,结合细胞学检测结果计算出其特异度和灵敏度分别是96.0%和78.6%。已被FDA批准用于检测膀胱癌的诊断工具UroVysion、NMP22等可作为非侵入性方式预测膀胱癌。目前有研究表明,尿脱落细胞学结合尿液cfDNA 诊断膀胱癌敏感性(77.5%)要高于尿脱落细胞学结合UroVysion(67.5%)[19]。这进一步说明我们的结果与以往研究有一致性的同时,FGFR3S249C 突变对于UC 的诊断效能有一定临床应用价值。本研究结果的重要之处是对于尿脱落细胞学诊断不明确但病理结果为UC 的样本中,FGFR3S249C突变检测可以提高UC检出率且具有一定的诊断效能。
本研究从尿液中提取cfDNA 浓度在各尿脱落细胞学HGUC 和SHGUC 中浓度都有升高的趋势,且在HGUC 组和SHGUC 组中MAF 值均较高。尤其在SHGUC 组中当不明确是否是高级别UC 时,FGFR3S249C 突变阳性可辅助诊断SHGUC 以提高UC 诊断效能。SHGUC 中FGFR3S249C突变对UC 检出率为50%[AUC=0.781,95% CI(0.407,1.000)],这提示在尿cfDNA中使用ddPCR检测FGFR3S249C的突变对诊断UC有一定的辅助作用。由于尿cfDNA提取并对其进行ddPCR 检测存在一定的技术难度,导致可纳入到本研究的合格样本数量较少,所以该研究结论还需要进一步扩大样本量来进行验证。
综上所述,使用ddPCR 检测尿cfDNA 中FGFR3S249C 突变作为一种非侵入性的检测方式可以辅助提高尿脱落细胞学诊断不明确样本的诊断效能。该方法将在临床上对于提高UC的早期筛查能力,辅助UC患者术前诊断、术后复发监测及预后判断上提供一定的参考依据。
