早期宫颈癌子宫切除术后HR-HPV 清除及其影响因素研究
2023-05-23曹君阳张玉虹陈江平
曹君阳,张玉虹,陈江平
宫颈癌是一种常见的妇科恶性肿瘤,在女性恶性肿瘤发病率中占第2 位,严重危害女性健康。近年来随着居民饮食、生活习惯的改变,宫颈癌的发病率呈逐年上升趋势[1]。子宫切除术是治疗早期宫颈癌的有效手段,但术后肿瘤细胞残留和复发率仍是一大难题[2]。因此,对早期宫颈癌子宫切除术后患者进行随访与筛查十分有必要。高危型人乳头瘤病毒(HR-HPV)是一种常见的性传播病毒。有研究显示[3],HR-HPV 的持续感染是宫颈上皮内瘤变及宫颈浸润癌发生的必要条件,也是宫颈癌前病变治疗后较为敏感的预测指标之一,且已有研究表明HR-HPV 的持续感染与宫颈癌的发生存在密切相关性[4-5]。患者行子宫切除术后,HR-HPV 转阴说明治疗较为成功,但术后生殖器残留的HR-HPV 感染、清除情况或转阴率尚不明确[6],而探究子宫切除术后HR-HPV 是否完全清除,对患者预后恢复具有重要意义。基于此,本研究回顾性分析早期宫颈癌行子宫切除术后的患者HR-HPV 清除情况及其影响因素。
1 对象与方法
1.1 研究对象 回顾性分析2017 年5 月至2020 年5 月在河北北方学院附属第一医院因早期宫颈癌行子宫切除术的100 例患者临床资料。根据HR-HPV清除情况,将患者分为清除组(n=81)和未清除组(n=19)。术后定期随访,并定期进行HR-HPV 分型检测及宫颈液基细胞学检测(thinprep cytologic test,TCT),每4~6 个月随访1 次,若2 次随访HR-HPV及TCT 均呈阴性时,延长至每隔1 年随访1 次。纳入标准:(1)符合《宫颈癌及癌前病变规范化诊疗指南(试行)》中宫颈癌诊断标准[7],经病理学诊断确诊,分期为Ⅰ~Ⅱ期,且接受子宫切除术者;(2)全部为已婚妇女;(3)知情同意行TCT 及HR-HPV 检查者;(4)同意定期随访者。排除标准:(1)失访及随访未能完成者;(2)合并严重肝、肾、肺等疾病者;(3)合并其他生殖系统恶性肿瘤者。(4)长期服用免疫抑制剂者。剔除标准:(1)患者资料缺失者;(2)无法取样者,存在阴道出血、阴道排液等症状者。100 例术后患者年龄30~70 岁[(55.36 ± 6.79)岁];鳞癌64 例,腺癌36 例。
1.2 方法 (1)随访内容:通过回顾患者就诊时的门诊及住院病历、相关化验和检查结果,收集患者年龄(55 岁为界限)、是否存在遗传史、淋巴结是否转移、术后是否接受辅助治疗(放化疗)、肿瘤浸润深度[8](浸润深度<3.5 mm 为浅层,浸润深度3.5~7 mm 为中层,浸润深度>7 mm 为深层)、初次性生活年龄(20 岁为界限)、吸烟史、性伴侣人数、孕次、病理类型。(2)HR-HPV 检查及清除效果判定:所有患者术后复诊时,进行HR-HPV 取样。患者取截石位,暴露颈管口,采用宫颈刷取标本和实时荧光定量聚合酶链式反应技术进行检测,试剂盒来自翌圣生物科技股份有限公司。阳性判定标准:受检标本相对发光单位(RLU)/标准阳性对照(CO)≥1 为阳性,表示HR-HPV 未消除。持续性感染判定标准[9]:随访12 个月以后HR-HPV 持续性感染;病毒清除判定标准:随访6 个月以上连续2 次检测为阴性。
1.3 统计学处理 选用SPSS 22.0 统计学软件对所得数据进行处理,计量资料以表示,2 组间比较采用独立样本t检验;计数资料以百分比(%)表示,组间比较行χ2检验;多组间因素分析采用Logistic 回归分析。P<0.05 表示差异有统计学意义。
2 结果
2.1 早期宫颈癌子宫切除术后HR-HPV 未清除的单因素分析 术后100 例患者中HR-HPV 清除81 例,清除率为81.00%(81/100);未清除为19 例,未清除率为19.00%(19/100)。未清除组中年龄≥55 岁、首次性交年龄<20 岁、淋巴结转移、性伴侣人数≥2 人、孕次≥2 次、术后未接受辅助治疗、肿瘤浸润深度较深的人数占比均高于清除组,差异有统计学意义(P<0.05)。见表1。
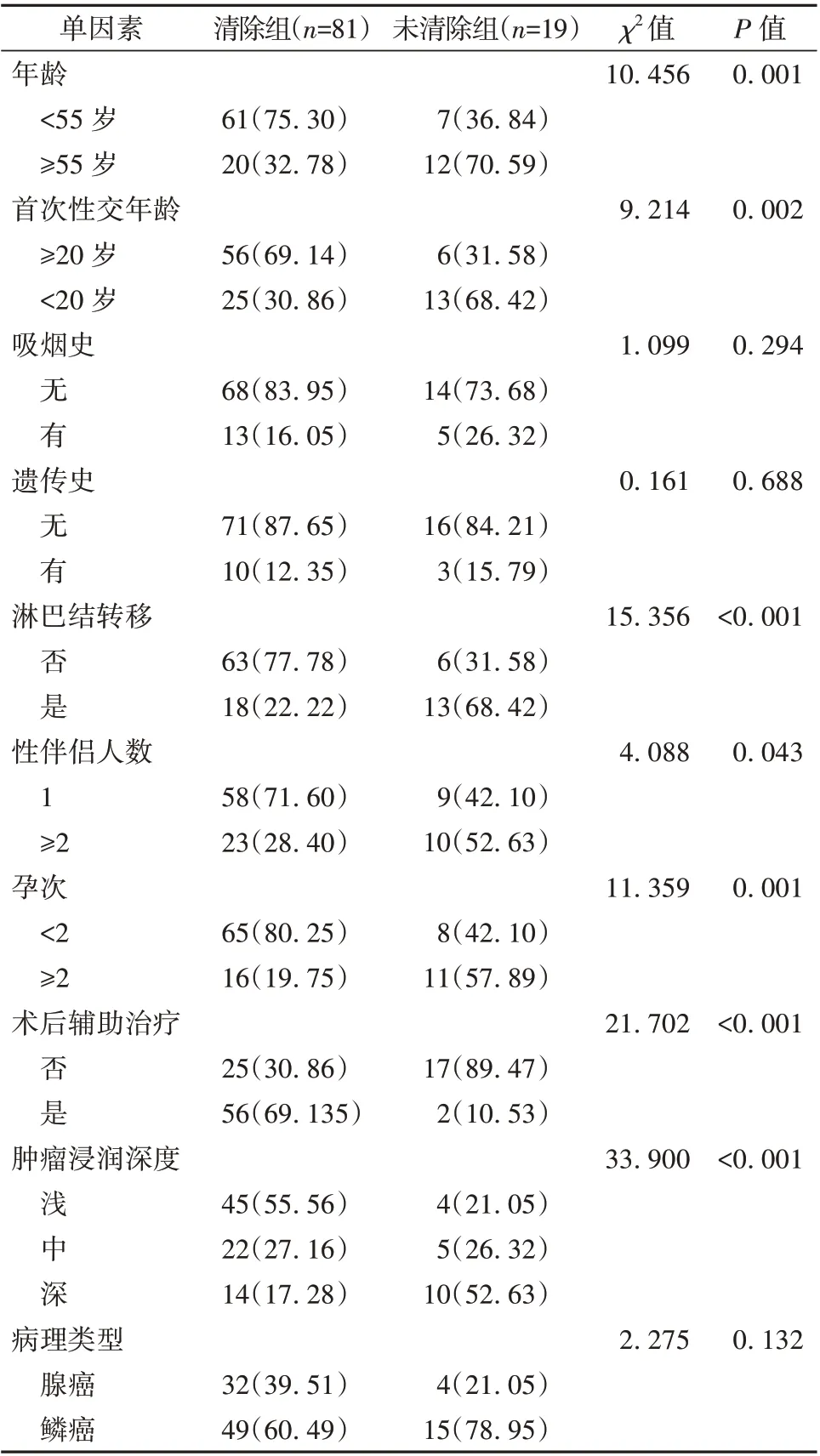
表1 早期宫颈癌子宫切除术后HR-HPV 未清除的单因素分析[例(%)]
2.2 早期宫颈癌子宫切除术后HR-HPV 未清除的多因素Logistic 回归分析 以HR-HPV 是否清除作为因变量,以上述有统计学意义项(年龄、首次性交年龄、淋巴结转移、性伴侣人数、孕次、术后接受辅助治疗、肿瘤浸润深度)作为自变量,并行量化赋值,即年龄(<55 岁=0,≥55 岁=1)、首次性交年龄(≥20 岁=0,<20 岁=1)、淋巴结转移(否=0,是=1)、性伴侣人数(1 人=0,≥2 人=1)、孕次(<2 次=0,≥2 次=1)、术后辅助治疗(是=0,否=1)、肿瘤浸润深度(浅、中=0,深=1),将其纳入Logisitic 回归模型中,发现年龄≥55 岁、首次性交年龄<20 岁、淋巴结转移、性伴侣人数≥2 人、孕次≥2 次、术后未接受辅助治疗、肿瘤浸润深度较深均是早期宫颈癌子宫切除术后HRHPV 未清除的危险因素(P<0.05)。见表2。
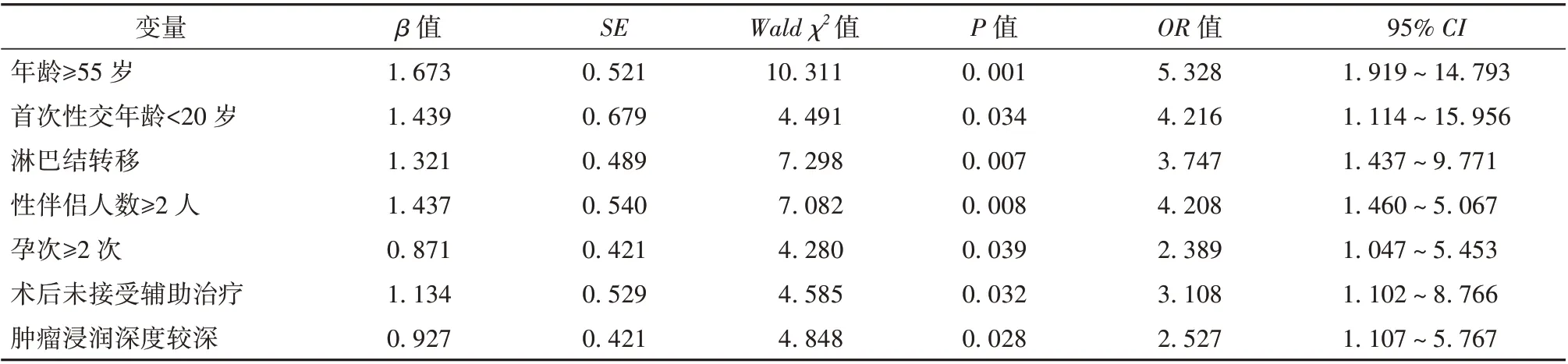
表2 早期宫颈癌子宫切除术后HR-HPV 未清除的多因素Logistic 回归分析
3 讨论
宫颈癌在全球内较为常见,具有较高的发病率及病死率。近年来,由于宫颈筛查在临床上广泛开展,在一定程度上降低了宫颈癌的发病率,但该病仍是危害女性健康的常见疾病[10]。随着分子生物学和分析流行病学的迅速发展,病毒感染与肿瘤关系逐渐受到重视。张一方等[11]研究证实,HR-HPV感染与宫颈癌的发生密切相关。临床上针对早期宫颈癌患者多采用子宫切除术,能有效切除病灶组织,阻断病情蔓延及清除HR-HPV[12]。但仍有相关因素会干扰,导致HR-HPV 不能彻底清除,致使患者预后不良[13]。
本研究显示,术后2 年内,100 例患者中HRHPV 清除81 例,清除率为81.00%(81/100),未清除为19 例,未清除率为19.00%。陈锐等[14]研究显示宫颈癌患者在根治术3 年内,HR-HPV 清除率为88.4%。这与本研究结果差异较小。同时,本研究单因素分析显示,未清除组年龄≥55 岁、首次性交年龄<20 岁、淋巴结转移、性伴侣人数≥2 人、孕次≥2 次、术后未接受辅助治疗、肿瘤浸润深度较深的人数占比均高于清除组;多因素Logisitic 回归分析证实,年龄≥55 岁、首次性交年龄<20 岁、淋巴结转移、性伴侣人数≥2 人、孕次≥2 次、术后未接受辅助治疗、肿瘤浸润深度较深均是早期宫颈癌子宫切除术后HR-HPV 未清除的危险因素。这与Avian 等[15]提出的HPV 阴性宫颈癌瘤体容易发生局部侵犯和淋巴结转移而导致预后较差的结论相似。患者年龄越大,抵抗力越弱,机体越易被HR-HPV 侵袭,形成病毒持续感染,进而延长HR-HPV 清除时间与影响清除效果[16]。本研究中临界年龄为55 岁,支持上述结论。在年龄较小时发生性交,其生殖道尚未发育成熟,对HR-HPV 抵抗能力较为薄弱,也会存在持续感染而影响HR-HPV 清除效果,同时性伴侣不固定,更容易感染HR-HPV 而影响清除效果[17];癌性肿瘤浸润较深者,也会使HR-HPV 隐藏在较高的水平,从而降低术后清除效果[18];当宫颈癌患者发生淋巴结转移时,说明患者病情较为严重,其HR-HPV 载量较高,单一的手术清除效果不佳,需联合其他治疗手段[19]。同时,多孕、多产的患者,更容易发生生殖道损伤和黏膜受损,易受到HR-HPV 的入侵,而影响手术后的清除效果[20]。
针对以上危险因素需采取有效干预措施,对于年龄较大的患者,子宫切除术前,应进行彻底的预治疗,以维持其内环境稳定和增加对手术的耐受性,提高HR-HPV 的清除率;应加强青少年性知识的科普与教育,提高对宫颈癌及HR-HPV 的认识;对于发生淋巴结转移及浸润较深的患者,应充分了解其肿瘤分期、浸润深度,综合考虑后再制定治疗方案;子宫颈切除后,应根据患者病情采取术后辅助治疗手段,如采取放射、化学、药物等治疗,以提高HR-HPV 的清除率。
综上所述,早期宫颈癌子宫切除术后患者受年龄、首次性交年龄、淋巴结转移、性伴侣人数、孕次、术后辅助治疗、肿瘤浸润深度等因素影响而使HRHPV 未能完全清除,应采取有效措施进行干预,提高术后HR-HPV 的完全清除率。
