调强放疗联合甲磺酸阿帕替尼治疗局部晚期胃癌的效果评价
2023-04-12么志军郭振江巴楠郑力豪孙满满李文
么志军 郭振江 巴楠 郑力豪 孙满满 李文
[摘 要] 目的:探讨调强放疗(intensity modulated radiation therapy,IMRT)技术联合甲磺酸阿帕替尼治疗局部晚期胃癌的临床疗效。方法:局部晚期胃癌患者124例,随机分为观察组和对照组各62例。对照组给予IMRT技术治疗,观察组在对照组基础上联合应用甲磺酸阿帕替尼治疗。比较两组治疗2个月后临床疗效、治疗前及治疗2个月后血清肿瘤标志物水平、1年总生存率(overall survival,OS)和无进展生存率(progression free survival,PFS)以及治疗毒副反应。结果:观察组治疗2个月后疾病控制率75.81%,客观缓解率51.61%,分别高于对照组的58.06%及32.26%,差异均有统计学意义(P<0.05)。治疗2个月后观察组血清癌胚抗原(carcinoembryonic antigen,CEA)、糖类抗原199(carbohydrate antigen 199,CA199)和CA724水平分别为6.06±1.52 ng/mL、29.72±3.49 U/mL和6.85±1.03 U/mL,对照组分别为7.86±1.50 ng/mL、34.08±4.11 U/mL和9.20±1.52 U/mL,两组均较治疗前下降,但观察组较对照组下降更为明显,差异均有统计学意义(P<0.05)。观察组1年PFS为74.19%,1年OS为77.42%,分别高于对照组的56.45%和56.45%,差异均有统计学意义(P<0.05)。两组毒副反应发生率比较,差异均无统计学意义(P>0.05)。结论:IMRT技术联合甲磺酸阿帕替尼治疗局部晚期胃癌可提高短期临床疗效,降低肿瘤标志物水平,改善患者生存情况,安全性良好。
[关键词] 局部晚期胃癌;调强放疗;甲磺酸阿帕替尼;疾病控制率;客观缓解率;无进展生存率;总生存率
[中图分类号] R735.2 [文献标志码] B [DOI] 10.19767/j.cnki.32-1412.2023.06.009
胃癌為临床常见的消化系统恶性肿瘤,由于早期症状缺乏特异性,大部分患者在确诊时已为局部晚期,失去手术治疗最佳时机[1]。与常规放疗相比,调强放疗(intensity modulated radiation therapy,IMRT)治疗局部晚期胃癌毒副作用更小,照射效果更佳[2]。但IMRT技术的高度适形可能遗漏一部分靶区,增加疾病复发的风险。甲磺酸阿帕替尼为新型分子靶向药物,通过抑制血管内皮细胞生长因子受体2(vascular endothelial growth factor receptor 2,VEGFR-2)来抑制肿瘤血管的生成[3]。目前IMRT技术联合甲磺酸阿帕替尼治疗老年食管癌、晚期肺癌的临床疗效已得到证实[4-5]。本研究选取我科2020年1月—2022年5月收治的局部晚期胃癌患者124例,探讨IMRT技术联合甲磺酸阿帕替尼的治疗效果。
1 资料与方法
1.1 一般资料 局部晚期胃癌患者124例,采用随机数字表法分为观察组与对照组各62例。观察组男性38例,女性24例,年龄38~69岁,平均53.13±6.36岁;体质量指数15.8~24.4 kg/m2,平均19.71±2.02 kg/m2;病理类型:腺癌20例,腺鳞癌15例,髓样癌14例,未分化细胞癌13例。对照组男性36例,女性26例,年龄41~68岁,平均52.97±6.46岁;体质量指数15.5~23.6 kg/m2,平均19.82±2.14 kg/m2;病理类型:腺癌19例,腺鳞癌14例,髓样癌15例,未分化细胞癌14例。两组一般资料比较,差异均无统计学意义(P>0.05),具有可比性。纳入标准:(1)符合《内科学(第9版)》[6]中胃癌诊断标准,且经由胃镜活检确诊;(2)影像学及消化道造影检查明确均为贲门部Ⅲ、Ⅳ期胃癌;(3)无法耐受化疗或经二线化疗失败者;(4)预计生存期>6个月;(5)卡氏功能状态评分>70分;(6)患者及家属均知情同意。排除标准:(1)合并严重心、肝、肾功能障碍或伴有其他恶性肿瘤;(2)病理类型为印戒细胞癌;(3)营养状况差,无法耐受放疗或靶向治疗;(4)既往接受过靶向治疗或放疗;(5)伴有自身免疫性疾病或血液系统疾病;(6)哺乳期或妊娠期女性。本研究经医院医学伦理委员会批准。
1.2 治疗方法
1.2.1 对照组:接受IMRT技术治疗,治疗前2 h嘱患者禁食并口服0.9%氯化钠注射液500 mL。采用热塑膜固定患者体位,CT扫描并采集图像,定位治疗靶区及危及器官。使用Primus-Hi直线加速器(德国西门子股份公司)6 MV X线进行放射治疗,设置照射野方向≥4个,单次放射剂量1.8~2.2 Gy,靶区及阳性淋巴结区总放射剂量为60~66 Gy,每天放射治疗1次,5次/周。
1.2.2 观察组:患者在IMRT放疗基础上口服甲磺酸阿帕替尼片(江苏恒瑞医药股份有限公司),初始剂量500 mg/次,1次/d, 1~2周后依据患者情况增加剂量,最高剂量为850 mg/次,于餐后半小时以温开水送服,连续服用至疾病进展或不耐受。
1.3 观察指标 (1)临床疗效:治疗2个月后患者复查影像学检查,依据实体瘤疗效评价标准[7]判定疗效,所有靶病灶消失为完全缓解(complete response,CR);靶病灶直径之和减少≥30%为部分缓解(partial response,PR);以整个研究过程中测得的最小靶病灶直径之和为参照,直径和相对增加≥20%且直径和绝对值增加≥5 mm判定为疾病进展(progressive disease,PD);靶病灶有减少但程度未达到PR,或有增加但程度未达到PD判定为疾病稳定(stable disease,SD)。疾病控制率=(CR+PR+SD)例数/总例数×100%,客观缓解率=(CR+PR)例数/总例数×100%。(2)肿瘤标志物:治疗前、治疗2个月后测定患者血清癌胚抗原(carcinoembryonic antigen,CEA)、糖类抗原199(carbohydrate antigen199,CA199)、CA724水平。(3)生存情况:治疗开始后随访1年,通过电话、门诊记录患者生存时间、复发转移发生情况,计算无进展生存率(progression free survival,PFS)及总生存率(overall survival,OS)。(4)毒副反应:观察患者治疗期间骨髓抑制、胃肠道反应(恶心、呕吐、便秘、食欲不振等)、皮肤症状(局部皮肤瘙痒、皮肤干燥、毛发脱落等)、肝损伤、高血压、蛋白尿发生情况。
1.4 统计学处理 应用SPSS 25.0统计学软件处理分析数据。计量资料经Shapiro-Wilk正态性检验,符合正态分布的计量资料以x±s表示,组间比较采用独立样本t检验,组内比较采用配对样本t检验;计数资料以n(%)表示,组间比较采用χ2检验或Fisher精确检验。P<0.05为差异有统计学意义。
2 结 果
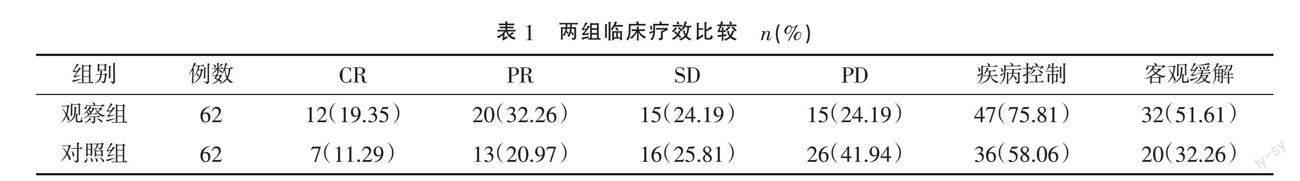
2.1 两组临床疗效比较 观察组疾病控制率及客观缓解率分别为75.81%和51.61%,分别高于对照组的58.06%(χ2=4.409)和32.26%(χ2=4.769),差异均有统计学意义(P<0.05)。见表1。
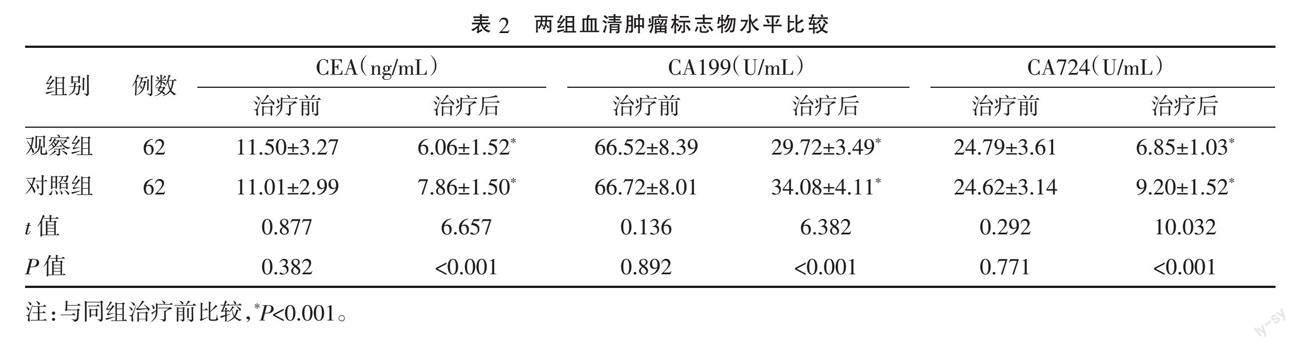
2.2 两组血清肿瘤标志物水平比较 两组治疗前血清CEA、CA199、CA724水平比较,差异均无统计学意义(P>0.05);治疗2个月后两组CEA、CA199、CA724水平均较治疗前下降,且观察组下降较对照组更明显,差异均有统计学意义(P<0.001)。见表2。
2.3 两组生存情况比较 随访1年,观察组16例疾病进展,1年PFS为74.19%,对照组27例疾病进展,1年PFS为56.45%,观察组1年PFS高于对照组,差异有统计学意义(χ2=4.308,P=0.038);观察组14例死亡,1年OS为77.42%,对照组27例死亡,1年OS为56.45%,观察组1年OS高于对照组,差异有统计学意义(χ2=6.158,P=0.013)。
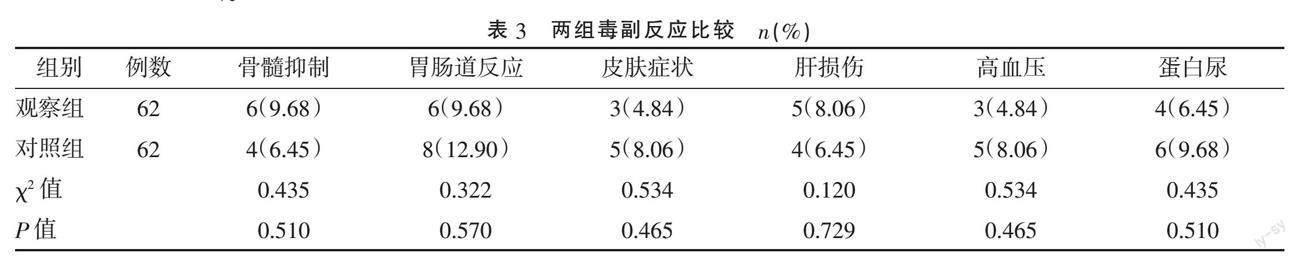
2.4 两组毒副反应比较 两组治疗期间毒副反应发生率比较,差异均无统计学意义(P>0.05)。见表3。
3 讨 论
IMRT技术在改善局部晚期胃癌患者生存质量、延长生存时间方面具有显著疗效,但仍有部分患者治疗效果不佳。当EGFR发生基因突变,导致EGFR通路失调,引起细胞异常增殖与转移,形成恶性肿瘤[8]。因此,抗血管生成、抑制EGFR基因突变成为延缓局部晚期胃癌患者病情进展的治疗靶点。甲磺酸阿帕替尼是针对EGFR突变的口服靶向药物,可选择性抑制EGFR活性,从而阻断细胞增殖和分裂,达到治疗目的[9]。
本研究结果显示,观察组治疗2个月后疾病控制率75.81%及客观缓解率51.61%,分别高于对照组的58.06%和32.26%,观察组血清CEA、CA199、CA724水平较对照组下降更为明显,观察组1年PFS为74.19%,高于对照组56.45%,差异均有统计学意义(P<0.05),表明IMRT技术联合甲磺酸阿帕替尼治疗可提高局部晚期胃癌临床疗效,延长患者生存时间,与张涛等[10-11]研究结果一致。与传统放疗相比,IMRT改善了靶区定位、勾画及放疗的实施方位,可调节射线束强度和形状,体内射线的空间分布在三维方向上与靶区外轮廓一致,每个小野均可得到均匀的放射剂量,提高了照射精准度,更全面杀灭肿瘤细胞,并有效减少对周围正常组织结构的照射[12]。甲磺酸阿帕替尼作为口服抗血管生成药物,通过与血管内皮生长因子竞争性结合VEGFR-2,阻断血管内皮生长因子信号通路,进而抑制肿瘤细胞生长与分裂,诱导肿瘤细胞凋亡[13]。甲磺酸阿帕替尼与IMRT技术联合应用可进一步减少肿瘤细胞增殖,固化放射杀灭肿瘤细胞的作用,抑制损伤肿瘤细胞修复,从而增加放疗敏感性,延长生存时间[14]。此外,两组治疗期间毒副反应发生率比较,差异均无统计学意义(P>0.05),表明IMRT技术联合甲磺酸阿帕替尼不会增加发生毒副反應风险,具有良好的安全性。
综上所述,IMRT技术联合甲磺酸阿帕替尼治疗局部晚期胃癌可提高短期临床疗效,降低肿瘤标志物水平,延长患者生存时间,且不增加毒副反应,安全性良好。
[参考文献]
[1] TAKAHARI D,KATAI H,TAKASHIMA A,et al. Perioperative TAS-118 plus oxaliplatin in patients with locally advanced gastric cancer:APOLLO-11 study[J]. Gastric Cancer,2023,26(4):614-625.
[2] 刘映,宋莹,张惠玲. 胃癌术后调强放疗自动与人工计划的剂量学比较[J]. 中华肿瘤防治杂志,2021,28(3):223-229.
[3] 刘昊川,介亚琼,韩新光. 放射性粒子植入联合抗血管生成靶向治疗在口腔颌面部恶性肿瘤患者中的应用效果[J]. 河南医学研究,2022,31(9):1587-1591.
[4] 王玉芳,刘美荣,李明君. 调强放疗联合小剂量阿帕替尼治疗老年食管癌的疗效观察[J]. 实用老年医学,2022,36(2):146-149.
[5] 杨永净,赵玲,许德权,等. 甲磺酸阿帕替尼联合放疗协同诱导结直肠癌细胞凋亡的体外研究及机制探讨[J]. 中国肿瘤,2022,31(10):839-845.
[6] 葛均波,徐永健,王辰. 内科学[M]. 9版. 北京:人民卫生出版社,2018:364-367.
[7] EISENHAUER E A,THERASSE P,BOGAERTS J,et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1)[J]. Eur J Cancer,2009,45(2):228-247.
[8] FATIMA I,BARMAN S,UPPADA J,et al. MASTL regulates EGFR signaling to impact pancreatic cancer progression[J].Oncogene,2021,40(38):5691-5704.
[9] 叶再生,曾奕,魏晟宏,等. 阿帕替尼联合奥沙利铂和替吉奥在胃癌腹膜转移转化治疗中的安全性及近期疗效观察[J]. 中华胃肠外科杂志,2021,24(3):240-247.
[10] 张涛,惠华,徐海亭,等. 调强放疗联合甲磺酸阿帕替尼治疗老年局部晚期贲门癌患者效果及对血管内皮生长因子受体的影响[J]. 肿瘤研究与临床,2018,30(2):99-102,106.
[11] 赵美琴,苏新华,杨杰,等. 榄香烯口服乳联合甲碘酸阿帕替尼治疗晚期胃癌的临床观察[J]. 南通大学学报(医学版),2023,43(5):430-433.
[12] 杜峰,王光明,魏曾曾. 调强放疗同步替吉奥或卡培他滨化疗治疗中老年晚期食管癌的临床研究[J]. 中国医刊,2022,57(4):389-392.
[13] 林文发,吴芳,蔡徐帆,等. 阿帕替尼联合SOX方案对胃癌伴腹膜转移患者进行转化治疗的临床疗效[J]. 中国医师杂志,2022,24(3):341-345.
[14] 丁利芳,张惠洁. 阿帕替尼联合SOX方案对晚期胃癌患者疗效的影响[J]. 中国现代应用药学,2022,39(5):653-657.
[收稿日期] 2023-07-04
(本文编辑 王晓蕴)
