结肠镜联合内镜超声对溃疡性结肠炎疾病严重程度的评估价值研究
2023-04-10杨黄欢邓中民危贵君朱晟易唐忠明丁文
杨黄欢 邓中民 危贵君 朱晟易 唐忠明 丁文
溃疡性结肠炎(ulcerative colitis,UC)是一种非特异性的结直肠炎症性病变,其发病原因不明,无特异性临床表现,且病程长,反复发作,现已成为世界范围内的公共卫生问题[1]。UC 诊断有赖于结肠镜及其病理活检,结肠镜下黏膜结构改变有助于判断炎症程度,但仅限于黏膜表层基本组织形态,难以准确判断肠壁结构损伤的严重程度及转归[2]。内镜超声融合了内镜及超声的特点,通过内镜引导下观测肠壁回声改变来判断UC 炎症浸润深度及评估疾病严重程度[3]。本研究回顾性分析UC 患者的结肠镜及内镜超声表现,结合疾病严重程度进行相关性研究,以期为提高UC 内镜下诊断的精确度提供客观的参考依据,现报道如下。
1 对象和方法
1.1 对象 选取2018 年7 月至2022 年4 月湖州师范学院附属第一医院收治的92 例UC 患者为研究对象。其中男51 例,女41 例;年龄23~84(42±13)岁。纳入标准:(1)符合UC 诊断标准;(2)同时进行了结肠镜及内镜超声检查的患者;(3)处于疾病活动期。排除标准:(1)肠道准备差影响观察者;(2)继发肠道肿瘤患者;(3)不能配合完成全结肠检查的患者。本研究经医院医学伦理委员会批准。
1.2 结肠镜与内镜超声检查方法
1.2.1 仪器设备 结肠镜检查采用日本奥林巴斯CFH260AI 电子结肠镜。超声检查仪器采用日本奥林巴斯UM-DP12-25R 超声微探头(12 MHz,旋转型)和日本奥林巴斯EU-ME2 EUS 影像处理器。
1.2.2 检查方法 患者术前1 天低渣半流质饮食,检查当天禁食,并提前6 h 服用复方聚乙二醇电解质散(江西恒康药业有限公司,批号:H20020031)溶液3 L进行肠道清洁准备,肠道清洁程度要求波士顿评分6分及以上[4]。患者行结肠镜检查过程中观察病变部位范围,有无黏膜充血、糜烂溃疡、出血等表现,并进行内镜评分,检查同时随时切换内镜超声扫查,充分注水后选取炎症最明显部位进行观察,摄取图片、记录相关数据完成报告书写。
1.3 实验室检查 抽取患者空腹静脉血5 ml,采用全自动生化仪(山东博科医疗器械有限公司,型号:BK-200)检测CRP、ESR、降钙素原(precipitation,PCT)水平。
1.4 UC 诊断与疾病活动度评估标准 UC 诊断标准参照我国2018 年版《炎症性肠病诊断和治疗共识意见》[5]。UC 疾病严重程度评估参照改良Truelove 和Witts 疾病严重程度分型标准[6],疾病范围的分布参考蒙特利尔(Montreal)分型[7]。采用UC内镜下严重程度指数(ulcerative colitis endoscopic index of severity,UCEIS)[8]进行结肠镜下评分。
1.5 观察指标
1.5.1 结肠镜下观察指标 包括结肠血管纹理、黏膜色泽形态、黏膜脆性,及有无糜烂、溃疡形成及自发性出血等情况。UCEIS 评分1~3 分:黏膜红斑,血管纹理减少,轻度脆性,见图1(插页)。 UCEIS 评分4~6 分:黏膜明显红斑,血管纹理消失,脆性糜烂,见图2(插页)。UCEIS 评分7~8 分:弥漫性充血糜烂,自发性出血,溃疡形成,见图3(插页)。
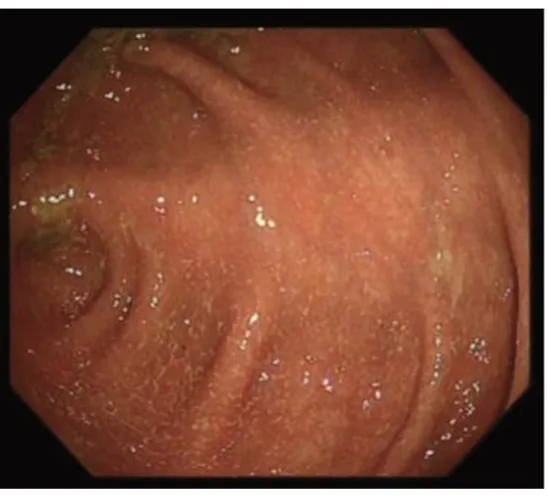
图1 溃疡性结肠炎内镜下严重程度指数评分1~3 分
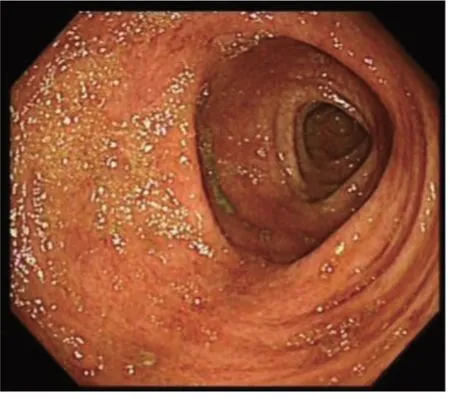
图2 溃疡性结肠炎内镜下严重程度指数评分4~6 分
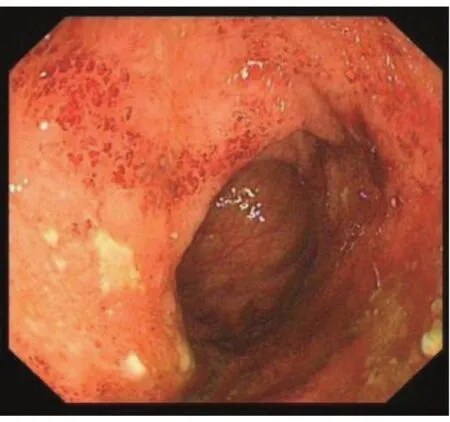
图3 溃疡性结肠炎内镜下严重程度指数评分7~8 分
1.5.2 内镜超声观察指标 (1)肠壁总厚度:于炎症范围内测肠壁最薄及最厚处取平均数,根据内镜超声图像上的比例尺在图像软件下进行放大矫正后计算肠壁总厚度[9],见图4、5。(2)肠壁炎症浸润深度,包括局限于黏膜层,见图6;浸润黏膜下层或深层,见图7;侵犯固有肌层,见图8;以及观察肠壁各层次间界限清晰度。

图4 超声内镜肠壁测量示意图
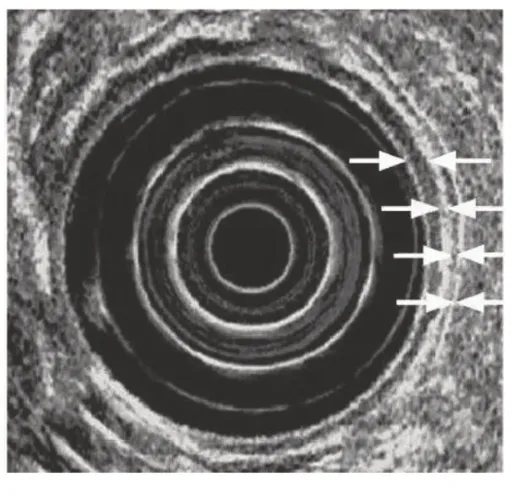
图5 超声内镜肠壁测量
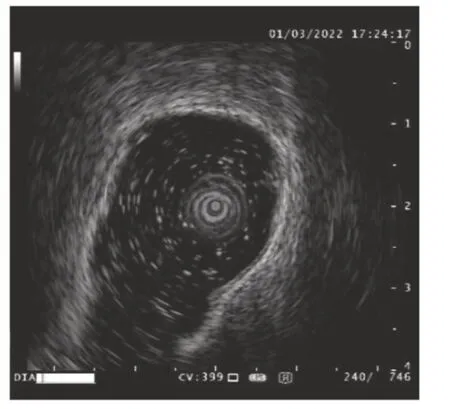
图6 病变局限于黏膜层
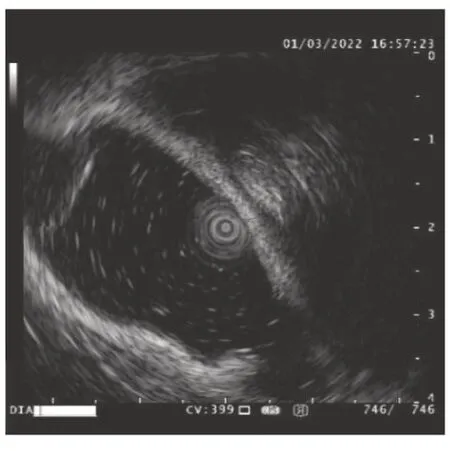
图7 病变侵犯黏膜下层或深层

图8 病变侵犯固有肌层
2 结果
2.1 UC 患者疾病情况 92 例患者根据改良Truelove和Witts 评分轻度31 例(33.7%),中度50 例(54.3%),重度11 例(12.0%);病变范围以左半结肠(E2)为主45 例(48.9%),广泛结肠型(E3)32 例(34.8%),直肠型(E1)15 例(16.3%);UCEIS 评分1~3 分29 例(31.5%),4~6 分53 例(57.6%),7~8 分10 例(10.9%)。
2.2 患者UCEIS 评分与疾病严重程度的相关性 轻度、中度、重度患者UCEIS 评分分别(2.79±0.61)、(4.10±0.81)、(6.41±0.42)分,Spearman 秩相关分析显示患者UCEIS 评分与疾病严重程度呈正相关(rs=0.712,P<0.05),UCEIS 评分越高,疾病越重。
2.3 UC 患者内镜超声观察所见 内镜超声下正常肠壁不增厚(<3 mm),层次间结构清晰。本组92 例UC患者中肠壁增厚89 例(96.7%),肠壁总厚度(4.51±0.85)mm,其中黏膜层平均厚度(1.34±0.28)mm,黏膜下层平均厚度(2.08±0.71)mm,固有肌层平均厚度(1.27±0.35)mm,总体以黏膜层及黏膜下层增厚为主,固有肌层未见明显增厚,且肠壁多呈连续对称性环周增厚。
2.4 UC 患者内镜超声下肠壁厚度参数与疾病严重程度的相关性 Spearman 秩相关分析显示,除固有肌层厚度外,UC 患者肠壁总厚度、黏膜层厚度、黏膜下层厚度与疾病严重程度均呈正相关(均P<0.05),厚度越厚,疾病越重。见表1。
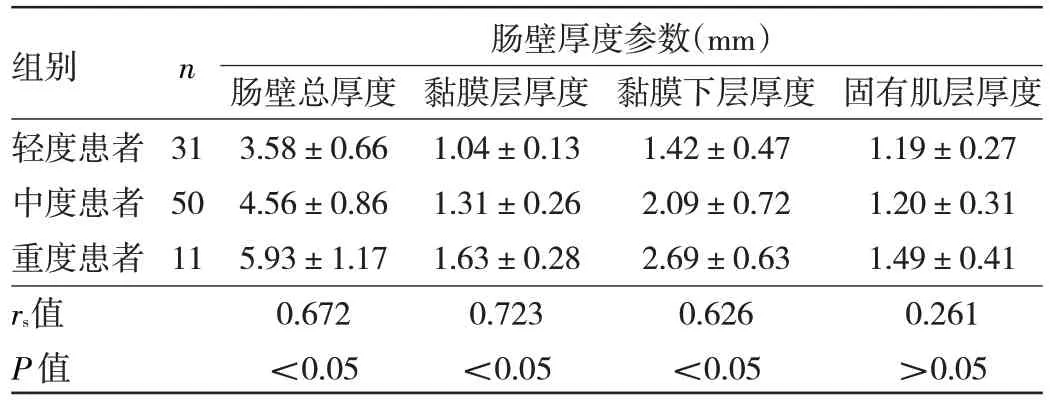
表1 UC患者内镜超声下肠壁厚度参数与疾病严重程度的相关性
2.5 不同疾病严重程度UC 患者内镜超声下肠壁各层次间界限清晰度比较 轻度、中度、重度UC 患者肠壁黏膜层与黏膜下层间界限清晰度比较差异有统计学意义(P<0.05),重度患者界限清晰度低于轻度、中度患者(均P<0.05)。而轻度、中度、重度UC 患者肠壁黏膜下层与固有肌层间界限清晰度比较差异无统计学意义(P>0.05)。见表2。
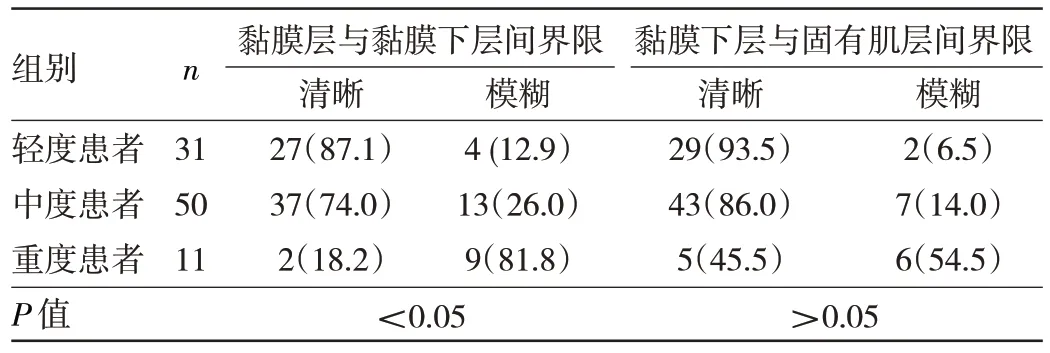
表2 不同疾病严重程度UC 患者内镜超声下肠壁各层次间界限清晰度比较[例(%)]
2.6 重度UC 发生的影响因素分析 单因素分析显示,患者年龄、病变范围、CRP、ESR、肠壁总厚度、黏膜层厚度、黏膜下层厚度、固有肌层厚度,及黏膜层与黏膜下层间界限模糊、黏膜下层与固有肌层间界限模糊是重度UC 发生的影响因素(均P<0.05),见表3。多因素分析显示,患者病变范围、ESR、肠壁总厚度、黏膜下层厚度及黏膜下层与固有肌层间界限模糊是发生重度UC 的独立影响因素(均P<0.05),见表4。
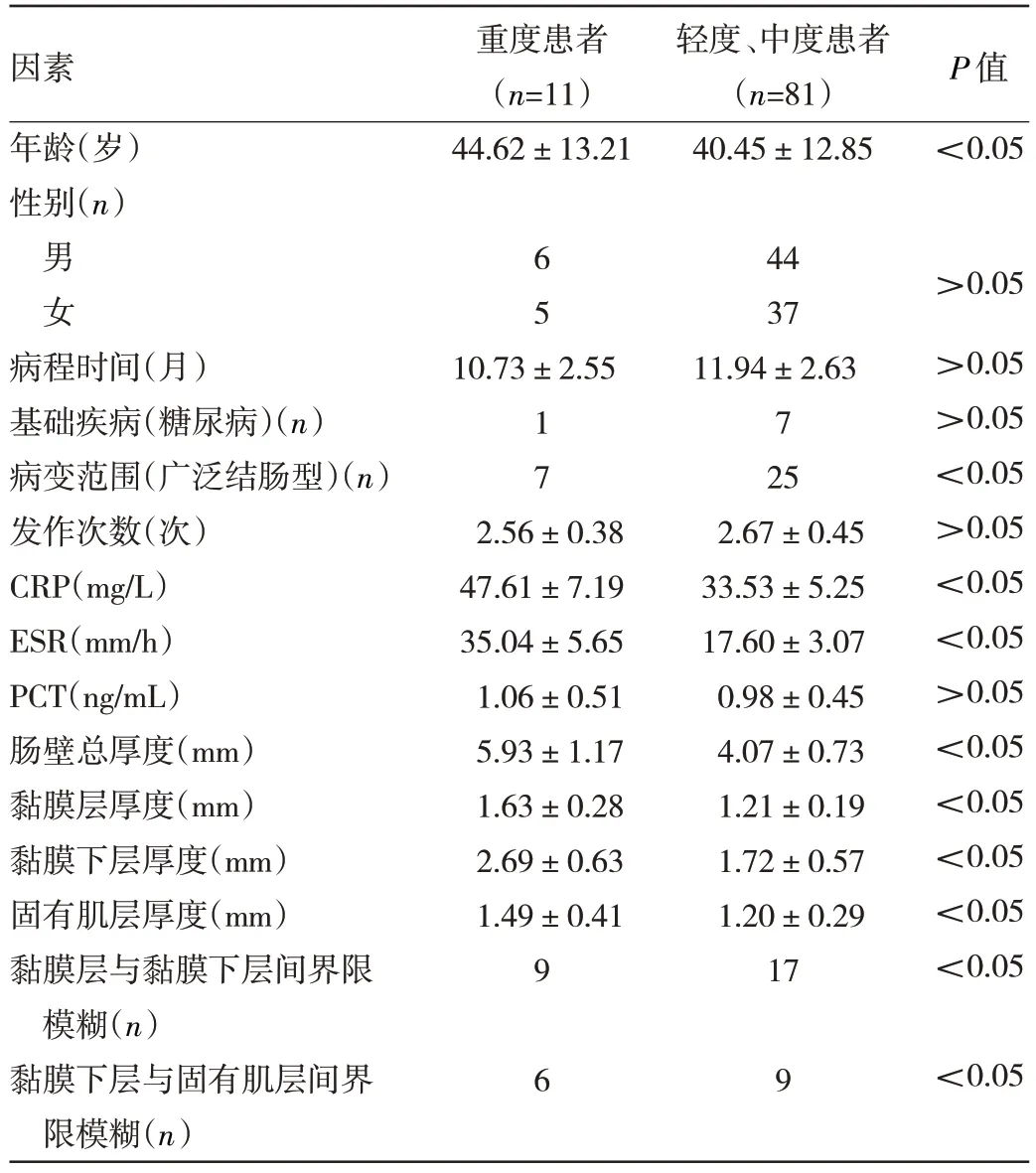
表3 重度UC 发生的影响因素单因素分析
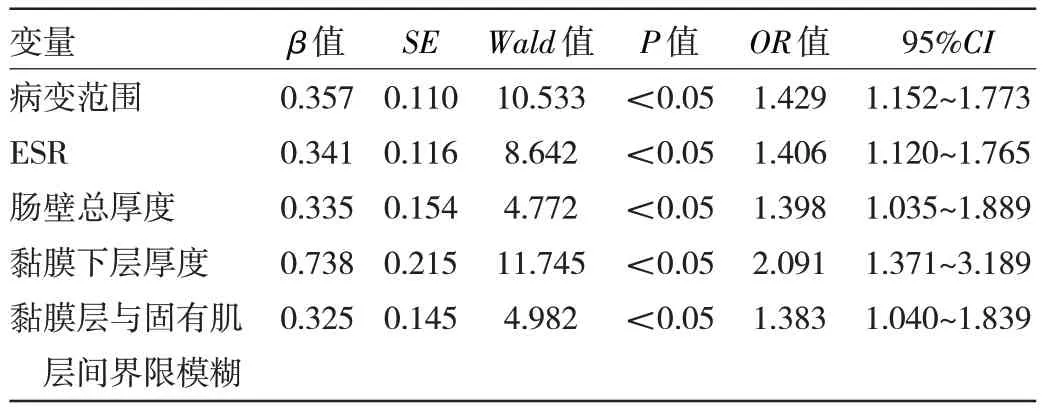
表4 重度UC 发生的影响因素多因素分析
2.7 发生重度UC 的预测模型建立及诊断效能分析将病变范围、ESR、肠壁总厚度、黏膜下层厚度及黏膜下层与固有肌层间界限模糊这几个指标,采用多因素logistic 回归分析建立发生重度UC 的预测模型,采用ROC 曲线评估模型的诊断效能,诊断发生重度UC 的灵敏度为0.833,特异度为0.650,AUC 为0.821(95%CI:0.713~0.928),该模型具有较好的诊断效能(P<0.05),见图9。
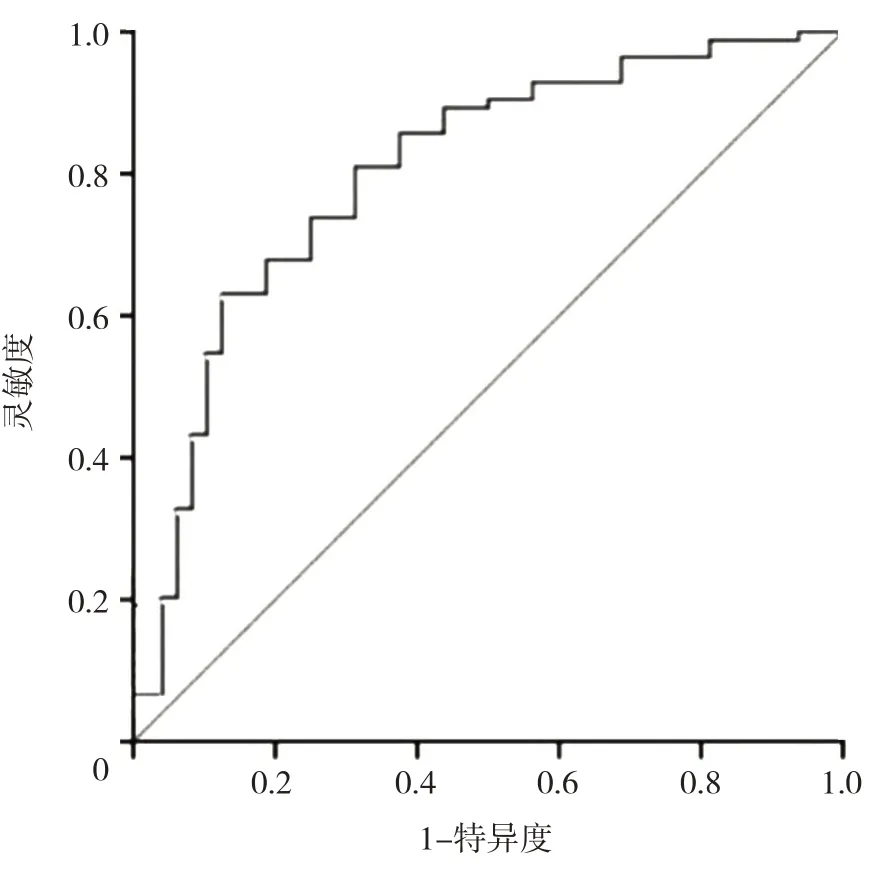
图9 重度溃疡性结肠炎预测模型的ROC 曲线
3 讨论
临床上UC 诊断缺乏金标准,主要依据临床、影像学、实验室检查,特别是内镜和组织病理学检查等进行综合判断,尤其是在排除其他疾病的基础上作出诊断[10]。UC 结肠镜下表现为绝大多数直肠受累的结肠连续性炎症性改变,黏膜弥漫性充血、粗糙伴黏液附着,质脆易出血,血管纹理模糊、消失,可见糜烂、溃疡形成,甚者肠管僵直,假性息肉或黏膜桥形成[11]。目前有多种内镜评分系统用于评价UC 内镜下严重程度[12]。本研究采用UCEIS 评分进行评估,并显示该评分系统与临床病情严重程度间呈正相关,适合作为UC患者判断疾病严重程度的有效方法。
近年来,随着内镜超声技术的日趋成熟,其在炎症性肠病特别是UC 的诊断和病情评估上显现出一定的价值。Brenmer 等[13]提出,当肠壁总厚度>3.0 mm,判断UC 活动期或缓解期的灵敏度为0.49,特异度为0.93。部分学者研究了经腹壁超声对于UC 诊断的价值,结果提示肠壁局灶血运丰富和肠壁增厚(>3 mm)对于判断疾病活动度有帮助[14]。但经腹超声频率偏低,受脂肪厚度、腔内气体等干扰因素多,回声清晰度不如经内镜超声,内镜超声小探头贴近观察可以使消化道管壁的层次结构清晰地显示出来,通过观测肠壁增厚程度及炎症浸润深度来判定UC 分期及预测炎症程度,且操作简便,过程无痛苦。本研究对UC 患者进行常规结肠镜检查外加超声内镜观察,发现UC 病变绝大多数肠壁增厚,平均厚度>4 mm,大多以黏膜层及黏膜下层增厚为主,呈现连续对称性环周增厚,而固有肌层增厚并不明显,这与UC 的非透壁性炎性病变,并呈弥漫性对称分布等特点相符。因此对于炎症深度的评估内镜超声较普通白光内镜显现出优势。
UC 病变大多限于结肠黏膜与黏膜下层,其固有层中炎症细胞大量浸润,隐窝炎或脓肿形成致黏膜组织广泛异常[15]。虽然内镜及病理组织学检查可间接评估UC 侵犯深度,但是难以判断因肿胀、渗出、脓肿或纤维化等导致的肠壁结构改变。Dagli 等[16]提出肠壁厚度评定准则:<3.1 mm 为正常,缓解期在3.1~5.2 mm,疾病活动>5.3 mm,能获取0.98 的特异度和0.606 的灵敏度。本研究在UC 患者不同疾病严重程度分组比较中发现,肠壁厚度最厚是重度患者,之后为中度、轻度患者;在黏膜层及黏膜下层厚度比较中有相同特点。说明肠壁各厚度参数除固有肌层外均与UC 病情严重程度呈显著正相关,超声内镜测定肠壁厚度对于UC疾病活动性评价有帮助。而固有肌层厚度在轻、中度患者中比较无明显差异,重度患者较之增厚。UC 炎症主要累及肠壁浅层,而本研究发现重度患者肌层增厚可能与炎症浸润黏膜下深层影响肌层或累及浆膜层致回声减低有关。
另外,在UC 患者肠壁层次间界限清晰度比较中,随疾病严重程度的加重,黏膜层与黏膜下层间的界限清晰度进行性下降,因此观察肠壁层次间界限清晰度有助于评估疾病严重度。但黏膜下层与固有肌层间的界限清晰度在轻、中度患者间无明显差异,在重度患者中则明显减低,究其原因可能是UC 大多数为非透壁性炎症,病变相对表浅,非重度患者炎症主要限于黏膜下深层以上所致。
本研究logistic 多因素分析显示,ESR、病变范围、肠壁总厚度、黏膜下层厚度及黏膜下层与固有肌层间界限模糊是发生重度UC 的独立影响因素,经ROC 曲线分析该预测模型具有较好的诊断价值。临床上应对上述指标进行检测,特别是关注内镜及内镜超声下肠壁改变,以准确发现重度患者,及时干预以提高疗效,改善预后。
综上所述,UC 的诊断及病情评估仍是临床工作的重点,而结肠镜检查尤为重要,UCEIS 评分与疾病严重程度有较好的相关性,可作为临床上评价病情的有效工具。内镜超声检查通过测量肠壁各层厚度及观察肠壁层次间界限清晰度来判断疾病严重程度,很好地弥补白光内镜下UC 垂直浸润深度诊断方面的不足。此外借助内镜及内镜超声检查可准确发现重度患者加以干预。所以结肠镜联合内镜超声检查可提高内镜下诊断精准度,对评估UC 严重程度和治疗方案的制定具有较好的临床指导意义。
