脾脏影像纹理特征预测肝硬化患者食管静脉曲张严重程度的研究
2023-04-10张华妮李嘉颖周敏辉陈海波孙志超
张华妮 李嘉颖 周敏辉 陈海波 孙志超
食管静脉曲张破裂出血是肝硬化门静脉高压症死亡的主要原因,6 周死亡率高达15%~25%[1]。食管静脉曲张严重程度可分为轻度、中度及重度,轻中度和重度患者每年出血的风险分别为5%和15%[2]。早期预测食管静脉曲张严重程度并提早干预可明显改善患者预后。肝内血流阻力增高是肝硬化早期门静脉高压形成的主要原因,出现食管静脉曲张等侧支循环开放时影响门静脉高压的主要因素则是肝外因素,如脾脏内的高动力血流循环和血管扩张[3]。研究表明,脾脏硬度与门静脉高压及食管静脉曲张密切相关[4],临床上脾脏硬度值的测量主要通过超声弹性成像技术,然而易受操作者的主观性以及患者自身条件(如肥胖、腹水等)的影响[5]。内镜检查结果是评估食管静脉曲张程度的“金标准”[3],但患者往往不易耐受。因此,临床亟需一种新的无创性的方法来评估肝硬化患者食管静脉曲张严重程度。尽管临床已有许多无创性血清学诊断指标,如天门冬氨酸氨基转移酶-丙氨酸氨基转移酶比值(aspartate aminotransferase to alanine aminotransferase ratio,AAR)、肝纤维化4 因子(fibrosis index based on four factors,FIB-4)、肝纤维化指数(fibrosis index,FI)等用于预测食管静脉曲张严重程度,但尚未达成共识[6]。影像纹理特征是无创、客观和可重复的影像生物学指标,可间接反映病理生理改变,并已被广泛用于肝脏疾病的诊断和评估[7-8]。因此,本研究基于脾脏影像纹理特征构建肝硬化食管静脉曲张严重程度的预测模型,并探讨其临床应用价值,现报道如下。
1 对象和方法
1.1 对象 回顾性收集2015 年1 月至2021 年5 月浙江中医药大学附属第一医院收治的肝硬化患者1 385例。纳入标准:(1)符合《肝硬化诊治指南(2019 版)》[9]的临床诊断标准;(2)内镜检查结果显示存在食管静脉曲张;(3)所有患者均接受腹部CT 检查,与内镜检查时间间隔不超过1 个月。排除标准:(1)有门静脉高压相关治疗史,如经颈静脉肝内门体分流术、脾切除、部分脾栓塞等;(2)自发形成脾肾胃异常分流;(3)临床资料和影像资料不全;(4)有肝脏及脾脏肿瘤史;(5)合并有严重心脑血管疾病、肾功能衰竭和造血系统疾病等原发性疾病。根据纳排标准,本研究最终纳入73 例患者,其中男46 例,女27 例;年龄30~97 岁。本研究经医院医学伦理委员会批准(批件号:2020-KL-049-01)。
1.2 方法
1.2.1 无创性血清学指标收集 患者无创性血清诊断指标包括AAR、FIB-4、FI、天门冬氨酸氨基转移酶-血小板比值(aspartate aminotransferase-platelet ratio index,APRI)、King 指数、Lok 指数[10]。收集血生化指标:白蛋白(albumin,ALB)、TBil、AST、ALT、γ-谷氨酰转肽酶(gamma-glutamyl transpeptidase,GGT)。凝血类指标:PT、国际化标准比值(international standard ratio,INR)、Fib。血常规参数:PLT、血小板压积(platelet specific volume,PCT)。具体计算公式如下:(1)AAR=AST/ALT;(2)FIB-4=(年龄×AST)/(PLT×ALT1/2);(3)FI=8-0.01×PLT-ALB;(4)APRI=[(AST/ULN)×100]/PLT(ULN=AST 的正常上限值);(5)King 指数=年龄×AST×INR/PLT;(6)Lok 指数=-5.56-0.0086×PLT+1.26×AST/ALT+5.27×INR。
1.2.2 腹部CT 检查 多层螺旋CT 扫描仪(日本东芝公司Aquilion ONE 320 和德国西门子公司SOMATOM Sensation 64),扫描参数:管电压120 kV,自动管电流100~250 mA,准直0.5 mm×80 或0.6 mm×64,矩阵512×512,常规层厚5.0 mm、薄层重建层厚1.0 mm、层间距0.8 mm,重建算法为软组织算法。
1.2.3 内镜检查 胃镜检查采用CV290 电子胃镜(日本Olympus 公司),由10 年以上工作经验的消化内科医师进行胃镜检查。根据日本门静脉高压研究会提出的标准,将患者分为轻度食管静脉曲张组(EV1组)、中度食管静脉曲张组(EV2 组)和重度食管静脉曲张(EV3 组):EV1,轻度线状扩张;EV2,中度串珠扩张;EV3,显著结节状或瘤状扩张[11]。根据食管静脉曲张破裂出血的风险,将患者进一步分为高危食管静脉曲张组(EV2、EV3 和EV1 并伴有红色征)和低危食管静脉曲张组(EV1 不伴有红色征)[12]。
1.2.4 脾脏影像纹理特征的提取和模型构建
1.2.4.1 图像分割 将腹部CT 平扫图像以DICOM 格式通过影像归档和通信系统(picture archiving and communication system,PACS)下载并导入ITK-SNAP(Version 3.4.0)软件中,由1 名放射诊断医师在脾门层面沿着脾脏边缘进行感兴趣区(region of interest,ROI)的手动勾画,勾画时避开周围大血管及脏器,并由另一名放射诊断医师进行图像审核。将勾画好的ROI 图像保存为NIFTI 格式。
1.2.4.2 特征提取 将保存为NIFTI 格式的ROI 图像和原图像一起导入多模态科研平台(Version 1.6.3.6),使用Python 软件包PyRadiology(2.2.0 版)进行特征提取,提取的特征包括一阶统计量、形状特征、灰度共生矩阵、灰度游程矩阵、灰度连通区域矩阵、灰度依赖矩阵、转换类型、小波变换、局部二值模式等,共1 379 个特征值。
1.2.4.3 特征筛选及模型构建 (1)数据预处理:使用Z-SCORE 方法对所提取的特征进行归一化处理。(2)特征选择:为了消除特征之间严重的共线性,先计算特征之间的线性相关系数ρ,当ρ≥0.90 时剔除其中1个特征,直到所有特征之间的线性相关系数<0.90;再使用方差分析进行特征选择。最后将所有患者以7∶3随机分为训练组与验证组,随机次数设置为5。(3)影像组学模型构建:基于筛选后保留的组学特征值通过LinearSVC 方法进行影像组学模型构建,并对模型进行验证。
1.3 观察指标 (1)比较低危食管静脉曲张组与高危食管静脉曲张组一般资料;(2)分析无创性血清学指标对肝硬化食管静脉曲张严重程度的诊断效能。(3)筛选出与肝硬化食管静脉曲张严重程度相关的脾脏影像纹理特征参数,并分析其构建的模型对肝硬化食管静脉曲张严重程度的诊断效能。
2 结果
2.1 低危食管静脉曲张组与高危食管静脉曲张组一般资料比较 在73 例肝硬化食管静脉曲张患者中,低危食管静脉曲张组23 例(31.5%),高危食管静脉曲张组50 例(68.5%)。两组患者性别、年龄、肝炎类型、ALB、TBil、AST、ALT、GGT、PT、INR、PLT、PCT 比较差异均无统计学意义(均P>0.05),高危食管静脉曲张组患者Fib 水平低于低危食管静脉曲张组,差异有统计学意义(P<0.05)。见表1。
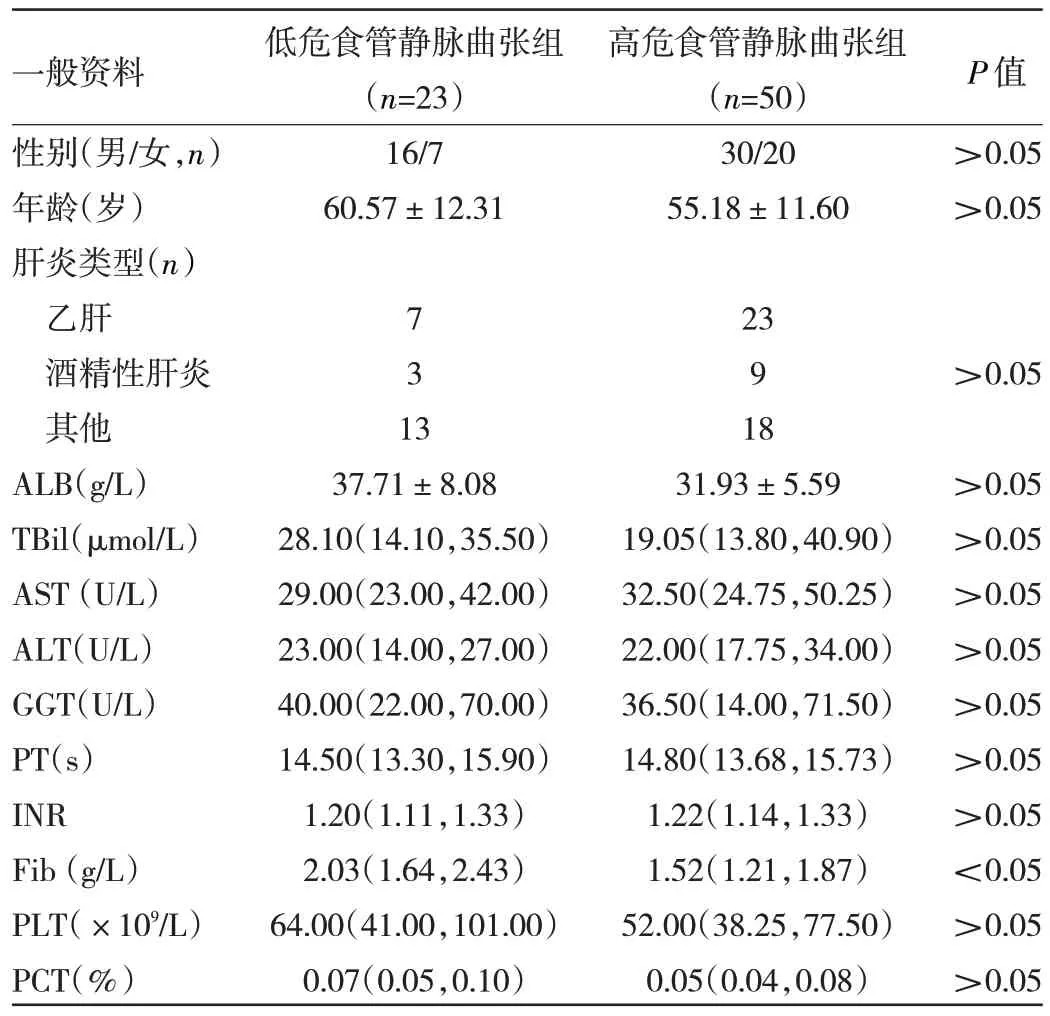
表1 低危食管静脉曲张组与高危食管静脉曲张组一般资料比较
2.2 无创性血清学指标对肝硬化食管静脉曲张严重程度的诊断效能分析 ROC 曲线分析显示,APRI 的预测效能最高,AUC 为0.631(95%CI:0.499~0.763),灵敏度0.480、特异度0.826、阳性预测值0.857、阴性预测值0.422。FI 的 预测 效 能最 低,AUC 为0.477(95%CI:0.314~0.641),灵敏度0.820,特异度0.348,阳性预测值0.723,阴性预测值0.470,见图1(插页)、表2。
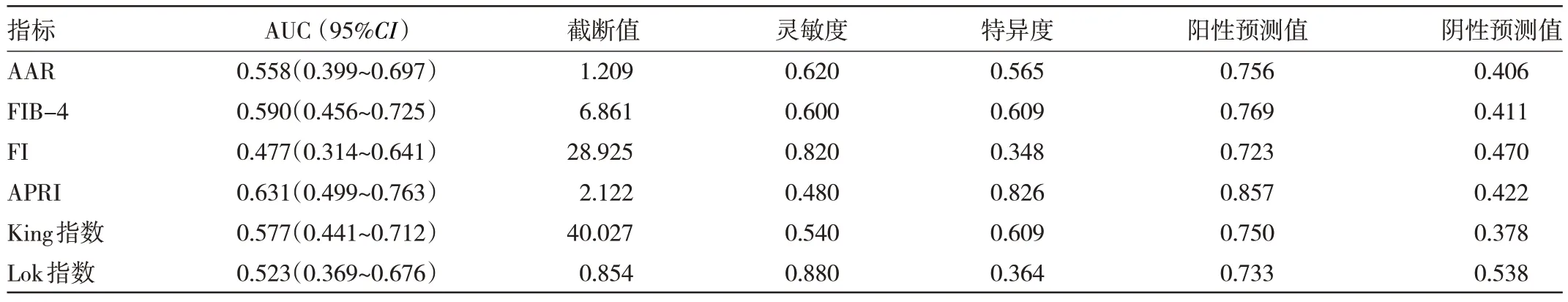
表2 无创性血清学指标对肝硬化食管静脉曲张严重程度的诊断效能分析
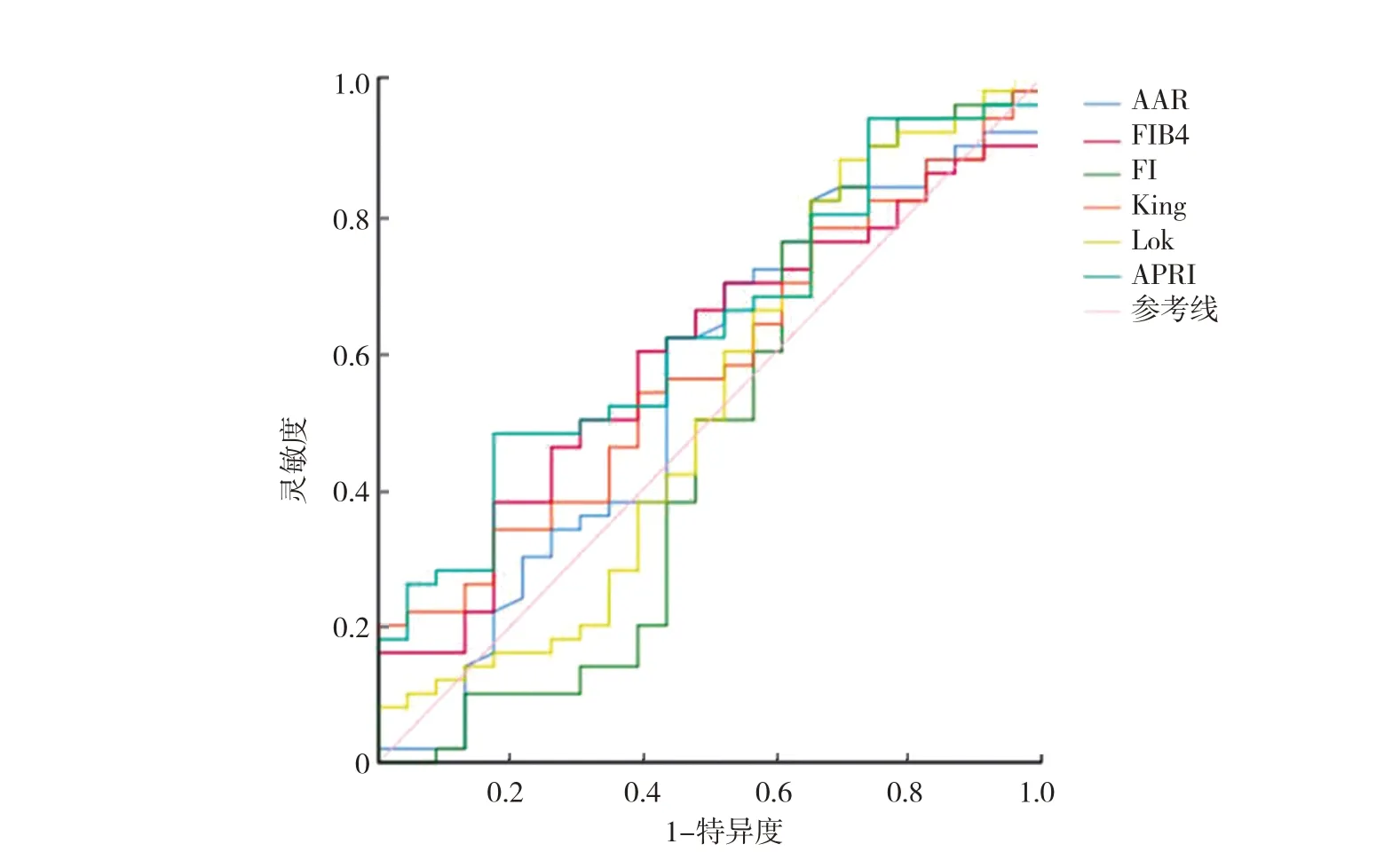
图1 无创性血清学指标诊断肝硬化食管静脉曲张严重程度ROC 曲线
2.3 脾脏影像纹理特征参数筛选结果及构建的模型对肝硬化食管静脉曲张严重程度的诊断效能分析1 379 个影像纹理特征参数中,最终筛选出8 个与肝硬化食管静脉曲张严重程度显著相关,见表3,其中wavelet-LLH_glszm_SizeZoneNonUniformity 特征参数相关性最高(r=0.437,P<0.05)。基于筛选的8 个影像纹理特征参数构建LinearSVC 模型,训练组AUC 为0.870(95%CI:0.773~0.967),灵敏度0.823,特异度0.765;验证组AUC 为0.876(95%CI:0.723~1.000),灵敏度0.867,特异度0.714;见图2(插页)。

表3 基于方差分析筛选具有统计学差异的与肝硬化食管静脉曲张严重程度相关的脾脏影像纹理特征参数
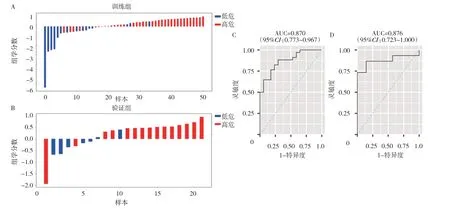
图2 脾脏纹理特征模型瀑布图及ROC 曲线(A、C:训练组;B、D:验证组)
3 讨论
食管静脉曲张是肝硬化门静脉高压引起的主要侧支循环,当门静脉高压形成门-体侧支循环后,内脏小血管舒张,门静脉血流量增加促使门静脉压力增高[3]。脾脏是重要的血液储存器官,随着肝硬化门静脉压力的增加,脾淋巴组织增大和过度激活以及血管生成和纤维化增加,导致脾脏的被动充血,最终引起脾脏体积的增大[13]。因此,脾脏的变化可以间接反映食管静脉曲张的严重程度。
本研究在腹部CT 平扫的图像上进行脾脏影像纹理特征的提取,相对于增强CT 而言,CT 平扫可以避免对比剂对人体肾脏的毒性损害。本研究共提取出8 个与肝硬化食管静脉曲张严重程度具有相关性的影像纹理特征参数,主要为wavelet 转换特征,小波转换特征是高阶特征,能够反映图像多领域多尺度的信息[14],可反映脾脏内部结构细节变化(血管增生和纤维化)的差异程度;original_shape 形态学特征,可反映脾脏形态、大小和规则度等信息,从而反映脾脏的纤维化程度[15];lbp 特征为局部二值模式,具有旋转不变性和灰度不变性等优点[16],可稳定地呈现脾脏局部纹理特征的改变。肝硬化患者出现食管静脉曲张侧支循环开放时,脾脏是影响门静脉高压的主导因素。随着门静脉压力的增加,患者不仅会出现脾脏的形态增大,而且脾内的血管生成和纤维化也逐渐增加。既往研究也发现高危食管静脉曲张患者的脾脏硬度值较低危患者高[4],与本研究发现的8 个脾脏纹理特征参数与食管静脉曲张严重程度呈正相关的结果类似。因此,脾脏纹理特征参数可以客观反映不同程度食管静脉曲张患者的异质性。
基于8 个脾脏CT 平扫影像纹理特征构建的影像组学模型,在训练组和验证组中的AUC 均高于0.850,表明影像组学模型在无创性评估肝硬化食管静脉曲张严重程度上具有比较稳定的预测能力。Liu 等[17]通过一项前瞻性的多中心研究发现基于CT 的影像组学模型在预测门静脉高压症方面表现良好,AUC 为0.849(95%CI:0.786~0.911),可作为一种无创性预测门静脉高压症的方法。Tseng 等[18]构建了一项CT 影像组学模型来无创性预测门静脉高压及患者结局,同样发现该模型具有比较好的诊断效能(AUC= 0.866);与本研究构建的脾脏CT 影像组学模型的预测能力类似。无创性血清学指标(AAR、FIB-4、FI、APRI、King 评分、Lok评分)在预测肝硬化食管静脉曲张中也有一定的应用价值[19]。但在本研究中,无创性血清学指标模型的AUC 均在0.700 以下。Bledar 等[20]采用AAR、FIB-4、FI 、APRI、King 评分指标来预测食管静脉曲张破裂出血分险,同样发现其AUC 均比较低,范围在0.450~0.550,这与本研究结果是相似的。这些血清学指标预测肝硬化食管静脉曲张严重程度的效能均不高,可能是因为不能排除其他混杂因素导致的血清学指标变化,如抗病毒治疗的时间不一致等[20]。因此,在预测食管静脉曲张严重程度方面,本研究构建的无创性脾脏影像纹理特征模型较血清学指标更稳定且具有更大的应用潜能。
本研究也存在局限性:第一,本研究为回顾性研究,且样本量较少,缺少外部验证;第二,针对肝硬化患者未进行代偿期和失代偿期的分层研究;第三,没有对肝硬化的不同病因(酒精性、HBV等)进行分类分析;第四,未对患者进行弹性成像检查获得脾脏硬度值。
综上所述,脾脏影像纹理特征模型对肝硬化食管静脉曲张严重程度有一定的预测价值,可以辅助临床医生为肝硬化食管静脉曲张患者早期精准地制定个体化诊疗方案,以降低食管静脉曲张破裂出血的风险,提高肝硬化门静脉高压症患者的生活质量。
