球等鞭金藻CRY1与COP1互作及生物信息学分析
2023-03-15李欢李龙玉钟洁陈由强余雪冰何文锦陈建楠
李欢 李龙玉 钟洁 陈由强 余雪冰 何文锦 陈建楠

李歡,李龙玉,钟洁,等.球等鞭金藻CRY1与COP1互作及生物信息学分析[J].福建农业科技,2023,54(12):07-14.
收稿日期:2023-11-02
作者简介:李欢,女,1999年生,硕士,主要从事分子生物学研究。
*通信作者:陈建楠,男,1991年生,硕士,实验师,主要从事三角褐指藻培育研究(E-mail:381220681@qq.com)。
基金项目:福建省自然科学基金项目(2023J01509)。
摘 要:为验证球等鞭金藻的隐花色素蛋白IgCRY1与下游蛋白IgCOP1是否互作,通过提取球等鞭金藻的总RNA反转录成cDNA为模板,扩增目的片段,构建BD-IgCRY1和AD-IgCOP1载体,共同转入AH109酵母菌株进行酵母双杂验证,并对IgCOP1蛋白进行生物信息学分析。结果显示:从球等鞭金藻中克隆到IgCRY1和IgCOP1的CDS序列分别为1560 bp和1185 bp。通过酵母双杂验证了IgCRY1蛋白和IgCOP1蛋白相互互作。对互作蛋白IgCOP1进行生物信息学分析,发现该蛋白的分子量大小为43.7 kDa,编码的氨基酸个数为394个,二级结构62.69%为不规则卷曲,是典型的亲水性蛋白。系统发育树分析显示IgCOP1蛋白聚于分支底部,与其他分支的亲缘关系较远。IgCRY1蛋白和IgCOP1蛋白相互互作的验证,为球等鞭金藻的光信号调控生物学过程提供了重要的理论基础。
关键词:球等鞭金藻;酵母双杂;IgCRY1蛋白;IgCOP1蛋白;生物信息学分析
中图分类号:Q 943.2 文献标志码:A 文章编号:0253-2301(2023)12-0007-08
DOI: 10.13651/j.cnki.fjnykj.2023.12.002
Interaction and Bioinformatics Analysis of CRY1 and COP1 in Isochrysis Galbana
LI Huan1,2,3,4, LI Long-yu1,2,3,4, ZHONG Jie1,2,3,4, CHE You-qiang1,2,3,4,YU Xue-bing1,2,3,4, HE Wen-jin1,2,3,4, CHEN Jian-nan1,2,3,4*
(1. College of Life Science, Fujian Normal University, Fuzhou, Fujian 350117, China; 2. Public Service
Platform for Industrialization Development Technology of Marine Biological Medicine and Products,
Fuzhou, Fujian 350117, China; 3. Fujian Key Laboratory of Special Marine Bioresource Sustainable
Utilization, Fuzhou, Fujian 350117, China; 4. Fuzhou Institute of Marine Research, Marine Active
Substances and Products Technology R & D Center, Fuzhou, Fujian 350117, China)
Abstract: In order to verify whether the cryptochrome protein IgCRY1 of Isochrysis galbana interacted with the downstream protein IgCOP1, the total RNA of Isochrysis galbana was extracted and reverse transcribed into cDNA as a template to amplify the target fragment. The BD-IgCRY1 and AD-IgCOP1 vectors were constructed and co-transfected into the yeast strain AH109 for the yeast two-hybrid verification. And the bioinformatics analysis of IgCOP1 protein was performed. The results showed that the CDS sequences of IgCRY1 and IgCOP1 cloned from Isochrysis galbana were 1560 bp and 1185 bp, respectively. The mutual interaction between IgCRY1 protein and IgCOP1 protein was verified by the yeast two-hybrid system. The bioinformatics analysis of the interacting protein IgCOP1 revealed that the molecular size of the protein was 43.7 kDa, and the number of encoded amino acids was 394, which was a typical hydrophilic protein with 62.69% of its secondary structure irregularly coiled. The phylogenetic tree analysis showed that IgCOP1 protein was clustered at the bottom of the branch, and had a distant relationship with the other branches. The verification of the interactions between IgCRY1 protein and IgCOP1 protein provided an important theoretical basis for the biological process of light signal regulation in Isochrysis galbana.
Key words: Isochrysis galbana; Yeast two-hybrid; IgCRY1 protein; IgCOP1 protein; Bioinformatics analysis
球等鞭金藻是等鞭金藻科,等鞭金藻属的海洋微藻[1],适合生长在温度为22℃、光照强度为75 μmol·m-2·s-1、pH 偏碱性的环境中[2]。这种微藻的生长速度快、易于培养、个体较小且无细胞壁[3-4],这些特点使得它在实验室研究和大规模生产中都极具吸引力。球等鞭金藻富含大量的色素、不饱和脂肪酸等营养物质,这些成分对人体健康有很多益处,如抗氧化、降低胆固醇等,因此被广泛应用于食品、保健品和生物医药等领域。
隐花色素(Cryptochrome,Cry)是一种重要的蓝光受体,它能够吸收蓝光和近紫外光,也能参与植物下胚轴及茎节的伸长过程,还对开花及生物钟的光敏调控起到关键作用[5]。自1979年被Gressel首次发现以来,Cry在不同领域的研究一直备受关注[6]。在植物中,蓝光会抑制茎节间和下胚轴的伸长,对光形态建成和开花调控具有显著的影响[7-8]。为了更好地理解这一现象,学者们对隐花色素的组成进行了深入研究,发现主要由CRY1、CRY2和CRY3三大成员组成,其中,CRY1是参与蓝光调控光形态发生过程的主要成分,而CRY2则与光周期调控开花时间有关,CRY3则主要负责损伤修复作用[9]。在真核微藻中,隐花色素也广泛存在。例如,红藻[9]、等鞭藻[10]和莱茵衣藻[11]等藻类都含有隐花色素。研究发现,在蓝光条件下,莱茵衣藻中CRY蛋白的缺失会对类胡萝卜素的合成以及光合系统的调控产生影响[12-13],这一发现提供了更多关于隐花色素在微藻中的功能和作用机制的线索。
CONSTITUTIVELY PHOTOMORPHOGENIC 1(COP1)在植物学领域中具有举足轻重的地位,它是第一个被克隆的光形态建成核心调控因子[14-15]。光受体通过感知不同的波长,将外界信号传递给COP1,COP1再调控下游相关的基因和转录因子的表达[16]。在蓝光条件下,COP1的功能受到一定的抑制,这种抑制作用有助于稳定CO,进一步促进植物的开花过程[17-22]。值得注意的是,COP1会与CRY1直接相互作用,共同调控植物的光形态建成,这一互作关系提供了更多关于光响应机制的深入理解。
为了进一步研究球等鞭金藻在光响应过程中的机制,本研究利用酵母雙杂验证蓝光受体蛋白IgCRY1与IgCOP1蛋白之间是否相互互作,同时结合生物信息学分析IgCOP1蛋白的相关信息,进一步全面地了解COP1在藻类中的功能和作用机制,从而为藻类的光信号转导机制提供理论基础。
1 材料与方法
1.1 材料
球等鞭金藻Isochrysisgalbana来自福建省特色海洋生物资源可持续利用重点实验室,高保真限制酶、EcoR I和BamH I、质粒小量提取试剂盒、PCR产物纯化回收试剂盒均购买自北京全式金生物公司,AH109酵母感受态细胞及所赠送的Trans1-T1感受态细胞购买于上海唯地生物公司,pGADT7(AD)载体和pGBKT7(BD)载体由本实验室保存。目的条带所扩增的引物合成及菌落PCR验证测序由擎科生物公司完成。
1.2 试验方法
1.2.1 球等鞭金藻总RNA提取与反转录 用北京全式金RNA提取试剂盒(Q20629)提取生长至藻细胞数约为1×108个的球等鞭金藻总RNA,参照说明书。对于球等鞭金藻总RNA的反转录参照北京全式金反转录试剂盒(Q20415)。
1.2.2 BD-IgCRY1和AD-IgCOP1载体的构建 利用北京全式金生物公司的同源重组试剂盒(CU201-03),设计在带有酶切位点EcoR I和BamH I的pGBKT7载体同源臂引物,见表1,以球等鞭金藻的cDNA扩增目的片段,按说明书将克隆好的IgCRY1基因序列无缝克隆到pGBKT7载体上,IgCOP1基因序列无缝克隆到pGADT7载体上,转化至大肠杆菌Trans1-T1感受态细胞,分别用卡那霉素(100 mg·mL-1)和氨苄卡那霉素(100 mg·mL-1)的LB培养基37℃过夜培养。挑取单克隆进行菌落PCR验证,验证正确的克隆进行送公司测序比对。
1.2.3 BD-IgCRY1载体自激活和毒性检测 将测序正确的 BD-IgCRY1质粒和空载BD质粒分别转化至AH109酵母感受态中。通过比较长在色氨酸缺陷型平板上的菌落情况来判断BD-IgCRY1是否对 AH109 有细胞毒性作用,其中以含有空载BD 的菌为对照。并将含有BD-IgCRY1的酵母菌分别涂布于色氨酸缺陷、色氨酸缺陷加X-α-Gal以及色氨酸缺陷加X-α-Gal和AbA的平板上。观察菌落是否变蓝,来判断BD-IgCRY1是否存在自激活现象。其中X-α-Gal的浓度为20 mg·mL-1,AbA的浓度为500 μg·mL-1。
1.2.4 酵母双杂验证IgCRY1和IgCOP1的互作 将测序正确的BD-IgCRY1和AD-IgCOP1质粒共同转入酵母菌株AH109中,涂布SD/-Leu/-Trp、SD/-Leu/-Trp/-His/-Ade和SD/-Leu/-Trp/-His/-Ade/X-α-Gal/AbA培养基上培养。将AD空载和BD空载共转以及BD-IgCRY1与AD空载共转的酵母菌株作为阴性对照。
1.2.5 生物信息学分析 利用从拟南芥数据库TAIR(https://www.arabidopsis.org/index.jsp) 得到已知COP1蛋白序列,在球等鞭金藻的基因组数据库进行Blast P比对搜索筛选候选蛋白质。球等鞭金藻COP1蛋白质的分子量和等电点通过ExPASy(http://www.expasy.ch/tools/pi_tool.html)进行预测。应用SWISS-MODEl(https://swissmodel.expasy.org/)在线网站及SMART(http://smart.embl-heidelberg.de/smart/set_mode.cgi?NORMAL=1)网站预测IgCOP1蛋白的三级结构及结构域,并用Hydrophobicity ProtScale(https://web.expasy.org/protscale/pscale/Hphob.Sweet.html)在线网站预测IgCOP1蛋白质的疏水性,最后使用 MEGA7.0 软件对球等鞭金藻和其他物种的蛋白质序列进行比对并构建系统发育树。
2 结果与分析
2.1 球等鞭金藻总RNA的提取 本试验提取生长至对数期的球等鞭金藻总RNA。用2%琼脂糖电泳检测,有3条完整的条带(图1)。用核酸蛋白仪检测其浓度为560
ng·μL-1,纯度OD260/OD280的比值为2.0。
2.2 BD-IgCRY1和AD-IgCOP1基因全长的克隆
以球等鞭金藻cDNA为模板,扩增IgCRY1和IgCOP1基因全长,其中IgCRY1为1560 bp,IgCOP1为1185 bp。用1%琼脂糖凝胶电泳进行跑胶检测,见图2。
2.3 诱饵蛋白BD-IgCRY1细胞毒性检测
含BD-IgCRY1的酵母菌是否对AH109酵母细胞有毒性,结果见图3,发现与阴性对照组相比并无差别,因此BD-IgCRY1对酵母AH109无毒性。
2.4 诱饵蛋白BD-IgCRY1自激活检测
含有BD-IgCRY1的酵母菌AH109分别涂布于色氨酸缺陷、色氨酸缺陷加X-α-Gal以及色氨酸缺陷加X-α-Gal和AbA的平板上,由图4可知,酵母菌在组氨酸缺陷加X-α-Gal平板能够生长并且呈蓝色,说明 BD-IgCRY1存在自激活现象。加上500 μg·mL-1的AbA发现BD-IgCRY1能正常生长且没有变蓝,说明该浓度下能够抑制BD-IgCRY1的自激活现象。
2.5 球等鞭金藻IgCRY1蛋白和IgCOP1蛋白的互作验证
由图5可知,AD-IgCOP1与BD-IgCRY1共转化的菌株、AD空载与BD-IgCRY1载体共转和AD与BD空载共转在色氨酸、亮氨酸缺陷型的平板上均能正常生长,说明都成功共同转入酵母菌株中。其中AD-IgCOP1与BD-IgCRY1共转化的菌株在组氨酸、亮氨酸、色氨酸、腺嘌呤缺陷型平板上也能正常生长,并且能使组氨酸、亮氨酸、色氨酸、腺嘌呤缺陷型平板加X-α-Gal和AbA的培养基变蓝(图6)。但BD- IgCRY1与AD空载体、AD与BD空载共转的菌在组氨酸、亮氨酸、色氨酸、腺嘌呤缺陷性平板以及加X-α-Gal和AbA的平板上均无法生长。说明了 IgCRY1蛋白和IgCOP1蛋白可以发生相互互作。
2.6 球等鞭金藻IgCOP1蛋白的生物信息学分析
2.6.1 IgCOP1蛋白一级结构、二级结构的分析 通过ExPaSy在线网站对IgCOP1进行一级结构的分析,结果显示,该蛋白的分子量大小为43.7 kDa,编码的氨基酸个数为394个,等电点为4.77,为酸性蛋白。IgCOP1蛋白的不稳定系数为44.09,略大于40时,为不稳定蛋白[11]。
为了进一步研究IgCOP1蛋白,其二级结构见表2,不规则卷曲是IgCOP1的主要组成部分,占比为62.69%,而α-螺旋为7.61%,延伸链结构为29.7%,无β-螺旋结构(图7)。
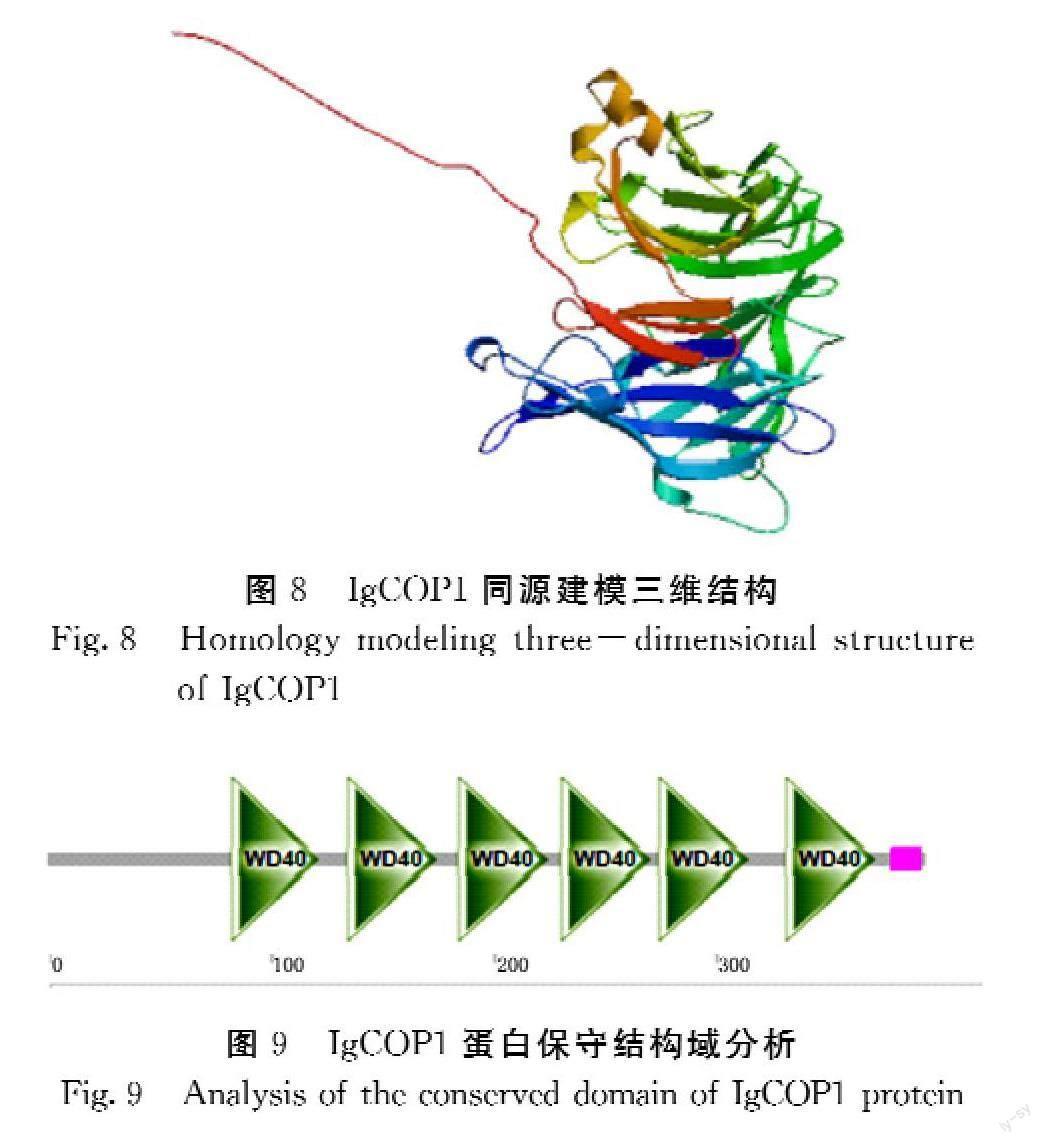
2.6.2 IgCOP1三级结构及蛋白保守结构域分析 对IgCOP1进行三级结构的预测建模见图8。对IgCOP1蛋白的保守结构域分析应用SMART在线网站,由图8可知,IgCOP1蛋白序列的保守结构域为第80~370位是WD40结构域。
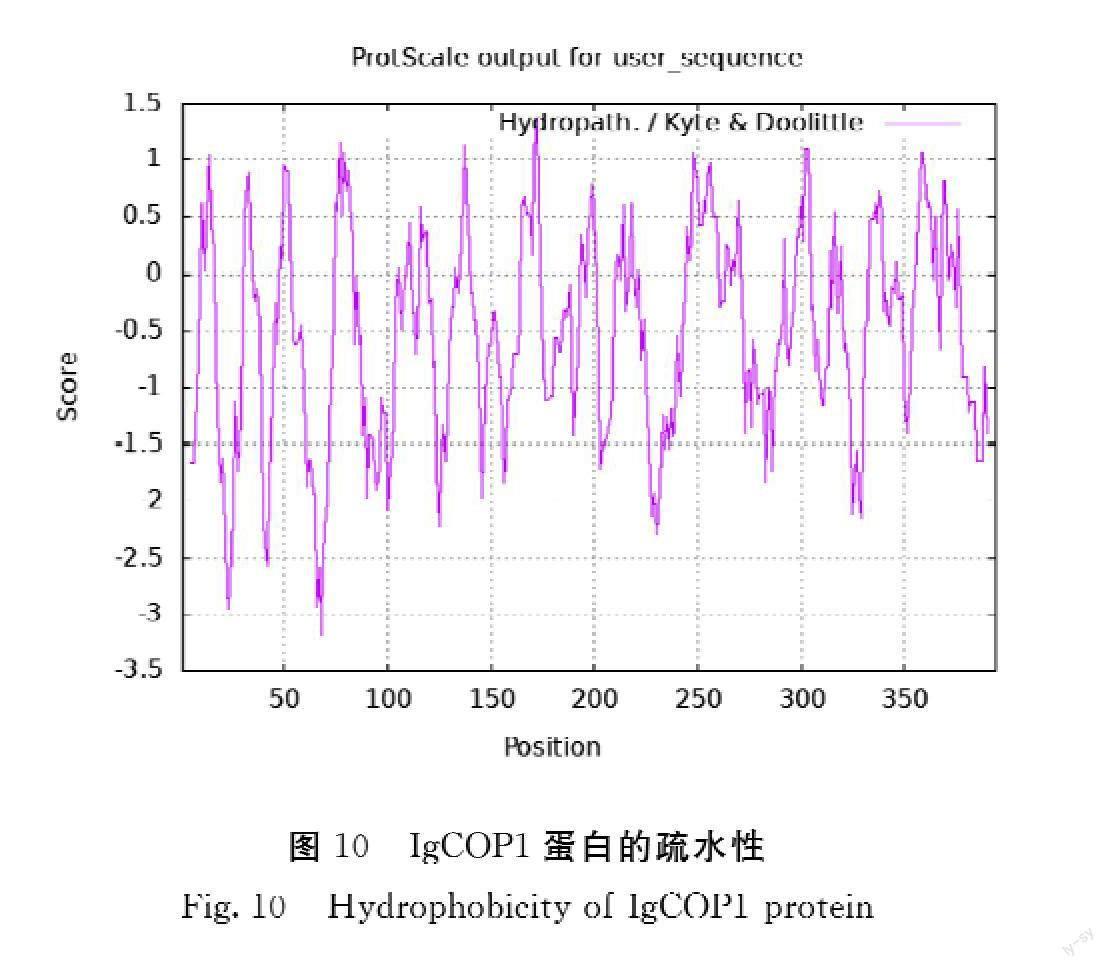
2.6.3 疏水性分析 利用Hydrophobicity ProtScale软件预测IgCOP1蛋白质的疏水性。由图10可知,IgCOP1蛋白质疏水性最小为-3.179,最大值为1.367,并通过ProtParam软件IgCOP1蛋白进行亲疏水性分析,分析结果显示其亲水性平均系数为-0.544,是典型的亲水蛋白。
2.6.4 IgCOP1系统发育树分析 通过NCBI下载不同物种中与IgCOP1同源性较高的氨基酸序列并进行多序列比对,与拟南芥、欧洲油菜、银杏、芸薹、豌豆、花生、水稻、大叶藻、布氏轮藻、荫平鲉、条纹斑竹鲨的COP1蛋白序列进行建树,由图11可知,根据系统进化树的分支情况,得到球等鞭金藻的COP1蛋白处于单独一个分支。说明球等鞭金藻的COP1蛋白与其他物种发挥不同的功能。
3 討论与结论
隐花色素作为一类蓝紫光受体,在植物和藻类中参与了多种生理过程,并对环境刺激做出适应性反应。有研究表明,蓝光能够促进球等鞭金藻岩藻黄素和DHA含量的积累[23-24]。此外,蓝光对其他藻类的生理特性也有着重要的影响。例如,在三角褐指藻中,短时间的蓝光刺激培养同样会增加岩藻黄素和不饱和脂肪酸物质的积累[25];在坛紫菜中,蓝光能促进果孢子和壳孢子的萌发体颜色加深转变为鲜红色[26]。这些研究揭示了蓝光在调节藻类生长和发育中的重要作用。
为了深入研究球等鞭金藻在光下的信号转导机制,本研究首先从该藻中成功克隆了1560 bp和1185 bp的CDS片段,构建了BD-IgCRY1和AD-IgCOP1载体,通过酵母双杂验证了IgCRY1与IgCOP1之间存在显著的互作关系,生物信息学分析IgCOP1蛋白编码394个氨基酸,二级结构为62.69%的不规则卷曲,是典型的亲水蛋白。球等鞭金藻中IgCOP1蛋白与其他物种的COP1蛋白在结构上存在一定的差异。在模式植物拟南芥中,COP1蛋白包含了WD-40、RING finger和Coiled-coil3个结构域[27]。而本研究发现,球等鞭金藻的COP1蛋白仅包含WD40结构域,因此系统发育树分析得到COP1与其他物种的亲缘关系较远,这表明该蛋白在演化过程中可能发生了一些适应性的变化。
综上所述,本研究不仅揭示了球等鞭金藻中CRY1和COP1蛋白之间的相互作用关系,并对IgCOP1蛋白进行理性分析。为了解CRY1和COP1在藻类中的光信号转导机制提供理论基础,并为未来的应用研究提供有价值的参考。
参考文献:
[1]王珺,王永强,陈雪芬,等.金藻0898培养的生态条件研究[J].海南大学学报(自然科学版),2008(1):93-98.
[2]吴电云,邹宁,常林,等.球等鞭金藻(Isochrysis galbana parke)的培养研究进展及应用前景[J].科技信息,2010,(33):28-29.
[3]胡鸿钧,吕颂辉,刘惠荣.等鞭金藻属(等鞭金藻目)1新种——湛江等鞭金藻(Isochrysis zhanjiangensis sp.nov)及其超微结构的观察[J].海洋学报(中文版),2007,(1):111-119.
[4]毛连菊,张从尧,由学策.湛江等鞭金藻的超微结构研究[J].大连水产学院学报,1999(4):7-12.
[5]ANGELIQUE D F,ALESSANDRA R,MAURIZIO R D A,et al.Exploring the molecular basis of responses to light in marine diatoms[J].Journal of experimental botany,2012,63(4):1575-1591.
[6]EDMUNDS L N.Blue-Light Photoreception in the Inhibition and Synchronization of Growth and Transport in the Yeast Saccharomyces[J].Springer Berlin Heidelberg,1980,30(1):749-754.
[7]刘玉兵,陈海燕,王军伟,等.LED红蓝光质调控辣椒幼苗生长的光合机制研究[J].河南农业科学,2021,50(7):145-153.
[8]屈成,刘芬,陈光辉,等.LED红蓝光质对水稻幼苗生长及生理特性的影响[J].核农学报,2020,34(9):2095-2102.
[9]任爽爽,隽乐梅,柳倩,等.油茶隐花色素基因CoCRY1的克隆及功能研究[J].植物遗传资源学报,2023,12(23):1-12.
[10]DOMINIK I,RAMONA S,JOACHIM H,et al.Blue light induces radical formation and autophosphorylation in the light-sensitive domain of Chlamydomonas cryptochrome[J].The Journal of biological chemistry,2007,282(30):21720-21728.
[11]IMMELN D,POKORNY R,HERMAN E,et al.Photoreaction of plant and DASH cryptochromes probed by infrared spectroscopy:the neutral radical state of flavoproteins[J].Journal of Physical Chemistry B,2010,114(51):17155-17161.
[12]李旺宁,张豪杰,李亚男,等.莱茵衣藻蓝光受体植物类型隐花色素CRY突变体的表型鉴定[J].生物技术通报,2023,39(2):243-253.
[13]ASIMGIL H,KAVAKLI I H.Purification and characterization of five members of photolyase/cryptochrome family from Cyanidioschyzon merolae[J].Plant Science,2012,185-186(none):190-198.
[14]DENG,CASPAR,QUAIL.cop1:a regulatory locus involved in light-controlled development and gene expression in Arabidopsis[J].Genes & Development,1991,5(7):1172-1182.
[15]DENG X W,QUAIL P H.Genetic and phenotypic characterization of COP-1 mutants of Arabidopsis thaliana[J].Plant Journal,2010,2(1):83-95.
[16]周璐,饶枫.动植物中COP1泛素连接酶介导的信号转导与蛋白质稳态调控[J].生物化学与生物物理进展,2023,50(4):714-724.
[17]H S S,J Y Y,ISHIKAWA M,et al.LAF1 ubiquitination by COP1 controls photomorphogenesis and is stimulated by SPA1[J].Nature,2003,423(6943):995-999.
[18]YANG J.Light Regulates COP1-Mediated Degradation of HFR1,a Transcription Factor Essential for Light Signaling in Arabidopsis[J].Plant Cell,2005,17(3):804-821.
[19]OSTERLUND M T,NING W,WANG D X.The Roles of Photoreceptor Systems and the COP1-Targeted Destabilization of HY5 in Light Control of Arabidopsis Seedling Development[J].Plant Physiology,2000,124(4):1520-1524.
[20]HOLM,M.Two interacting bZIP proteins are direct targets of COP1-mediated control of light-dependent gene expression in Arabidopsis[J].Genes & Development,2002,16(10):1247-1259.
[21]JUN-JIE,LING,JIAN,et al.Noncanonical role of Arabidopsis COP1/SPA complex in repressing BIN2-mediated PIF3 phosphorylation and degradation in darkness[J].Proceedings of the National Academy of Sciences of the United States of America,2017,114(13):3539-3544.
[22]PONNU J.Molecular mechanisms suppressing COP1/SPA E3 ubiquitin ligase activity in blue light[J].Physiologia Plantarum,2020,169(3):418-429.
[23]韓玉莹.光质介导球等鞭金藻岩藻黄素和脂肪酸积累及其蓝光受体IgCRY1结构解析[D]福州:福建师范大学,2022.
[24]龚林.球等鞭金藻隐花色素基因家族相关研究[D].福州:福建师范大学,2020.
[25]赵靖悦.三角褐指藻隐花色素/光解酶的研究[D].福州:福建师范大学,2020.
[26]刘嘉嘉,梁小君,周琳琳等.不同光质对坛紫菜果孢子和壳孢子萌发的影响[J].应用海洋学学报,2023,42(03):409-415.
[27]崔连花.玉米ZmCOP1基因的克隆和功能分析[D].河南:河南农业大学,2022.
(责任编辑:柯文辉)
