响应面法优化酿酒酵母发酵产谷胱甘肽工艺
2023-03-15林伟铃朱宏阳李泳宁
林伟铃 朱宏阳 李泳宁

林伟铃,朱宏阳,李泳宁.响应面法优化酿酒酵母发酵产谷胱甘肽工艺[J].福建农业科技,2023,54(12):27-34.
收稿日期:2023-11-10
作者简介:林伟铃,女,1984年生,硕士,实验师,主要从事微生物在生产中的应用研究。
*通信作者:朱宏阳,男,1979年生,博士,副教授,主要从事微生物在生产中的应用研究(E-mail:zhuhongyang@fjwzy.cn)。
基金项目:福建省自然科学基金项目(2022J01394),福建省卫健委青年基金项目(2019-1-97)。
摘 要:为了探索酿酒酵母发酵生产谷胱甘肽(Glutathione,GSH)的最佳工艺条件。在单因素试验基础上,通过Plackett-Burman试验结合响应面设计方法对液体发酵培养基进行优化。结果表明:酿酒酵母发酵生产GSH的最优培养基配方为葡萄糖71 g·L-1、酵母膏4 g·L-1、NH4Cl 6 g·L-1、KH2PO4 2.0 g·L-1、MgSO4 0.5 g·L-1,pH 6.0,在此条件下,GSH理论产量达79.51 mg·L-1。经3批次平行试验验证,GSH实际产量均值为80.5 mg·L-1,与预测值相近,较优化前产量(65.03 mg·L-1)提高了约19.2%。
关键词: 酿酒酵母; 谷胱甘肽; Plackett-Burman设计; 响应面分析; 优化
中图分类号:TQ 921 文献标志码:A 文章编号:0253-2301(2023)12-0027-08
DOI: 10.13651/j.cnki.fjnykj.2023.12.004
Technology Optimization for the Production of Glutathione Fermented by Saccharomyces cerevisiae
LIN Wei-ling, ZHU Hong-yang*, LI Yong-ning
(Department of Pharmacy, Fujian Health College, Fuzhou, Fujian 350101, China)
Abstract: In order to explore the optimal technological conditions for the production of glutathione (GSH) fermented by Saccharomyces cerevisiae, based on the single factor experiment, the liquid fermentation medium was optimized through Plackett-Burman design experiment combined with the response surface methodology. The results showed that the optimal culture medium for the production of GSH fermented by Saccharomyces cerevisiae was as follows: glucose of 71 g·L-1, yeast extract paste of 4 g·L-1, NH4Cl of 6 g·L-1, KH2PO4 of 2.0 g·L-1, MgSO4 of 0.5 g·L-1, pH of 6.0. After three batches of parallel experiments, the mean value for the actual yield of GSH was 80.5 mg·L-1, which was similar to the predicted value and increased by about 19.2% higher than that before optimization (65.03 mg·L-1).
Key words: Saccharomyces cerevisiae; Glutathione; Plackett-Burman design; Response Surface analysis; Optimization
谷胱甘肽(Glutathione,簡称GSH)是普遍存在于细胞中的一种含巯基的功能活性三肽,由L-谷氨酸、L-半胱氨酸和L-甘氨酸缩合而成,是真核细胞中小肽类巯基化合物的重要组成部分[1]。GSH在细胞内存在还原型及氧化型两种形式,还原型GSH是生物细胞抵抗氧化损伤的关键,有着多种重要的生理功能[2]。GSH具有增强机体免疫、抗氧化、解毒、提高动物生殖能力等功效,被广泛应用于农作物种植、畜禽水产养殖、食品及医药等领域[3-6],具有良好的市场前景。研究发现,在农业生产中使用GSH灌溉浇种可以提高农作物对铅、砷、镉、微塑料以及盐碱的耐受性[7-11]。此外,在食品应用领域,Tang等[12]的研究发现GSH可以通过氢键与淀粉相互作用,加速淀粉颗粒的膨胀,促进有序双螺旋结晶的形成,从而抑制淀粉的消化,可应用于减肥食品。
目前,直接萃取法、化学合成法、酶法与微生物发酵法是生产GSH主要方法[5]。其中,微生物发酵法具备生产效率高、成本低、污染少等特点,是目前生产GSH的主要方法[13]。在产GSH微生物中,酿酒酵母Saccharomyces cerevisiae因其在廉价原料培养基中生长迅速,且具有在细胞中积累高含量GSH的潜力而脱颖而出[14]。此外,酿酒酵母是FDA规定的无害食品添加剂,属于一般公认的安全类添加剂,适合用于GSH的商业化生产[15]。自1970年开始,日本协和发酵生物株式会社(Kyowa Hakko Bio)用酵母发酵生产GSH,目前占据我国GSH市场供应的主要份额。国内GSH生产还停留在工厂实验阶段或生产起步阶段,制约国内生产GSH的主要原因是生产水平较低、提取率低下。因此如何提高GSH生产效率、降低生产成本、提高竞争力,对于实现GSH自主生产、打破外国企业的垄断具有非常重要的意义。本研究对前期筛选获得的具有GSH生产能力的菌株Saccharomyces cerevisiae ZF-11进行发酵条件优化,旨在提升GSH产量,为大规模发酵生产GSH提供依据。
1 材料与方法
1.1 菌株
酿酒酵母S.cerevisiae ZF-11,由本实验室筛选并保藏。
1.2 试剂与培养基
斜面培养基与菌种活化培养基:葡萄糖30 g·L-1、酵母膏3 g·L-1、蛋白胨3 g·L-1、牛肉膏3 g·L-1、琼脂粉20 g·L-1,pH 6.0,121℃灭菌20 min。种子培养基:葡萄糖30 g·L-1、酵母膏3 g·L-1、蛋白胨3 g·L-1、牛肉膏3 g·L-1,pH 6.0,121℃灭菌20 min。基础发酵培养基:葡萄糖50 g·L-1、酵母膏5
g·L-1、蛋白胨5 g·L-1、KH2PO4 2 g·L-1、MgSO40.5 g·L-1,pH 6.0,121℃灭菌20 min。
试剂:四氧嘧啶为分析纯。
1.3 主要仪器
SW-CJ-1F超净工作台(上海苏净实业有限公司)、ZQZY-88CN全温振荡培养箱(上海知楚仪器有限公司)、SPX-100-B-Z细菌生化培养箱(福建省科学器材中心)、SBA-40E型生物传感仪(山东省科学院生物研究所)、SQ810C全自动高压蒸汽灭菌器(雅马拓)、H2-16KR台式高速冷冻离心机(湖南可成仪器设备有限公司)、DHG-9070电热恒温鼓风干燥箱(上海精宏)、UV-1800型紫外可见分光光度计(上海美谱达仪器有限公司)。
1.4 试验方法
1.4.1 种子液制备 将斜面保藏的菌种接入活化培养平板,28℃条件下于细菌生化培养箱中培养24 h,从活化平板上挑取一环菌接入装有种子培养基的三角瓶中,28℃、220 r·min-1振荡培养24 h。
1.4.2 发酵条件 将种子液以10%接种量接入到发酵培养基中,28℃、220 r·min-1振荡培养72 h。
1.4.3 菌体浓度的测定 取25 mL发酵培养液,5000 r·min-1离心10 min收集菌体,用蒸馏水重悬菌体后5000 r·min-1离心10 min收集菌体(重复3次),于电热恒温鼓风干燥箱中70℃烘至恒重后称重。
1.4.4 发酵液中葡萄糖的测定 取1 mL发酵培养液进行适当稀释后用生物传感仪测定葡萄糖的含量。
1.4.5 GSH含量的测定[16] 取25 mL发酵培养液,5000 r·min-1离心10 min收集菌体,用蒸馏水重悬菌体后于-20℃冷冻过夜,沸水浴5 min,
5000 r·min-1离心10 min,取上清液,采用四氧嘧啶法测定GSH含量。
1.4.6 单因素试验 (1)不同碳源对酿酒酵母发酵产GSH的影响。发酵培养基中的碳源分别为葡萄糖、果糖、蔗糖、麦芽糖、木糖,碳源加入量为5%,其余成分与基础发酵培养基一致,进行发酵试验,考察不同碳源对酿酒酵母菌体生长和产GSH的影响。(2)葡萄糖浓度对酿酒酵母发酵产GSH的影响。以葡萄糖为碳源,浓度分别40、50、 60、70、80、90、100 g·L-1,其余成分与基础发酵培养基一致,进行发酵试验,考察酿酒酵母菌体生长和产GSH的最佳葡萄糖浓度。(3)不同氮源对酿酒酵母发酵产GSH的影响。以70 g·L-1葡萄糖作为碳源,氮源分别为酵母膏、牛肉膏、蛋白胨、尿素、NH4Cl、(NH4)2SO4,氮源添加量为1%,其余成分与基础发酵培养基一致,进行发酵试验,考察不同氮源对酿酒酵母菌体生长和产GSH的影响。(4)复合氮源对酿酒酵母发酵产GSH的影响。以70
g·L-1葡萄糖作为碳源,酵母膏分别与尿素、NH4Cl、(NH4)2SO4以1∶1的量复配作为氮源,总氮源添加量为1%,其余成分与基础发酵培养基一致,进行发酵试验,考察不同的有机氮源与无机氮源复配组合对酿酒酵母菌体生长和产GSH的影响。(5)复合氮源酵母膏与NH4Cl配比对酿酒酵母发酵产GSH的影响。以70 g·L-1葡萄糖作为碳源,调整酵母膏与NH4Cl的配比,分别为4∶1、3∶1、3∶2、1∶1、2∶3、1∶3、1∶4,总氮源添加量为1%,其余成分与基础发酵培养基一致,进行发酵试验,考察复合氮源酵母膏与NH4Cl的不同配比对酿酒酵母菌体生长和产GSH的影响。
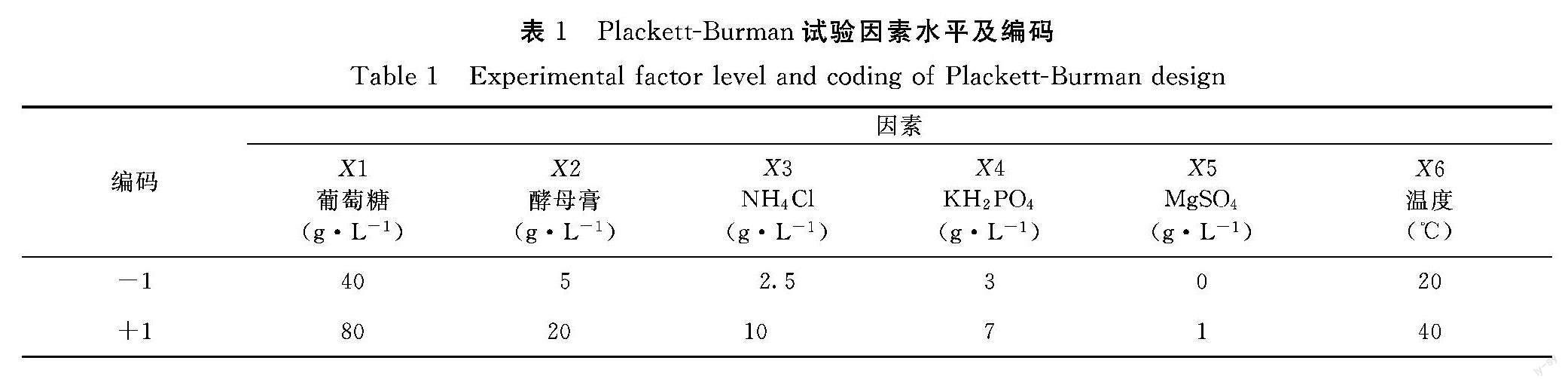
1.4.7 Plackett-Burman试验设计 在单因素试验基础上,采用Plackett-Burman(PB)试验设计[17]对影响酿酒酵母菌体浓度和产GSH的6个因素的显著性进行评估,这6个因素分别为:葡萄糖、酵母膏、NH4Cl、KH2PO4、MgSO4、温度。Plackett-Burman试验的因素及水平见表1。
1.4.8 響应面试验设计 根据Plackett-Burman试验结果,选取3个影响菌体浓度和产GSH的关键因素,分别是葡萄糖、酵母膏、NH4Cl。根据三因素五水平的中心组合设计试验原理,以葡萄糖(X1)、酵母膏(X2)、NH4Cl(X3)为自变量,以酵母菌体浓度及GSH产量为响应值,设计中心组合试验,各因素的试验水平及编码值见表2。
2 结果与分析
2.1 单因素试验结果
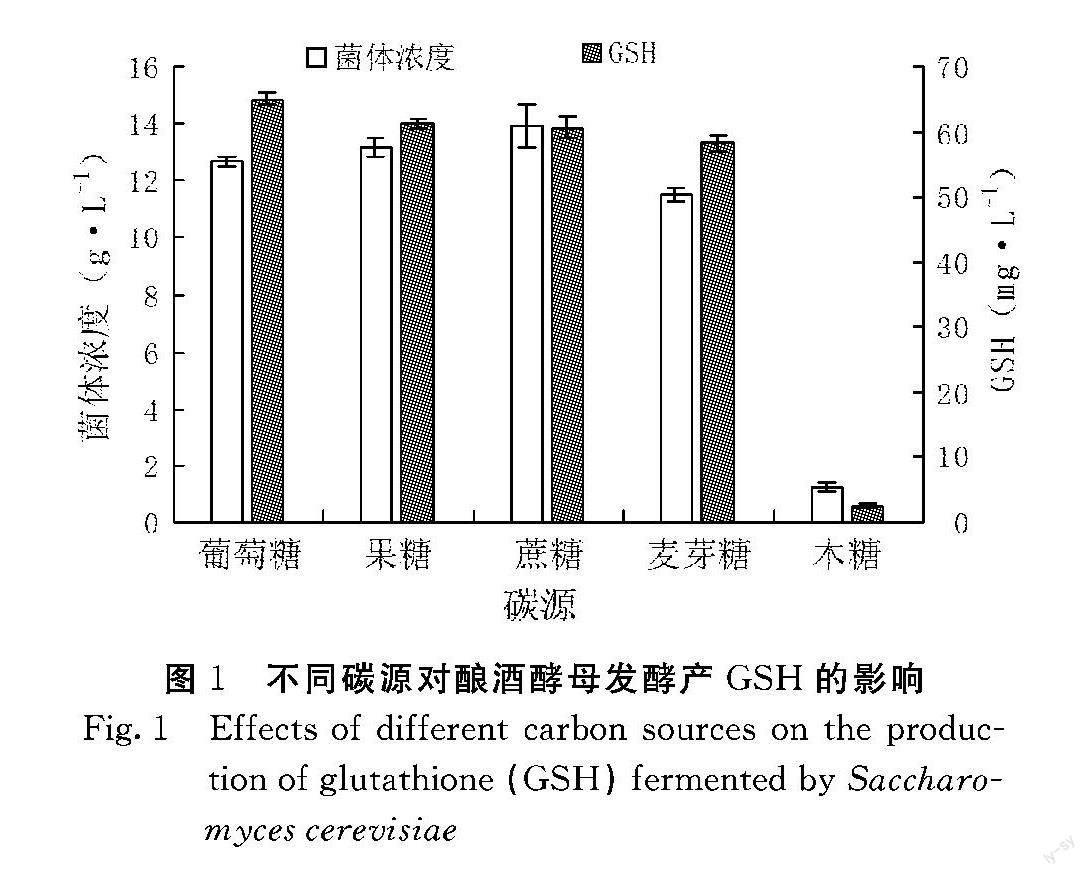
2.1.1 不同碳源对酿酒酵母发酵产GSH的影响 由图1可知,以葡萄糖为碳源时,菌体生长良好且GSH产量最高,以果糖、蔗糖为碳源时,菌体生长良好且GSH产量较高,麦芽糖可促使菌体生长但GSH生产能力差,S.cerevisiae ZF-11不能利用木糖。综合菌体浓度及GSH产量考虑,确定葡萄糖为最佳碳源,此时菌株菌体浓度为12.67 g·L-1,GSH产量为65.03
mg·L-1。
2.1.2 碳源浓度对酿酒酵母发酵产GSH的影响 由图2可知,随着葡萄糖浓度的提高,菌株生长逐步受到影响,当葡萄糖浓度增至100 g·L-1时,菌株的生长受到抑制。从对菌株生长的影响来看,低碳源浓度有利于菌体生长。从GSH产量上看,随着碳源浓度的升高,GSH产量逐步增加,当碳源浓度升至70 g·L-1时,GSH产量最高(69.32 mg·L-1),而后碳源浓度继续上升,GSH产量开始迅速下降。分析原因可能是高浓度的碳源抑制了菌株的生长,进而影响产物GSH的合成。
2.1.3 不同氮源对酿酒酵母发酵产GSH的影响 由图3可知,以酵母膏为氮源,菌体生长良好且GSH产量最高;以牛肉膏和蛋白胨为氮源,菌体生长良好,但在生产GSH方面的表现不如以酵母膏为氮源;以NH4Cl、尿素和(NH4)2SO4为氮源,在菌体生长方面不如有机氮源,但对GSH生产具有较好的效果。所以后续试验选择酵母膏与无机氮源复配,进一步考察复合氮源对GSH发酵生产的影响。
2.1.4 复合氮源对酿酒酵母发酵产GSH的影响 由图4可知,相比以无机氮源为唯一氮源,有机氮源酵母膏与无机氮源复配的复合氮源能够使得菌体生长良好,同时GSH的产量又比以酵母膏作为唯一氮源时得到提高。其中,酵母膏和NH4Cl组成的复合氮源在发酵生产中GSH产量最高,所以后续试验选择酵母膏与NH4Cl复配的复合氮源。
2.1.5 复合氮源酵母膏与NH4Cl对酿酒酵母发酵产GSH的影响 由图5可知,酵母膏和NH4Cl配比为2∶3时,GSH产量最高,此时产量为74.42
mg·L-1。
2.2 Plackett-Burman试验结果
Plackett-Burman试验各因素水平取值及试验结果见表3,分析结果见表4。利用Statistica 8.0统计软件对数据进行计算和分析,该模型显著(R2=0.99927),通过回归系数显著性可知葡萄糖(P=0.0235)、酵母膏(P=0.0360)、NH4Cl(P=0.0362)都在95%的概率水平上差异显著;KH2PO4、MgSO4和温度的P值介于0.5~0.1,属于边界因素,因此KH2PO4、MgSO4和温度仍选择初始值作为后续试验参数。本研究选择葡萄糖、酵母膏、NH4Cl作为影响菌体生长及GSH产量的关键影响因素。
2.3 响应面试验设计结果
中心组合试验设计及结果见表5。通过Statistica 8.0统计软件对表5中试验数据进行了二次多项式回归拟合,获得了S.cerevisiae ZF-11发酵生产GSH对葡萄糖、酵母膏、NH4Cl多元回归方程为:
Y=3.328X1-7.907X12+0.899X2-5.090X22-0.198X3-4.984X32-1.175X1X2-0.720X1X3-1.380X2X3+79.319
该方程R2=0.899,这表明模型可以用来解释试验结果,对拟合方程求极值得:X1=71.03,X2= 4.03,X3=6.00,代入回归方程得最大值Y=79.51 mg·L-1。上述回归方程所作出的响应曲面图及其等高线见图6、7、8,各因素及其交互作用对响应值的影响结果可通过该组图直观反映出来。
2.4 GSH发酵生产最佳条件及验证试验
经响应面分析,比较回归方程的解,为试验操作的方便,GSH发酵生产最佳发酵培养基配方为葡萄糖71 g·L-1、酵母膏4 g·L-1、NH4Cl 6 g·L-1、KH2PO4 2 g·L-1、MgSO4 0.5 g·L-1, pH 6.0。在该条件下预测GSH产量为79.51 mg·L-1。在该模型处经过3次平行试验验证,测得GSH产量均值为80.5 mg·L-1(GSH产量较优化前提高19.21%),菌体浓度均值为20.3 g·L-1。此结果与预测值接近,证实了模型的有效性及存在着极大值点,能很好地预测实际发酵情况。
3 结论与讨论
本研究考察了碳源以及氮源对S.cerevisiae ZF-11发酵生产GSH的影响,结合Plackett-Burman试验及响应面分析结果表明:在碳源试验中发现葡萄糖为最适碳源,氮源以酵母膏与NH4Cl配比为2
∶3时最优。通过Plackett-Burman试验筛选获得葡萄糖、酵母膏及NH4Cl为显著影响因素,利用响应面试验设计优化后,获得最佳培养基配方:葡萄糖71 g·L-1、酵母膏4 g·L-1、NH4Cl 6 g·L-1、KH2PO4 2.0 g·L-1、MgSO4 0.5 g·L-1,pH 6.0。在上述最佳培养条件下GSH产量可达80.5 mg·L-1,菌体浓度为20.3
g·L-1,GSH产量较优化前提高19.21%。本研究證明了S.cerevisiae ZF-11具有生产GSH的商业价值,有助于开发更经济的GSH发酵生产工艺。
参考文献:
[1]BINATI RL,LARINI I,SALVETTI E,et al.Glutathione production by non-Saccharomyces yeasts and its impact on winemaking:A review[J].Food Research International,2022,156(111333):1-11.
[2]GASMI A,NASREEN A,LENCHYK L,et al.An Update on Glutathione′s Biosynthesis,Metabolism,Functions,and Medicinal Purposes[J].Curr Med Chem,2023,10(26):1-23.
[3]蔡友华,吴子豪,黄晓辰,等.还原型谷胱甘肽的特性、工业生产及在大健康行业的应用研究进展[J].食品与机械,2022,38(11):1-10.
[4]杨世慧,王军,秦永发,等.谷胱甘肽生理功能、发酵生产及其在动物生产中应用的研究进展[J].动物营养学报,2022,34(11):6927-6935.
[5]李敏,殷述亭,迟晓丹.谷胱甘肽生产及在水产养殖中的应用[J/OL].饲料工业,1-8.[2024-01-01].
[6]苗启庆.谷胱甘肽的生理功能及其在食品加工中的应用前景[J].科技风,2010(8):247.
[7]AHMED S,KHAN M,SARDAR R.Glutathione primed seed improved lead-stress tolerance in Brassica rapa L.through modulation of physio-biochemical attributes and nutrient uptake[J].Int J Phytoremediation,2023,25(12):1614-1624.
[8]ARIANMEHR M,KARIMI N,SOURI Z.Exogenous supplementation of Sulfur (S) and Reduced Glutathione (GSH) Alleviates Arsenic Toxicity in Shoots of Isatis cappadocicaDesv and Erysimum allionii L[J].Environ Sci Pollut Res Int,2022,29(42):64205-64214.
[9]LI GZ,CHEN SJ,LI NY,et al.Exogenous Glutathione Alleviates Cadmium Toxicity in Wheat by Influencing the Absorption and Translocation of Cadmium[J].Bull Environ ContamToxicol,2021,107(2):320-326.
[10]CHEN F,AQEEL M,KHALID N,et al.Glutathione treatment suppresses the adverse effects of microplastics in rice[J].Chemosphere,2023,322:138079.
[11]AHMED AMA,KHALID KA.Glutathione to ameliorate growth criterions and chemical constituents of geranium irrigated with salt water[J].Heliyon,2023,9(7):1-14.
[12]TANG YF,ZHAN WX,LI MZ,et al.Glutathione inhibited starch digestion:Structural and kinetic analysis of substrate and α-amylase[J].Food Chemistry,2023,405(134979):1-9.
[13]HU X,SHEN X,ZHU S,et al.Optimization of glutathione production in Saccharomyces cerevisiae HBSD-W08 using Plackett-Burman and central composite rotatable designs[J].BMC Microbiol,2023,23(11):2-9.
[14]SANTOS LO,SILVA PGP,Lemos Junior WJF,et al.Glutathione production by Saccharomyces cerevisiae:current state and perspectives[J].Appl MicrobiolBiotechnol,2022,106(5-6):1879-1894.
[15]IMURA M,NITTA K,IWAKIRI R,et al.Comparison of metabolic profiles of yeasts based on the difference of the Crabtree positive and negative[J].J BiosciBioeng,2020,129(1):52-58.
[16]劉娟,王雅琴,刘刚,等.发酵液中还原型谷胱甘肽三种测定方法的改进及其比较[J].北京化工大学学报(自然科学版),2004(3):35-38.
[17]YU H S,LEE N K,KIM W J,et al.Optimization of an Industrial Medium and Culture Conditions for Probiotic Weissellacibaria JW15 Biomass Using the Plackett-Burman Design and Response Surface Methodology[J].J MicrobiolBiotechnol,2022,32(5):630-637.
(责任编辑:柯文辉)
