永春醋来源微生物筛选及多样性分析
2023-03-15谢喜珍林风李志强郑秋霞吴丽云
谢喜珍 林风 李志强 郑秋霞 吴丽云


谢喜珍,林风,李志强,等.永春醋来源微生物筛选及多样性分析[J].福建农业科技,2023,54(12):15-26.
收稿日期:2023-10-05
作者简介:谢喜珍,女,1990年生,研究实习员,硕士,主要从事应用微生物学研究。
*通信作者:吴丽云,女,1966年生,博士,教授级高级工程师,主要从事发酵工程研究(E-mail:lywu66717@163.com)
基金项目:福建省科技計划公益类项目(2021R1005002、2023R1005008)。
摘 要:永春老醋发酵过程微生物菌落变化对其品质形成及工艺优化具有重要意义。对永春老醋发酵过程样品进行微生物筛选、形态学鉴定及分子生物学初步鉴定,共筛选出107株菌株,鉴定多为芽孢杆菌、醋酸杆菌、乳酸菌、酵母菌、霉菌。利用高通量测序技术对样品进行细菌与真菌多样性分析,不同水平下分析微生物群落结构,在细菌菌落组成中,YCV1(醋母)、YCV4(2.5年陈醋)组成相似,YCV2(8个月陈醋)、YCV3(3年陈醋)、YCV5(1.5年陈醋)组成相似,YCZ1(糟床1)、YCZ2(糟床2)组成相似,HYQ1(黑衣曲)与其他样品差异较大;真菌菌落组成分析中,YCV2与YCV3组成相似,YCV4、YCV5两者较为相似与YCZ2一定程度相似,YCV1、HYQ1及YCZ1与其他样品相差大。不同样品真菌与细菌菌落结构差异大。该研究结果为永春醋发酵过程的理论研究及工业化生产提供科学依据,也可为后期永春醋药食同源开发奠定基础。
关键词:永春老醋;分离纯化;细菌多样性;真菌多样性
中图分类号:Q 93 文献标志码:A 文章编号:0253-2301(2023)12-0015-12
DOI: 10.13651/j.cnki.fjnykj.2023.12.003
Microbial Screening and Diversity Analysis of Yongchun Aged Vinegar
XIE Xi-zhen, LIN Feng, LI Zhi-qiang, ZHENG Qiu-xia, WU Li-yun*
(Fujian Institute of Microbiology, Fuzhou, Fujian 350007, China)
Abstract: The changes of microbial community in the fermentation process of Yongchun aged vinegar are of great significance to its quality formation and process optimization. In this paper, the microbial screening, morphological identification and molecular biology preliminary identification were carried out on the fermentation samples of Yongchun aged vinegar. A total of 107 strains were screened, and most of them were identified as Bacillus, Acetobacterium Balch, lactic acid bacteria, Saccharomyces and Aspergillus. The high-throughput sequencing technology was used to analyze the bacterial and fungal diversity of the samples, and the microbial community structure was analyzed at different levels. In the composition of bacterial colonies, YCV1 (mother of vinegar) and YCV4 (2.5 years vinegar) were similar in composition, YCV2 (8 months vinegar), YCV3 (3 years vinegar) and YCV5 (1.5 years vinegar) were similar in composition, and YCZ1 (bed 1) and YCZ2 (bed 2) were similar in composition. HYQ1 (Heiyiqu) was significantly different from other samples. In the compositional analysis of fungal colonies, YCV2 and YCV3 were similar in composition, YCV4 and YCV5 were similar to YCZ2 to a certain extent, and YCV1, HYQ1 and YCZ1 were significantly different from other samples. The structure of fungal and bacterial colonies varied greatly in different samples. The research results provided scientific basis for the theoretical research and industrial production of Yongchun vinegar fermentation process, and could also lay a foundation for the later medicine-food homologous development of Yongchun vinegar.
Key words: Yongchun agaed vinegar; Separation and purification; Bacterial diversity; Fungal diversity
食醋作为日常生活中常见的调味料,有着悠久的历史文化。据现代科学研究表明食醋具有缓解疲劳、增强食欲、促进消化、促进血液循环、平衡血液酸碱度、改善肝功能等保健功效,深受大众青睐,是中国药食同源文化研究的最佳切入点[1-5]。随着人民生活水平的提高以及研发技术的革新,人们对食品的需求已从温饱上升到营养、保健类,醋类产品的开发从仅局限于食醋调味品拓展到以各种水果或果汁为原料生产果醋,既保留水果的风味营养,又改善口感,深受大众喜爱[6]。无论是食醋还是果醋,其核心都是醋酸菌发酵产酸[7-9]。永春老醋以红曲、芝麻、糯米为原料,采用液态发酵方式,经糯米浸泡蒸煮、酒精发酵、液态醋酸发酵、陈酿等多道工序酿造而成,呈棕褐色,口感柔和带甜味,因其独特性质,与镇江香醋、四川保宁醋、山西陈醋并称为四大名醋[10]。由于地理环境及酿造工艺的差异,不同种类食醋的口感,微生物种类、丰富度、多样性都存在较大差异[11-12]。
醋的发酵和陈酿的过程同时也是微生物通过富集、繁殖成稳定的菌落结构的过程,这些微生物菌落对食醋的营养和风味至关重要[13]。本研究拟对实验室所采集的来源于福建永春老醋不同生产过程的样品,进行微生物筛选、分离、菌种鉴定,并对永春老醋不同发酵过程中微生物多样性进行菌群分析[14-18],以期获得永春老醋不同阶段具有优势作用的微生物群落组成,为探索不同阶段微生物菌落组成对永春老醋酿造及风味影响提供科学依据,为永春醋药食同源研究奠定基础。
1 材料与方法
1.1 试剂与仪器
主要试剂:RBA、MRS干粉培养基购于北京陆桥技术股份有限公司;琼脂糖购于Genetech 公司;OMEGA Gel Extraction kit购于OMEGA公司;2×Taq PCR MasterMix购于TIANGEN公司、5000 bp DNA Ladder Marker购于TaKaRa公司;其他试剂均为国产分析纯。
主要仪器:高压蒸汽灭菌锅(GR110DR型,Zealway),超净工作台(SW-CJ-FB,江苏苏净集团有限公司),pH计(FE20K型,METTLER TOLEDO),水浴锅(DK-2000-111L型,黄骅菲斯福实验仪器有限公司),电热鼓风干燥箱(GZX-9240MBE,上海博迅实业有限公司医疗设备厂)、振荡培养箱(ZQZY-CF8型,上海知楚仪器有限公司),PCR仪(CF-16RX,Thermo Fisher公司),凝胶成像系统(JS-680型,上海培清科技有限公司),旋涡振荡器(VORTEX3,IKA),光学显微镜(DM2000型,Leica),分析天平(BSA223S型,Sartorius)。
1.2 试验材料
YCV1为醋母样品、YCV2为8个月陈醋样品、YCV3为3年陈醋样品、YCV4为2.5年陈醋样品、YCV5为1.5年陈醋样品、YCZ1为糟床样品1、YCZ2糟床样品2、HYQ1为黑衣曲样品,以上分离样品均取样于福建永春老醋有限责任公司。
1.3 培养基配制
PDA培养基:去皮马铃薯200 g,加适量蒸馏水煮沸0.5 h,纱布过滤,加入20 g葡萄糖、20 g琼脂,定容至1000 mL,121℃灭菌30 min。
PCA培养基:胰蛋白胨5.0 g、酵母膏2.5 g、葡萄糖 1.0 g、琼脂15 g,调pH至7.0±0.2,定容至1000 mL,121℃灭菌30 min。
NA培养基:蛋白胨10.0 g、牛肉膏3.0 g、氯化钠5.0 g、琼脂15 g,调pH至7.3±0.2,定容至1000 mL,121℃灭菌30 min。
RBA培养基:蛋白胨5.0 g、葡萄糖 10.0 g、碳酸二氢钾1.0 g、无水硫酸镁 0.5 g、孟加拉红0.033 g、氯霉素 0.1 g,琼脂20 g,定容至1000 mL,121℃灭菌30 min。
1.4 试验方法
1.4.1 样品分离纯化 采用稀释涂布法分离样品,在无菌条件下,将8个样品原液用无菌生理盐水稀释到不同浓度梯度(10-6~10-1),取适量稀释后样品分别涂布于PCA培养基及MRS培养基,37℃培养数日;涂布于RBA培养基,25℃培养数日,待菌落长出,用接种环挑取单菌落至相应培养基平板再次分离纯化。
1.4.2 菌株的形态学鉴定 观察菌株的菌落形态,进行结晶紫草酸铵染色,在油镜下观察菌落形态并记录,根据菌落形态的不同,初步判定是否为单菌落,并分别分类保存。
1.4.3 菌株的分子生物学鉴定 将初筛、分离纯化得到的菌株,接种于液体培养基培养2~4 d,分别采用TIANGEN公司的细菌、真菌基因组DNA试剂盒提取基因组DNA,以提取的基因组DNA为模板,采用16S rRNA通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-TACGGCTACCTTGTTACGACTT-3′),ITS通用引物ITS1(5-TCCGTAGGTGAACCTGCGG-3)和ITS4(5-TCCTCCGCTTATTGATATGC-3),PCR扩增得到目的序列,经琼脂糖凝胶电泳观察目的条带与预期一致,送测,比对,鉴定。PCR扩增体系为2×Taq PCR MasterMix 25 μL、两端引物各0.5 μL、基因組DNA 5 μL、纯水补充体积至50 μL;扩增程序为,94℃预变性5 min;94℃变性30 s,55℃退火30 s,72℃延伸90 s,35个循环;72℃延伸5 min;10℃保存。将PCR扩增产物进行1.2%琼脂糖凝胶电泳,16S rRNA序列目的条带大小约1500 bp,ITS目的条带大小约600 bp,产物送福州铂尚测序有限公司测序。测序序列在美国国家生物信息技术中心(NCBI)数据库进行比对。
1.4.4 永春醋来源样品微生物多样性分析 采用Illumina Miseq 平台对永春老醋不同发酵过程中具有代表性的8个样品进行高通量测序,利用生物学软件对样品进行多样性分析[19-20]。利用 Uclust 软件,以97%为阈值进行操作分类单元(operational taxonomic units,OTUs)划分,进而实现样品序列的聚类,利用Mothur v 1.30.1软件对相似水平大于97% 的OTUs进行细菌和真菌的α-多样性分析,包含Chao1、Coverage指数、Observed species、PD whole tree、Shannon、Simpson指数,进而评估永春醋来源不同样品微生物群落的丰富度和多样性。通过R语言及作图软件分析对物种进行Venn 图和细菌、真菌的群落组成成分分析,层级聚类分析,从而对永春醋来源不同样品的微生物进行β-多样性分析。
2 结果与分析
2.1 永春醋来源微生物菌株分离及形态学鉴定结果
本试验样品来源于永春老醋不同生产发酵过程,选择具有代表性的8种样品,利用不同筛选培养基初筛,经分离纯化,共筛选菌株107株。通过结晶紫染色、微生物形态学观察主要筛选得到的菌株有芽孢杆菌、杆菌、酵母菌等。部分样品镜检图片见图1。
2.2 永春醋来源微生物菌株分子生物学鉴定结果
本批次共培养107株菌,3株经多次尝试未能提取基因组,11株测序后峰图出现杂峰、套峰等原因不可用。在分类学上,当2个分类单元间的序列同源性大于97.5%,可认为属于同一个种,若同源性低于97.5%的菌株需要结合形态学表型鉴定。经鉴定芽孢杆菌占比43.52%、醋酸杆菌占比12.04%、乳酸菌占比11.11%、酵母菌占比9.35%、霉菌占比3.71%。
2.3 永春老醋来源样品α-多样性分析
由表1可知,来源于永春醋不同生产发酵过程的8个样品Coverage指数都大于0.99,说明物种测序深度已基本覆盖到样品中几乎所有物种,较接近物种的实际情况。Chao1表示群落中预估的物种数量,而Observed-species表示所能观察到的物种数量,在细菌多样性指数检测结果中,HYQ1和YCV4的Chao1指数、Observed-species指数较高,表明物种丰富度越大,YCV2最低,物种丰富度较低;PD-whole-tree是依据系统发育树而来的一种多样性指标,数值越大,群落多样性越高,在8个样品中差别较大,其中YCV4最大,HYQ1次之,YCV2最小;Shannon指数来源于信息熵,是信息理论的测量数值,用来度量群落丰富度,其中HYQ1数值最大,YCV3最小;Simpson指数越大,说明群落多样性较丰富,其中HYQ1数值最大,YCV1和YCV5次之,YCV3最小,其他样品之间差距较小。
就真菌的α-多样性而言,YCV2的chao1指数最大,YCV5次之,YCV1最小;在8个样品中Observed-species中YCV5最大、YCV2次之,同样YCV1最小,说明YCV2和YCV5物种数量较多,YCV1的物种丰富度低;PD-whole-tree值和Shannon值都是YCV5最大,YCV2次之,YCV1最小;Simpson指数YCV2、YCV3较大、YCV1最小。综上在α-多样性指数中,真菌的多样性与细菌多样性差距较大,永春醋来源样品中HYQ1、YCV4细菌物种丰富度较高,而在真菌中YCV2、YCV5丰富度较高,说明在黑衣曲样品和发酵2.5年的陈醋中细菌为优势菌群,而在YCV2和YCV5中真菌多样性较丰富,说明在陈酿8个月及1.5年的样品中,真菌为优势菌群。
2.4 永春老醋来源样品的物种Venn图分析
将永春醋不同发酵阶段样品按类分组,YCV1~YCV5取样均匀混合,糟床样品YCZ1、YCZ2混合均匀,如图2-a 所示细菌的OTU数量图中,永春醋样品YCV、糟床样品YCZ、黑衣曲样品HYQ中共有OTU数585个。3个样品共有OTU数156个,YCV与YCZ共有238个OTU,YCZ和HYQ共有197个OTU,YCV和HYQ共有 212个OTU,单独存在于YCV、YCZ、HYQ的OTU各有161、36、53个,说明3个样品在一定程度上物种组成存在相似,相似中又有不同,都有各自独特的物种;在真菌的OTU 数量图2-b中,3个阶段样品共有OTU数902个,3个样品中共有的OTU数185个,YCV与YCZ共有273个OTU,YCZ和HYQ共有228个OTU,YCV和HYQ共有 227个OTU,单独存在于YCV、YCZ、HYQ的OTU各有484、33、527个,图中可得YCV即永春醋不同发酵及陈酿阶段的群落结构较为丰富,菌株数量较多。
2.5 永春醋来源样品细菌群落结构分析
在门水平下研究细菌群落结构组成,由图3可知,YCV1、YCV4、 YCZ1、YCZ2中变形菌门为主,分别占比81.81%、82.43%、83.73%、79.83%;YCV2、YCV3、YCV5主要是厚壁菌门为主,分别占比99.42%、97.40%、92.85%;HYQ1以厚壁菌门及变形菌门为主,各占54.28%、43.41%。变形菌门的成员广泛包括严格厌氧、严格需氧、兼性厌氧菌等,大多数变形菌门属于兼性厌氧型,而在醋酸发酵阶段以属于α-变形菌纲的好氧菌为主,在食醋的醋酸发酵阶段需要好氧菌发挥重要作用,能将乙醇等醇类物质及糖类转化为有机酸;而厚壁菌门多为厌氧菌,且厚壁菌门多数可产芽孢,能在極端及脱水环境下生存。芽孢杆菌多为兼性厌氧型,能分解一些糖类及蛋白质,为醋酸发酵阶段做铺垫,此外还可加快四甲基吡嗪的生成,四甲基吡嗪具有扩张血管、抗血栓、抗血小板凝集、改善微循环等作用,可为永春醋药食同源后续研究提供支持。永春醋发酵及贮存过程是一系列复杂微生物共同作用的结果,醋酸发酵阶段及贮存期间高酸环境为芽孢、醋酸菌、乳酸菌等一系列菌的生长创造条件。在永春醋不同发酵及贮藏阶段,其细菌菌落变化存在波动和差异。
在属水平下研究细菌群落结构组成,由图4可知,YCV1主要含相对丰富度67.77%醋酸杆菌科的驹形杆菌、4.84%的乳酸菌、3.13%的芽孢杆菌以及其他多种少量丰富度的菌落结构; YCV4、YCV1中以驹形氏杆菌为主,相对丰富度各为67.77%、81.03%;YCV2、YCV3、YCV5以乳酸杆菌属为主,各占98.98%、96.29%、92.64%;YCZ1、YCZ2在属水平上组成几近相似,以醋酸杆菌为主,各占82.63%、78.69%;HYQ1则含有相对丰富度为44.87%的芽孢杆菌、32.19%的伯克霍尔德氏菌、9.25%的乳酸菌、8.34%的醋酸菌及其他种类微生物。在永春醋的醋酸发酵阶段及贮藏初期,变形菌门的醋酸杆菌及厚壁菌门的乳酸菌为主要活跃菌落组分。醋酸杆菌在其发酵产酸过程发挥重要作用,可加快乙酸生成。食醋中的不挥发酸,也是关乎食醋质量的重要指标,其中的乳酸便由乳酸菌发酵而来,乳酸菌亦可提升老醋中乳酸含量。除此之外,多数样品含有多种相对丰富度较低的其他微生物,菌落组成丰富而复杂,也从侧面反映永春醋发酵过程是多种微生物共同作用的结果。
综上,从不同水平分析永春醋来源8个样品的细菌群落结构,在属水平分析微生物菌落组成则剖析的越细致。YCV1、YCV4、YCZ1、YCZ2所含的细菌群落主要是变形菌门、α-变形菌纲、醋酸杆菌目,其中YCV1、YCV4在属水平主要群落结构为驹形氏杆菌,而YCZ1、YCZ2中多数是醋酸杆菌。YCV2、YCV3、YCV5细菌群落结构主要来源于厚壁菌门、芽孢杆菌纲、乳酸杆菌目、乳酸杆菌属。HYQ1含有厚壁菌门又含有变形菌门的微生物、芽孢杆菌纲和变形菌纲、芽孢杆菌目和伯克氏菌目、芽孢桿菌属和伯克霍尔德氏菌。YCV1(醋母)是8个样品中细菌群落组成最为丰富的,醋母顾名思义“醋酸发酵之母”,醋酸发酵是在醋酸菌的作用下,将酒精氧化产酸的过程[21],可见醋母在醋酸发酵过程的重要作用。在细菌群落结构中,8个样品并无呈现明显的菌落变化规律,在发酵及陈酿期,细菌结构以醋酸杆菌、乳酸杆菌、芽孢杆菌为主。醋酸杆菌在永春醋的醋酸发酵阶段将醇类物质转化为有机酸,赋予永春醋特殊的口感,且能氧化糖类、糖醇、有机酸等物质,具有保健功效。乳酸菌代谢过程生成多种氨基酸、有机酸、矿物质、微量元素、酶等,对永春醋风味形成、改善以及营养价值的提升至关重要。芽孢杆菌为兼性厌氧型菌,芽孢杆菌所含的一些酶能将部分糖及蛋白质水解成葡萄糖单糖及小分子多肽。永春老醋之所以成为老醋,是因为自然转酸时间长,虽然现代工艺可大大缩短发酵时间,但为了更好地传承永春醋工艺及风味,传统工艺还是被诸多酿造者延续用至今。
2.6 永春醋来源样品真菌群落结构分析
在门水平下研究真菌群落结构组成,图5可知子囊菌门除了在YCZ1中相对丰富度占比最低仅65.73%,在其他样品中相对丰富度均大于85%。子囊菌门作为真菌界最重要的门,种类繁多,其所属的寄生的子囊菌广泛应用于酿造行业,在本批次永春醋来源不同样品中处于优势菌群,说明其对永春醋发酵过程中起到举足轻重的作用。
在属水平下研究真菌群落结构组成,由图6可知,YCV1中不确定分类的属相对丰富度占97.87%;YCV2和YCV3以不明分类的属及酵母菌为主;YCV4和YCV5以酵母菌属为主要菌群,各占82.89%、54.58%,其中YCV5中还含有多种微量的菌群共同起作用;YCZ1枝孢菌属占39.83%、不确定分类属占18.38%、曲霉属占18.13%、节担菌属占17.84%以及微量的其他分类菌属;YCZ2中酵母菌属相对丰富度占38.70%、曲霉菌占24.39%、梅奇酵母科占9.34%、枝孢菌科占8.2 6%、不确定分类占7.04%;HYQ1中曲霉属占56%、红曲霉属占33.72%,其余多为其他种类的菌落。属水平分析不同样品真菌群落结构可知出不确定属的分类外,以酵母菌、曲霉属居多。在食醋酿造过程,酵母菌与所含糖类成分经过一系列复杂的反应生成醇类物质,大部分醇类物质氧化生成酸,部分醇与酸在酵母、霉菌和细菌所产生的脂酶的作用下,发生酯化反应生成脂类物质,食醋中脂类物质种类繁多,营养丰富,这一系列有趣的反应形成特殊的成分造就了永春醋特殊的风味。属水平上比较各样品真菌与细菌群落结构多样性,YCV1和HYQ1细菌群落结构比真菌群落结构多样复杂,除此之外,其他样品中普遍存在真菌的群落结构多样性大于细菌群落结构多样性。
综上,在不同水平分析永春醋来源8个样品的真菌群落结构可知,来源于永春醋不同生产阶段的8个样品,真菌的菌落结构较细菌菌落结构更为复杂多变,说明在永春发酵及贮存阶段,真菌为主导力量。YCV1主要是来源于子囊菌门、粪壳菌纲、不确定分类的目、属一类的微生物;YCV2和YCV3主要是来源于不确定分类属、酵母属、曲霉属等微生物;YCV4和YCV5真菌组成较为相似,主要来源于子囊菌门、酵母属的微生物;YCZ1主要是枝孢菌属、曲霉属、节担菌属、不确定分类的属;YCZ2主要是酵母菌属、曲霉属的微生物;HYQ1则是曲霉属和红曲霉属。在永春醋贮存及发酵阶段,霉菌虽相对丰富度不高,但其所代谢产生特殊风味物质,对永春醋品质的提升有极大的促进作用。
2.7 永春醋来源不同样品β-多样性分析
2.7.1 PCA分析 图7、图8为来源于永春醋不同生产过程样品的真菌及细菌PCA分析图,图中获悉在细菌的PCA分析图中YCV1和YCV4在二维坐标上距离最接近,组成更为相似;同理,YCV2、YCV5及YCV3这3个样品距离较近,组成较为相似,YCZ1与YCZ2组成相似,HYQ1与其他样品差距都较大;而在真菌的PCA图中不同样品的差异较大,YCV1与其他物种差距较大,YCV2与YCV3组成较相似,YCV4与YCV5组成相似,YCZ1与YCZ2虽都来源于糟床样品,且他们在细菌主成分分析上较为相似,但真菌的菌落结构汇总差异较大,HYQ1相比于其他样品,群落结构组成差距大。该分析结果与前述中真菌、细菌中,在不同水平下菌落结构图的结果是吻合的。
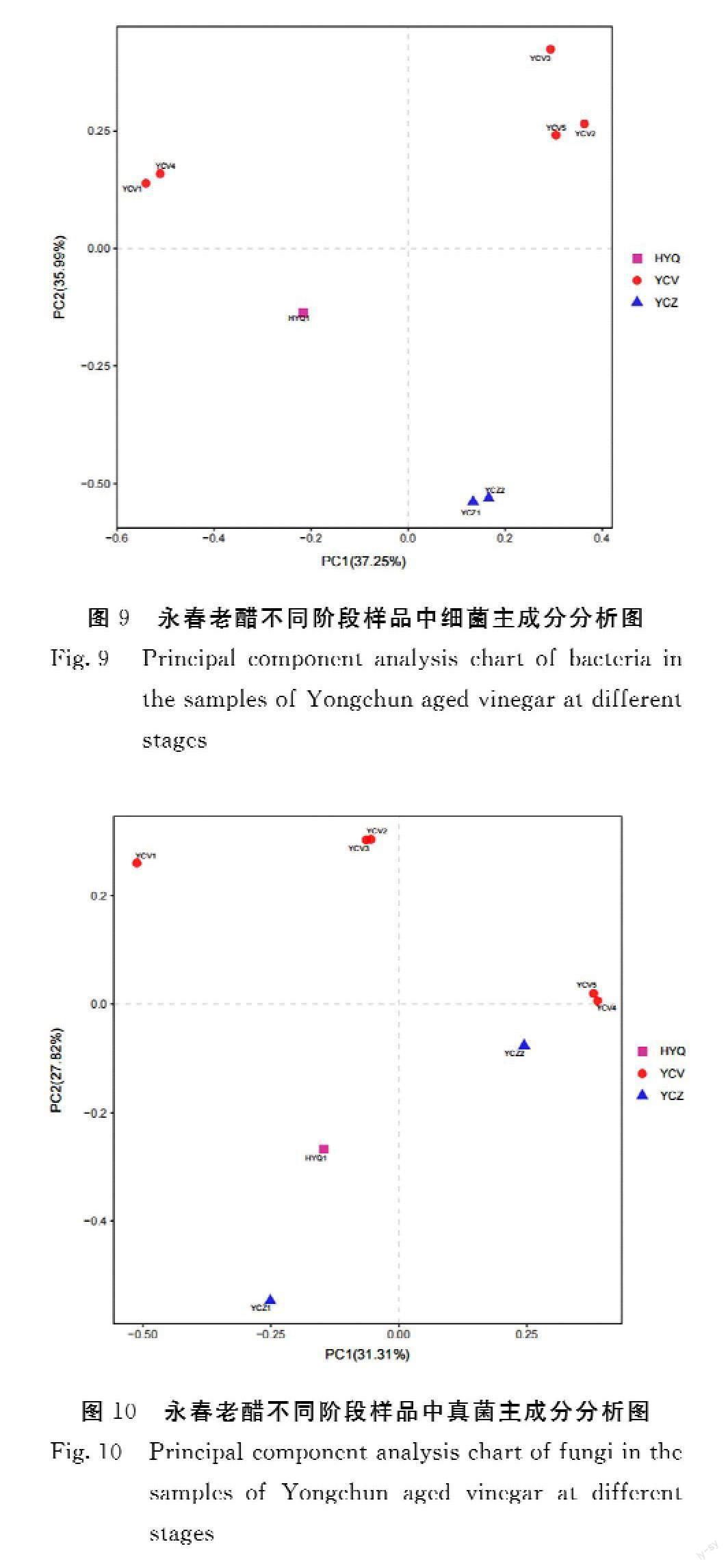
2.7.2 PCoA分析 图9、图10为来源于永春醋不同生产过程样品的真菌及细菌PCoA分析图,不同样品间的群落结构组成越相似,这些样品在坐标上越倾向于聚集在一起,当群落组成结构差异性较大时,样品则会分开散落。YCV1和YCV4在二维坐标上距离最接近,组成更为相似;同理,YCV2、YCV5及YCV33个样品组成较为相似,YCZ1与YCZ2组成相似,HYQ1与其他样品差距都较大;而在真菌的PCoA图中不同样品的差异较大,YCV1与其他物种差距较大,YCV2与YCV3组成较相似,YCV4与YCV5组成相似,YCZ1与YCZ2虽都来源于糟床样品,且他们在细菌主成分分析上较为相似,但真菌的菌落结构汇总差异较大,HYQ1相比于其他样品,群落结构组成差距大。该分析结果与前述中真菌、细菌中在不同水平下菌落结构图及PCA的分析的结果是吻合的。
2.7.3 PLS-DA分析 由图11、图12可知,本试验中来源于永春醋不同过程的8个样品,在真菌和细菌多样性中差距较大,来源于YCV1-YCV5这5个永春醋不同发酵及贮藏阶段的样品,菌落结构存在波动但又较为相似;YCZ1和YCZ2是来源于不同糟床上的样品,两者较为相似;HYQ1无论在真菌或者细菌的PLS-DA分析中与其余样品相比存在较大差异。
2.7.4 聚类分析 由图13可知,细菌的树状图中各个样品间都存在一定程度的差异,YCV1与YCV4优先聚类,两样品间距离为0.26606;YCV2与YCV5优先聚类后再和YCV3聚类,YCV2与YCV5距离为0.14144;YCV2与YCV3距离0.27241,YCV5与YCV3距离0.40624,YCZ1与YCZ2优先聚类,两样品间距离为0.0544;HYQ1与其他样品距离都在0.98以上,说明HYQ1与其他样品细菌菌落结构差异大。
由图14可知,真菌的树状图各样品间相比细菌的菌落组成差异性更大,YCV2与YCV3优先聚类,距离0.11741;YCV4与YCV5优先聚类后与YCZ2聚类,YCV4与YCV5距离0.40082,YCV4与YCZ2距离0.71899,YCV5与YCZ2距离0.67567,HYQ1与其他样品真菌菌落组成差异大,距离在0.77356以上;YCZ1与其他样品真菌菌落组成差异大,距离在0.82169以上。同一个样品的真菌和细菌菌落组成差异大,YCV1细菌菌落和YCV4相近0.26606,但在真菌菌落组成中两者差异大,距离达0.97715;YCZ1与YCZ2在细菌菌落相似树状图组成相近,距离为0.0544,而在真菌树状图中并没有优先聚类,距离达0.82169。
综上可得,本批次永春醋不同生产过程样品,真菌的菌落相似性高于细菌的,菌落组成更为丰富。YCV1、YCV2、YCV3、YCV4、YCV5为陈醋发酵及不同陈酿时间段的样品,这些样品细菌的菌落组成结构较为相近,说明在永春醋发酵阶段及贮存陈酿早期时间,醋液中细菌菌菌落的变化大于细菌菌落变化,随着贮存时间的延长,真菌菌落多样性更为丰富,真菌菌落的变化对永春老醋风味的形成至关重要,而在 YCZ1、YCZ2、HYQ1中真菌群落变化大于细菌菌落变化。
3 结论与讨论
本研究利用不同菌株对不同培养基的偏好性,对采集于永春老醋有限公司不同生产过程的8个样品进行微生物筛选,并对筛选所得部分菌株进行形态学分析及分子生物学初步鉴定,共筛选107株菌株,通过结晶紫染色、形态学观察,所筛选的菌株大部分为杆状菌、芽孢杆菌、酵母菌。采用试剂盒提取基因组DNA,利用聚合酶链式反应进行16S rDNA或ITS鉴定,将PCR产物测序,序列在NCBI进行同源性分析可得筛选菌株多为芽孢杆菌属、醋酸杆菌、乳酸菌、酵母菌、霉菌。
利用Illumina Miseq 高通量测序技术对高通量测序,对永春醋来源不同样品微生物进行多樣性分析。对相似水平大于97%的操作分类单元进行α-多样性分析,包括Chao1指数、Coverage指数、Observed species、PD whole tree、Shannon、以此来评估微生物多样性及丰富程度,发现不同样品真菌和细菌的物种丰富度及多样性差距较大,HYQ1(黑衣曲样品)、YCV4(2.5年陈醋)细菌物种丰富度较高,而在真菌中YCV2(8个月陈醋)、YCV5(1.5年陈醋)丰富度较高,说明在黑衣曲样品和发酵2.5年的陈醋中细菌为优势菌群,而在YCV2和YCV5中真菌多样性较丰富,说明在陈酿8个月及1.5年的样品中,真菌为优势菌群。对不同样品分组做Venn图分析,YCV组群落结构较糟床样品及黑衣曲样品更为丰富。对永春醋不同发酵过程中的不同样品进行微生物群落结构分析,可得不同样品都存在个体差异,越往深一级水平探究菌落组成结构,剖析的越细致。在细菌菌落组成YCV1(醋母)、YCV4(2.5年陈醋)相似,以驹形氏杆菌为主;YCV2(8个月陈醋)、YCV3(3年陈醋)、YCV5(1.5年陈醋)以乳酸杆菌属为主,YCZ1(糟床1)、YCZ2(糟床2)中多数是醋酸杆菌,HYQ1(黑衣曲)以芽孢杆菌属和伯克霍尔德氏菌为主要菌落。真菌菌落组成较为复杂,不同样品差异大,YCV1以不确定分类的属为主;YCV2、YCV3真菌组成相似,以不确定分类属、酵母属、曲霉属等微生物为主;YCV4和YCV5真菌组成较为相似,酵母菌为优势菌群;YCZ1以枝孢菌属、曲霉属、节担菌属、不确定分类的属为主;YCZ2以酵母菌属、曲霉属为主;HYQ1以曲霉属和红曲霉属为主。
对永春醋来源样品进行真菌及细菌的PCA(聚类分析)、主坐标分析(PCoA)、相似度聚类树分析,其分析结果与微生物菌落结构组成分析是想吻合的。利用树状图直观反映多个样品之间的相似和差异程度,图中可得不同样品细菌与真菌的菌落结构差别较大,在细菌树状图清晰可见YCV1与YCV4优先聚类,YCV2与YCV5优先聚类后再和YCV3聚类,YCZ1与YCZ2优先聚类,HYQ1与其他样品相比差异明显;而在真菌树状图中YCV2与YCV3优先聚类,YCV4与YCV5优先聚类后与YCZ2聚类,YCV1、HYQ1及YCZ1与其他样品相比差距较大。
永春老醋发酵是一个非常复杂、需要多种微生物共同参与的过程,老醋富含18种22氨基酸及多种对人体有益的发酵微生物,营养价值较高,对永春醋发酵过程中的不同样品微生物群落结构研究,可探究永春醋独特风味的来源,同时为传统酿造食醋的科学研究和工业化生产提供相关理论基础,以及为新型功能性食醋的开发提供理论参考。
永春老醋凭借其精湛的工艺,在品质、食用和药用等有着独特的竞争优势,除去腥调味等作用,永春老醋具有降血脂[22]、降血压、缓解疲劳、提高食欲、软化血管等功效[23-24],其特有的红曲成分对心脑血管疾病具有一定的防治作用[25]。本研究对永春醋不同生产阶段微生物的筛选及初步鉴定为课题组菌种保藏库注入新的活力,永春老醋作为国家地理标志产品,历史悠久,发酵中所涉及菌群经世代驯化已极具当地特色[26],对其微生物多样性分析,为永春醋发酵过程的理论研究及工业化生产提供科学依据,今后的研究工作将对所筛选的优势菌株做进一步的生理生化鉴定,模拟应用至发酵工艺,研究其是否能对发酵过程产生有利影响,如缩短发酵周期、提高产量等,为优化生产工艺及和控制质量提供更多的可能,推动福建永春老醋产业的高质量发展。
参考文献:
[1]吴子航,张祥龙,刘丹彤,等.中国传统食醋营养健康物质组成研究进展[J].中国酿造,2022,41(12):9-14.
[2]霍君生.食醋的医疗保健功能[J].上海调味品,1999(3):30-31.
[3]李南材,黄国彬.永春老醋:持久弥香[J].福建质量技术监督,2011(3):29-29.
[4]BEH B K,MOHAMAD N E,YEAP S K,et al.Anti-obesity and anti-inflammatory effects of synthetic acetic acid vinegar and Nipa vinegar on high-fat-diet-induced obese mice[J].Scientific Reports,2017(7):1-9.
[5]信亚伟,孙惜时,谈甜甜,等.食醋的营养价值和保健功能作用研究进展[J].中国调味品,2015,40(2):124-127.
[6]刘凤珠,牛小明.水果醋的营养研究分析[J].中国调味品,2011,36(6):93-96.
[7]XU W,XU Q P,CHEN J H,et al.Ligustrazine formation in Zhenjiang aromatic vinegar: changes during fermentation and storing process[J].Journal of the Science of Food & Agriculture,2011,91(9):1612-1617.
[8]马永昆,许满青,陈必祥,等.桑椹果醋营养功能功效解读[J].食品安全质量检测学报,2021,12(6):2117-2124.
[9]成剑峰.浅谈食醋发酵及醋酸菌的应用[J].山西食品工业,2002(1):10-12.
[10]张璟琳,黄明泉,孙宝国.四大名醋的游离氨基酸组成成分分析[J].食品安全质量检测学报,2014, 5(10):3124-3131.
[11]刘若辰,李荣,姜子涛,等.不同类型食醋的香气特征及挥发性成分分析[J].食品科学,2022,43(8):227-237.
[12]吴亚楠,李林洁,刘小菁,等.传统食醋主要有机酸组成综述及其风味特征分析[J].中国调味品,2021,46(1):161-165.
[13]周建民.用醋酸菌和酵母混合发酵酿制米醋[J].中国调味品,1990(12):26-30.
[14]沈萍,陳向东.微生物学实验[M].4版.北京:高等教育出版社,2007.
[15]王俊奇,黄卫红,李双彤,等.永春老醋不同生产阶段细菌和真菌多样性动态变化特征分析[J].食品与发酵工业,2021,47(2):738-744.
[16]张威,章高森,刘光琇,等.天山乌鲁木齐河源1号冰川中真核微生物多样性分布及时空变化研究[J].冰川冻土,2010(5):906-913.
[17]朱逸娴,王笑梅,周洁,等.草菇污染菌的微生物菌落结构及多样性分析[J].常熟理工学院学报,2020,34(5):106-110.
[18]于文平,张亚豪,吴正云,等.青菜泡菜工业发酵过程中微生物群落结构变化分析[J].中国调味品,2019,44(6):30-35.
[19]李恒,陈功,伍亚龙,等.高通量测序方法研究传统四川泡菜母水中微生物群落的动态变化[J].食品科学,2018,39(24):138-145.
[20]戴玲瑛,齐曼婷,王立梅,等.虾酱中间产物细菌群落结构及多样性[J].食品科学,2018,39(22):173-178.
[21]邹昆,程强,鲁兰,等.红曲醋的研究现状和发展趋势[J].中国调味品,2022,47(2):211-215,220.
[22]张海燕,杨汀,曾锦章,等.永春老醋与桃溪牌软胶囊对大鼠调节血脂作用的实验研究[J].食品研究与开发,2004,25(5):121-123.
[23]刘硕.我国传统固态发酵食醋主要风味物质组成分析[J].中国食品,2021(13):120-121.
[24]陈晶晶.基于SWOT分析福建永春老醋产业的发展策略研究[J].大众科技,2023,25(3):212-215.
[25]孙双双.永春老醋:古法技艺的匠心传承[J].中国食品工业,2022(2):74-75.
[26]周香珍,林书发,何书华,红曲药学评价研究进展[J].中国现代中药,2016,18(7):936-941.
(责任编辑:柯文辉)
