定点突变对决明Kunitz抑制剂抑制活性的影响
2023-03-13黄斌翰李文杰周嘉裕
唐 婕,黄斌翰,李文杰,周嘉裕,廖 海
(西南交通大学生命科学与工程学院,成都 610031)
【研究意义】蛋白酶参与生物体内多种生理生化过程,如新陈代谢、细胞周期、细胞凋亡等,对其活性的精准调控是维持正常生命活动的关键。生物体可以通过激活蛋白的内源性抑制剂对其活性进行调控[1]。植物中含有大量的抑制剂[2],它们以类似底物的方式与酶的活性部位紧密结合,形成稳定的复合体,从而达到调控蛋白酶活性的效果。自从1946年库尼茨(Kunitz)发现大豆胰蛋白酶抑制剂以来,已经从不同的豆科植物中分离出许多蛋白酶抑制剂,已有一部分研究对这些蛋白酶抑制剂的营养价值进行了介绍[3],但关于它们发挥生理作用的确切机制研究较少[4]。蛋白酶抑制剂传统上被归类为半胱氨酸抑制剂、丝氨酸蛋白酶抑制剂、天冬氨酸蛋白酶抑制剂和金属蛋白酶抑制剂。Kunitz蛋白酶抑制剂(Kunitz trypsin inhibitor,KTI)属于丝氨酸蛋白酶抑制剂家族中的胰蛋白酶抑制剂。KTI是一类天然的小分子蛋白,其分子量通常在18~24 kDa,常见于含羞草亚科、苏木亚科和凤蝶亚科的贮藏组织,如果实、块茎和种子中,对维系生物体的正常生命活动具有重要作用,主要可以抑制丝氨酸蛋白酶的活性。依据肽链及二硫键的数量差异,KTI被分为6个亚类型[5]。KTI通常含有一个或多个串联的Kunitz结构域,通过与靶酶形成抑制剂-靶酶复合物,从而抑制靶酶的活性。KTI家族成员的三维结构在植物中高度保守,形成β-三叶草(β-trefoil)型结构,由位于中央的疏水核心骨架与位于外围的亲水Loop环构成。疏水核心骨架包括12个反向平行β-折叠,其中6个反向平行β-折叠形成骨架底部的β-桶(β-barrel),其余6个反向平行β-折叠形成骨架顶部的盖子(Lid)。该骨架结构中含有较多疏水性氨基酸,彼此通过氢键等次级键与相邻的氨基酸相互作用,参与骨架结构的组装与稳定。因此,研究这些氨基酸的功能不仅有利于确定β-三叶草结构形成的分子机制,也对KTI结构的深入研究具有重要指导意义。【前人研究进展】KTI具有抗虫、抗菌、抗病毒、抗肿瘤转移和迁徙、炎症调节以及抗非生物胁迫等多种生物学活性。例如,Dunse等[6]将转入马铃薯I型和II型丝氨酸蛋白酶抑制剂的棉花饲养棉铃虫11 d后,发现棉铃虫的生长出现停滞,喂食含有2种丝氨酸蛋白酶抑制剂的幼虫重量比没有喂食抑制剂的对照幼虫轻40%,且长度比对照幼虫短90%,证明KTI的抗虫能力;Ramalho等[7]从雅致宽足豆(Platypodiumelegans)的种子中分离得到一种Kunitz蛋白酶抑制剂(PeTI),其对草地贪夜蛾(Spodopterafrugiperda)的中肠类胰蛋白酶具有抑制作用。喂食含有PeTI的人工饲料后,草地贪夜蛾的生长发育与生物量积累出现明显的阻滞,从而为草地贪夜蛾的生物防治与基因工程育种筛选到1个较好的候选抗虫因子;Lopes等[8]研究发现,在长期的进化过程中,包括KTI在内的蛋白酶抑制剂与昆虫消化酶相互对抗并在冲突中产生进化的推动力,增加了植物蛋白酶抑制剂的多样性,因此,研究蛋白酶抑制剂有助于深入理解物种进化与环境适应的基本原理;Zhu等[9]研究发现,当茶树(Camelliasinensis)感染炭疽病菌或受到茶尺蠖咬食后,KTI基因的表达会显著增加,并集中分布于叶及邻近组织,表明KTI是茶树防御体系的成员之一,保护茶树免受炭疽病菌或茶尺蠖的伤害,证明KTI的抗虫和抗菌能力;Fang等[10]从韩国大黑豆中纯化出分子量为20 kDa的Kunitz型胰蛋白酶抑制剂,检测得到其半抑制浓度 (IC50)值为 0.71 μmol/L,而对照组62 kDa的斑豆凝集素IC50值为2.2 μmol/L,说明KTI能够抑制HIV-1的反转录酶活性,证明KTI的抗病毒作用;Clemente等[2]对来自大豆的Bowman-Birk抑制剂(Bowman-Birk inhibitors,BBI)进行重组后得到rTI1B,用rTI1B处理HT29人结肠腺癌细胞和非恶性结肠成纤维细胞CCD-18Co细胞,发现rTI1B处理浓度越高,HT29人结肠腺癌细胞的生长越缓慢,而对照组CCD-18Co细胞则没有受到rTI1B处理浓度的影响。当对rTI1B的关键活性位点突变后,用突变体再次处理HT29细胞,发现HT29细胞的生长没有显著变化。这些发现表明,BBI和相关蛋白可以作为研究癌变早期阶段潜在的化学预防作用的分子靶点;近期有报道称KTI基因还能够提高植物抵抗非生物胁迫的能力。例如,Zhang等[11]研究发现,将野生大豆(Glycinesoja)来源的KTI基因在拟南芥中过表达,能够改善植物的抗旱能力,具体体现为缺水21 d后,80%转基因植物能够存活,而相同条件下,仅有5%的野生型植物能够存活;Yu等[12]从川产道地中药川芎 (Ligusticumchuanxiong)中分离出一个具有Kunitz结构域的α-淀粉酶/枯草杆菌蛋白酶抑制剂基因,该基因的mRNA含量在盐、低温与干旱胁迫下明显增加,表明其在响应非生物胁迫过程中发挥重要作用。【本研究切入点】西南交通大学生命科学与工程学院药用植物与分子生物学实验室在前期研究中,从豆科决明属植物决明(Cassiaobtusifolia)中分离得到决明Kunitz蛋白酶抑制剂1(CassiaobtusifoliaKunitz trypsin inhibitor,CoTI1)基因,其重组蛋白对胰蛋白酶等丝氨酸类蛋白酶具有较强的抑制活性[13]。比较CoTI1与其它物种来源的KTI,发现它们均含有保守的Cys44、Tyr134和Lys135残基,分析这3个残基在CoTI1三维结构中可能发挥的作用,然后再利用定点突变进行验证。【拟解决的关键问题】基于CoTI1的结构分析,探究定点突变对其抑制活性的影响,进一步为CoTI1的结构研究及后续改造提供坚实的理论依据。
1 材料与方法
1.1 材料
试验所用大肠杆菌(Escherichiacoli)DH5α和BL21(DE3)感受态购自上海生工生物工程(成都)有限公司,CoTI1-pET28a表达载体由西南交通大学生命科学与工程学院药用植物与分子生物学实验室前期构建保存;定点突变试剂盒Mut Express II Fast Mutagen-esis Kit V2购自南京诺唯赞公司;N-苯甲酰基-DL-精氨酸-硝基苯胺(N-Benzoyl-DL-arginine-pnitroaniline,BAPNA)购自Sigma公司;质粒抽提试剂盒Omega Plasmid Mini Kit I和胶回收试剂盒Gel Extraction Kit购自OMEGA公司;异丙基硫代半乳糖苷(Isopropyl-beta-D-thiogalactopyranoside,IPTG)购自MEKER公司;BCA蛋白浓度测定试剂盒购自碧云天公司;卡那霉素(Kanamycin,Kana)购自上海生工生物工程有限公司。
1.2 试验方法
1.2.1CoTI1基因的定点突变 定点突变采用一步法[14]原理,根据Cys44、Tyr134和Lys135在CoTI1-pET28a中对应的核苷酸序列设计突变引物(表1),通过PCR将TGC(Cys44)、TAC(Tyr134)和AAG(Lys135)分别突变成GCC(Ala)、GCC(Ala)和GCG(Ala)。
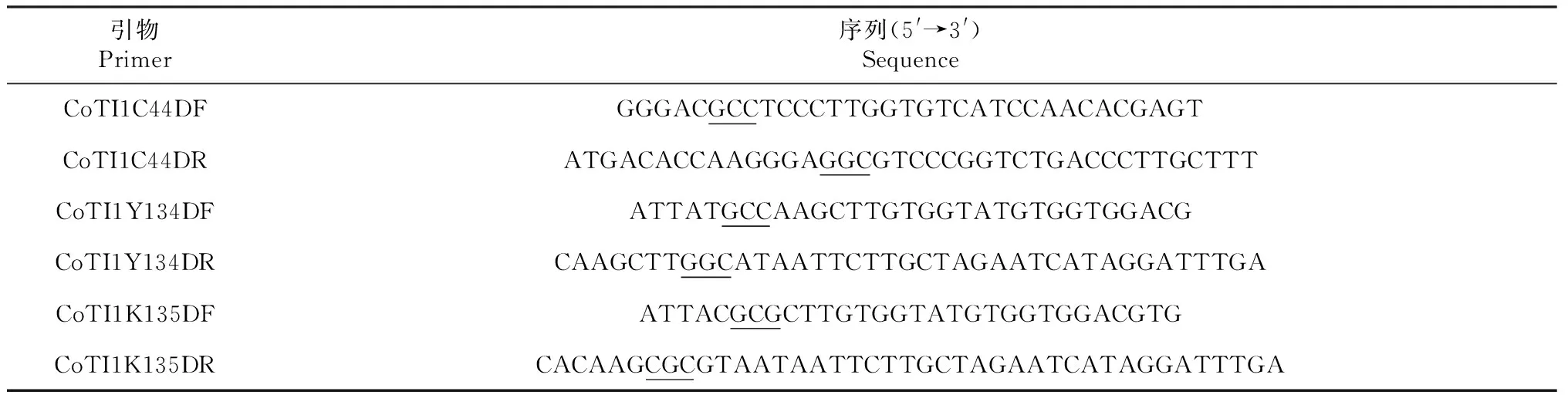
表1 本研究所用引物
PCR反应体系如表2所示,PCR反应条件为95 ℃预变性30 s; 95 ℃变性10 s,Cys44、Tyr134和Lys135分别用70、66和68 ℃退火15 s,72 ℃延伸45 s(30个循环); 最后再72 ℃延伸5 min,于4 ℃保存。

表2 PCR反应体系
PCR产物经DpnI消化去除甲基化模板质粒后,再用1%琼脂糖凝胶电泳检测并回收消化产物,将消化后产物用ExnaseII催化,使突变位点高效重组,实现DNA的体外环化。将重组产物转化DH5α,37 ℃过夜培养,测序确认重组产物,再提取正确突变质粒,将其转入BL21(DE3)进行表达。
1.2.2 突变体的表达、活性检测及菜青虫类胰蛋白酶提取 将突变体CoTI1C44D、CoTI1Y134D和CoTI1K135D菌液以1∶100的比例转接入含Kanamycin的液体LB培养基[15],在37 ℃、200 r/min的条件下培养至OD600(光密度值)为0.6后,加入工作浓度为1 mmol/L的异丙基硫代半乳糖苷(IPTG),在26 ℃、140 r/min的条件下诱导表达12 h。收集菌体进行超声破碎,离心后取上清加入Ni2+柱4 ℃结合1 h,弃掉上清,再用200 mmol/L的咪唑洗脱液洗脱得到突变体,最后对突变体进行透析过夜得到纯化后突变体[16]。纯化后突变体用BCA蛋白浓度测定试剂盒检测其浓度,再放入-80 ℃保存。突变体的活性检测[17]采用N-苯甲酰基-DL-精氨酸-硝基苯胺(BAPNA)为反应底物,CoTI1与胰蛋白酶相互作用产生黄色的对硝基苯胺,可在410 nm波长下检测到吸光值。
取4~5龄的菜青虫于预冷研钵中,用液氮研磨成粉末后加入1 mL的150 mmol/L NaCl生理盐水,在4 ℃条件下抽提蛋白15 min后,12 000 r/min,4 ℃离心15 min,所得上清液即为菜青虫类胰蛋白酶液,测定浓度后保存于-80 ℃备用[17]。
2 结果与分析
2.1 突变位点的确定
CoTI1的三维结构由12个反向平行的β-折叠和13个loop环组成[18],含有2个二硫键(Cys44-Cys89和Cys139-Cys147),活性基序为L64-V65-R66-P67-T68。β-三叶草骨架结构包括12个反向平行β-折叠,其中6个反向平行β-折叠形成骨架底部的β-桶(β-barrel),其余6个反向平行β-折叠形成骨架顶部的盖子(Lid)。Loop环可能是通过插入到靶蛋白酶的底物口袋中而发挥抑制作用。Cys44残基位于顶部盖子,Tyr134和Lys135残基位于底部桶内。通过与其他植物KTI序列(BvTI[19]、WBTI-2[20]、STI[21]、ILTI[22]、DrTI[23]、KTI5[24])比较可以看出,Cys44、Tyr134和Lys135残基在其他KTI中也高度保守(图1)。
通过分析CoTI1的Cys44、Tyr134和Lys135可知,Cys44位于β2和β3折叠之间,与Ile36形成氢键,与Cys89形成氢键和二硫键。Tyr134位于β9折叠,与Leu172形成氢键。Tyr135位于β9折叠,与Lys125和Asn149形成氢键。Cys44、Tyr134和Lys135通过与其他残基形成氢键或二硫键,参与三叶草骨架结构的形成并决定结构的稳定性(图2)。
2.2 CoTI1定点突变株的获取
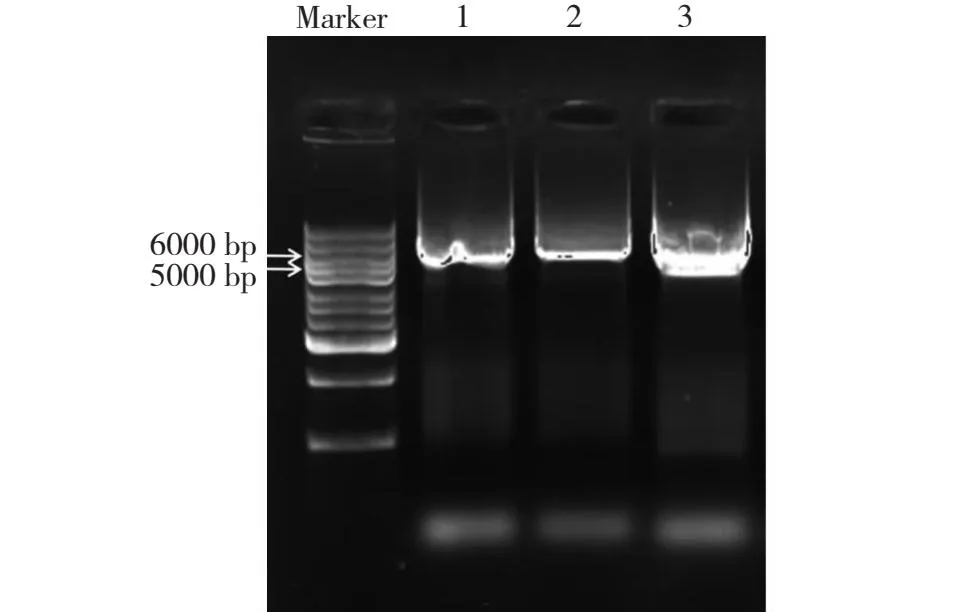
本研究采用一步法,PCR扩增获得3个突变体(约为5900 bp),电泳结果(图3)初步表明突变成功。由测序结果(图4)可知,原始序列由TGC(Cys44)、TAC(Tyr134)和AAG(Lys135)分别突变成GCC(Ala)、GCC(Ala)和GCG(Ala),随后提取正确突变的质粒转化大肠杆菌BL21(DE3)感受态得到突变体CoTI1C44D、CoTI1Y134D和CoTI1K135D的表达菌株。
2.3 突变体蛋白的表达与纯化
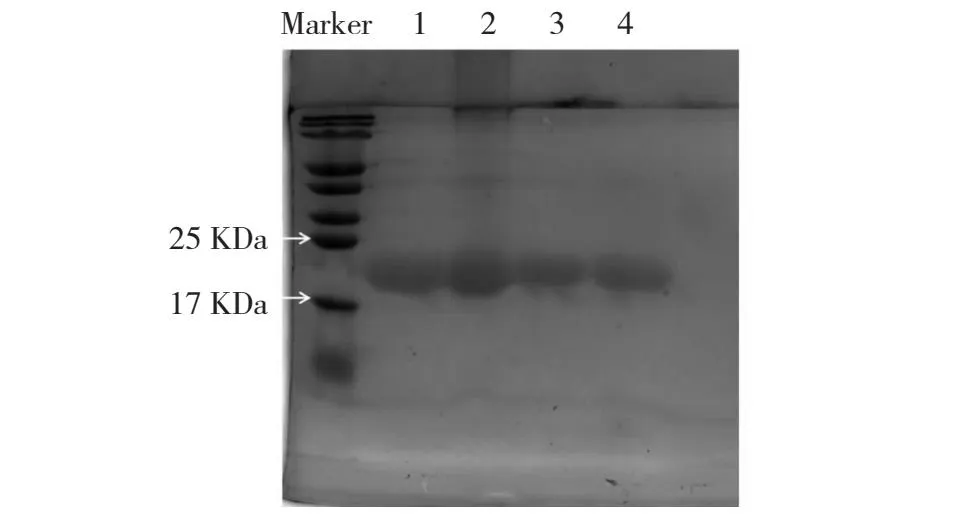
各取3 mL CoTI1、突变体CoTI1C44D、CoTI1Y134D和CoTI1K135D的菌液转接到300 mL的液体LB培养基中培养至OD600为0.6后,加入终浓度为1 mmol/L的IPTG在26 ℃、140 r/min条件下诱导表达12 h,电泳结果(图5)显示,CoTI1和3个突变体均表达成功,分子量约为24 kDa。
2.4 野生型和突变体蛋白的活性检测
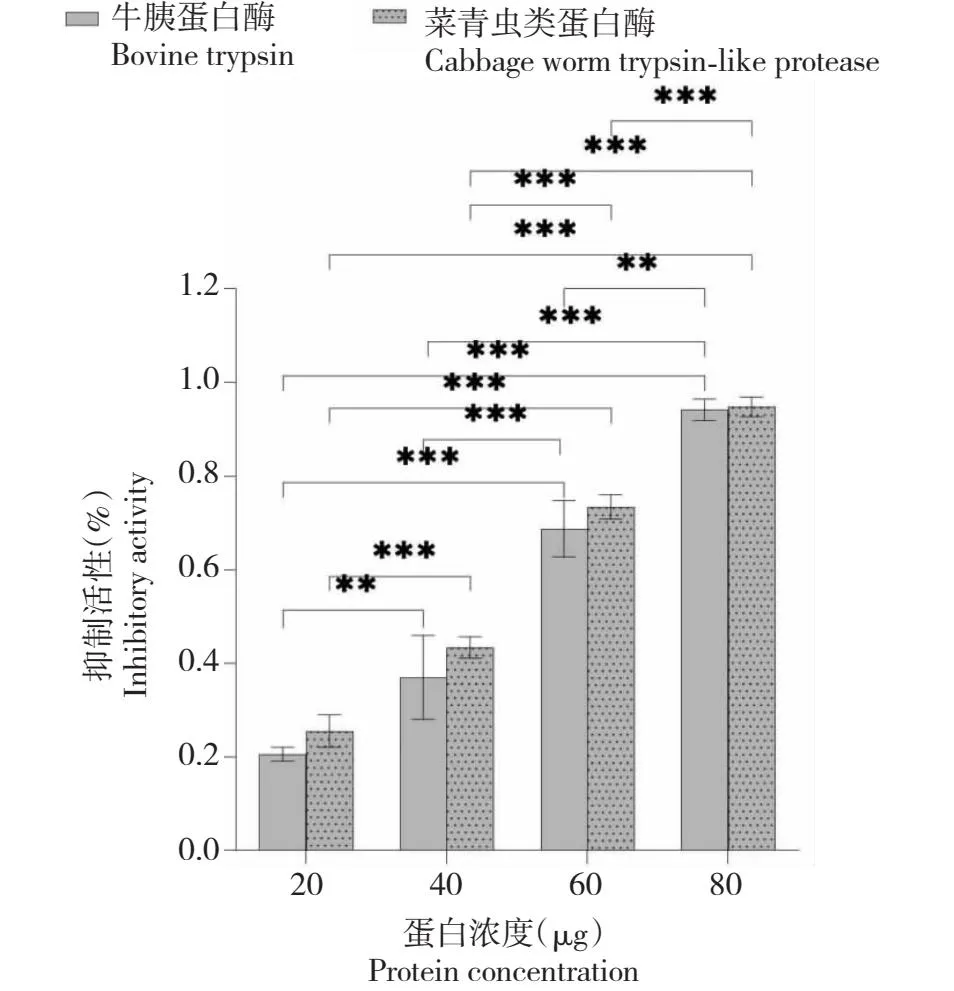
为验证序列比对的3个保守残基(Cys44、Tyr134和Lys135)的作用,分别将这3个保守残基突变成Ala。将CoTI1、CoTI1C44D、CoTI1Y134D和CoTI1K135D同时进行蛋白表达纯化和活性检测,蛋白浓度用BCA试剂盒检测,蛋白抑制活性用Erlanger法测定。结果显示, CoTI1对牛胰蛋白酶和菜青虫类胰蛋白酶均有较显著的抑制活性(图6),当CoTI1用量为80 μg时,其对牛胰蛋白酶和菜青虫类胰蛋白酶的抑制活性分别达94.52%和94.17%。

图1 CoTI1与其他KTIs多序列比对Fig.1 Multi-sequence alignment of CoTI1 and other KTIs
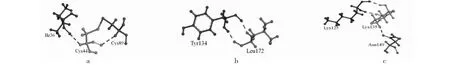
图2 Cys44(a)、Tyr134(b)和Lys135(c)的相互作用网络Fig.2 Interaction network of Cys44(a),Tyr134(b) and Lys135(c)
1~3分别代表CoTI1C44D、CoTI1Y134D和CoTI1K135D。1-3 indicate CoTI1C44D, CoTI1Y134D and CoTI1K135D, respectively.
图4 CoTI1、CoTI1C44D、CoTI1Y134D和CoTI1K135D的测序结果Fig.4 The sequencing results of CoTI1,CoTI1C44D,CoTI1Y134D and CoTI1K135D
CoTI1C44D对牛胰蛋白酶的抑制活性显著高于CoTI1,当CoTI1和CoTI1C44D用量均为40 μg时,CoTI1C44D对牛胰蛋白酶的抑制活性比CoTI1高41%(P<0.001),说明该Cys44残基的二硫键和氢键断裂之后更有利于CoTI1与牛胰蛋白酶结合(图7)。CoTI1Y134D和CoTI1K135D对牛胰蛋白酶的抑制活性显著低于CoTI1(P<0.001),当CoTI1、CoTI1Y134D和CoTI1K135D用量均为80 μg时,CoTI1Y134D和CoTI1K135D对牛胰蛋白酶的抑制活性分别比CoTI1低45.66%和36.73%,说明Tyr134和Lys135残基对于提高CoTI1与胰蛋白酶的结合具有重要意义。
1~4分别代表CoTI1、CoTI1C44D、CoTI1Y134D和CoTI1k135D。1-4 indicate CoTI1, CoTI1C44D, CoTI1Y134D and CoTI1K135D, respectively.
*、**和***分别代表P<0.05、P<0.01、P<0.001。*, **and *** indicate P<0.05, P<0.01 and P<0.001, respectively.
相较于CoTI1,CoTI1C44D、CoTI1Y134D和CoTI1K135D对菜青虫类胰蛋白酶的抑制活性均有不同程度的减弱,其中CoTI1Y134D最显著(P<0.001)。当用量为80 μg时,CoTI1C44D、CoTI1Y134D和CoTI1K135D对菜青虫类胰蛋白酶的抑制活性分别较CoTI1低46.94%、49.00%和38.11%(图8)。说明Cys44、Tyr134和Lys135对于增强CoTI1与菜青虫类胰蛋白酶的结合均起到了重要作用。
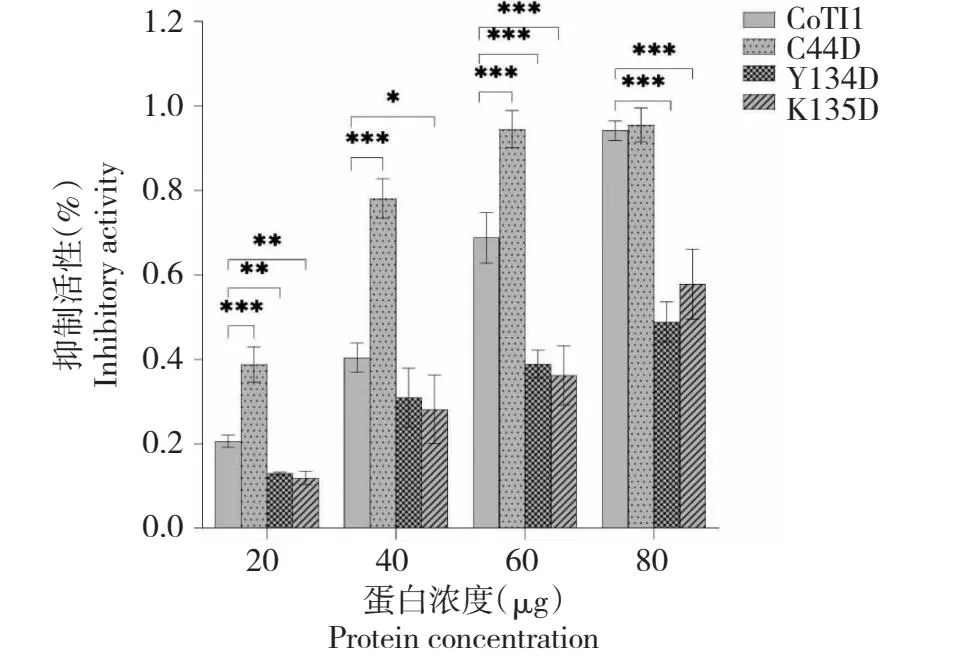
图7 不同浓度CoTI1、CoTI1C44D、CoTI1Y134D和CoTI1K135D对牛胰蛋白酶的抑制活性Fig.7 The inhibition essays of different concentrations of CoTI1,CoTI1C44D,CoTI1Y134D and CoTI1K135D to bovine trypsin
3 讨 论
大多数KTI在单链或双链多肽中有4个保守的半胱氨酸残基,形成2个二硫键。Oliva等[5]依据肽链及二硫键的数量差异将KTI分为6个亚家族,CoTI1具有1条肽链和2对二硫键,属于IV型亚家族。通常认为位于抑制活性环两侧的2个Cys残基(CoTI1中的Cys44与Cys89)保守性较强,两者间形成的二硫键有助于支撑抑制活性环的空间位置;而位于下游的2个Cys残基(CoTI1中的Cys139与Cys147)保守性较差,例如豆科铁木豆属植物(Swartziapickellii)[25]的KTI中仅含有2个保守性较强的Cys残基。本研究通过序列比对发现,Cys44在KTI中高度保守,位于顶部盖子的β2和β3折叠之间,与Cys89形成二硫键和氢键,与Ile36形成氢键。当Cys44突变后,突变体对牛胰蛋白酶的抑制活性提高41%,推测尽管Cys44和Cys89之间的二硫键发生断裂,但氨基酸残基间仍能够通过氢键形成正常的折叠,维持抑制活性环的空间位置,甚至更为突出,有利于与牛胰蛋白酶结合,提高抑制活性。例如紫荆花Kunitz蛋白酶抑制剂(BauhiniaKunitz-type proteinase inhibitorsr,BbKI)不含二硫键,但其结构稳定性和生物学功能由氢键维持[26]。与此同时,本研究观察到CoTI1C44D突变体对菜青虫类胰蛋白酶的抑制活性下降46.94%,可能是因为菜青虫在进化过程中其原始的类胰蛋白酶底物口袋里的某些氨基酸残基发生了突变,使其对KTI的敏感性下降,产生了抗性。
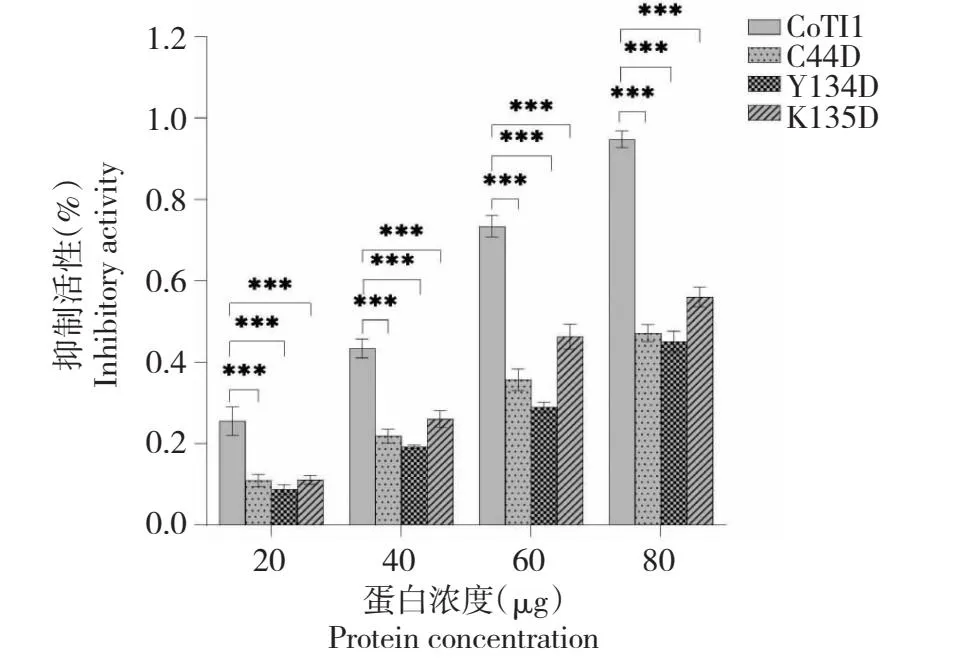
图8 不同浓度CoTI1、CoTI1C44D、CoTI1Y134D和CoTI1K135D对菜青虫类胰蛋白酶的抑制活性Fig.8 The inhibition essays of different concentrations of CoTI1,CoTI1C44D,CoTI1Y134D and CoTI1K135D to cabbage worm trypsin-like protease
尽管各KTI氨基酸序列相似度仅有43%,但它们均具有共同的β-三叶草型的三级结构。β折叠在该三级结构中扮演重要角色,其形成了内部的疏水核心,支撑起三维整体结构。通过序列比对发现,Tyr134与Lys135在KTI中高度保守,位于底部β-桶的β9折叠中,Tyr134与Leu172形成氢键,Lys135与Lys125和Asn149形成氢键。Tyr134与Lys135发生突变后,分别对牛胰蛋白酶降低45.66%和36.73%的抑制活力,对菜青虫类胰蛋白酶降低49.04%和38.11%的抑制活力。说明这2个氨基酸在维持三级结构的过程中发挥了重要作用,推测突变后,原有的氢键被打断,可能导致折叠疏水核心的崩塌,并最终引起抑制活性的降低。该区域其它位点的氨基酸残基也具有类似作用,例如Majumder等[27]分析大豆Kunitz抑制剂(STI)的晶体结构,发现Trp91残基位于底部β-桶与顶部盖子的连接处,其突变后突变体内部出现较大空隙,蛋白结构塌陷,抑制活性明显下降。然而在Ravichandran等[28]的研究中,位于β-桶的Asn14氨基酸突变之后尽管其典型的构象保持完整,但其对同源酶的抑制亲和活性提高了2倍。表明β-桶的构建较为复杂,参与β-三叶草型构成的关键氨基酸还需进一步研究。
4 结 论
Cys44、Tyr134和Lys135 3个位点突变后对牛胰蛋白酶和青虫类胰蛋白酶的抑制活性发生了较大改变,说明它们参与了β-三叶草结构的形成,是稳定CoTI1的空间结构及抑制活性的重要残基,但关于β-桶的结构研究仍需进一步深入。以上结果为CoTI1的结构功能相关研究提供了理论支持。
