侵染贵州烟草的辣椒脉斑驳病毒鉴定及其基因组分子特征分析
2023-03-13冷东蔚韦学锋张洪保马志锋吴慧子田维强
冷东蔚,韦学锋,张洪保,马志锋,蒋 卫,吴慧子,田维强,蔡 璘
(1.贵州大学烟草学院/贵州省烟草品质研究重点实验室,贵阳 550025;2.贵州省烟草公司遵义市公司,贵州 遵义 563000)
【研究意义】烟草(NicotianatabacumL.)是茄科烟草属植物,是一种重要的叶用经济作物[1-2]。贵州省作为我国第二大烟草产区,常年植烟面积在1.33×105hm2以上,烤烟种植是带动贵州省乡村振兴的重要产业。目前已知侵染烟草的病原物至少109种,每年给我国烟草造成的产值损失达7×108元以上[3-5]。我国在烟草上已发现17种病毒,常见的病毒有烟草花叶病毒(Tobacco mosaic virus,TMV)、黄瓜花叶病毒(Cucumber mosaic virus,CMV)、马铃薯 Y病毒(Potato virus Y,PVY)、烟草蚀纹病毒(Tobacco etch virus,TEV)和烟草脉带花叶病毒(Tobacco vein banding mosaic virus,TVBMV)等[6]。烟草病毒病发生广泛,危害严重,使烟草产量降低30%~50%,严重时甚至造成绝产,已成为制约各烟区发展的主要因素[7-8]。因此,明确贵州烟草病毒病发生现状及变化趋势对贵州烤烟生产可持续发展具有重要意义。【前人研究进展】辣椒脉斑驳病毒(Chilli veinal mottle virus,ChiVMV)是一种正义单链RNA病毒,属于马铃薯Y病毒科(Potyviridae)马铃薯Y病毒属(Potyvirus)。1979年Ong等[9]在马来半岛首次发现ChiVMV危害辣椒;随后在亚洲及非洲等多个茄科作物上检测到该病毒[10-15],表明其在亚洲和非洲广泛分布。相关研究表明,ChiVMV主要通过蚜虫和机械摩擦传播,茄科作物(如辣椒、番茄、茄子、烟草和曼陀罗等)是ChiVMV的主要寄主,此外,ChiVMV还会侵染醉鱼草、滇重楼和部分藜属植物[16-18]。2003年谭根堂等[19]首次在我国陕西省的辣椒上检测到该病毒,此后在我国西南地区和沿海地区的茄科作物上也陆续发现其危害[20-28],表明其在我国已大面积发生且危害日趋严重。2017年王莉爽等[27]首次在贵州辣椒上发现ChiVMV危害,辣椒受害后叶脉呈暗绿条纹、叶沿皱缩、叶片变小和畸形,导致产量和品质严重下降,造成严重经济损失。2021年Chen等[28]首次报道ChiVMV在贵州烟草上危害,引起叶片呈圆形褪绿、枯斑和烟草系统性坏死等症状,很大程度上降低烟叶可用性。近年来,对ChiVMV的研究报道越来越多,主要集中在对ChiVMV的株系分化、遗传多样性和分子进化特征等方面。贾树丹等[21]研究表明,我国ChiVMV的株系分化存在较强的地域性,地理位置接近的广东和海南ChiVMV分离株之间的变异较小,而地理位置相隔较远的四川和海南ChiVMV分离株之间的亲缘关系较远;王莉爽等[27]对比分析发现,贵州ChiVMV辣椒分离株的CP序列与四川ChiVMV辣椒分离株之间同源性为99%,与云南ChiVMV株系之间也有很近的亲缘关系。Anindya等[29]2004年首次报道ChiVMV全基因组序列。ChiVMV是马铃薯Y病毒属家族成员,具有马铃薯Y病毒属基因组结构的典型特征,基因组全长约9.7 kb,其中5′-非编码(5′-UTR)包含163碱基,3′-非编码区(3′-UTR)包含281个碱基,5′末端结合1个基因组连接蛋白(Viral genome-linked protein,VPg),3′末端具有Poly(A)尾,编码的通读蛋白被切割成11个蛋白,其中CP、HC-Pro和VPg病毒蛋白在病毒粒子和核酸的组装、传播和病毒侵染过程中具有重要作用[30-31]。【本研究切入点】ChiVMV在烟草上的危害日趋严重但相关研究鲜见报道,仅有四川、云南和贵州在烟草上检测到ChiVMV[16,28,32],且对于其株系分化和遗传多样性等研究多是基于该病毒的部分CP基因和3′-UTR序列,鲜有对ChiVMV全基因组进行分析比较。贵州各烟区病毒病发生严重,但对贵州各烟区病毒病发生以及变化趋势的系统研究鲜见报道。【拟解决的关键问题】针对贵州省疑似病毒侵染的烟草进行TMV、PVY、CMV和ChiVMV等病毒检测,以掌握ChiVMV和主要病毒病在贵州烟草上的发生情况;在此基础上采用RT-PCR分段扩增法明确贵州烟草分离株ChiVMV-GZ(GenBank:OP589298)的基因组特点,通过序列一致性分析以及构建系统发育进化树明确贵州烟草ChiVMV分离株与我国其他省份不同ChiVMV株系之间的遗传进化关系,以期为贵州烟草病毒病防控提供理论依据。
1 材料与方法
1.1 材料
1.1.1 样品 2022年6月采自贵州省贵阳、遵义、安顺和铜仁等地烟区,烟叶表现不规则褪绿和枯斑的疑似病毒侵染症状,共80份。
1.1.2 试剂 TRizol(北京宝日医生物技术有限公司),反转录试剂盒(南京诺唯赞生物科技股份有限公司),大肠杆菌感受态细胞DH5α(上海唯地生物技术有限公司),pTOPO-Vector载体、2×PCR Mix(北京市艾德莱生物科技有限公司),DNA凝胶回收试剂盒(北京擎科生物科技有限公司);所用引物均由北京擎科生物科技有限公司合成;无水乙醇、异丙醇和三氯甲烷等均为分析纯(天津富宇生化有限公司)。
1.2 方法
1.2.1 RNA提取及逆转录 采用TRizol法提取RNA,并参考反转录试剂盒(南京诺唯赞生物科技股份有限公司)说明合成cDNA,反转录体系:2×NovoScript 1st Strand cDNA Synthesis SuperMix 10 μL,Total RNA 2 μL,加入无酶水补足至20 μL。反转录程序:50 ℃ 30 min,85 ℃ 2 min。产物cDNA保存于-20 ℃待用。
1.2.2 病毒的检测 根据NCBI已公布TMV、PVY、CMV、ChiVMV、TEV和PVX的CP基因序列设计引物,包括ChiVMV-CP-F(GCAGGAGAGAGTGTTGATGC)、ChiVMV-CP-R(CAATCCTCGAACGCCCAG CA)、TMV-CP-F(ATGTCTTACAGTATCACTACTCC)、TMV-CP-R(TCAAGTTGCAGGACCAGAG)、CMV-CP-F(GATAAGAAGCTTGTTTCGCG)、CMV-CP-R(GCTC GATGTCGACATGAAGT)、PVY-CP-F(GCAAATGACACAATTGATGCAG)、PVY-CP-R(TCACAGGTTCT TGACTCCAAG)、TEV-F(TGATGGATGGTGAGGAG)、TEV-R(GTGCCGTTCAGTGTCTT)、PVX-CP-F(ATGTCAGCACCAGCTAGCAC)和PVX-CP-R(TTATGGTGGTGGGAGAGTGAC)。采用RT-PCR对样品进行病毒检测,PCR反应体系:2×PCR Mix 12.5 μL、10 μmol/L上下游引物各1 μL、cDNA 2 μL,双重蒸馏水补足至25 μL。PCR扩增程序:94 ℃预变性3 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸60 s,共34个循环;72 ℃再延伸10 min。产物用1%琼脂糖凝胶进行电泳。
1.2.3 ChiVMV基因组扩增 根据1.2.2扩增出的ChiVMV的CP序列以及NCBI已发表基因序列(MK405594.1)设计6对特异引物,包括ChiVMV-P1-F(AATACAAACATACAGAAAACGAAC)、ChiVM V-P1-R(CCAATGGCCAACTTGCGAGTC),ChiVMV-P2-F(GGTTACCATGCAAAGAGGTTC)、ChiVMV-P2-R(GTGGAATAATGTGATGCTTCTC),ChiVMV-P3-F(GGTTGGAAAGATTGCACTTCAG)、ChiVMV-P3-R(GAGTGCAATCAACTATGGAGAG),ChiVMV-P4-F(CTTGACATTGAGGCTGTGGTTG)、ChiVMV-P4-R(GACTTTAAGTACGGGGGAAACC),ChiVMV-P5-F(GTACAGTAACCCTGGAATTC)、ChiVMV-P5-R(CAATCGGCGTAGTGAATACCGC),ChiVMV-P6-F(TACTGCTGATGGAACAATAGTC)、ChiVMV-P6-R(AACGCCAACTATTGAACAACTC);引物所在基因组的位置如图1所示。PCR扩增反应体系延伸时间为3 min,其他程序与1.2.2一致。参考DNA回收试剂盒(北京擎科生物科技有限公司)操作说明回收目的条带,将产物连接到pTOPO-Vector载体,转化至DH5α大肠杆菌感受态细胞,于37 ℃条件下培养16 h后筛选阳性克隆送至北京擎科生物科技有限公司测序。
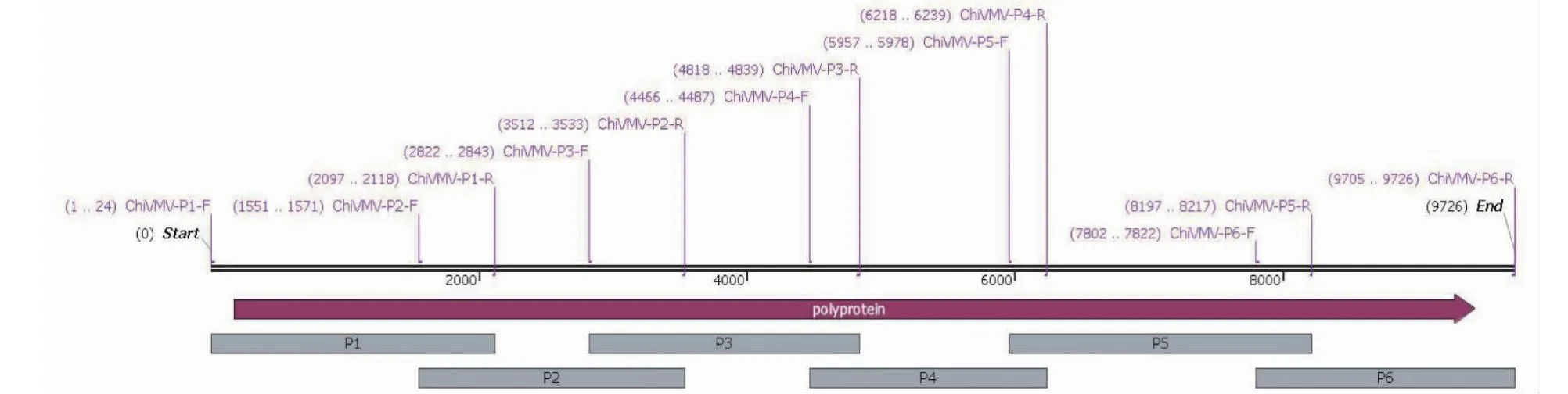
图1 设计的6对引物所在基因组(MK405594.1)位置Fig.1 The location of designed 6 pairs of primers in the genome (MK405594.1)
1.2.4 病毒序列分析 使用Vector NTI Advance 11.5.1软件拼接ChiVMV基因组,NCBI数据库ORF finder程序确定其开放阅读框。为进一步分析贵州ChiVMV-GZ分离株在遗传上的进化关系,基于NCBI公布的ChiVMV基因组序列,以同属的辣椒叶脉斑驳病毒(PVMV,DQ645484)和辣椒斑驳病毒(PepMoV,EU586121)作为外源病毒使用软件MEGA 7.0以邻近法构建系统发育树,用SDT 7.1分析序列的一致性。
2 结果与分析
2.1 发病烟叶的症状及RT-PCR扩增产物
使用6种病毒特异引物对样品进行检测,共检出4种病毒:ChiVMV、TMV、PVY和CMV,但未检出TEV和PVX病毒(图2)。从表1可知,除铜仁烟区采集的烟叶样品未检出CMV外,贵阳、遵义和安顺烟区样品均检出ChiVMV、TMV、PVY和CMV 4种病毒,其中,TMV占比最高(48.75%),其次是ChiV MV(37.50%)和PVY(35.00%),CMV占比最低(8.75%)。PVY、TMV和CMV病毒以复合侵染为主,有少数样品检出PVY单独侵染,由PVY单独侵染的烟叶主要表现叶片黄化、卷曲和叶脉呈黑褐色等症状;ChiVMV侵染烟叶以单独侵染为主,ChiVMV单独侵染的烟叶会在叶脉之间形成黄色亮斑,少数样品检出ChiVMV与PVY或TMV间存在复合侵染现象。从表2看出,病毒之间复合侵染烟草的现象较普遍,从样品中共检出TMV+PVY、PVY+ChiVMV、PVY+CMV和ChiVMV+PVY+TMV 4种复合侵染类型,其中,4个地区均检出复合侵染类型TMV+PVY和PVY+CMV,占比分别为26.25%和10.00%;贵阳的1个样品、安顺的1个样品和遵义的3个样品检出PVY+ChiVMV侵染类型,总占比6.25%;遵义的2个样品和安顺的1个样品检出ChiVMV+PVY+TMV侵染类型,总占比3.75%。总体看,TMV+PVY侵染类型最为普遍,且不同病毒复合侵染引起的症状复杂,PVY+ChiVMV侵染烟叶除叶脉间出现圆形黄色斑点外,沿叶脉还会表现褪绿黄化以及坏死等症状;PVY+TMV侵染烟叶症状主要表现为黄化、细长畸形且厚薄不均;PVY+CMV侵染引起坏死症状,沿叶脉还会出现闪电状坏死;受PVY+TMV+ChiVMV 侵染烟叶表现出褪绿黄化、圆形亮斑、叶片细长和叶脉坏死等症状(图3)。
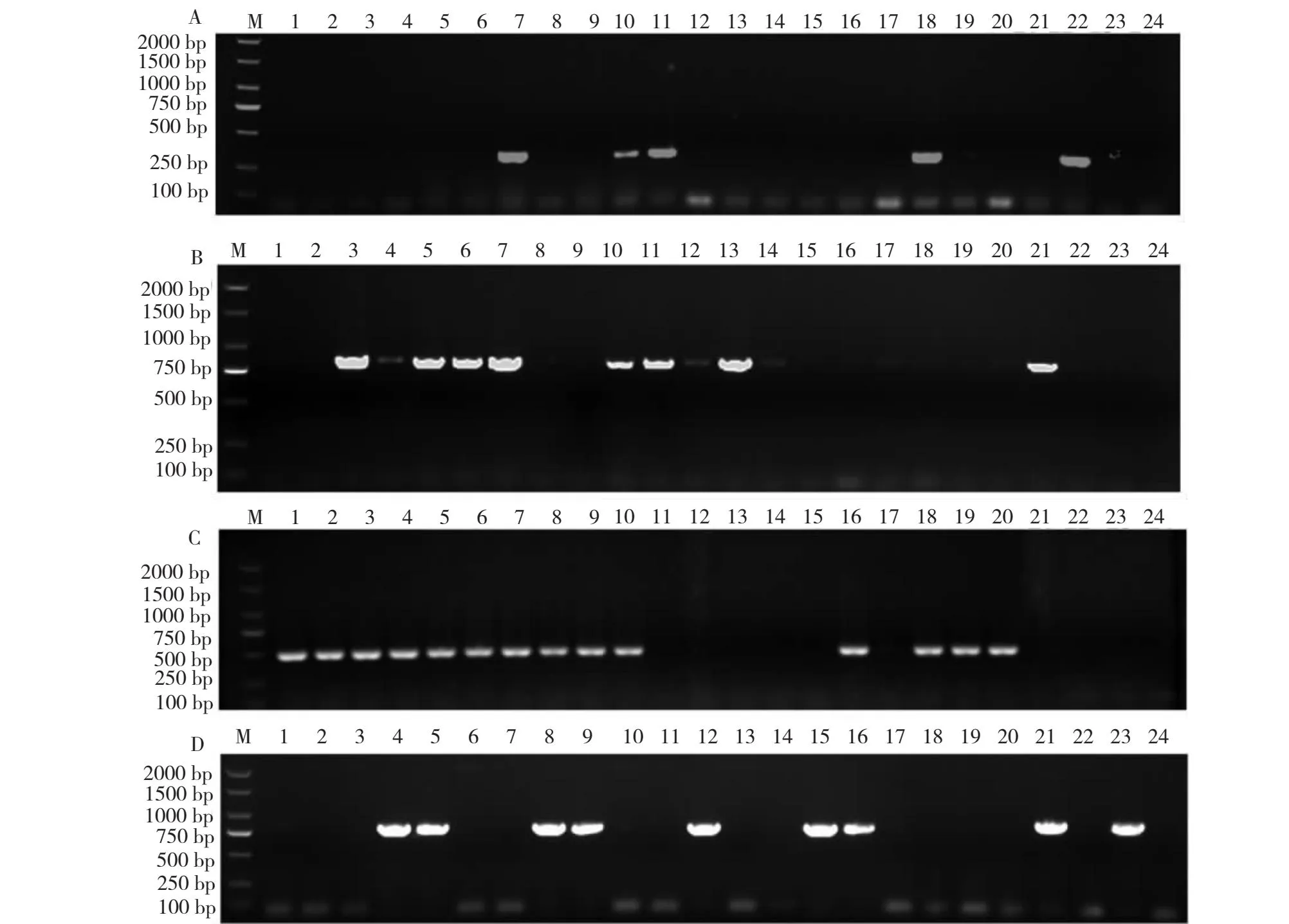
M.DL2000 DNA Marker;1~22.烟草样本;A.CMV;B.ChiVMV;C.TMV;D.PVY。M.DL2000 DNA Marker;1-22.Tobacco samples;A.CMV;B.ChiVMV;C.TMV;D.PVY.
2.2 贵州ChiVMV间的差异性及基因组全长
贵州贵阳、遵义、铜仁和安顺4个烟草产区的样本均检出ChiVMV,经序列比对及基于CP序列构建系统发育树(图4)发现,4个地区的ChiVMV无明显的遗传分化。因此,后续研究随机挑选贵州遵义分离所得的一段ChiVMV的CP序列进行全长扩增。从图5看出,6对引物分别扩增获得符合预期的片段,使用NTI Advance 11.5.1进行拼接获得ChiV MV全长序列,全长为9736 nt,其中,5′UTR 179 nt,3′UTR 287 nt,编码3089 aa的通读蛋白。将获得的序列上传至NCBI,命名为ChiVMV-GZ,获得GenBank登录号OP589298。
2.3 ChiVMV-GZ的进化关系
从图6看出,贵州烟草分离株ChiVMV-GZ与四川番茄分离株(KC711055)的序列一致性最高,为98.70%,其次与四川泸州烟草分离株(MK405594)也具有较高的序列一致性(98.50%),此外与云南省辣椒分离株(MT974520、MT787292)和安徽省的烟草分离株(KX650863)的同源性均大于90%。从图7看出,基于基因组序列构建的系统发育树中ChiVMV分为4大分支,第Ⅰ支为美国落葵(BasellaalbaL.)分离株(OM108478);第Ⅱ支包括来自我国广东省辣椒分离株(KU987835)、广西省辣椒分离株(MT782116、MZ358113)、湖南省辣椒分离株(KR29 6797、LN832362)、台湾省分离株(OK181760)和海南省辣椒分离株(GQ981316),韩国分离株(AM909719、AJ972878)和印度分离株(NC005778、AJ237843);第Ⅲ支包括来自印度的辣椒分离株(MN207122、MN508959、GU170808和GU1790807),来自巴基斯坦的辣椒分离株(MN508960);贵州分离株ChiVMV-GZ(OP589298)分布在第Ⅳ支株系,与我国四川省的烟草分离株(MK405594)和番茄椒分离株(KC711055、KC711056)、云南省的烟草分离株(JX088636)和辣椒分离株(MT974520、MT787292)、安徽省的烟草分离株(KX650863)在遗传进化上的距离最近,聚为一支。

a.PVY侵染烟叶;b.ChiVMV侵染烟叶;c.PVY+ChiVMV侵染烟叶;d.PVY+TMV侵染烟叶;e.PVY+CMV侵染烟叶;f.PVY+ChiVMV+TMV侵染烟叶。a.Tobacco leaf infected by PVY; b.Tobacco leaf infected by ChiVMV; c.Tobacco leaf infected by PVY and ChiVMV; d.Tobacco leaf infected by PVY and TMV; e.Tobacco leaf infected by PVY and CMV; f.Tobacco leaf infected by PVY, ChiVMV and TMV.

表1 贵州各烟区烟草样品的病毒侵染类型

表2 贵州各烟区烟草样品不同病毒复合侵染类型的检出率
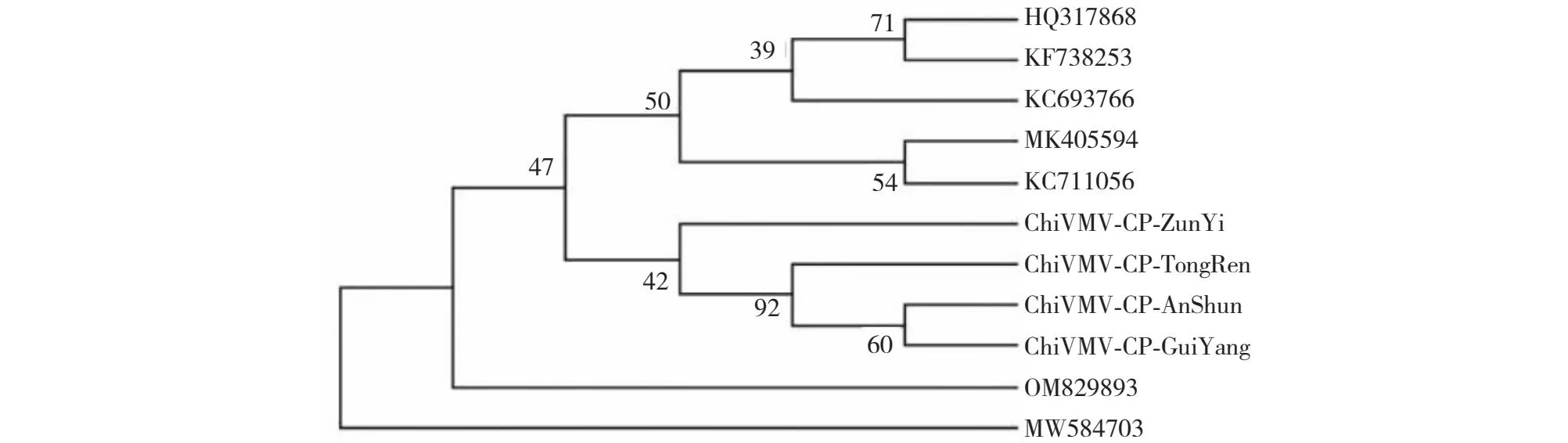
图4 贵州4个区域的ChiVMV-CP与其他来源地ChiVMV的系统发育进化树Fig.4 Phylogenetic evolutionary tree of ChiVMV-CP in four regions of Guizhou and ChiVMV from other sources

M.DL5000 DNA Marker; P1~P6.ChiVMV基因组的6个片段。M.DL5000 DNA Marker;P1-P6.Six segments of the ChiVMV genome.
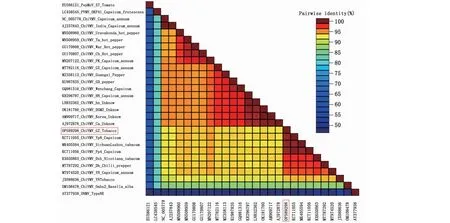
图6 ChiVMV-GZ与其他来源地ChiVMV株系基因组序列的一致性Fig.6 Sequence identity between ChiVMV-GZ and ChiVMV lines from other origins

图7 ChiVMV-GZ与其他来源地ChiVMV株系的系统发育进化树Fig.7 Phylogenetic tree of chiVMV-GZ and ChiVMV strain from other origins
3 讨 论
自1979年Ong等[9]在马来西亚半岛发现ChiVMV以来,已检测到该病毒在多个国家和地区发生。2017年王莉爽等[27]在贵州贵阳、遵义和毕节的黔西及大方4个辣椒产区检测到ChiVMV,这是贵州省内首次报道该病毒;2021年Chen等[28]在贵州烟草上也检测到该病毒,说明其已在贵州烟草和辣椒产区上普遍发生,且在茄科作物间广泛传播。ChiVMV的存在不仅造成了严重的经济损失,还严重制约了贵州辣椒和烟草等作物的生产。本研究针对贵州省贵阳、遵义、铜仁和安顺等地主要植烟区表现褪绿和枯斑等症状的烟草样品(80份)进行鉴定,其中,TMV检出率最高(48.75%),ChiVMV检出率为37.50%,CMV检出率最低(8.75%);遵义烟区的病毒检出率最高,与实际调查情况相符,说明遵义烟区的病毒病在4个区域中发生最严重。王莉爽等[7]对贵州烟草发生的主要病毒病进行检测的结果显示,TMV是贵州省优势病毒种群,而PVY是次优势病毒种群。本研究结果表明,TMV在4个烟区的检出率均最高,与王莉爽等[7]的研究结论一致,说明TMV仍是危害贵州烟草的主要病毒。但由于近年贵州省内对烟草病毒病检测报道较少,不能明确病毒病的发生变化趋势。ChiVMV在贵州省内主要烟区已经普遍发生并在部分区域危害严重程度甚至超过PVY,很有可能已经成为危害仅次于TMV的第二大病毒种群,应该引起重视与警惕。
本研究通过分段扩增获得贵州烟草分离株ChiVMV-GZ的基因组全长,基于基因组序列与GenBank上已公布的来自不同国家、地区和寄主ChiVMV的全基因序列分析发现,ChiVMV-GZ与四川的番茄和烟草分离株的基因序列一致性最高,分别为98.70%和98.50%,此外与来自云南的烟草和辣椒分离株也具有较高一致性。说明本研究中贵州分离物与地理位置更近的四川和云南分离物亲缘关系更近。2022年田绍锐等[26]在重庆涪陵、北碚地区烟叶样品中首次检出ChiVMV且基于ChiVMV的CP序列对比分析发现,重庆ChiVMV CP分离物与四川泸州烟叶ChiVMV CP分离物亲缘关系最近。汤亚飞等[23]基于全基因组分析比对发现,广东辣椒分离物与海南分离物的亲缘关系最近。贾树丹等[21]研究发现,来自四川的ChiVMV辣椒分离物与来自海南的ChiVMV辣椒分离物之间CP序列一致性仅有85.20%~86.20%,亲缘关系较远。本研究结果说明,地理隔离是影响ChiVMV株系分化的主要因素,云贵川渝地区的ChiVMV株系间亲缘关系很近,可能是4个地区相互接壤位于我国的西南部,地形均以山地和丘陵为主且生态环境类似所致,本研究结论与贾树丹等[21,23,26]的研究结论一致。本研究构建系统发育进化树发现,地理位置接近的地区ChiVMV分离物优先聚在同一分支,并未因寄主相同而聚在一分支,说明寄主并非影响ChiVMV株系分化的主要因素,但不可由此定论ChiVMV的株系分化完全由地理因素决定而不受寄主影响。杨洁等[17]研究发现,云南ChiVMV滇重楼分离物与云南ChiVMV烟草分离物之间的序列一致性最高(99.10%),而与云南ChiVMV辣椒分离物之间的序列一致性较低(85.70%),说明同一地区不同寄主的ChiVMV同样存在遗传分化趋势,后期可针对不同寄主ChiVMV之间遗传进化差异开展相关研究,以明确ChiVMV对不同寄主侵染的选择性。
由于采样点不全面以及样本数较少等原因限制,部分病毒病及部分区域的检测结果和实际调查情况有所差异,同时也还未能明确贵州省内不同地区、不同寄主的ChiVMV之间是否存在遗传进化趋势,下一步应在全省范围内对不同寄主的ChiVMV开展相关研究以明确其差异性。
4 结 论
辣椒脉斑驳病毒在贵州烟草上已普遍发生,应引起高度重视。本研究在贵州烟草上首次分离获得ChiVMV-GZ全长;基于遗传进化分析,发现ChiVMV-GZ与来自四川和云南的ChiVMV株系间的亲缘关系较近。本研究可为贵州烟草病毒病防控提供理论依据。
