拟南芥AtIDD4基因过表达植株构建及其对生长发育的影响
2023-03-13于德嘉张国斌陈健鑫徐晓东李林倩董萍萍郭丽红杨红玉
于德嘉,张国斌,陈健鑫,徐晓东,李林倩,董萍萍,郭丽红,杨红玉
(1.昆明学院农学与生命科学学院,昆明 650214;2.西南林业大学生物多样性保护学院,昆明 650224;3.云南农业大学植物保护学院,昆明 650201;4.曲靖师范学院生物资源与食品工程学院,云南 麒麟 655011)
【研究意义】转录因子(Transcription factors,TFs)又称为反式作用因子,在植物调控生长发育和响应逆境胁迫反应中发挥着重要作用[1],为探究拟南芥IDD基因家族中AtIDD4基因在调控植物生长发育与抗逆反应应答中的作用,本研究构建了拟南芥AtIDD4基因过量表达植物。【前人研究进展】锌指蛋白是重要的转录因子,C2H2型锌指蛋白广泛存在,且是锌指蛋白中研究最广和最清楚的一类[2]。INDETERMINATE DOMAIN(IDD)家族属于 C2H2型锌指蛋白转录因子其中一类,是植物中特有的转录因子,不论在单、双子叶植物中均高度保守。植物中的IDD基因通过与多种蛋白质相互作用,与激素级联重叠,控制或调节植物的生长发育与抗逆反应应答[3]。ID-domain基因最初是作为玉米中一个典型的开花基因INDETERMINATE1(ID1)而被报道[4]。ID1基因编码1个包含4个锌指单元的核蛋白,具有 C2H2型锌指蛋白的结构特点,由靠近 N 端的一个假定的核定位信号 NSL和4个锌指单元(C2H2、C2H2、C3H和C2HC)构成ID-domain[5-6]。在植物中通过ID1基因的ID-domain所定义的基因家族成为了 C2H2型锌指蛋白的一个亚族,即 IDD 锌指蛋白家族[7]。拟南芥中有16个IDD基因家族成员,为AtIDD1-16,AtIDD4基因是其中之一[8]。通过酵母双杂交系统筛选发现能与SCL3(Scarecrow-like 3)基因互作的转录因子有5个IDD基因家族成员,AtIDD4基因是其中之一[9]。SCL3通过这些转录因子调节 DELLA 蛋白和赤霉素 (Gibberellin,GA)的信号转导通路[10]。AtIDD4等IDDs基因通过调控不对称细胞分裂和细胞类型的模式化以确保植物根系的正常发育[11]。研究发现,AtIDD4在丝氨酸73位点磷酸化[12],这是一个高度保守的MAPK基序,在IDD/BIRD家族的所有家族成员中都是保守的[13],AtIDD4基因的缺失突变体植株转录组和全序列ChIP-SEQ分析表明,AtIDD4基因缺失突变体植株在先天免疫与生长发育的协调中起着重要作用,Völz 等[14-15]研究表明,拟南芥AtIDD4基因的缺失突变体植株显著增强了对半活体营养型病原菌丁香假单孢菌(Pseudomonassyringae)等病原物的抗性和对盐胁迫的抗性。【本研究切入点】目前有关拟南芥AtIDD4基因超表达后对植株生长发育的影响鲜有报道。【拟解决的关键问题】利用同源重组技术,旨在构建高表达载体pCAMBLA1300-35S-IDD4CDS,并通过农杆菌侵染法导入野生型拟南芥,提高AtIDD4基因在拟南芥中的表达水平,为探究AtIDD4基因对植物的抗性调控提供供试材料。
1 材料与方法
1.1 供试材料
野生型拟南芥(WT)(Arabidopsisthaliana)为Columbia生态型(Col-0),购自美国 Lehle seeds 公司[16]。农杆菌(Agrobacteriumtumefaciens)GV3101 购自上海唯地生物技术有限公司,大肠杆菌(Escherichiacoli)为DH5α,购自TaKaRa公司,限制性内切酶为BamHI和PstI,购自ThermoFisher SCIENTIFIC公司。试验中所用引物均由生工生物工程(上海)股份有限公司合成。
1.2 拟南芥培养条件
先用无菌水将拟南芥种子充分漂洗,再用消毒水[v(75%乙醇)∶v(30%H2O2)=4∶1]消毒30 s,无菌水漂洗3次后分散播种于MS培养基中,置于4 ℃冰箱中春化处理48 h。将处理后的种子放至光照培养箱(光周期为光照和黑暗各12 h/d,光照强度2000~3000 lx,温度 22 ℃,相对湿度40%~60%)培养[17]。待长出2片真叶后将幼苗移栽到温室调配的基质[v(营养土)∶v(珍珠岩)∶v(蛭石)=6∶6∶1]中继续培养。
1.3 载体构建
1.3.1 拟南芥总 RNA 和 DNA 的提取 Trizol 法提取拟南芥总RNA,之后通过琼脂糖凝胶电泳检测其结构完整性,并通过Biodrop测定其浓度和纯度;将检测合格的 RNA 样品用液氮速冻后于-80 ℃冰箱保存[18]。拟南芥总DNA采用CTAB法提取。测定样品的浓度和纯度,检测合格的 DNA 样品置于-80 ℃冰箱保存。
1.3.2 反转录合成cDNA 提取拟南芥叶片RNA,以RNA为模板用abm公司的逆转录试剂盒逆转录cDNA。首先在冰上预冷 200 μL的微量离心管,随后在管内依次加入AccuRT Reaction Mix 2 μL和Total RNA 1 μg,用Nuclease-free H2O补足8 μL并置于PCR 仪内,42 ℃反应2 min,后置于冰上;加入AccuRT Reaction Stopper 2 μL;在预冷的微量离心管内配置反转录体系10 μL,包括5×All-In-One RT MasterMix 4 μL、Nuclease-free H2O 6 μL,配制完成后加入上述已去除基因组DNA的体系中并混匀;置于PCR仪内,25 ℃反应10 min,42 ℃反应15 min,85 ℃反应5 min,于-20 ℃保存备用。
1.3.3AtIDD4基因CDS的克隆 通过TAIR (https://www.arabidopsis.org/)网查找出AtIDD4基因的CDS序列,结合载体构建原则运用软件Premier 5设计特异性引物,IDD4-F:5’-CGGGATCCATGTCGTCATCATCATATAACACA-3’、IDD4-R:5’-TGCACTGCAGTCAACCTCTTCCAAATGGATAA-3’;下划线部分分别为XohI和PstI酶切位点。通过PCR法利用特异性引物以cDNA为模板扩增出CDS片段,并用琼脂糖凝胶电泳进行目的片段检测,将正确条带片段切胶回收。
1.3.4 目的片段与载体连接 限制性内切酶将载体pCAMLA1300酶切后得到线性化质粒,使用天根纯化试剂盒进行纯化后置于-20 ℃备用,将回收纯化后的DNA目的片段通过酶切位点连接至带有35S启动子驱动的pCAMBLA1300载体上,4 ℃过夜。之后通过热激法将载体转化至大肠杆菌(E.coli) DH5α感受态细胞中扩增,在配制LB固体培养基时加入卡那霉素(Kanamycin),在此培养基上培养大肠杆菌感受态细胞,在平板上挑取阳性单菌落至LB/Kan+液体培养基中摇床过夜培养(250 r/min 37 ℃)对检验正确的单菌落扩繁,之后进行菌液PCR鉴定,1%琼脂凝胶电泳检测,以及质粒提取及测序,获得高表达载体pCAMBLA1300-IDD4CDS,见图1。将鉴定成功的阳性克隆质粒于-20 ℃保存。
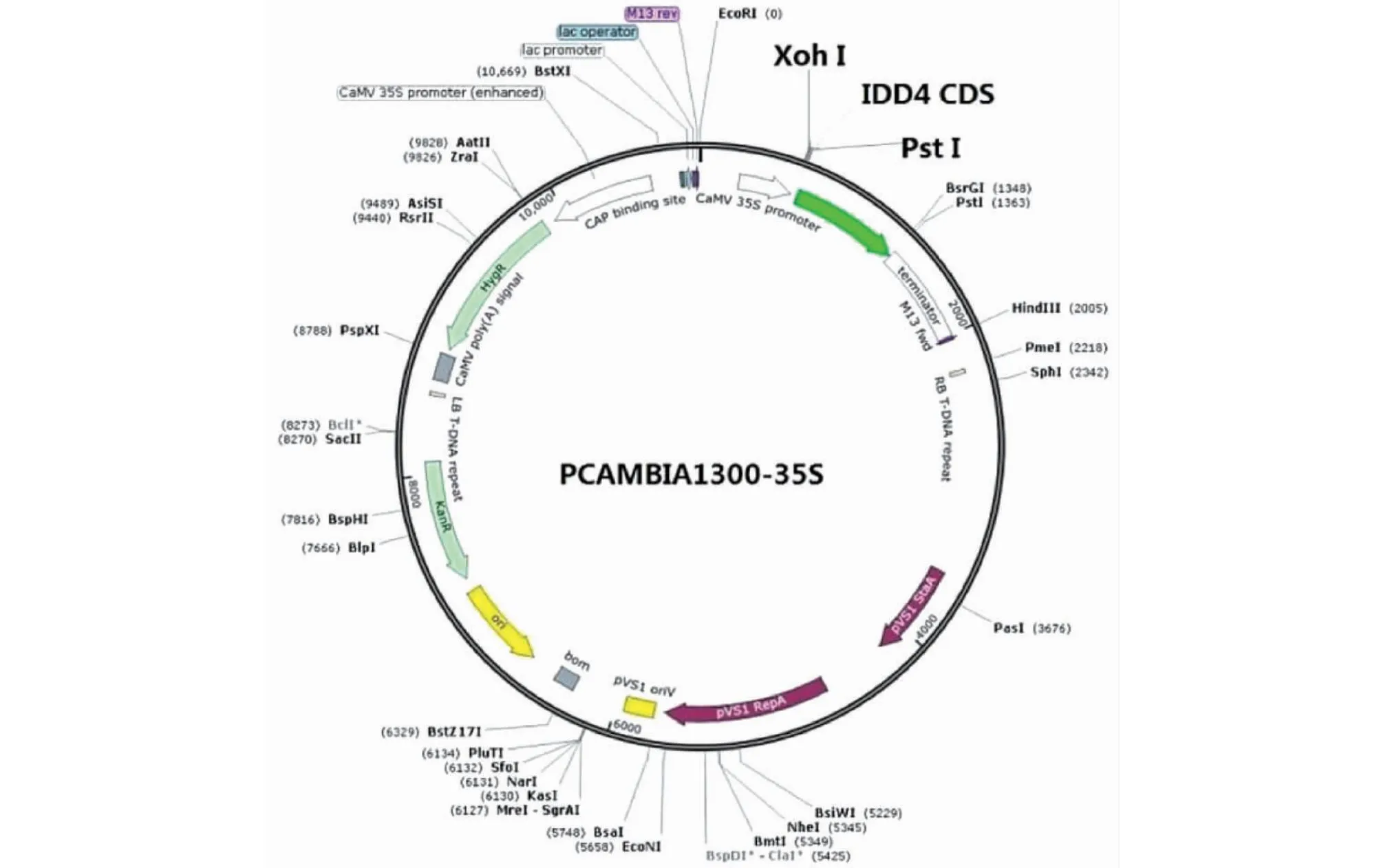
图1 pCAMBLA1300-IDD4CDS 载体图谱Fig.1 pCAMBLA1300-IDD4CDS vector map
1.4 农杆菌转化
将农杆菌感受态细胞 GV3101从-80 ℃冰箱取出,在冰上解冻完成后加入测序正确的重组质粒3~5 μL,冰上静置5 min。将离心管液氮速冻1 min,37 ℃水浴5 min,冰浴2 min,将重组质粒转化至农杆菌GV3101感受态细胞中。加入液体 LB 培养基800 μL,28 ℃ 摇床150 r/min 培养3 h,8000 r/min离心1 min,将弃上清液的悬浮液涂于含卡那霉素和利福平(Rifampicin)的LB固体培养基上28 ℃培养48 h。PCR鉴定能够生长的单菌落,并将成功转入高表达载体的农杆菌于含卡那霉素和利福平的LB液体培养基中摇床培养(250 r/min 28 ℃过夜)进行扩繁备用。
1.5 拟南芥转化及筛选
为促进拟南芥侧枝长出更多花枝,在移栽后25~30 d时将初次开花的拟南芥花蕾去除。选取拟南芥花序未成熟的植株,利用5%蔗糖溶液使农杆菌重悬并调整OD值为0.8,加入表面活性剂 silwet-77 至浓度为 0.05%。拟南芥花浸泡于农杆菌悬浮液中 20~30 s[19],侵染后的植株套袋横放培养,保持环境高度湿润的条件下避光培养 18~24 h,之后正常光照培养。待种子自然成熟后收集种子。
通过含有50 mg/L潮霉素(Hygromycin)的1/2 MS培养基筛选浸染后得到的T0代种子,能够在抗性培养基上正常生长的为成功转入重组质粒的种子。培养20 d后转入土壤继续培养,单株收种。
1.6 转基因阳性植株的鉴定
以拟南芥野生型植株为对照,利用半定量RT-PCR和实时荧光定量RT-PCR 测定拟南芥转基因植株AtIDD4基因的表达量。分别以拟南芥野生型和拟南芥转基因植株的cDNA为模板,扩增拟南芥内参Actin基因和拟南芥AtIDD4基因。实时荧光定量RT-PCR反应按照 Blastaq 2×qPCR MasterMix 试剂盒操作步骤要求进行,在 ABI 7500型Real-time PCR 仪上进行反应。反应条件:95 ℃预变性3 min,95 ℃变性15 s,55 ℃退火1 min,72 ℃延伸30 s,40个循环。拟南芥内参Actin基因引物:actin-F:5’-GGTAACATTGTGCTCAGTGGTGG-3’;actin-R:5’-AACGACCTTAATCTTCATGCTGC-3’。每个样品3次重复。
1.7 表型观察
将筛选鉴定出的T3代种子和野生型种子在MS培养基上同时点种,并移入光照培养箱中培养,待长出2片真叶后(生长10 d)将幼苗移栽到栽培土中,移入温室培养14 d后观察测量幼苗的生长状况[20],以10棵幼苗作为1组称量鲜重并进行5次重复,同时测量根系长度后进行统计学分析。生长25 d后观察比较转基因植株和野生型植株的表型。
2 结果与分析
2.1 AtIDD4基因的克隆
以野生型拟南芥(WT)的cDNA为模板,利用特异性引物通过PCR法扩增拟南芥AtIDD4基因的CDS片段。通过琼脂糖凝胶电泳检测PCR产物,产物片段长度约为1500 bp(图2),与预期片段的长度一致。
2.2 载体构建及阳性克隆检测
大肠杆菌菌液PCR产物凝胶电泳结果(图3)显示,1~2、4~7、9~10及12~14号单菌落PCR条带清晰且大小约1000 bp,与预期相符,说明质粒转化成功。挑选条带清晰的单菌落继续扩繁、质粒提取及测序,并进行序列比对。如图4所示,测序序列与网站序列完全一致,证明pCAMBLA1300-35S-IDD4CDS表达载体构建成功,该基因克隆成功。
2.3 农杆菌阳性克隆
上述测试正确的重组质粒转化至农杆菌GV3101感受态细胞中,验证正确的农杆菌扩繁后取菌液进行PCR扩增,扩增产物用1%琼脂糖凝胶电泳鉴定。结果显示与预期相符,得到成功转化的农杆菌。
2.4 拟南芥转化植株筛选与鉴定
利用农杆菌侵花法,将验证正确的含有目的片段的质粒转化到拟南芥野生型(WT)植株中,在含有潮霉素(Hygromycin, Hyg)的 MS 培养基上将收取的T0代种子点种进行潮霉素抗性筛选,在培养约2周后,挑选能够在潮霉素板上正常生长的阳性植株。转基因成功的幼苗可以在抗性培养基上正常生长,而非转基因植株生长被严重抑制,一般在萌发10 d后死亡。将阳性植株移至营养土中继续培养,成熟后收取T1代种子,将T1代种子再次播种于潮霉素板中,待植株稍长大后进行PCR鉴定,阳性植株移栽至营养土中单株收取T2代种子(图5)。
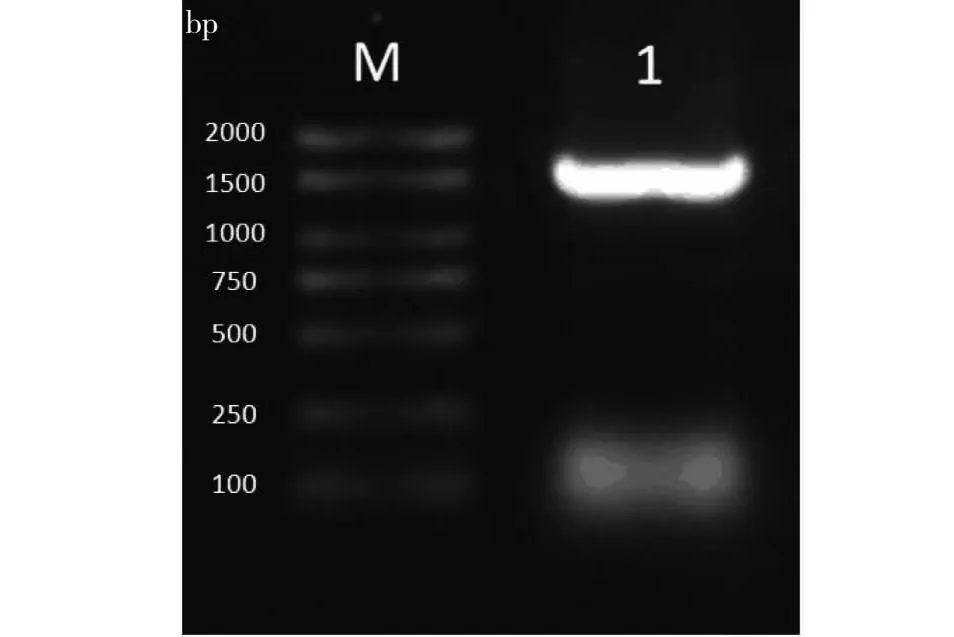
M: DNA标记; 1: AtIDD4 CDS。M:DNA Marker; 1:AtIDD4 CDS.
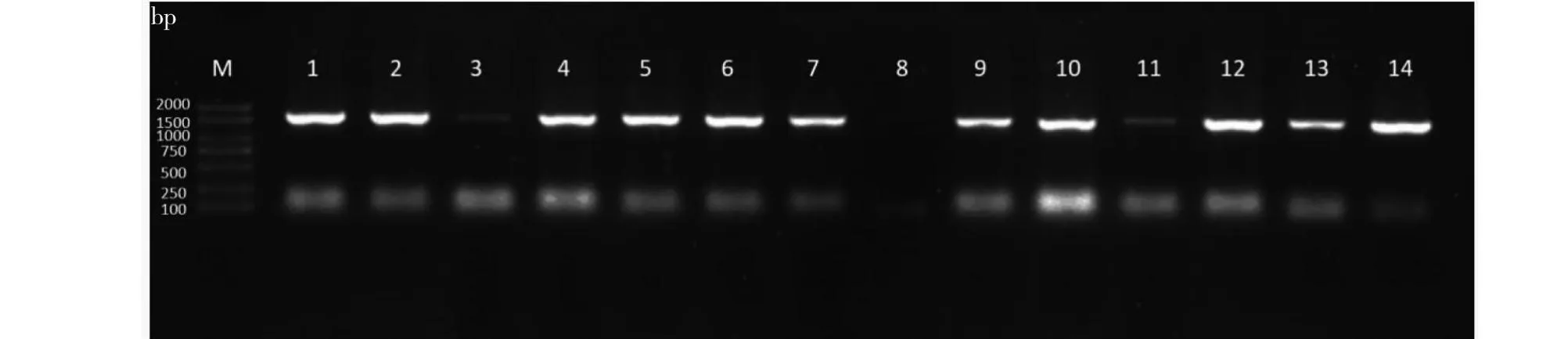
M: DNA标记;1~14: pCAMBLA1300-35S-IDD4CDS。M: DNA Marker;1-14: pCAMBLA1300-35S-IDD4CDS.
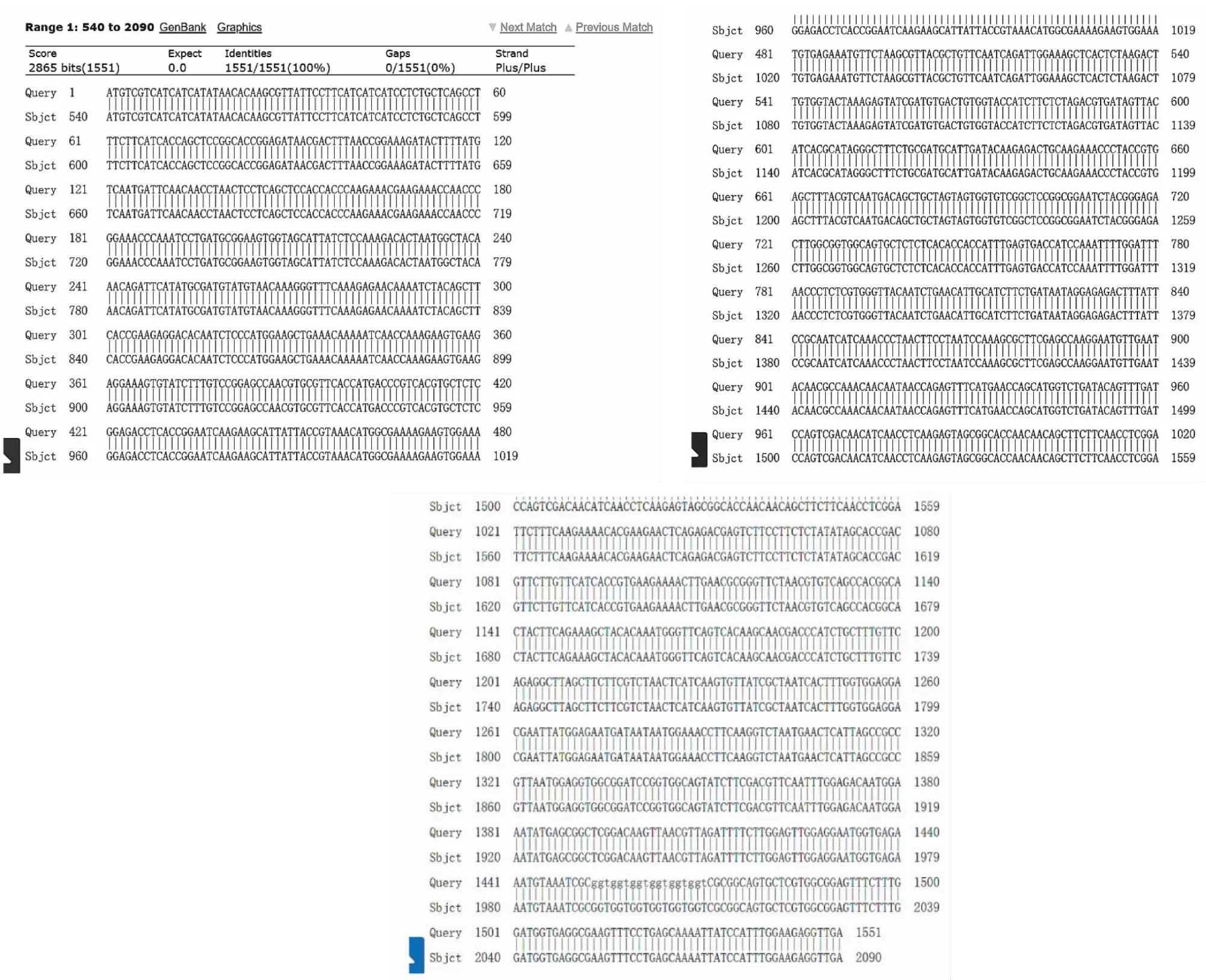
pCAMBIA-1300-35S: AtIDD4阳性克隆测序序列; Sbjct: AtIDD4的CDS序列。The sequence of positive clon pCAMBIA-1300-35S: AtIDD4; Sbjct: The sequence of AtIDD4 CDS.
2.5 转基因植株中 AtIDD4 基因的表达量检测
以拟南芥野生型(WT)植株为对照,用半定量RT-PCR和实时荧光定量RT-PCR的方法检测T3代转基因植株中拟南芥AtIDD4基因的表达量,内参基因选取拟南芥Actin基因。相较拟南芥野生型植株转基因植株2个株系AtIDD4基因的表达量显著提高,荧光定量RT-PCR显示转基因植株中AtIDD4基因的表达量约为拟南芥野生型植株的2倍,与半定量RT-PCR的结果相符。说明得到了拟南芥AtIDD4高表达的转基因植株,并将这些植株命名为AtIDD4-OE(Over-expression)(图6)。

箭头: 平板上长出的幼苗为转基因成功的植株。Arrow: Seedlings grown on the plate are transgenic plants.
2.6 转基因植株表型观察
为研究拟南芥AtIDD4基因过表达植株生长状况,观察统计了在 MS 培养基中垂直培养 14 d 的拟南芥AtIDD4基因过表达植株与拟南芥野生型(WT)植株幼苗的生长情况。发现两者平均根系长度分别为3和5 cm,拟南芥AtIDD4基因过表达植株根系长度明显短于拟南芥野生型(WT)植株。而两者的平均幼苗鲜重分别为0.15 和0.29 g,拟南芥AtIDD4基因过表达植株幼苗鲜重显著低于拟南芥野生型(WT)植株鲜重(图7)。通过观察在土壤中生长14 d的幼苗生长情况,从图8可见,拟南芥AtIDD4基因过表达植株较野生型(WT)植株整体生长状态较弱、幼苗矮小、莲座叶面积较小。
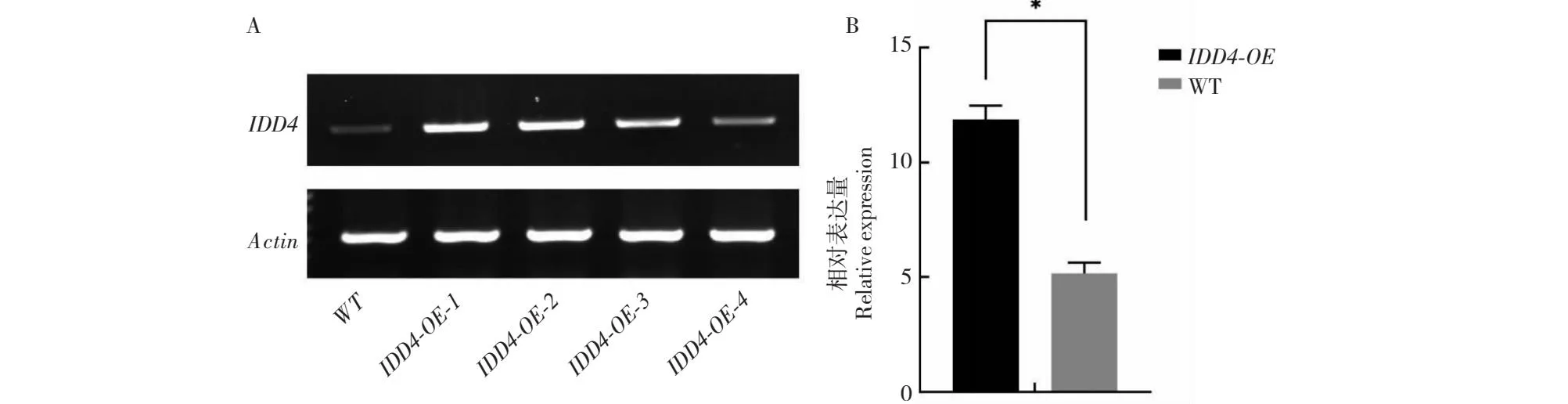
A:半定量RT-PCR;B:荧光定量RT-PCR;WT: 野生型; IDD4-OE-1、IDD4-OE-2、IDD4-OE-3、IDD4-OE-4代表各株系;*表示 P<0.05。A: Semi-quantitative RT-PCR; B: Fluorescence quantitative RT-PCR;WT: Wild type;IDD4-OE-1,IDD4-OE-2,IDD4-OE-3 and IDD4-OE-4 represent each strain;*means P<0.05.

A:IDD4-OE和WT; B:过表达植株与野生型植株幼苗根系长度的统计学分析;C:过表达植株与野生型植株幼苗鲜重的统计学分析;****表示 P<0.05;标尺: 1 cm。A: IDD4 overexpression and wild type; B: Statistical analysis of root length in seedling of overexpressed and wild-type plants; C: Statistical analysis of fresh weight in seedling of overexpressed and wild-type plants;****means P<0.05; Ruler: 1 cm.

A:WT;B:IDD4-OE。
3 讨 论
随着反向遗传学研究的深入,应用不同方法使基因超量表达或将基因表达量降低或敲除使基因不表达来观察表型的变化已成为研究基因功能的一种重要手段[20]。过量表达植株的鉴定主要利用cDNA为模板进行qPCR扩增,因其程序繁琐和操作具有一定难度,在大量筛选中不具有快速检测的优势[21]。鉴于“三引物”法在T-DNA插入突变体的纯合性及插入位点鉴定中的重要作用[22-23],可将其用于过表达植株的鉴定,基于重组质粒的结构设计3个引物并两两配对过表达植株进行鉴定,第1对引物为35S启动子左边界与AtIDD4基因右边界进行配对,第2对引物为AtIDD4基因左右边界配对,进行快速鉴定。需要注意的是,在利用“三引物法”快速鉴定过表达植株时,回复突变和基因修复往往容易被忽略。
IDD家族是高等植物中高度保守的一类转录因子,IDD家族中的大多数成员已被广泛证实能调控GA和IAA等植物激素的合成与转导,共同调控植物的生长与形态建成[24]。Cui 等[25]研究了拟南芥AtIDD14、AtIDD15和AtIDD16基因协同调控生长素的生物合成和运输,通过直接靶向作用于YUC5、TAA1和PIN1基因调节生长素的空间积累从而促进生长素的生物合成和转运,进而控制植物器官形态发生和向地力反应,因此推断AtIDD4基因过表达后将通过复杂的调控网络调控植物生长激素种类和含量进而影响植株的正常生长发育。本研究构建的AtIDD4基因过表达植株,通过生长表型观察,发现拟南芥AtIDD4基因过量表达后,拟南芥幼苗根系长度显著降低,且生长势显著低于野生型植株,揭示了AtIDD4基因在拟南芥生长发育方面发挥负调控作用。既往研究证实,IDD4受KAN和REV的转录抑制[3],本研究中AtIDD4基因过表达株系在叶片形成和叶片大小方面受到损害,与HD-ZIPIII基因被抑制产生的形态相似[25],AtIDD4基因可能参与了上述3个因子的负反馈调节网络。近年来,植物激素在植物免疫中的重要作用被大量研究所证实,拟南芥IDD家族成员2、3、4、5、9和10作为转录支架,使DELLA/RGA反式激活,调节GA信号转导途径[3]。GA、SA和JA互作网络共同调控和平衡植物的生长与免疫进程,AtIDD4基因是否参与植物信号激素转导是今后研究的重要切入点。因此,本研究构建的AtIDD4基因过表达植株为后续探究AtIDD4基因协调植物防御等其他生物学功能提供了重要的材料。
4 结 论
本研究构建了拟南芥AtIDD4基因过量表达植物AtIDD4-OE,植株中AtIDD4基因的表达量显著提高。表型观察结果表明,AtIDD4-OE幼苗根长和幼苗鲜重等指标显著低于拟南芥野生型(WT)植株;土壤中生长14 d的拟南芥AtIDD4基因过表达植株与拟南芥野生型(WT)植株比较,植株矮小,莲座叶面积较小,表明拟南芥AtIDD4基因过量表达会抑制拟南芥的生长,其在拟南芥生长发育过程中以负调控因子发挥作用。
