二硫键在蛋白质中的作用及其氧化改性研究进展
2016-12-01李军生阎柳娟黄国霞
钟 新,李军生*,阎柳娟,黄国霞,王 薇
(1.广西科技大学生物与化学工程学院,广西柳州545006;2.广西糖资源绿色加工重点实验室,广西柳州545006;3.广西高校糖资源加工重点实验室,广西柳州545006)
综述
二硫键在蛋白质中的作用及其氧化改性研究进展
钟 新1,2,3,李军生1,2,3*,阎柳娟1,2,3,黄国霞1,2,3,王 薇1,2,3
(1.广西科技大学生物与化学工程学院,广西柳州545006;2.广西糖资源绿色加工重点实验室,广西柳州545006;3.广西高校糖资源加工重点实验室,广西柳州545006)
蛋白质是维持一切生命活力的基础,含有较多的二硫键,但是目前有关二硫键的相关研究相对较少。本文简述了二硫键的构成要素;从二硫键对蛋白质结构和表面活性影响的角度分析了二硫键的重要性;对采用打开二硫键的方法提高蛋白质表面活性的可行性和近年来采用氧化改性提高蛋白质表面活性的研究进展进行了综述。
二硫键;蛋白质;表面活性;氧化改性
二硫键存在于很多蛋白质和多肽当中,是维持蛋白质结构稳定的重要共价键之一,不同于氢键、静电作用和范德华力,二硫键的稳定性几乎完全依靠二硫键的周围环境(Creighton,1988),可以通过氧化还原作用使二硫键和游离巯基含量发生改变。二硫键的形成对两个半胱氨酸的位置和方向有着严格的立体化学要求,天然二硫键的形成要求两个硫原子之间的距离必须在2.05到2.08之间,二硫键与每个色氨酸残基的β-碳原子的夹角必须接近103°,且两个硫原子与各自相连的β-碳原子形成的两个S—C键的夹角保持90°(Creighton,1988)。二硫键的存在严重限制了蛋白质分子结构的伸展,所以它们影响着结构的柔性和紧实度,这是蛋白质分子结构稳定性和功能性质的决定性因素(Gekko等,2003)。对蛋白质结构的影响主要表现在稳定蛋白质的天然结构、促进蛋白质正确折叠以及防止疏水基团的暴露三个方面。从结构上讲,任何蛋白质都是由疏水和亲水两种氨基酸组成,天然蛋白质在折叠的过程中,由于二硫键锁定的缘故,疏水基团一般被包裹在分子内部,可以有效防止疏水基团与水等溶剂的接触,这在一定程度上降低了蛋白质的表面活性。通常情况下,二硫键的断裂或错误连接会导致蛋白质结构变得疏松以及内部结构的暴露。
1 二硫键对蛋白质结构的影响
虽然人们通过凝胶排阻层析法、小角X射线衍射等方法对还原态二硫键进行了大量的研究,但是对于二硫键维持蛋白质结构稳定性机理的相关数据依然很有限,一般认为构象熵的变化是蛋白质天然构象失稳的重要原因(Klink,2000)。
杨程(2010)采用分子动力学模拟从分子水平研究了二硫键对胰岛素结构稳定性的影响,发现二硫键断裂后,A、B链解离,B链的中心螺旋趋于失稳,胰岛素稳定性降低。Klink(1992)通过对核糖核酸酶A(RNase A)的二硫键进行突变研究了二硫键对蛋白构象稳定性的影响,结果表明,每个二硫键突变去折叠有两种状态过程,每个二硫键对蛋白质的构象稳定性都有很大的影响,且两个终端的二硫键比两个嵌入式二硫键对维持蛋白质结构稳定作用更大。Kang(2003)采用β-巯基乙醇断裂二硫键的方法研究了牛血清白蛋白(BSA)结构的变化,发现随着二硫键断开程度的增加,色氨酸基团荧光强度下降且最大发射峰位蓝移,表明随着二硫键断开程度增加蛋白质逐渐变性,疏水环境的色氨酸逐渐发生变化;同时远紫外圆二色谱表明二硫键断裂后蛋白质的α-螺旋含量没有显著变化,表明二硫键断裂对蛋白质的二级结构影响不大。Kella(1989)研究二硫键对乳清蛋白结构的影响,当二硫键断开率在25%和50%时内源荧光分别红移了7 nm和12 nm;二硫键断开率进一步提高内源荧光开始蓝移。Kalapathy(1997)分别用10 mmol/L的β-巯基乙醇和6 mmol/L的尿素断开大豆蛋白的二硫键,发现二硫键全部断裂后色氨酸最大发射峰位蓝移,色氨酸残基暴露向着非极性的环境转移,说明分子的部分去折叠发生在色氨酸基团附近。二硫键断裂除了会引起色氨酸基团微环境的变化,还会引起二级结构的变化。如Kella(1988)对二硫键断裂导致BSA结构的变化进行了详细的分析,紫外差示光谱显示S—S断裂后287~288 nm的负峰出现蓝移,在279 nm处出现肩峰,表明酪氨酸残基集中在Ⅰ区和Ⅱ区,且二硫键断裂后由于结构发生变化导致酪氨酸残基从内部向外部水环境转移;内源荧光光谱显示随着二硫键断开率增加,内源荧光强度逐渐下降且最大发射峰位逐渐蓝移,认为是由于二硫键断裂后蛋白质变性、分子柔性增加导致色氨酸基团由非极性环境向极性环境转移;同时远紫外圆二色谱表明,随着二硫键的断裂,α-螺旋含量降低,β-折叠和转角含量增加;当二硫键全部断裂后,α-螺旋含量由原来的54.8%减少至15.4%,而β-折叠和转角的含量分别由原来的9.4%、3.9%升高至32.4%和13.7%。从以上数据可以得出二硫键断裂后改变了蛋白质的三级结构。黎阳(2012)研究了二硫键断裂后对胰岛素二级结构的影响,试验结果表明,二硫键断裂后α-螺旋含量出现了不同程度的下降,β结构含量略有升高。有研究发现,溶菌酶二硫键被断裂后导致无规则卷曲含量显著增加,分子之间相互聚集(Goldberg等,1991)。Gekko(2003)研究了二硫键对五种球蛋白的体积、紧实度、热膨胀性的影响,发现当二硫键全部断裂后,圆二色谱和荧光光谱显示球蛋白的二级和三级结构部分遭到破坏,构象变化伴随着微分比容、绝热压缩系数下降和热膨胀性的提高,表明球蛋白的内部空腔降低和表面水合作用提高。
2 二硫键对蛋白质表面活性的影响
二硫键是维持蛋白质结构稳定的重要共价键之一,由于蛋白质的结构特点,内部疏水基团无法转移至分子表面,这在很大程度上制约了蛋白质分子的表面活性。蛋白质的去折叠可以使分子更好的排列在油水或气液界面,形成更稳定的构象熵,在很大程度上提高蛋白质的表面活性(Kella等,1989)。一般考察蛋白质的乳化性、起泡性、黏度、表面疏水性等表面活性的变化情况。如Kella(1986)研究了二硫键断裂对大豆球蛋白和亚基表面活性的影响,发现二硫键的断裂改变了蛋白质的溶解性和等电点,表面疏水性都呈现出升高的趋势,同时发现二硫键的断裂有利于蛋白质的体外消化。1989年,Kella等(1989)又研究了乳清蛋白二硫键断裂后蛋白质在气液界面行为的变化,研究结果表明,pH在6.0~2.0,二硫键全部断裂后乳清蛋白的不溶性蛋白占到95%~100%;二硫键断开率≤50%时,表面疏水性提高,蛋白质黏度和表面压力增加,当二硫键断开率大于75%时表面疏水性减小,蛋白质黏度和表面压力下降;随着二硫键的断裂程度的增加,乳清蛋白的起泡能力逐渐提升,且有效提高了起泡稳定性,在二硫键断开率为75%时稳定性最好。二硫键在断裂过程中形成的磺酸基团带来的负电荷显著提高了蛋白质的表面电荷,当二硫键断开率为25%、50%、75%和100%时乳清蛋白的等电点分别为4.74、4.38、4.2和4.0。Kang(2003)在对BSA的研究中发现,天然BSA乳化性稳定性较差,随着二硫键的断裂程度增加,BSA的乳化稳定性得到提高。二硫键断裂后蛋白质结构展开有效提高了疏水基团使蛋白质去折叠后可以很好地吸附在油水界面,大大提高了BSA的乳化活性。Snouwaert(1991)研究了二硫键对人白细胞介素活性的影响,发现cys45-cys51二硫键的缺失比半胱氨酸自由突变具有更高的生物活性。Kalapathy等(1997)对大豆蛋白的改性发现,由于二硫键的断裂导致蛋白质去折叠,溶液中的疏水性蛋白质含量增加,大豆蛋白的溶解性显著提高,当二硫键断开率为28%时,大豆蛋白的黏度、粘合强度和疏水特性最佳,但是二硫键的断裂对蛋白的粘合强度没有显著影响。German(1985)研究发现,随着亚基内二硫键的断裂,11S球蛋白的起泡性和起泡稳定性显著提高。Klemaszewski(1991)发现随着二硫键打开程度的提高乳清蛋白的乳化活性也随之提高。Kim(1987)用5 mol/L和10 mol/L的二硫苏糖醇处理大豆球蛋白,发现还原剂用量越多,11S球蛋白表面疏水性和黏度越高,表面膜的屈服应力和弹性越强,因此乳化稳定性也越强。
综上所述,二硫键对维持蛋白质结构和构象稳定性具有十分重要的作用,由于二硫键的存在使蛋白质具有紧密的三级结构,导致蛋白质的表面活性较差。因此要改善蛋白质的表面活性可以从打开二硫键入手,改变二硫键在蛋白质中的存在形式归结于通过氧化还原反应改变蛋白质分子中二硫键的含量。
3 蛋白质氧化改性
蛋白质在贮存、加工等过程中,很容易出现氧化情况,对于该类氧化造成蛋白质功能性质、风味、结构等的影响已有报道(Ye等,2015;Ye等,2013)。反应性氧系(ROS)包括:羟基自由基(·OH)、超氧自由基阴离子(O2-)、NO、过氧化物自由基(ROO-)、过氧化氮自由基(ONOO-)、单氧(1O2)、次氯酸(HClO)、过氧化氢(H2O2),另外还包括醛基和酮基(朱卫星等,2011)。蛋白质在这些物质的氧化作用下,结构和功能性质的确会引起很大的变化,羰基含量、巯基和二硫键含量、二聚酪氨酸含量、表面疏水性等数据成为评价蛋白质氧化程度的指标。
在氧化条件下,蛋白质巯基和二硫键可以相互转化,主要是因为强氧化剂会将二硫键氧化成游离巯基或进一步被氧化成磺酸基团,引起分子游离巯基和二硫键的变化。2001年,Thomas(2001)对蛋白质的巯基和二硫键氧化作了详细解释,认为二硫键有两种氧化形式,即可逆和非可逆两种状态,如下所示:
巯基的可逆氧化形式
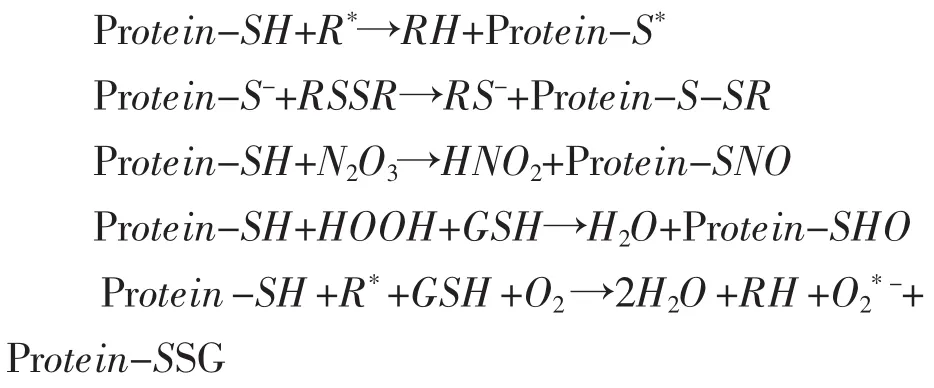
巯基的不可逆氧化形式
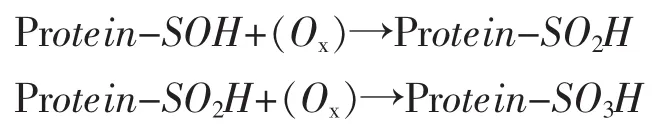
通过以上结构、功能性质、氧化形式等分析,通常认为,二硫键是影响蛋白质表面活性的主要原因。因此,如要提高大豆、乳清等蛋白质的表面活性必须断开分子中所含的二硫键使内部疏水性基团暴露至分子表面,通过改变蛋白质结构,增加表面疏水性改善其表面活性。目前,关于蛋白质氧化造成的结构和功能性质的变化已有报道。如蔡建勇(2013)和刘晶(2014)分别使用过氧化自由基和丙二醛对大豆蛋白氧化改性,发现温和的氧化条件可以一定程度上提高蛋白质的表面活性,但是过度激烈的氧化会降低蛋白质的表面活性。Wu(2010、2009、2009、2009)分别采用了四种不同氧化剂对大豆蛋白进行改性,发现大豆蛋白经丙烯醛、丙二醛、过氧自由基和13-氢过氧化-顺-9,反-11-十八碳二烯酸氧化后大豆游离巯基和二硫键含量下降,α-螺旋含量、表面疏水性、内源荧光强度下降,并推断氧化后大豆蛋白由于非二硫键共价交联形成可溶性聚集体。
通过对二硫键功能的分析,人们尝试采用打开二硫键的方式对蛋白质进行改性。对于如何断开二硫键进行了相关研究,使用的传统生化试剂有β-巯基乙醇(β-ME)、二硫苏糖醇(DTT)等。这些试剂可以有效断开蛋白质中的二硫键,但是,这些试剂也带来了一些不容忽视的问题,同时这类试剂不能在酸性条件下使用,有时候还会与肽段形成加合物。β-ME具有一定的毒性,会给科研工作者身体健康和环境造成危害,其次从理论上讲,该类试剂在断开二硫键后形成相应的巯基化合物,当这些还原剂被除去后很容易因为环境的变化导致结构展开的蛋白质出现复折叠的现象。Sanger(1949)将过甲酸断开二硫键的方法运用到胰岛素的研究中。Hirs(1956)进一步将该方法的应用扩大,认为过甲酸可以将半胱氨酸氧化成磺基苯丙酸。Toennies(1942)经过研究发现,过甲酸只氧化蛋白质中的色氨酸、甲硫氨酸和半胱氨酸,而不会对其他氨基酸造成较大破坏。张维农(2005)采用双氧水氧化大豆分离蛋白发现,双氧水可以改变大豆分离蛋白二硫键的含量,但是并没有进一步研究二硫键和表面活性之间的关系。随着研究的深入,李军生(2008)提出了通过打开二硫键制备蛋白质基表面活性剂的方法。王微(2016)采用过甲酸改变大豆蛋白的结构,再采用海藻酸钠进行接枝改性,结果表明,单纯的海藻酸钠改性大豆蛋白后蛋白质的表面活性并没有很大程度提高,二硫键对蛋白质的表面活性和结构影响很大,认为用过甲酸氧化二硫键对蛋白质的分子性质具有十分重要的意义。王朗(2013)运用正交试验研究了过氧乙酸打开大豆分离蛋白二硫键的最佳工艺,起泡性、乳化性等都得到了不同程度的提高。目前对于大豆蛋白化学改性的方法主要有两种,一是通过化学修饰采用共价键结合将疏水基团接到分子上;二是利用非共价键结合或吸附使离子型表面活性剂与蛋白质分子结合。从结构上讲,蛋白质自身含有较多的疏水及亲水性氨基酸,受二硫键锁定的影响使得天然蛋白质的表面活性较差,如果通过断开二硫键的方式使内部的疏水区域转移至极性环境中,足以提高蛋白质的表面活性。
4 展望
蛋白质是由极性和非极性氨基酸构成,其自身的氨基酸组成决定了蛋白质具有良好的表面活性。由于二硫键的锁定作用,大部分的疏水性氨基酸被包裹在分子内部,绝大多数蛋白质表面活性较差,从断开二硫键入手可以大大改善蛋白质的表面活性。但是对于二硫键对蛋白质结构和表面活性的影响需要进一步加强研究。目前虽然在试验上已经证实该方法的有效性,但是二硫键在分子水平上对蛋白质结构的影响尚不明确。近年来,随着计算机技术的普及,分子动力学模拟研究分子微观结构和功能的变化成为一种新的技术。相信今后的研究可以进一步将模拟和试验结合,通过计算机模拟了解二硫键断裂引起结构和表面活性变化的机理,然后通过模拟指导试验、试验验证模拟的方式研究二硫键与结构和表面活性的关系,并能生产出具有更高表面活性的蛋白质类产品。
[1]蔡勇建,吴晓娟,吴伟,等.过氧自由基氧化对大豆蛋白功能性质影响[J].粮食与油脂,2013,8:13~16.
[2]黎阳.二硫键对胰岛素聚集性的影响[硕士学位论文][D].湖北武汉:华中科技大学,2012:14~20.
[3]李军生,李丽娜,陈海涛.通过打开蛋白质二硫键制备蛋白质基表面活性剂的方法:中国,200810166640,4[P].2012-02-18,http://epub,sipo,gov,cn/patentoutline,action
[4]刘晶,蔡勇建,吴伟,等.丙二醛氧化对大豆蛋白功能性质的影响[J].中国油脂,2014,6:41~44.
[5]王朗,李军生,阎柳娟,等.过氧乙酸氧化大豆蛋白工艺参数优化[J].食品工业科技,2013,22:213~216.
[6]王微,李军生,阎柳娟,等.氧化变构-海藻酸钠复合修饰对大豆分离蛋白表面活性的影响[J].饲料研究,2016,5:42~46,51.
[7]杨程,卢滇楠,张敏莲,等.分子动力学模拟二硫键对胰岛素构象稳定性的影响[J].化工学报,2010,4:929~934.
[8]张维农,刘大川.大豆分离蛋白H2O2氧化改性研究[J].中国油脂,2005,5:32~35.
[9]朱卫星,王远亮,李宗军.蛋白质氧化机制及其评价技术研究进展[J].食品工业科技,2011,11:483~486.
[10]Creighton T E,Disulphide bonds and protein stability[J].BioEssays,1988,8(2~3):57~63.
[11]Gekko K,Kimoto A,Kamiyama T.Effects of disulfide bonds on compactness of protein molecules revealed by volume,compressibility,and expansibility changes during reduction[J].Biochemistry,2003,42(46):13746~13753.
[12]Gekko K,Kimoto A,Kamiyama T.Effects of disulfide bonds on compactness of protein molecules revealed by volume,compressibility,and expansibility changes during reduction[J].Biochemistry,2003,42(46):13746~13753.
[13]German J B,O’neill T E,Kinsella J E.Film forming and foaming behavior of food proteins[J].Journal of the American Oil Chemists’Society,1985,62(9):1358~1366.
[14]Goldberg M E,Rudolph R,JAENICKE R.A kinetic study of the competition between renaturation and aggregation during the refolding of denatured-reduced egg white lysozyme[J].Biochemistry,1991,30(11):2790~2797.
[15]Hirs C H W.The oxidation of ribonuclease with performic acid[J].Journal of Biological Chemistry,1956,219(2):611~621.
[16]Kalapathy U,Hettiarachchy N S,Rhee K C.Effect of drying methods on molecular properties and functionalities of disulfide bond-cleaved soy proteins [J].Journal of the American Oil Chemists'Society,1997,74(3):195~199.
[17]Kang Y N,Kim H,Shin W S,et al.Effect of Disulfide Bond Reduction on Bovine Serum Albumin‐Stabilized Emulsion Gel Formed by Microbial Transglutaminase[J].Journal of food science,2003,68(7):2215~2220.
[18]Kella N K D,Barbeau W E,Kinsella J E.Effect of oxidative sulfitolysis of disulfide bonds of glycinin on solubility,surface hydrophobicity and in vitro digestibility[J].Journal of Agricultural and Food Chemistry,1986,34(2):251~256.[19]Kella N K D,Kang Y J,Kinsella J E,Effect of oxidative sulfitolysis of disulfide bonds of bovine serum albumin on its structural properties:A physicochemical study[J].Journal of protein chemistry,1988,7(5):535~548.
[20]Kella N K D,Yang S T,Kinsella J E,Effect of disulfide bond cleavage on structural and interfacial properties of whey proteins[J],Journal of Agricultural and Food Chemistry,1989,37(5):1203~1210.
[21]Kim S H,Kinsella J E.Surface active properties of food proteins:effects of reduction of disulfide bonds on film properties and foam stability of glycinin[J]. Journal of Food Science,1987,52(1):128~131.
[22]Klemaszewski J L,Kinsella J E.Sulfitolysis of whey proteins:effects on emulsion properties[J],Journal of agricultural and food chemistry,1991,39(6):1033~1036.
[23]Klink T A,Woycechowsky K J,Taylor K M,et al.Contribution of disulfide bonds to the conformational stability and catalytic activity of ribonuclease A[J].European Journal of Biochemistry,2000,267(2):566~572.
[24]Sanger F.Fractionation of oxidized insulin[J].Biochemical Journal,1949,44(1):126.
[25]Snouwaert J N,Leebeek F W,Fowlkes D M.Role of disulfide bonds in biologic activity of human interleukin-6[J].Journal of Biological Chemistry,1991,266(34):23097~23102.
[26]Thomas J A,Mallis R J.Aging and oxidation of reactive protein sulfhydryls[J].Experimental gerontology,2001,36(9):1519~1526.
[27]Toennies G,Homiller R P.The oxidation of amino acids by hydrogen peroxide in formic acid[J].Journal of the American Chemical Society,1942,64(12):3054~3056.
[28]Wu W,Hou L,ZhangG C,et al.Structural modification of soy protein by 13-hydroperoxyoctadecadienoic acid[J].European Food Research and Technology,2009,229(5):771~778.
[29]Wu W,Wu X,Hua Y.Structural modification of soy protein by the lipid peroxidation product acrolein[J].LWT-Food Science and Technology,2010,43(1):133~140.
[30]Wu W,Zhang C,Hua Y.Structural modification of soy protein by the lipid peroxidation product malondialdehyde[J],Journal of the Science of Food and Agriculture,2009,89(8):1416~1423.
[31]Wu W,Zhang C,Kong X,et al.Oxidative modification of soy protein by peroxyl radicals[J].Food Chemistry,2009,116(1):295~301.
[32]Ye L,Liao Y,Sun W,et al.Effect of protein oxidation on the stability of peanut beverage[J].CyTA-Journal of Food,2015,13(1):49~55.
[33]Ye L,Liao Y,ZhaoO M,et al.Effect of protein oxidation on the conformational properties of peanut protein isolate[J].Journal of Chemistry,2013,2013.
Protein is the foundation of all life,which contains many disulfide bonds,but the current research on the disulfide bonds is relatively less.In this paper,the disulfide bond inscape was simply introduced,the importance of disulfide bonds was analyzed from the perspective of effect on the structure and functional properties;the feasibility of the method of improving surface activity by cleaving disulfide bonds in the protein and advances in oxidation modification to improve protein surface activity in recent years were reviewed.
disulfide bond;protein;surface activity;oxidation modification
10.15906/j.cnki.cn11-2975/s.20161702
S816
A
1004-3314(2016)17-0006-04
国家自然科学基金项目(21466006);国家科技型中小企业技术创新项目(14C26214502814);广西科学研究与技术开发计划项目(桂科能14122009-3-3、桂科转14125006-30);广西高等学校高水平创新团队及卓越学者计划资助(桂教人〔2014〕7号)
*通讯作者
