介入法构建新西兰兔髂内动脉出血模型
2023-03-11邓堂魏胜超冯玉红孙刚钟士杰张名林刘华江廖勇金桂云吕鹏飞
邓堂,魏胜超,冯玉红,孙刚,钟士杰,张名林,刘华江,廖勇,金桂云,吕鹏飞
1.海南医学院第一附属医院介入血管外科,海南 海口 570000;
2.海南医学院急救与创伤研究教育部重点实验室,海南 海口 570000;
3.海南大学,海南 海口 570000;
4.海南医学院第一附属医院乳腺外科,海南 海口 570000
出血性疾病是急诊常见病,每年有15%~20%的患者因各种原因导致的出血而就诊于急诊科[1],以临床常见的骨盆骨折出血及产后出血(postpartum hemorrhage,PPH)为例:骨盆骨折约占全身骨折的3%[2],骨盆骨折大出血是患者伤后24 h内死亡的主要原因,病死率可高达40%[3];PPH是孕产妇死亡的首要原因[4-5],2017年全国高龄(≥35岁)的孕产妇比例升至前所未有的17.13%,经产妇比例高达84.07%,直接产科原因导致的孕产妇死亡占53.9%[6-7]。骨盆骨折及产后出血属于盆腔脏器出血,罪犯血管多来源于髂内动脉及其属支[8-9],针对出血的治疗方式多种多样,包括外科手术治疗、介入血管栓塞治疗、内科药物保守治疗等。在过去的几十年里,人们逐渐从复杂的开放手术转向并发症更少、精准、微创的介入血管栓塞治疗;介入栓塞指的是出于治疗目的对靶血管注射栓塞剂,减少或阻断靶血管血流,以达到止血的效果[10-11]。近年来,血管栓塞材料发展迅速,但尚缺乏一种理想的出血动物模型来评价介入血管栓塞材料的性能。本研究采用介入法构建髂内动脉出血的动物模型,将助力盆腔脏器出血介入栓塞材料的基础研究。
1 材料与方法
1.1 实验动物新西兰雌兔,3个月龄,体质量8~10 kg,长沙天勤,许可证号:SCXK(湘)2019-0015。
1.2 仪器与材料数字减影血管造影机(美国通用电气),21G穿刺针(美国COOK),V18导丝(美国,Boston Scientific),明胶海绵块(艾力康),微导管微导丝(美国,Boston Scientific),碘海醇注射液(美国通用电气),速眠新Ⅱ(敦化圣达),舒泰50(法国维克),全自动血细胞分析仪(迈瑞6800plus)等。
1.3 实验方法
1.3.1 动物麻醉新西兰雌兔术前禁食水12 h,肌肉注射速眠新Ⅱ(2 mg/kg)诱导麻醉后,耳缘静脉注射舒泰(7.5 mg/kg)维持麻醉。
1.3.2 暴漏左侧颈总动脉麻醉成功后,颈部备皮、消毒。选取左侧颈总动脉(common carotid artery,CCA)搏动最强处皮肤做一长约2 cm的纵型切口,使用弯头止血钳(12.5 cm)钝性分离出左侧颈总动脉,分别于近心段及远心端2-0慕斯线悬吊(图1)。
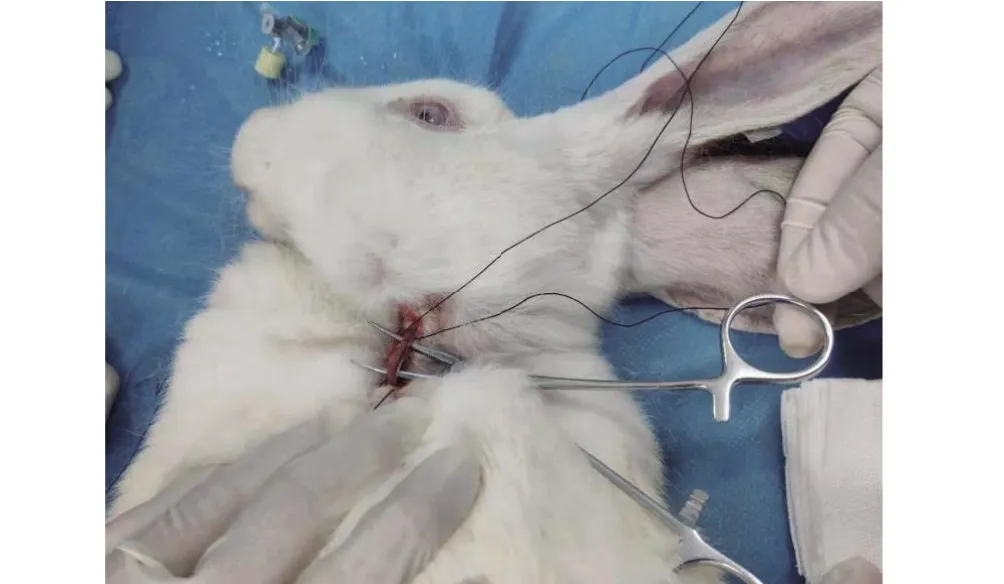
图1 暴露左侧颈总动脉Figure 1 The left common carotid artery was exposed
1.3.3 构建左侧髂内动脉出血模型21G微穿针穿刺左颈总动脉成功,置入V18导丝交换微导管,按公斤体质量输注肝素生理盐水5 mL(0.5 mg/Kg);输注完毕将微导管于腹主动脉分叉上方,使用5 mL注射器快速注射碘海醇5 mL,观察新西兰雌兔双侧髂动脉的走行及分支。将微导丝超选至左侧髂内动脉,然后将微导管置于左侧髂内动脉,固定微导管,撤出微导丝,V18导丝硬端进入微导管快速将左髂内动脉戳破,造影见左髂内动脉造影剂溢出,评估造模成功。
1.3.4 栓塞髂内动脉出血模型造模后等待10 min,路图下微导管微导丝分别超选双侧髂内动脉,将明胶海绵块切成3 mm×10 mm大小,在干洁纱布块上将明胶海绵块搓成0.5 mm×10 mm大小,置入1 mL注射器中,经微导管快速注入双侧髂内动脉主干,复查造影双侧髂内动脉截断,造影剂溢出征象消失,拔除微导管,明胶海绵块适当力度压迫左颈总动脉15 min,观察无出血,消毒缝合皮肤,肌肉注射青霉素(5万U/Kg,1次/d,连续7 d)预防感染。
1.3.5 造模前后红细胞计数、红细胞压积、血红蛋白测定分别于造模前及造模后10 min经耳缘静脉抽取全血5 mL置入含有EDTA-K2抗凝剂的采血管,血细胞分析仪测定红细胞计数、血红蛋白含量、红细胞压积。
1.4 统计学方法应用SPSS24.0软件对新西兰兔造模前后红细胞计数、红细胞压积、血红蛋白含量测定结果数据进行统计分析。计量资料符合正态分布,以均数±标准差(±s)表示,造模前后组间比较采用配对t检验。以P<0.05为差异有统计学意义,P<0.01为差异有显著统计学意义。
2 结果
2.1 造模结果8只新西兰兔均造模成功,无感染、无死亡,无血尿及血便,未出现偏瘫、口唇歪斜等脑梗并发症。造模后前3 d,新西兰兔食欲较前减退,精神状态欠佳,懒动,3 d后食欲及精神状态逐渐恢复正常,行走自如。
2.2 新西兰兔DSA动脉图解依造影所见,新西兰兔动脉血管解剖与人体结构相仿,经左颈总动脉置入微导管于主动脉弓造影(图2),可见主动脉弓发出头臂干动脉(brachiocephalic trunk,BCT)、左颈总动脉(left common carotid artery,LCCA)及左锁骨下动脉(left subclavian artery,LSA)、椎动脉(left vertebral artery,LVA)、右锁骨下动脉(right subclavian artery,RSA)(图2A)。将微导管置于腹主动脉上段造影可见腹腔干动脉(celiac axis,CA)、脾动脉(splenic artery,SA)、肠系膜上动脉(superior mesenteric artery,SMA)、左肾动脉(left renal artery,LRA)、右肾动脉(right renal artery,RRA)显影(图2B);微导管置于腹主动脉下段造影,可见双侧髂总动脉(common iliac artery,CIA)显影,髂内动脉(internal iliac artery,IIA)为髂总动脉第一分支,往下延续为髂外动脉(external iliac artery,EIA)、股总动脉(common femoral artery,CFA)、股深动脉(deep femoral artery,DFA)、股浅动脉(superficial femoral artery,SFA)、腘动脉(popliteal artery,PA)、胫前动脉(anterior tibial artery,ATA)、胫后动脉(posterior tibial artery,PTA)及腓动脉(fibular artery,FA)(图2C)。微导管置于左侧髂内动脉造影(图3),可见臀上动脉(superior gluteal artery,SGA)、臀下动脉(interior gluteal artery,IGA)、子宫动脉(uterion artery,UA)、膀胱动脉(vesical arteries,VA);阴部内动脉(interior pudendal artery,IPA);将微导丝塑型可将微导管超选入双侧髂内动脉进行造模及栓塞止血治疗。
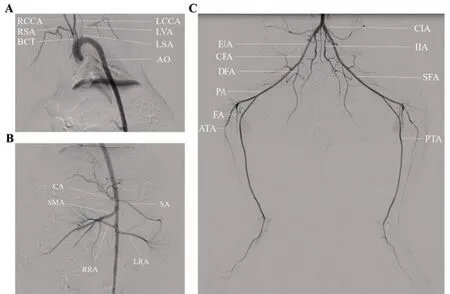
图2 新西兰兔全身动脉DSA图解Figure 2 New zealand rabbit DSA diagram of systemic arterial
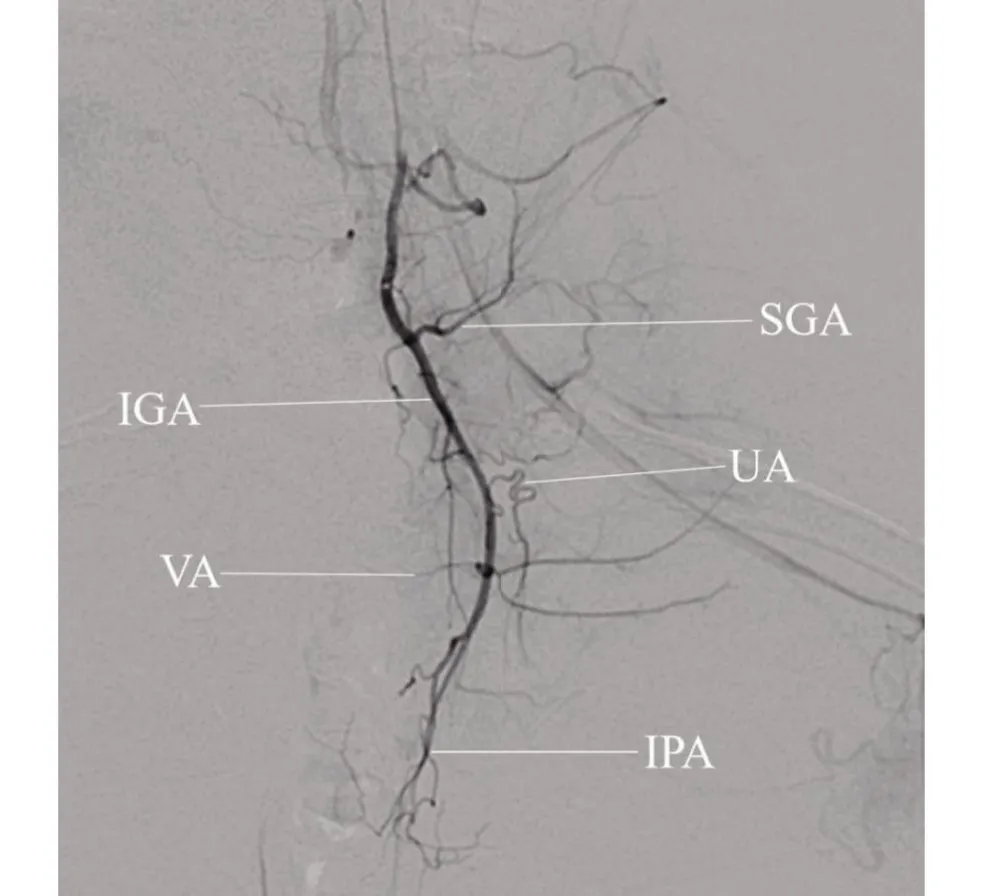
图3 新西兰雌兔髂内及其分支动脉DSA图解Figure 3 New zealand rabbit DSA diagram of Internal iliac artery and its branch arteries
2.3 新西兰兔出血模型制备前后及栓塞后DSA影像出血模型制作前造影见双侧IIA走形正常,无异常狭窄、瘤样扩张(图4A);将微导管置于左侧IIA,予V18导丝硬端将左IIA戳破,造影可见左IIA造影剂溢出的出血征象(图4B);微导管分别超选双侧IIA,予自制明胶海绵条栓塞双侧IIA主干,复查造影双侧IIA截断,出血征象消失(图4C)。
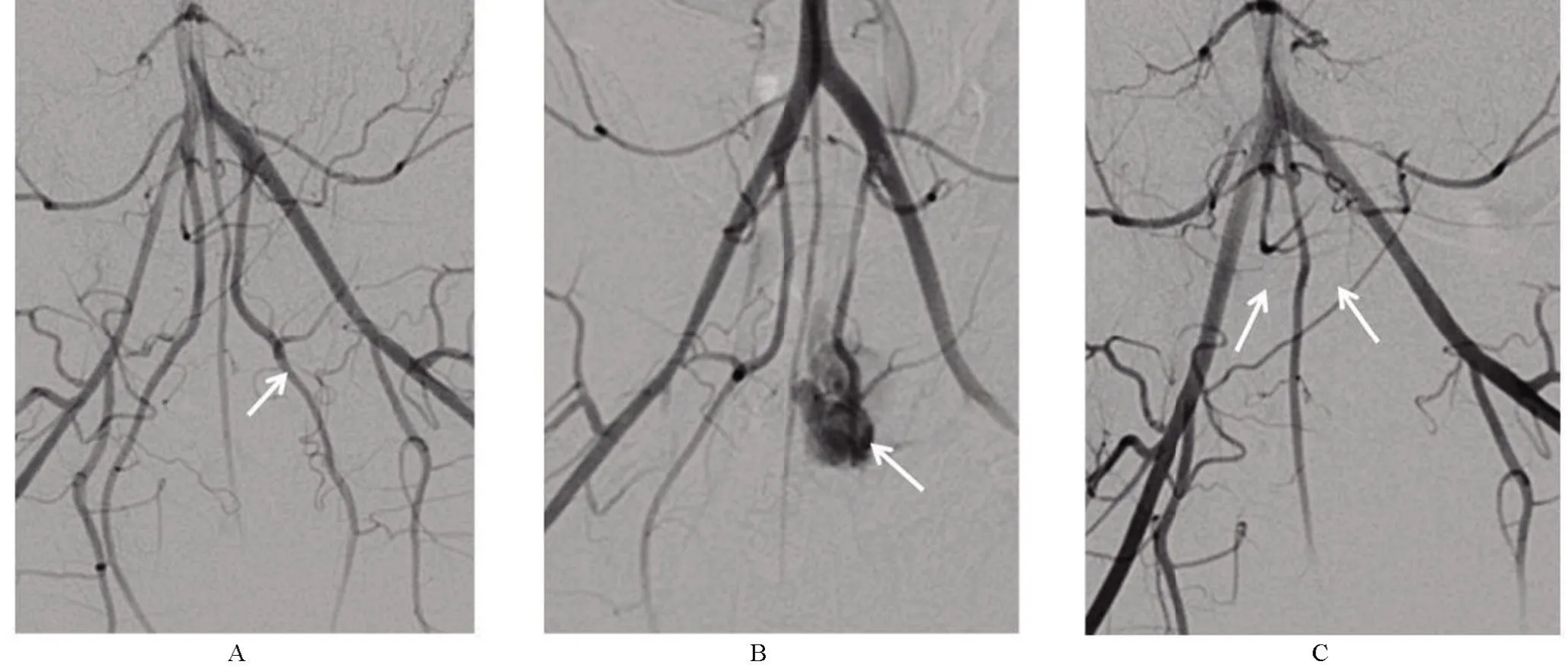
图4 新西兰兔出血模型构建前后及栓塞后DSA图解Figure 4 New zealand rabbit DSA diagram of before and after the bleeding model construction and the embolization
2.4 造模前后红细胞计数、血红蛋白、红细胞压积含量变化造模前新西兰兔全血红细胞计数(RBC)4.4×1012/L,血红蛋白含量(HGB)93 g/L,红细胞压积(HCT)32%,造模后新西兰兔全血RBC 3.6×1012/L,HGB 75 g/L,HCT 25%,造模后新西兰兔RBC、HGB、HCT含量较造模前明显降低(图5),差异均有显著统计学意义(P<0.01)。
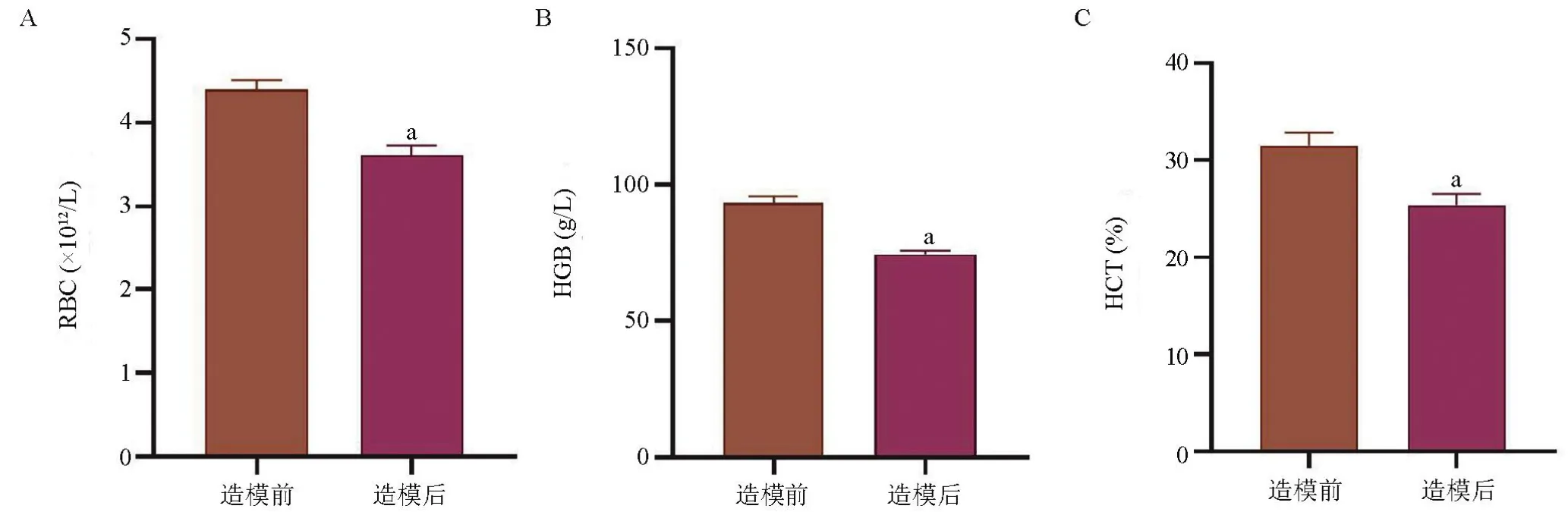
图5 新西兰兔造模前后RBC、HGB及HCT含量变化Figure 5 Changes of RBC,HGB and HCT in New zealand rabbits before and after modeling
3 讨论
据报道,食蟹猴、猪、犬、兔、鼠等动物均可用于出血模型的构建,虽然猪、猴、犬在体型上占据优势,血管较粗,血管内介入操作难度相对较低,但价格昂贵,饲养场地及饲养条件均要求高;小鼠价格低廉、饲养条件简单,但体型过小,血管纤细,血管内介入操作难度较大。本项目构建的动物盆腔出血模型主要应用于介入血管栓塞材料的基础研究,新西兰兔体型中等,血管直径适宜,可以实现血管内介入操作,且价格适中、饲养条件要求不高[12-17]。有研究者发现新西兰兔的CIA分为两侧的IIA和EIA,子宫动脉起源于IIA,与人体相仿[18],本研究经颈动脉穿刺造影发现新西兰兔动脉走形及解剖与人类动脉解剖基本一致,因此本项目选用新西兰兔构建IIA出血模型。
在对患者进行介入治疗时,股动脉是最常选择的穿刺路径,通常使用Seldinger术对一侧股动脉进行穿刺,穿刺成功后在普通导丝引导下将Cobra导管翻山置于对侧CIA进行下一步操作。本研究对新西兰兔解剖发现,成年新西兰兔股动脉直径不足1 mm,行Seldinger术穿刺置管难度较大。即使通过Seldinger术穿刺股动脉成功,因盆腔脏器多为双侧供血,也需穿刺两侧股动脉,分别将Cobra导管翻山置于对侧CIA操作,手术步骤繁琐、手术耗时较长。本研究解剖新西兰兔颈动脉时发现,LCCA的血管直径约3 mm,是股动脉的2~3倍,是穿刺入路的较佳选择。因此笔者通过经皮切开暴露颈动脉鞘,游离出左侧CCA后进行血管穿刺,在透视下操控V18导丝越过主动脉弓,将微导管超选入腹主动脉下段造影,充分评估及了解双侧IIA血管走行后,可直接超选双侧IIA进行造模及栓塞治疗,即1次穿刺解决双侧问题,新西兰兔经颈动脉穿刺插管行DSA造影及治疗在国内外文献罕见报道。传统的出血模型构建主要通过组织切开找到靶血管,破坏靶血管构建出血模型,此种方法创伤大且术后常因感染等并发症导致动物模型死亡[19-21]。本研究结合放射介入学精准、微创的优势,创新性地选择血管腔内介入法构建新西兰兔IIA出血模型,即在DSA透视下将微导管超选至侧IIA,使用V18导丝硬端刺破IIA,造影评估IIA造影剂溢出,呈出血影像学表现。用于制作髂内动脉出血造模的导丝为Boston Scientific的V18亲水涂层导丝,长度300 cm,头端7.6 g,不锈钢轴芯,V18具有通过性好、操控性佳、支撑性优的特点,常用于下肢动脉硬化闭塞症的开通,该款导丝尺寸较长可用于微导管交换且硬端锐利、硬度高,V18导丝硬端可用于足底动弓动静脉穿刺,使静脉动脉化重建下肢动脉血运[22-25],正是由于上述的优良特性,新西兰兔髂内动脉出血模型才会选择该款导丝,V18导丝用于出血动脉模型的构建暂未见文献报道。进一步对造模前后新西兰兔静脉全血分析发现,造模后RBC、HGB及HCT均明显降低,该变化结合造影表现评估出血模型构建成功,为防止新西兰兔因失血过多休克死亡,笔者通过超选双侧IIA使用自制明胶海绵条栓塞止血成功,明胶海绵属于中短效栓塞剂,具有良好生物相容性,在体内7~14 d可被完全吸收,对机体无毒副作用[26-27],栓塞术后新西兰兔全部存活,未出现感染、脑梗、异位栓塞等并发症。
综上所述,使用介入法构建新西兰兔IIA出血模型具有精准、微创、简单、易复制、并发症少等优点,可推广用于盆腔脏器出血介入栓塞材料的基础研究。但由于条件有限,新型冠状病毒疫情反复,实验室开放时间不固定,本模型目前仅使用造影、红细胞计数、血红蛋白测定等指标评估,并未对新西兰兔进行磁共振、病理检查评估,后续实验将持续改进及完善。
