基于网络药理学和生物信息学的黄杨碱抑制肾癌细胞的作用机制及实验验证研究
2023-03-11马旭东杨进陈林吴波李嘉王威威梁国标
马旭东,杨进,陈林,吴波,李嘉,王威威,梁国标
1.遵义医科大学,贵州 遵义 563000;
2.成都大学附属医院泌尿外科,四川 成都 610081;
3.郫都区人民医院泌尿外科,四川 成都 611730
肾细胞癌是泌尿系统最常见和最具风险的肿瘤之一,约占全世界所有确诊癌症数的5%[1],主要发生在男性中[2]。并且在未来几年中,肾细胞癌(renal cell carcinoma,RCC)的发病率和死亡率仍将继续攀升,至2040年全球肾癌死亡人数估计高达30多万[2]。肾细胞癌可以被分为不同的分子和组织学亚型[3],透明细胞癌、乳头状肾细胞癌和嫌色细胞癌是肾细胞癌中最常见的亚型(≥90%),而剩余的亚型≤10%。重要的是,每种亚型在预后和治疗方面都具有特异性[4]。由于缺乏早期症状,大量肾细胞癌患者在发现时已有远处转移,手术治疗困难。因此,药物治疗对于大多数肾细胞癌患者非常重要。
近年来,随着科学技术的进步和国内外研究者的不断努力,不断涌现出许多有潜力治疗肾细胞癌的新疗法,例如针对哺乳动物雷帕霉素靶点(mTOR)和蛋白酪氨酸激酶(RTK)信号的靶向治疗[5]。最近,基于免疫治疗的新策略也被开发出来,旨在针对癌症免疫细胞之间的相互作用(免疫检查点抑制剂),这种方案在RCC治疗中取得了一些成功[6]。虽然使用免疫治疗的患者生存率明显高于单独化疗,但总体预后仍较差。因此,医学界迫切需要找到一种新的、有效的抗肾细胞癌的药物。
有证据表明,一些天然产物有确切的治疗作用,如抑制细胞增殖、诱导凋亡、促进线粒体损伤、促进氧化应激等[7-8]。黄杨碱(cyclovirobuxine D,CVB-D)是一种生物碱,来源于中国黄杨和其他同属植物。已发表的研究表明,CVB-D能通过CTHRC1-AKT/ERK-Snail信号通路抑制结直肠癌的发展[9]。此外,CVB-D在胃癌细胞、乳腺癌细胞中都有一定的抑制作用[10-11]。目前CVB-D的抗癌作用和详细机制较为复杂,而CVB-D对肾癌的具体作用及机制尚不明确,故本研究希望进一步探索CVB-D对肾癌的作用机制。
1 材料与方法
1.1 网络药理学与生物信息学分析
1.1.1 CVB-D的预测靶点从PharmMapper(http://www.lilab-ecust.cn/pharmmapper/)数据库筛选CVB-D的潜在治疗靶点。基因符号名称在UniprotKB数据库(https://www.UniProt.org/)中手动规范化。
1.1.2 肾癌的潜在靶基因肾癌相关的靶基因来自DisGeNET(https://www.disgenet.org/)。搜索策略:设置关键字为“renal cell carcinoma”,物种确定为智人。
1.1.3 蛋白互作网络构建为了阐明黄杨碱药物作用靶点与肾癌靶点之间的相互作用,使用Venny 2.1.0在线软件(https://bioinfogp.cnb.csic.es/tools/venny/index.html)获得交集基因并绘制Venn图。然后将交集靶点基因提交到STRING 11.0数据库(https://STRING-db.org),构建蛋白质-蛋白质相互作用(PPI)网络模型,将生物物种设置为智人(Homo sapiens),最小相互作用阈值设置为中置信度(>0.4)。通过CytoScape(3.7.2)调整并作图,再使用CytoHubba插件进一步分析网络中的Hub基因。
1.1.4 富集分析使用基因本体论(GO)分析和京都百科全书(KEGG)通路富集分析来探索交集基因的生物学途径和潜在的功能。将交集靶点基因分别输入到DAVID数据库(https://david.ncifcrf.gov/)和KEGG数据库(https://www.kegg.jp/),限定物种为人,设置P<0.05,分析主要的生物过程和代谢途径,并进行富集分析,保存结果,并使用微生信(https://www.bioinformatics.com.cn)在线工具将数据可视化。
1.1.5 核心靶点基因生物信息学分析从癌症基因组图谱(TCGA)数据集(https://portal.gdc.com)获得肾透明细胞癌的RNAseq数据(level3)和相应的临床信息。GTEx数据来自V8版本(https://gtexportal.org/home/datasets)。使用R软件v4.0.3进行统计分析。P<0.05被认为差异具有统计学意义。并利用基因表达分析交互分析数据集(GEPIA,http://gepia.cancer-pku)进一步分析肾透明细胞癌患者总生存期(OS)与核心基因表达水平的相关性(P<0.05,其他选项设置为默认值)。
1.2 实验验证
1.2.1 实验材料和试剂人肾透明细胞癌细胞系786-O、Caki-1皮肤转移癌细胞均购自中科院细胞库,RPMI-1640培养基(Gibco),胰蛋白酶(Biosharp),胎牛血清(Gibco),黄杨碱试剂(Med Chem Express),CCK-8试剂盒和BCA试剂盒(ThermoFisher),EGFR抗体(ABclonal)、AKT、p-AKT、PI3K、p-PI3K抗体(华安生物)、β-actin抗体(ABclonal)、鼠兔IgG二抗(华安生物)。
“食品安全学”是学院食品质量与安全专业重要的专业核心课程,同时也是学校设立的大学公共选修课,该课程具有综合性、实践性和应用性等特点,课程内容理论性较强,与多个学科存在交叉,细小知识点较多,因此作为公选课要让其他专业的学生学习好该课程,教学方式的选择是教学效果达成的重要因素。近年来,“互联网+”在各行各业反响强烈,充分利用互联网优势,把互联网的创新成果融合到社会的各个领域,其中,“互联网+教育”是在尊重教育本质特性的基础上,利用互联网重塑教学方法,备受各界专注[1]。
1.2.2 细胞培养786-O和Caki-1细胞在添加10%胎牛血清,100 U/mL青霉素-链霉素混合抗生素的RPMI 1640培养基中培养,细胞均放置在37℃,5%CO2湿化培养箱中。
1.2.3 CCK-8增殖实验将肾癌细胞系Caki-1和786-O以2×104细胞/mL的密度接种在96孔板(每孔100μL培养基)中。接种24 h后,用无水乙醇(对照组)和黄杨碱[20μmol/L、40μmol/L、60μmol/L、80μmol/L、100μmol/L、120μmol/L、140μmol/L]分别处理肾癌细胞,每个浓度包括5个重复。24 h后吸去96孔板中培养基,并在每孔中加入混有10μL CCK-8试剂的100μL完全培养基,培养箱孵育4 h后用酶标仪在450 nm波长下读取吸光度,测量细胞增殖和活力,以上实验重复3次。
1.2.4 细胞克隆形成实验用6孔板培养细胞,每孔接种1 000个细胞。细胞贴壁后,药物干预24 h;然后,将细胞置于正常培养基中10 d。移去培养基,用磷酸盐缓冲液(PBS)洗涤细胞两次。加入通用组织固定剂15 min后取出。加入结晶紫染色液染色10~20 min,冲去染色剂,晾干后用手机拍照。计算细胞克隆的数量。
1.2.5 倒置荧光显微镜下观察细胞形态学的变化取对数生长期786-O和Caki-1细胞,接种于6孔板内,贴壁培养24 h后,用黄杨碱30μmol/L、60μmol/L个浓度给药,并设空白对照组,于24 h后使用倒置荧光显微镜观察786-O和Caki-1细胞形态并拍照。
1.2.6 流式细胞术测凋亡按说明书测定细胞凋亡率。在60 mm培养皿中添加约2×105个细胞,并用黄杨碱(0μmol/L、30μmol/L、60μmol/L)不同浓度进行处理。处理24 h后,收集细胞,在300μL结合缓冲液中重悬,在4℃黑暗中用PI和Annexin V-FITC染色约30 min。结果用流式细胞仪分析。
1.2.7 Western blot检测通路靶点蛋白质表达采用蛋白免疫印迹法(Western blot)检测EGFR、PI3K、p-PI3K、AKT、p-AKT蛋白表达。取对数生长期786-O、Caki-1细胞,以5×105个,2 mL完全培养基接种6孔板,贴壁培养24 h后弃去每孔中旧培养基,分别用黄杨碱(30μmol/L、60μmol/L)两个浓度给药,并设空白对照组,收集各组干预24 h后的细胞提取总蛋白,并用BCA法测定各组蛋白浓度,经凝胶电泳、转膜、封闭后,孵育对应的一抗(1∶1 000)和二抗(1∶20 000),显影后用Image J软件分析,并用目的蛋白灰度值/内参灰度值表示蛋白相对表达量。
1.3 统计学方法所有验证实验均至少进行3次,实验的计量数据结果均以均数±标准差(±s)表示,所有的统计学分析都使用Graphpad Prism V9软件进行。两组间比较采用独立样本t检验,多组间比较采用单因素方差分析。以P<0.05为差异具有统计学意义。
2 结果
2.1 黄杨碱和肾细胞癌的靶向基因本研究从Pharm Mapper数据库中获得黄杨碱136个治疗靶点。从DisGeNET数据库收集的肾细胞癌靶点数量为2 084个。
2.2 构建PPI蛋白互作网络与分析黄杨碱和肾细胞癌的靶点通过Venny 2.1.0取交集,获得68个CVB-D治疗肾细胞癌的预测靶点(图1A)。PPI网络由STRING v11.0构建,并用Cytoscape软件进行可视化(图1B)。该PPI网络包括68个节点和465条边,平均节点度13.7。圆形节点代表每个蛋白质,节点大小越大,度值越高。节点之间的直线表示两种蛋白质之间的相互作用。线越粗,相互作用越强。Hub基因由cytoHubba插件计算。利用MCC、Degree方法计算出前10个Hub基因(图1C、1D),并将结果进行交集得到5个核心靶点基因为:ALB、IGF1、AKT1、EGFR、SRC。
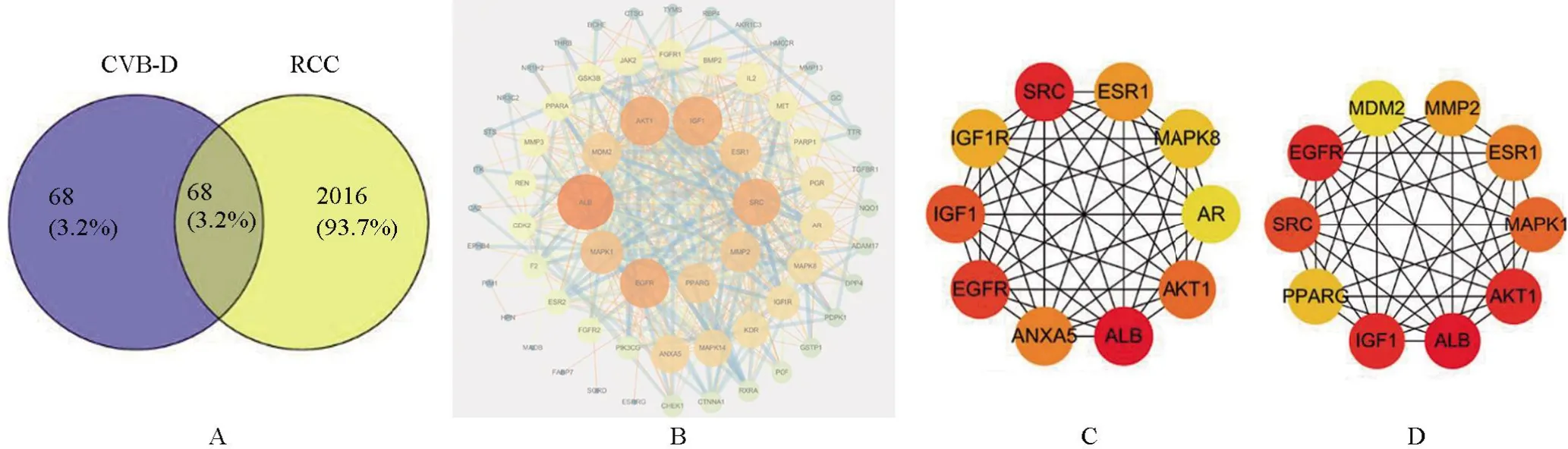
图1 黄杨碱与肾细胞癌的交叉靶点分析Figure 1 Analysis of the intersection targets of CVB-D and RCC
2.3 GO和KEGG通路富集分析为了探究黄杨碱和肾细胞癌交集基因的生物学功能,本研究进行了两种富集分析:(A)GO富集分析和(B)KEGG富集分析。黄杨碱主要参与的生物学过程包括信号转导、凋亡过程的正向调控、细胞周期的正向调控等(图2A)。分子功能主要集中在蛋白结合、ATP结合、锌离子结合等方面(图2A)。所涉及的主要通路有:癌症通路、PI3K-AKT通路、前列腺癌、癌症中蛋白聚糖、MAPK信号通路等(图2B)。
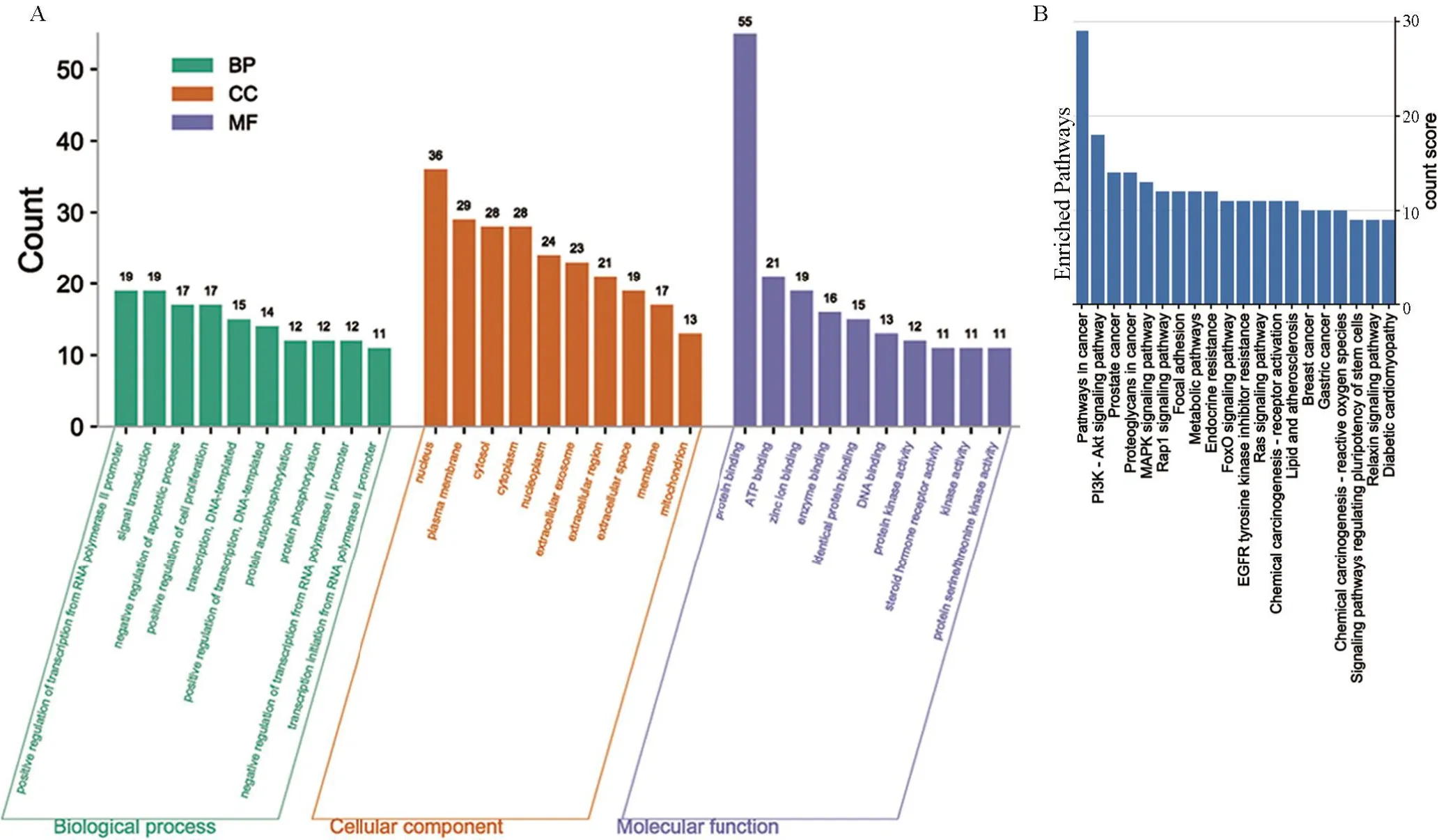
图2 黄杨碱与肾细胞癌交集靶基因的富集分析Figure 2 Enrichment analysis of target genes at the intersection of CVB-D and RCC
2.4 核心靶点表达与RCC的相关性分析在肾细胞癌中对ALB、IGF1、AKT1、EGFR、SRC这5个核心靶点进行表达差异筛选和生存分析筛选,结果显示5个核心靶点中EGFR在肾癌组织中表达增高最为显著(图3A)。生存分析筛选得出高表达AKT1与肾细胞癌患者生存时间密切相关(图3B)。故推测EGFR可能与黄杨碱治疗肾细胞癌的作用密切相关。
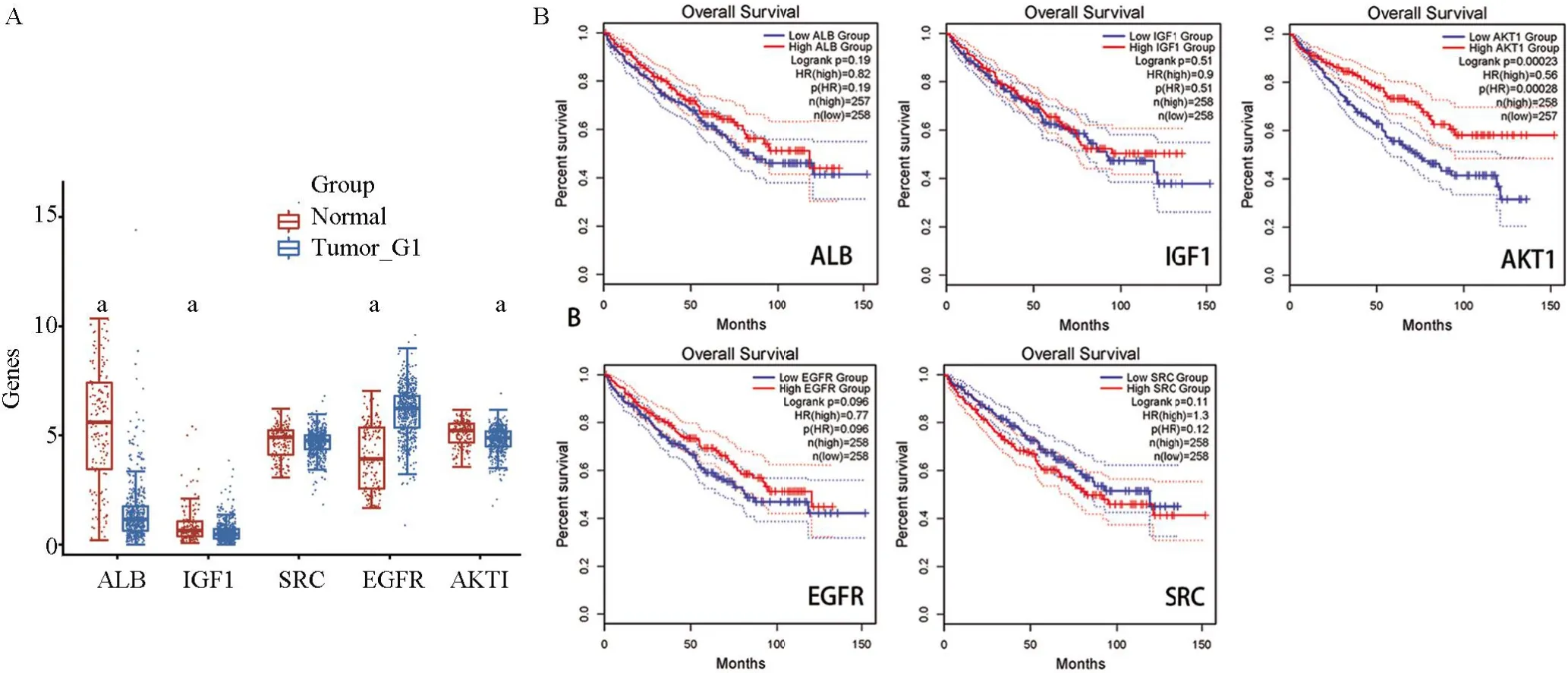
图3 核心靶点的差异表达和预后分析Figure 3 Differential expression and prognostic analysis of Hub genes
2.5 黄杨碱对肾细胞癌786-O、Caki-1细胞活性及增殖的影响通过细胞活力测定评价黄杨碱对786-O和Caki-1细胞的毒性作用。与对照组相比,用黄杨碱(0、20μmol/L、40μmol/L、60μmol/L、80μmol/L、100μmol/L、120μmol/L、140μmol/L)处理后肾癌细胞存活率显著降低,且呈浓度依赖性(图4A,786-O 24 h IC50:51.51μmol/L;Caki-1 24 h IC50:42.19μmol/L)。且黄杨碱能明显抑制肾癌细胞的集落形成(图4B),说明黄杨碱具有明显抑制肾细胞癌细胞的作用。
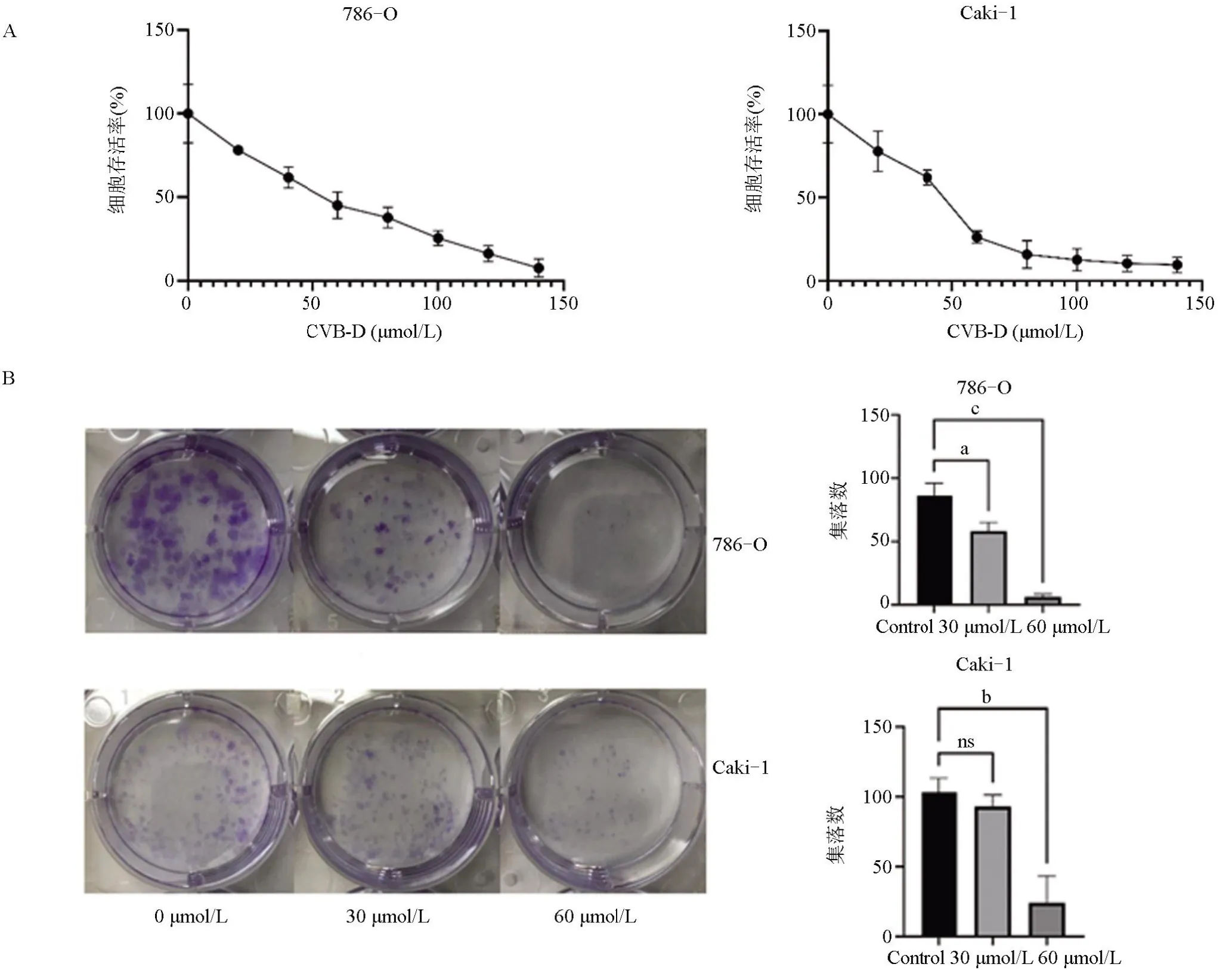
图4 黄杨碱对肾癌细胞的抑制作用Figure 4 Inhibitory effect of CVB-D on RCC
2.6 黄杨碱对786-O和Caki-1细胞形态学的影响在显微镜下可观察到,空白对照组肾癌细胞786-O、Caki-1正常增殖,形态饱满,细胞间连接紧密。黄杨碱30μmol/L、60μmol/L组可见细胞数量明显减少,细胞皱缩且变得圆滑,悬浮细胞数量明显增多。提示黄杨碱对肾癌细胞有抑制作用,如图5所示。

图5 光镜下观察黄杨碱作用前后细胞形态的变化Figure 5 Morphological changes of cells observed under light microscope before and after treatment with CVB-D
2.7 黄杨碱能诱导786-O、Caki-1细胞凋亡根据网络药理学分析结果,发现黄杨碱可能参与诱导细胞凋亡,进而抑制肾癌细胞增殖。因此,本探究采用流式细胞术探究黄杨碱对肾癌细胞凋亡的影响。黄杨碱处理后786-O和Caki-1细胞早期和晚期凋亡增加(图6A),与网络药理学结果一致。此外,还研究了Bax/Bcl-2的表达,因为它们在细胞凋亡中发挥着重要作用。Western blot结果显示黄杨碱处理肾癌细胞后,抗凋亡的Bcl-2表达降低,促凋亡的Bax表达增加(图6B),表明黄杨碱能促进肾癌细胞凋亡。
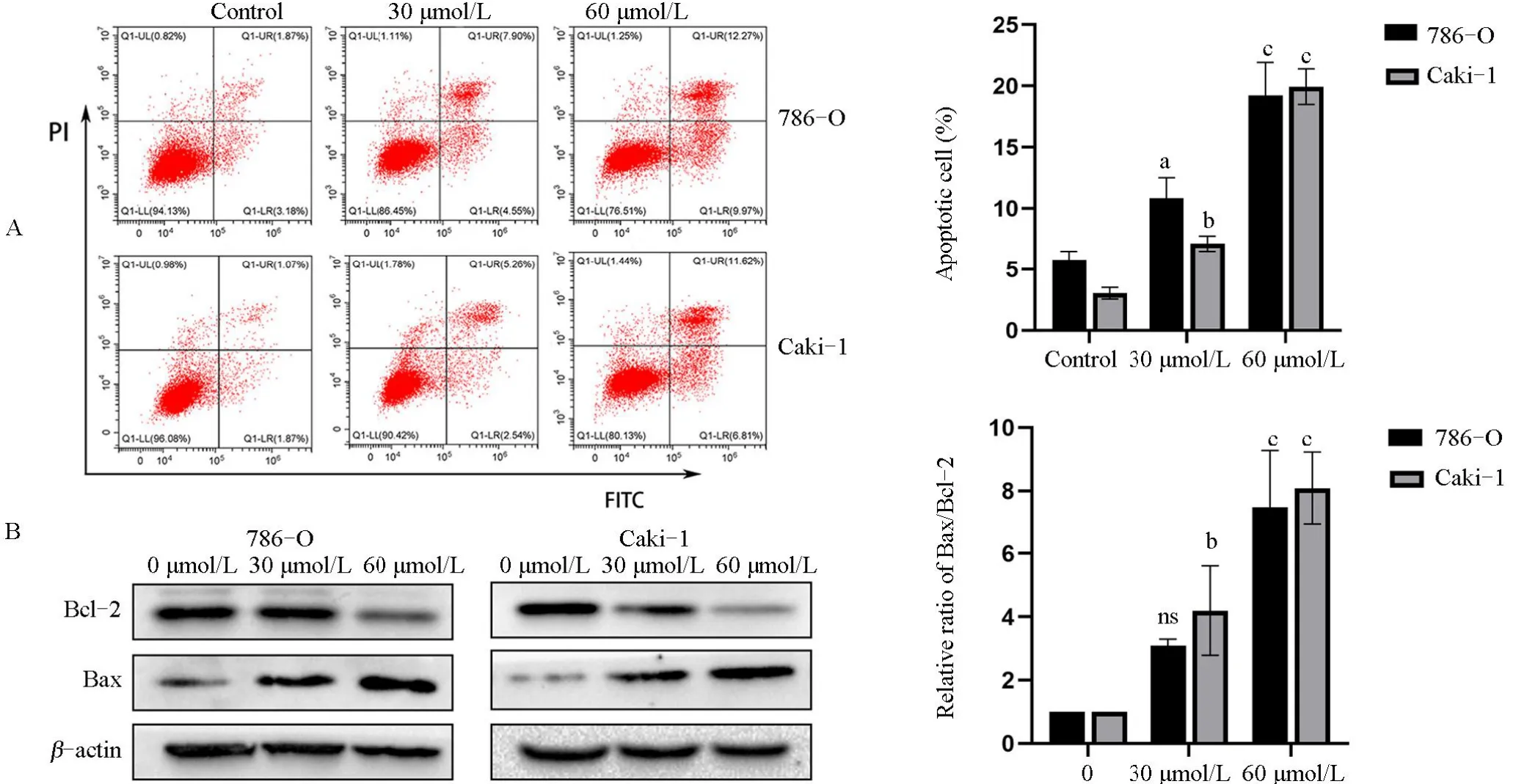
图6 黄杨碱对786-O和Caki-1细胞凋亡的影响Figure 6 Effect of CVB-D on apoptosis of 786-O and Caki-1 cells
2.8 黄杨碱能抑制肾透明细胞癌中EGFR、p-PI3K、p-AKT的表达黄杨碱作用786-O和Caki-1细胞24 h后,与空白对照组比较,CVB-D处理组肾癌细胞的EGFR、p-PI3K、p-AKT蛋白表达明显下调(图7),提示黄杨碱对EGFR、p-PI3K、p-AKT蛋白表达具有抑制作用。
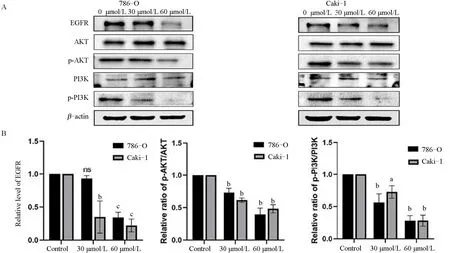
图7 Western blot检测黄杨碱处理786-O和Caki-1细胞后EGFR、p-PI3K、p-AKT的表达Figure 7 Expression of EGFR,P-PI3K,and P-Akt in 786-O and Caki-1 cells treated with CVB-D detected by Western blot
3 讨论
肾细胞癌是最常见的癌症之一,通过手术治疗,局限性肾细胞癌预后较好,但实际临床工作中大多数患者在诊断时已是转移性肾癌。转移性肾细胞癌治疗难度大,主要原因是耐药、反应率低、预后差[5],常规临床治疗效果不理想。因此,迫切需要找到新的治疗方法和药物。
黄杨碱具有多种生物活性,包括抗氧化、抗炎、抗肿瘤等。黄杨碱对多种癌症都有抑制作用,包括结直肠癌[9]、胃癌[10]、乳腺癌[11]、肺癌[13]等。虽然许多研究都提出黄杨碱的抗肿瘤活性,但黄杨碱在肾细胞癌中的详细机制尚未完全阐明。在本研究中,通过预测黄杨碱治疗肾癌潜在靶点得到68个靶基因。基于网络药理分析构建肾细胞癌与黄杨碱之间的蛋白互作网络,获得核心靶点基因ALB、IGF1、AKT1、EGFR、SRC。生信分析结果显示,EGFR在肾癌组织中高表达,ALB、IGF1、AKT1在肾癌组织中低表达;生存分析显示AKT1低表达的患者总生存期较高表达患者短。这表明ALB、IGF1、AKT1、EGFR、SRC参与多种肿瘤发展和信号通路,也表明黄杨碱可能是通过作用于以上靶点从而对肾细胞癌发挥直接或者间接的调控作用。表皮生长因子受体(epidermal growth factor receptor,EGFR)是ErbB家族酪氨酸受体激酶的成员之一,在促进细胞增殖、对抗细胞凋亡方面发挥着重要作用[14-15]。EGFR的扩增和突变已被证明是许多癌症的驱动因素,如非小细胞肺癌[16]、肾癌[17]和基底样乳腺癌[18]等。例如,Smith等[19]发现EGFR可能是hif-2α依赖性肿瘤发生的关键决定因素,也是VHL肾癌治疗的可靠靶点。有报道称,下调EGFR可促进肾癌细胞凋亡,抑制细胞的增殖[20],且本研究中生物信息学分析表明EGFR在肾细胞癌中高表达,故推测黄杨碱可能通过调控EGFR靶点对肾癌细胞起抑制作用。
本研究首次利用网络药理学和生物信息学,具体分析了黄杨碱治疗肾细胞癌的分子机制。GO和KEGG富集分析表明黄杨碱治疗肾透明细胞癌的关键靶点主要涉及凋亡、增殖、自身磷酸化、炎症反应等生物学过程和PI3K-AKT、MAPK、Rap1等信号通路。通过上述分析提示黄杨碱可能通过EGFR-PI3K-AKT通路诱导细胞凋亡在肾细胞癌中发挥作用。体外实验进一步证实黄杨碱的确能抑制786-O和Caki-1细胞活力,促进细胞凋亡,且呈浓度依赖性,与网络药理学预测结果一致。此外,实验发现黄杨碱处理后肾癌细胞系786-O和Caki-1中EGFR的表达降低且磷酸化PI3K、AKT表达降低。因此,本研究推测黄杨碱可能通过调控EGFR的表达抑制PI3K-AKT的磷酸化诱导肾癌细胞凋亡从而抑制肾癌细胞。当然EGFR具体通过什么机制调控PI3K-AKT通路还需要后续研究进一步验证。
综上,通过网络药理学、生物信息学分析和体外实验验证,对黄杨碱治疗肾细胞癌的作用及机制进行预测和验证,表明黄杨碱可能通过多靶点、多途径调控肾细胞癌的进展。本研究,首次证实黄杨碱可能通过抑制EGFR-PI3K-AKT通路促进肾癌细胞凋亡,在肾细胞癌中发挥重要作用,为未来肾细胞癌的进一步研究提供新的思路。
