腹主动脉瘤腔内修复术中髂内动脉的疏与堵
2017-03-23赵珺
赵珺
(上海交通大学附属第六人民医院 血管外科,上海 200233)
髂内动脉,是栓塞还是保持通畅?近20多年来,虽然腹主动脉瘤(abdominal aortic aneurysm,AAA)腔内修复术(endovascular aortic repair,EVAR)在国际范围内的开展越来越广泛,这个问题却一直存有争议。大约16%~30%左右的EVAR中,需要将移植物延伸越过髂内动脉开口,获得髂外动脉锚定区[1-2]。此时需术前进行决策:是栓塞髂内动脉(或者直接覆盖其开口),还是采用各种方法维持髂内动脉正向血流灌注?要回答这个问题,必须首先了解栓塞(或阻断)髂内动脉是否有不良后果?该后果是否难以承受?如果不能承受,如何减少或避免其发生?以下细分各个小题逐一探讨。
1 盆腔血液供应的解剖学研究
当出于治疗病损的目的而需要髂内动脉阻断时,必然会考虑到其供血脏器、范围、以及侧支循环的代偿情况。因此,早在1902年,已经有人注意到闭孔动脉与髂外动脉之间交通支连接并绘制成图(图1)[3]。
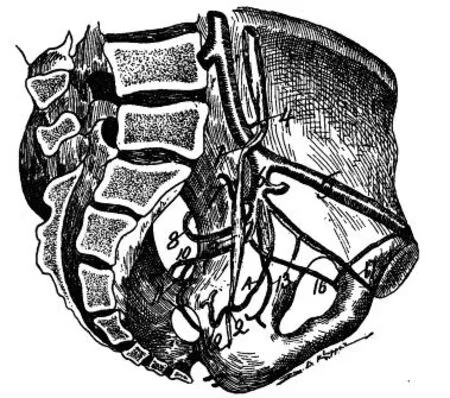
图1 髂内动脉解剖,可见闭孔动脉与髂外动脉之间交通支[3]Figure 1 Anatomy of the hypogastric artery and presence of the communicating branches between the obturator artery and external iliac artery[3]
Adachi在1928年发表了关于髂内动脉的解剖分型,获得广泛应用,而且日本学者[4]直到1998还在解剖大量尸体探讨髂内分型的意义。1952年,解剖学杂志再次刊登了对髂内动脉在Adachi基础上的分型,且体现出了交通的分布(图2)[5]。

图2 图示闭孔动脉与髂外动脉交通[5]Figure 2 Illustration of the communication between the obturator artery and external iliac artery[5]
1968年,Chiat等[6]首次采用动脉造影技术对髂内动脉解剖、分布进行了详细的研究,尤其对侧支循环的交通连接进行了重点观察,发现了髂内动脉系统存在至少12条侧支循环通路,这些通路在髂总或髂内动脉主干阻断后1 s即表现为开放状态。包括:⑴ 最后一对腰动脉→髂腰动脉;⑵ 骶外侧动脉→骶外侧动脉;⑶ 骶正中动脉→骶外侧动脉;⑷ 直肠上动脉→直肠中动脉;⑸ 旋股内侧动脉→臀下动脉;⑹ 旋股内侧动脉→闭孔动脉;⑺ 旋股外侧动脉→臀上动脉;⑻ 旋髂深动脉→臀上动脉;⑼ 旋髂深动脉→髂外动脉;⑽ 最后一对腰动脉→臀上动脉;⑾ 最后一对腰动脉→旋髂深动脉;⑿ 髂腰动脉→旋髂深动脉。虽然还有其他侧支循环通路存在(例如系膜上动脉、系膜下动脉等等),但该研究涵盖了绝大多数盆腔交通支,为结扎或阻断髂内动脉血流提供了坚实的解剖学证据。
2 非血管盆腔手术中髂内动脉结扎及腔内栓塞
早在100年前,英国军队的外科医生就已经报道了多例髂内动脉直接结扎用于臀部和盆腔创伤感染出血案例,无明显并发症发生[7-8]。上世纪60年代以来,妇产科、骨矫形和普外科、肿瘤外科等针对产后大出血或盆腔其他大出血的情况实施了较多的髂内动脉结扎手术[9-12]。1969年,Blackford等[13]首次尝试采用血管腔内技术以微球栓塞髂内动脉。1972年Michael等[14]采用自体血凝块导管内注射的方法栓塞骨盆外伤导致的盆腔大出血,证实了该法是快速微创腔内栓塞止血的有效技术。随后采用各种材料栓塞髂内动脉的报道大量出现,用于盆腔骨折、盆腔肿瘤手术预防和减少出血。包括医用胶[15]、栓塞微球[16]、明胶海绵[17]、弹簧圈[18]等。超选择性髂内动脉分支栓塞的应用也获得了良好效果,例如盆腔出血的分支动脉准确栓塞[19]。虽然少数病例有一定并发症出现[20],但大多获得满意的临床效果。直到近年,该技术还作为临床有效手段在应用中。
3 腹主动脉瘤开放手术中髂内动脉血流栓塞或阻断
在腹主动脉瘤开放手术时代,术后常见严重并发症包括结直肠坏死、臀肌坏死;较轻微并发症包括缺血性结直肠炎、臀肌跛行、性功能障碍等等。还有极少数其他脏器缺血出现。Pittaluga等[21]1998年总结了法国35个中心1 024例腹主动脉瘤开放手术后并发症,发现重建髂内动脉者与不重建者相比,术后结肠缺血分别是0.6%与2.1%,术后臀肌跛行分别为1.2%与1.9%,差别均不显著。当时对术后结直肠缺血比较重视,因而术后统计资料较多,对其发生原因也做了很多观察研究。例如Papadopoulos等[22]1974年报道的282例腹主动脉瘤修复术后,3例发生结肠缺血,其中1例发生于破裂腹主动脉瘤。作者认为,低血容量、低血压、覆膜后渗血是考虑所有可能性后的主要危险因素;而对髂内动脉血流的干扰不会发生明显不良后果。然而Johnston等[23]1988年报道了对666例非破裂性腹主动脉瘤开放手术的回顾性研究,发现当双侧髂内动脉受干扰后腹泻、结肠炎比率增加且有显著性差别。也有发现髂内动脉血流中断后出现严重问题:Iliopoulos等[24]1987年报道了11例主髂动脉重建术并髂内动脉结扎、低灌注、被隔绝、血栓形成的病例,其中髂内动脉结扎的3例患者出现持续性同侧臀肌跛行;其他8例双侧髂内动脉缺血患者中,4例出现臀肌缺血、麻痹无力,2例直肠膀胱括约肌紊乱,3例结直肠缺血。最终5例死亡。而且一旦臀肌坏死出现,100%死亡。这些并发症在主髂股旁路通畅情况下仍然出现。提示保持髂内动脉血流灌注的重要性。Lose等[25]认为主动脉-股动脉旁路术后臀肌及大腿缺血坏死现象虽然常有发生,但旁路通畅情况下,股动脉周围侧支循环破坏可能是缺血坏死最主要原因,强调了股动脉周围侧支循环保留的重要性。Alemany等[26]回顾性分析总结了该单位在1983—1986年间腹主动脉瘤开放手术资料,发现少量患者因髂内动脉灌注不良导致结直肠和臀部并发症甚至死亡,于是开始在1987—1989年的手术中重建髂内动脉血流,结果减少了手术并发症和病死率至少1%~3%。然而Ohshiro等[27]发现,左侧下腹神经丛的保留相较于髂内动脉灌注来说,对性功能的维持更为重要。总体上,开放性腹主动脉瘤手术中,髂内动脉受到干扰或阻断后,虽有盆腔缺血等并发症发生,但比之动脉瘤破裂的严重临床后果,这些并发症率尚能接受。
4 腹主动脉瘤EVAR中髂内动脉阻断或栓塞的后果
腹主动脉瘤EVAR术始于1990年,经过早期10年左右的国际间传播与经验积累,对EVAR中髂内动脉栓塞或血流阻断的后果逐渐有了一批报道。在2000年初,多数报道认为EVAR中阻断或栓塞髂内动脉无严重并发症。Criado等[28]于2000年报道,38例髂内动脉栓塞后约13%发生臀肌跛行,仅1例出现性功能障碍。没有诸如结直肠和臀肌坏死、脊髓缺血等严重并发症发生。其认为只要分期阻断双髂内动脉,不要深入阻断髂内分支,即可避免突然中止髂内动脉供血,因而侧支循环可以代偿。同期Razavi等[29]也发现最常见的2个并发症是臀肌缺血和性功能障碍,分别可以达到28%和12%。不常见的并发症包括结肠缺血、髂腰神经丛病变、膀胱直肠功能紊乱以及臀部会阴组织坏死。年龄与并发症发生率有一定相关性但尚未达到显著性差异。栓塞前经过球囊髂动脉阻断并采用经直肠多普勒探头检测直肠上动脉血流的方法可以预测髂内动脉栓塞是否引起盆腔缺血。而比较性价比,动脉瘤破裂的后果远较臀肌跛行与性功能障碍严重的多,因而髂内动脉栓塞导致的代价是可以接受的。Lee等[30]于2001年报道,大约39%的髂内动脉栓塞后出现臀肌跛行,之后均未恢复到术前活动基线水平。在对比了髂内动脉经腔内栓塞和开放手术结扎的并发症率之后发现,腔内栓塞者并发症率显著高于开放手术结扎者。推测与开放手术后伤口及术野疼痛掩盖了臀肌跛行症状有关。到了近年,有了更多大宗髂内动脉栓塞的临床研究结果。在单组病例报道中,Pavlidis等[31]于2012年发表了43例EVAR中髂内动脉栓塞的病例资料报告,结果52.3%出现臀肌跛行,认为维持盆腔血流通畅的措施必须实施。在综合资料分析报告中,2015年Chitragari等[32]查阅了互联网124篇涉及髂内动脉阻断或干扰其血流的文献,包含各类患者394例。其中妇科相关病例占53.3%,血管外科相关病例占25.1%,创伤相关病例占4.1%。术后总的盆腔缺血症状发生率22.6%,包括臀肌跛行12.2%,臀部坏死4.8%,性功能障碍2.7%,脊髓缺血4%,结肠缺血2.5%,膀胱坏死0.8%。并发症率数据显示,<48.5岁者少于48.5岁以上者;女性少于男性;妇科患者少于血管外科患者;结扎少于栓塞;近端干预少于远端干预。而单侧或双侧干预组无明显差异,栓塞材料种类对比也无差异。妇科手术组中,结扎后并发症少于栓塞。血管外科患者中,双侧栓塞后的并发症率远高于单侧(83.3% vs.30.5%)。肿瘤手术患者中,近端干预的并发症远少于远端干预者(25.5% vs.75.0%)。然而作者认为这些资料仍是回顾性分析且数据尚少,更缺乏随机对照研究的大宗资料,因而髂内动脉干预后导致并发症的真正危险因素仍需进一步探究。2017年Fariva等[33]报道了5 581例EVAR患者中,387例进行了髂内动脉栓塞。发现髂内动脉栓塞后缺血性结肠炎发生率为2.6%,而髂内动脉维持通畅者仅有0.9%,差异显著。
4.1 EVAR中栓塞单侧或双侧髂内动脉的结果
限于病例数量、病例选择、栓塞方法不同的原因,一些报道显示,仅栓塞单侧髂内动脉的结果与栓塞双侧相似。例如Veith团队[34]2001年报道,EVAR后单侧髂内动脉栓塞导致12%出现臀肌跛行,双侧髂内栓塞的数值是11%。两组性功能障碍发生率分别是9%和13%。表明单侧或双侧髂内动脉栓塞所导致的后果无显著性差异,总体后果也可接受。Rayt等[35]2008年报道了多中心634例髂内动脉栓塞结果显示,单侧髂内动脉栓塞者发生臀肌跛行31%,双侧者35%,无显著性差异;性功能障碍在栓塞单侧髂内动脉后为17%,双侧为24%,无显著性差异。但多数学者仍持审慎态度。Schoder[1]2001年报道了EVAR中髂内动脉栓塞46例,其中单侧36例,双侧10例。两组的臀肌跛行发生率分别为36.1%和80%,差异显著。2016年Kouvelos等[36]总结分析了30个报道中1 468例髂内动脉栓塞病例资料,30 d的臀肌跛行率为:双侧栓塞36.5%,单侧27.2%,差异显著。
4.2 EVAR中栓塞髂内动脉近端和远端的结果
2000年Cynamon等[37]报道了髂内动脉近端与分叉或分支内栓塞的临床结果的不同之处。他们发现,如果将弹簧圈置于髂内动脉近端,约10%出现臀肌跛行。如果弹簧圈置于髂内动脉分叉或分支内,约55%出现臀肌跛行。2003年Kritpracha等[38]报道髂内动脉近端栓塞仅有13%出现臀肌跛行;髂内动脉远端栓塞可导致75%出现臀肌跛行。也有资料显示,近端栓塞也不一定能更好地预防盆腔缺血。例如,2008年Farahmand等[39]的147例髂内动脉栓塞的资料显示,近端栓塞后,髂内动脉远端可出现延伸至分支动脉的血栓,从而导致二级分支及侧支循环阻断,同样会出现臀肌缺血症状。
4.3 EVAR中髂内动脉致密栓塞与疏松栓塞的结果
Cynamon等[37]在早期的髂内栓塞操作中,除了注意弹簧圈置放位置,也尝试了疏松栓塞的方式,EVAR术后即时造影存在髂内动脉正向血流者达41%,但并未增加2型内漏的几率。相反,Farahmand等[39]的报道中,该团队通常采用5~10只弹簧圈行致密栓塞,栓塞终止的指征是造影时髂内动脉正向血流完全消失。他们598例EVAR中,147(24.6%)需要单侧或双侧髂内动脉栓塞,最终臀肌缺血达50.0%,新发性功能障碍19.6%。回归分析表明,臀肌缺血的独立危险因素是髂内动脉栓塞。
4.4 EVAR中髂内动脉栓塞材料的选择
目前缺乏不同栓塞材料用于髂内动脉的对照研究,临床回顾性分析仅作为借鉴。Karch等[40]于2000年已经注意到,用于髂内动脉栓塞,弹簧圈比颗粒状或可溶性物质更好。可以更容易置放于髂内动脉近端而非远端或分支,甚至末梢,可减少对侧支循环的干扰,减少远端组织的缺血。目前多数临床报告以弹簧圈栓塞为主[28-38]。Warein等[41]2016年的多中心研究报告显示,169例实施封堵子(plug)栓塞髂内动脉,总的臀肌缺血率为24.3%。
4.5 EVAR中髂内动脉栓塞与开口直接覆盖的结果
2002年Wyers等[42]报道了204例EVAR中,33例需将覆膜支架延伸跨越髂内动脉开口至髂外动脉。其中67%直接跨越,33%先栓塞髂内动脉。两组臀肌缺血分别为27%和45%。后者还出现了1例臀肌坏死和神经坏死性病变。认为只要术前仔细通过CT评估局部动脉解剖情况并小心选择病例,高达67%的髂内动脉可以不用栓塞而直接覆盖即可。Farahmand等[39]的595例EVAR中,147例需阻断髂内动脉血流,其中75%的病例采用了栓塞髂内动脉,25%直接覆盖髂内动脉开口。术后1个月,42%的栓塞者有臀肌跛行,未栓塞而覆盖髂内动脉开口者仅有8%。2011年Papazoglou等[43]报道了117例EVAR中,延长腿仅跨越髂内动脉开口而不进行髂内动脉栓塞,平均观察期超过34个月。发现臀肌坏死0.8%,臀肌跛行12.9%,二期干预16.3%,8.5%出现2型内漏。作者认为该方法安全有效,并发症不高,再干预率可接受。2017年Kontopodis等[44]综述了8个研究报告,284例EVAR中采用髂动脉延长支直接遮盖髂内动脉开口,255例先栓塞髂内动脉再延长。两者盆腔缺血并发症率分别为6%和29%,差异显著。而两组间2型内漏差别不大。
既然直接覆盖髂内动脉开口比栓塞髂内动脉并发症率低,为何还有如此多的栓塞病例?显然实施栓塞者有出于担心2型内漏的考虑。
5 针对髂内动脉栓塞进行的盆腔血流动力学应用研究
前述大批文献资料已经提示,阻断髂内动脉血流,将引起盆腔多种并发症,即使致命的并发症率并不高,许多报道[1,30,32,37]显示臀肌跛行与男性患者性功能障碍发生率却非常高。而之前多年实施的开放手术中髂内动脉结扎临床结果正相反,极低的并发症率完全可以接受。是否栓塞导致了盆腔独特的血流动力学改变?故而相关研究从最初的单纯了解解剖形态进入了盆腔血流动力学改变的观察。Queral等[45]于1979年通过观察研究主髂股动脉血管重建手术方式后得出结论,股深动脉的通畅对盆腔脏器血供,尤其是术后性功能的维持有重要意义。术前发现股深动脉狭窄达到50%者,术中髂内动脉阻断后,更有可能出现盆腔脏器缺血表现。Pierce等[46]1982年总结主-股动脉手术方式优劣后指出,髂外动脉的盆腔侧支是髂内动脉结扎后的主要代偿动脉,对维持盆腔脏器血供意义重大。Iliopoulos等[47]在1989年发表了非常有意义的盆腔血流动力学临床试验结果。10例腹主动脉分叉人工血管置换术中,阻断髂内动脉并测定髂内动脉阻断点以远阻断前后的最高收缩压比值,并分别设置不同组合的阻断情形,例如同侧/对侧髂内动脉阻断,同侧髂内和/或髂外动脉阻断,单独阻断髂内动脉等等。结果发现,同侧髂外动脉的阻断对髂内动脉反流压的影响最大(图3-4),总体上同侧的侧支循环对髂内动脉血流的贡献超过对侧的交叉循环。Lin等[48]于2002年即在手术中发现,如果EVAR术中股动脉解剖完成后顺带做一个股深动脉成形术,有一定防止盆腔缺血的正面意义。
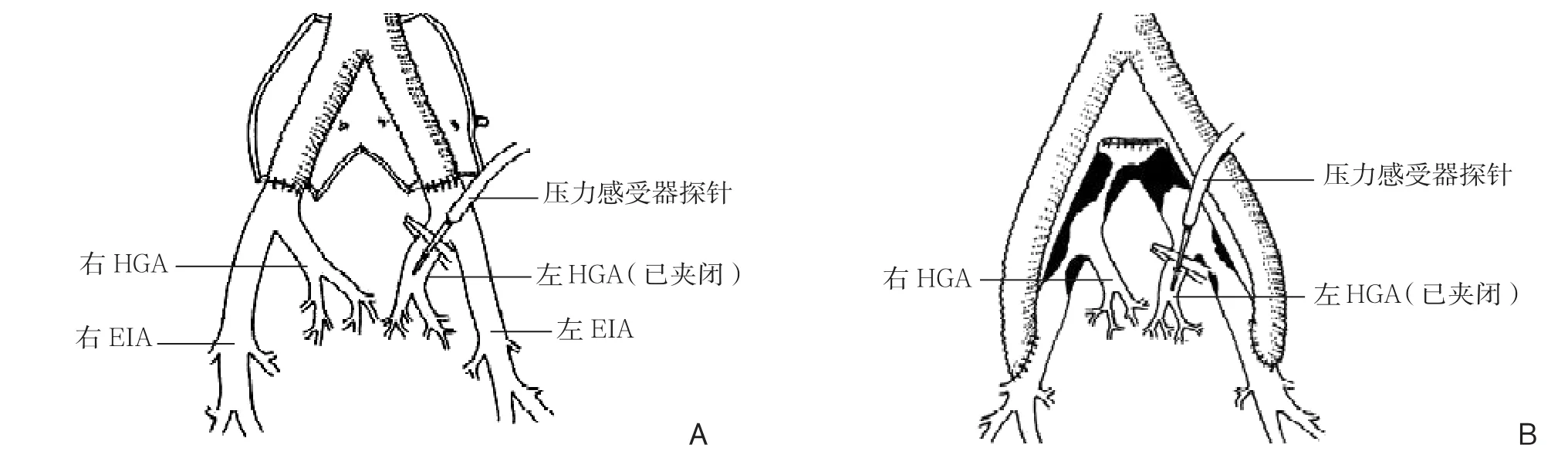
图3 术中设置不同阻断的组合测定阻断前后压力[47] A:主髂动脉瘤患者行主动脉转流术后;B:主髂动脉闭塞患者行主动脉-双侧股动脉转流术后Figure 3 Measurement of pressures before and after combinations of different occlusions[47] A: Patient with aortoiliac aneurysm undergoing aortic bypass procedure; B: Patient with aortoiliac occlusive disease undergoing aortobifemoral bypass procedure

图4 不同阻断模式对盆腔血流供应的影响[47]Figure 4 Influences of different occlusion patterns on blood supply to the pelvic cavity[47]
6 导致盆腔缺血的危险因素分析
Yano等[49]在2001年对盆腔缺血危险因素进行了理性总结。通过分析103例髂内动脉栓塞的资料,探寻导致盆腔缺血的危险因素。发现EVAR前造影过程中如果出现以下三种情形,表明有髂内动脉栓塞后盆腔缺血可能,甚至有结肠坏死等严重并发症风险:对侧髂内动脉开口超过70%狭窄、3支或更多支髂内动脉分支未显影、股动脉升支(与盆腔或臀部动脉的交通支)不充盈或有病变,就是说,动脉病变本身对结肠缺血的贡献度要大于栓塞髂内动脉的行为。Farahmand[39]的大宗髂内动脉栓塞病例中,臀肌跛行出现率达50%,即使术后6个月,也仍有34%存在症状。其分析了长期臀肌跛行的各种因素,注意到患者年轻以及左心室功能减退是其危险因素。年轻人更加易动,于是对臀肌跛行症状感受较明显。老年人活动少,察觉臀肌跛行也较少。而经计算,左心室功能减退者臀肌跛行发生率是正常者的4.5倍。显而易见,因心脏射血减少后,如果同侧髂内动脉栓塞,盆腔获得的血液更少,更易出现缺血症状。有趣的是,糖尿病患者术后臀肌跛行较少。作者分析可能为该类患者本身活动多有受限,因而臀肌跛行症状感受不明显。 还有学者发现盆腔神经丛对盆腔缺血也有贡献。例如Flanigan等[50]1982年报道,通过保护神经措施下分离动脉、重建盆腔血流,可使术前性功能障碍者中的30%重新获得性功能。
6.1 结肠缺血的主要危险因素
结肠缺血是EVAR后少见但危及生命的严重并发症。许多作者发现该并发症与髂内动脉血流阻断的单一因素无关。Gerhart等[51]1994年报道了开放腹主动脉瘤修复术后结肠缺血危险因素分析结果。经过筛选15个危险因素后,发现破裂性腹主动脉瘤、凝血功能紊乱、手术中低血压是3个最主要的危险因素,出现1个时结肠缺血发生可能性为10%,出现2个时达50%,3个都出现时超过90%的可能性出现结肠缺血并发症。2001年Dadian等[52]报道了278例EVAR资料,其中109例进行了单侧髂内动脉栓塞,13例进行了双侧髂内动脉栓塞。结肠缺血发生8例(2.9%),其中3例死亡,且发现广泛微血栓证据(结肠、皮下、肾脏、小肠、下肢);而仅1例发生于单侧髂内动脉栓塞,无双侧栓塞者。其余121例无论单侧还是双侧髂内动脉栓塞者,均无结肠缺血发生,认为EVAR后结肠缺血与髂内动脉干预无关,微血栓是结肠缺血的主要原因。2008年Becquemin等[53]总结了1 174例肾下腹主动脉瘤手术资料,其中开放手术682例,EVAR 492例。总的结肠缺血发生率2.9%,1月内病死率达53%。术后2年,结肠缺血组存活率为35%,非缺血组86%。经分析,腹主动脉瘤破裂、手术时间长、术前血肌酐> 200 mol/L为结肠缺血的独立危险因素。开放或腔内的手术方式区别未造成结肠缺血发生率的显著性差异。2004年,Zhang等[54]报道的702例EVAR中,10例出现结肠缺血,其中并存小肠缺血6例。总体发生率与开放手术相似,但并存6例小肠缺血者中,腹主动脉瘤颈部并存附壁血栓者5例,而6例患者全部未能存活。病理检查发现结肠节段性、跳跃性、补片性缺血灶,提示微栓塞可能是导致肠道缺血坏死的主因。2010年Adovasio等[55]报道了类似的结果。255例EVAR资料中,6例(2.4%)出现结肠缺血坏死,发现其中3例是由微栓引起。然而也有显示髂内动脉栓塞的确与结肠缺血相关。2017年Farivar等[33]调阅了美国国家外科质量提高计划项目中5 881例EVAR资料,其中6.6%(387例)同时进行了髂内动脉栓塞,术后结肠缺血2.6%,未栓塞组0.9%;统计显示髂内动脉栓塞是导致结肠缺血的独立危险因素。其增加了结肠缺血率与术后肾功能减退需透析的几率,提示EVAR中应该尽量保持髂内动脉通畅。Lee[30]曾指出,休克、使用血管收缩药物、动脉硬化闭塞才是真正导致结肠缺血坏死的元凶。亦有如Becquemin的分析,腹主动脉瘤破裂、手术时间长、术前血肌酐> 200 mol/L为结肠缺血的独立危险因素。开放或腔内手术方式的区别未造成结肠缺血发生率的显著性差异[53]。由上可知,术中对血栓形成的预防是十分重要的措施。
7 结 论
综上所述,人体的盆腔血液供应是一套复杂的系统,其中一条甚至多条通路受阻对盆腔脏器组织血供影响并不很大。例如,妇科大出血、骨盆骨折广泛出血、盆腔晚期肿瘤广泛切除等情形,结扎单侧髂内动脉甚至同时结扎双侧髂内动脉也并没有造成盆腔脏器组织缺血的高发。相反,一些影响全身性或区域性的病理因素的存在,再合并髂内动脉血流通道的阻断,可能才是更加致命的情形。例如,同样是结扎髂内动脉,如果这个措施出现在腹主动脉瘤等血管外科手术中,可能造成的盆腔脏器组织缺血并发症的发生率远高于前述非血管病的情形。原因可能在于,除了腹主动脉、髂动脉存在的靶血管病变,血管外科患者往往有高龄、广泛动脉硬化以及脏器功能呈边缘状态的情形。似乎不合情理的是近年广泛开展的微创手术,以EVAR为代表,居然在简单的栓塞髂内动脉后导致了比传统开放巨创手术更多的盆腔缺血并发症。这似乎是一个悖论,然而广泛分析近年各地的报道后可知,微创腔内手术在极大缩小了手术切口、极大减小了手术创伤的同时,更多的是减少了患者的痛苦。EVAR经过多年的实践与传播,已经深入人心,对其微创结果又赋予了极高的期望值。另外,许多难以承受手术的情形,比如伴随严重动脉硬化狭窄、心肺肾功能差、病情复杂、手术时间长、手术风险高,往往采用微创的EVAR技术进行治疗。而此时盆腔脏器血液供应原本处于边缘状态甚至恶化状态,如果叠加一个髂内动脉栓塞的情形,极有可能诱发或加重盆腔缺血表现,或将隐性缺血变为显性缺血。因此,即使非血管性盆腔手术至今仍在“毫无顾忌”地采用髂内动脉结扎或栓塞技术,针对腹主动脉和髂动脉病变的血管外科患者,无论是开放还是腔内微创手术,都应尽量保持髂内动脉通畅,即使在某些条件下必须栓塞髂内动脉,也应尽量做到以下措施:术前尽量改善患者基本情况;术前详细CTA评估髂内动脉各分支以及拟栓塞侧的髂股动脉分支;尽量避免双侧阻断髂内动脉;尽量采用弹簧圈、栓塞子栓塞,而不是其他颗粒或液体物质;尽量栓塞髂内动脉主干近端;尽量不栓塞髂内动脉,可将弹簧圈置于髂总动脉内的髂内动脉开口处;尽量保留髂股动脉的侧支动脉,如旋髂内外侧动脉,推荐穿刺完成EVAR操作;如股总、股浅动脉硬化严重,尤其是股深动脉开口狭窄,尽量做股深动脉成形术;术中肝素化;术中注意防止持续性低血压;术后常规采用抗凝抗血小板措施;术后常规使用血管活性药物。
[1]Schoder M, Zaunbauer L, Hölzenbein T, et al.Internal iliac artery embolization before endovascular repair of abdominal aortic aneurysms: frequency, efficacy, and clinical results[J].AJR Am J Roentgenol, 2001, 177(3):599–605.
[2]Fatima J, Correa MP, Mendes BC, et al.Pelvic revascularization during endovascular aortic aneurysm repair[J].Perspect Vasc Surg Endovasc Ther, 2012, 24(2):55–62.doi: 10.1177/153100351246 8036.
[3]Robinson B.II.Note on the Distribution of the Branches of the Internal Iliac Artery and the Zones of Exsanguination Resulting from its Deligation[J].Ann Surg, 1902, 35(2):189–206.
[4]Yamaki K, Saga T, Doi Y, et al.A statistical study of the branching of the human internal iliac artery[J].Kurume Med J, 1998,45(4):333–340.
[5]Braitwaite JL.Variations in origin of the parietal branches of the internal iliac artery[J].J Ana, 1952, 86(4):423–430.
[6]Chait A, Moltz A, Nelson JH Jr, et al.The collateral arterial circulation in the pelvis.An angiographic study[J].Am J Roentgenol Radium Ther Nucl Med, 1968, 102(2):392–400.
[7]Shepherd WM.Treatment of secondary haemorrhage from the buttock by ligature of the internal iliac artery[J].Br Med J, 1917,2(2970):718–719.
[8]Scott RL, McLachlan AR.Ligature of the right internal iliac artery for secondary hæmorrhage from the buttock[J].Lancet,1916, 188(4856):559–560.doi: http://dx.doi.org/10.1016/S0140–6736(01)27647–8.
[9]Binder SS, Mitchell GA.The control of intractable pelvic hemorrhage by ligation of the hypogastric artery[J].South Med J,1960, 53:837–843.
[10]Siegel P, Mengert WF.Internal Iliac Artery Ligation in Obstetrics and Gynecology[J].Jama, 1961, 178(11):1059–1062.doi:10.1001/jama.1961.03040500001001.
[11]Reich WJ, NechtowMJ.Ligation of the internal iliac arteries.A life-saving procedure in uncontrollable gynecologic and obstetric hemorrhage[J].J Mich State Med Soc, 1962, 61:1478–1481.
[12]Le Cocq F Jr.Internal iliac artery ligation[J].Am J Obst Gyneco,1966, 95(3):320–326.
[13]Blackford J, Bowers JD, Taylor PH, et al.Pellet embolism to the internal iliac artery[J].Am J Surg, 1969, 118(3):469–471.
[14]Michael NM, Ernest JR, Arthur C W, et al.Arteriography in the Management of Hemorrhage from Pelvic Fractures.N Engl J Med 1972; 287:317–321.
[15]Athanasoulis CA, Waltman AC, Barnes AB, et al.Angiographic control of pelvic bleeding from treated carcinoma of the cervix[J].Gynecol Oncol, 1976, 4(2):144–150.
[16]Smith DC, Wyatt JF.Embolization of the hypogastric arteries in the control of massive vaginal hemorrhage[J].Obst Gyneco, 1977,49(3):317–322.
[17]Lang EK, Deutsch JS, Goodman JR, et al.Transcatheter embolization of hypogastric branch arteries in the management of intractable bladder hemorrhage[J].J Urol, 1979, 121(1):30–36.
[18]Tisnado J, Beachley MC, Cho SR, Transcatheter embolization of the internal pudendal artery for control of massive perineal bleeding[J].Cardiovasc Intervent Radiol, 1980, 3(3):187–189.
[19]Heaston DK, Mineau DE, Brown BJ, et al.Transcatheter arterial embolization for control of persistent massive puerperal hemorrhage after bilateral surgical hypogastric artery ligation[J].AJR Am J Roentgenol, 1979, 133(1):152–154.
[20]Braf ZF, Koontz WW Jr.Gangrene of bladder.Complication of hypogastric artery embolization[J].Urology, 1977, 9(6):670–671.
[21]Pittaluga P, Batt M, Hassen-Khodja R, et al.Revascularization of internal iliac arteries during aortoiliac surgery: a multicenter study[J].Ann Vasc Surg, 1998, 12(6):537–543.
[22]Papadopoulos CD, Mancini HW, Marino AW Jr.Ischemic necrosis of the colon following aortic aneurysmectomy.Collective review and case reports[J].J Cardiovasc Surg (Torino), 1974, 15(4):494–500.
[23]Johnston KW, Scobie TK.Multicenter prospective study of nonruptured abdominal aortic aneurysms.I.Population and operative management[J].J VascSurg, 1988, 7(1):69–81.
[24]Iliopoulos JI, Howanitz PE, Pierce GE, et al.The critical hypogastric circulation[J].Am J Surg, 1987, 154(6):671–675.
[25]Lose G, Jørgensen L, Lorentzen JE.Regional ischemia due to compromised collateral circulation after arterial reconstruction[J].Acta Chir Scand, 1985, 151(3):301–303.
[26]Alemany J, Marsal T, Reim T.Importance of the revascularization of the hypogastric artery in reconstruction of infrarenal aortic aneurysms[J].Vasc Surg, 1999, 25:587–594.
[27]Ohshiro T, Kosaki G.Sexual function after aorto-iliac vascular reconstruction.Which is more important, the internal iliac artery or hypogastric nerve?[J].J Cardiovasc Surg (Torino),1984, 25(1):47–50.
[28]Criado FJ, Wilson EP, Velazquez OC, et al.Safety of coil embolization of the internal iliac artery in endovascular grafting of abdominal aortic aneurysms[J].J Vasc Surg, 2000, 32(4):684–688.
[29]Razavi MK, DeGroot M, Olcott C 3rd, et al.Internal iliac artery embolization in the stent-graft treatment of aortoiliac aneurysms:analysis of outcomes and complications[J].J Vasc Int Radio, 2000,11(5):561–566.
[30]Lee WA, O'Dorisio J, Wolf YG, et al.Outcome after unilateral hypogastric artery occlusion during endovascular aneurysm repair[J].J Vasc Surg, 2001, 33(5):921–926.
[31]Pavlidis D, Hörmann M, Libicher M, et al.Buttock claudication after interventional occlusion of the hypogastric artery--a mid-term follow-up[J].Vasc Endovascular Surg, 2012, 46(3):236–241.doi:10.1177/1538574411436329.
[32]Chitragari G, Schlosser FJ, Ochoa Chaar CI, et al.Consequences of hypogastric artery ligation, embolization, or coverage[J].J Vasc Surg, 2015, 62(5):1340–1347.doi: 10.1016/j.jvs.2015.08.053.
[33]Farivar BS, Kalsi R, Drucker CB, et al.Implications of concomitant hypogastric artery embolization with endovascular repair of infrarenal abdominal aortic aneurysms[J].J Vasc Surg, 2017,66(1):95–101.doi: 10.1016/j.jvs.2016.10.124.
[34]Mehta M, Veith FJ, Ohki T, et al.Unilateral and bilateral hypogastric artery interruption during aortoiliac aneurysm repair in 154 patients: a relatively innocuous procedure[J].J Vasc Surg, 33(2 Suppl):S27–32.
[35]Rayt HS, Bown MJ, Lambert KV, et al.Buttock claudication and erectile dysfunction after internal iliac artery embolization in patients prior to endovascular aortic aneurysm repair[J].Cardiovasc Intervent Radiol, 2008, 31(4):728–734.doi: 10.1007/s00270–008–9319–3.
[36]Kouvelos GN, Katsargyris A, Antoniou GA, et al.Outcome after Interruption or Preservation of Internal Iliac Artery Flow During Endovascular Repair of Abdominal Aorto-iliac Aneurysms[J].Eur J Vasc Endovasc Surg, 2016, 52(5):621–634.doi: 10.1016/j.ejvs.2016.07.081.
[37]Cynamon J, Lerer D, Veith FJ, et al.Hypogastric artery coil embolization prior to endoluminal repair of aneurysms and fistulas:buttock claudication, a recognized but possibly preventable complication[J].J Vasc Interv Radiol, 2000,11(5):573–577.
[38]Kritpracha B, Pigott JP, Price CI, et al.Distal internal iliac artery embolization: a procedure to avoid[J].J Vasc Surg, 2003,37(5):943–948.
[39]Farahmand P, Becquemin JP, Desgranges P, et al.Is hypogastric artery embolization during endovascular aortoiliac aneurysm repair(EVAR) innocuous and useful?[J].Eur J Vasc Endovasc Surg,35(4):429–435.doi: 10.1016/j.ejvs.2007.12.001.
[40]Karch LA, Hodgson KJ, Mattos MA, et al.Adverse consequences of internal iliac artery occlusion during endovascular repair of abdominal aortic aneurysms[J].J VascSurg, 2000, 32(4):676–683.
[41]Warein E, Feugier P, Chaufour X, et al.Amplatzer Plug to Occlude the Internal Iliac Artery During Endovascular Aortic Aneurysm Repair: A Large Multicenter Study[J].Eur J Vasc Endovasc Surg,2016, 51(5):641–646.doi: 10.1016/j.ejvs.2015.12.021.
[42]Wyers MC, Schermerhorn ML, Fillinger MF, et al.Internal iliac occlusion without coil embolization during endovascular abdominal aortic aneurysm repair[J].J Vasc Surg, 2002, 36(6):1138–1145.
[43]Papazoglou K, Sfyroeras GS, Zambas N, et al.Long term outcomes after coverage of the internal iliac artery without coil embolization during abdominal aortic aneurysm endovascular repair[J].J Vasc Surg, 2011, 53(6 Supple):S42.doi: http://dx.doi.org/10.1016/j.jvs.2011.03.089.
[44]Kontopodis N, Tavlas E, Papadopoulos G, et al.Embolization or Simple Coverage to Exclude the Internal Iliac Artery During Endovascular Repair of Aortoiliac Aneurysms? Systematic Review and Meta-analysis of Comparative Studies[J].J Endovasc Ther,2017, 24(1):47–56.doi: 10.1177/1526602816677962.
[45]Queral LA, Whitehouse WM Jr, Flinn WR, et al.Pelvic hemodynamics after aortoiliac reconstruction[J].Surgery, 1979,86(6):799–809.
[46]Pierce GE, Turrentine M, Stringfield S, et al.Evaluation of endto-side vs end-to-end proximal anastomosis in aortobifemoral bypass[J].Arch Surg, 1982, 117(12):1580–1588.
[47]Iliopoulos JI, Hermreck AS, Thomas JH, et al.Hemodynamics of the hypogastric arterial circulation[J].J Vasc Surg, 1989, 9(5):637–641.
[48]Lin PH, Bush RL, Chaikof EL, et al.A prospective evaluation of hypogastric artery embolization in endovascular aortoiliac aneurysm repair[J].J Vasc Surg, 2002, 36(3):500–506.
[49]Yano OJ, Morrissey N, Eisen L, et al.Intentional internal iliac artery occlusion to facilitate endovascular repair of aortoiliac aneurysms[J].J VascSurg, 2001, 34(2):204–211.
[50]Flanigan DP, Schuler JJ, Keifer T, et al.Elimination of iatrogenic impotence and improvement of sexual function after aortoiliac revascularization[J].Arch Surg, 1982, 117(5):544–550.
[51]Gerhart CD, Nicholas GG, Reed JF.Predictive model for colonic ischemia following abdominal aortic aneurysm repair[J].Vasc Endovasc Surg, 1994, 28(3):161–166.
[52]Dadian N, Ohki T, Veith FJ, et al.Overt colon ischemia after endovascular aneurysm repair: the importance of microembolization as an etiology[J].J Vasc Surg, 2001, 34(6):986–996.
[53]Becquemin JP, Majewski M, Fermani N, et al.Colon ischemia following abdominal aortic aneurysm repair in the era of endovascular abdominal aortic repair[J].J Vasc Surg, 2008,47(2):258–263.doi: 10.1016/j.jvs.2007.10.001.
[54]Zhang WW, Kulaylat MN, Anain PM, et al.Embolization as cause of bowel ischemia after endovascular abdominal aortic aneurysm repair[J].J Vasc Surg, 2004, 40(5):867–872.
[55]Adovasio R, Settembre N, Nikolakopoulos K, et al.Colonic ischemia after endovascular abdominal aortic aneurysm repair[J].Ita J Vasc Endovasc Surg, 2010, 17(2):59–63.
