人参皂苷Rh2联合万古霉素对万古霉素耐药型耐甲氧西林金黄色葡萄球菌生物膜和抑菌效果的影响
2023-03-11张霄霄邵海连戈伟汪定成董轲应后群
张霄霄,邵海连,戈伟,汪定成,董轲,应后群
1.中国人民解放军空军军医大学第二附属医院检验科,陕西 西安 710038;
2.南昌大学第二附属医院核医学科,江西 南昌 330006
耐甲氧西林金黄色葡萄球菌(methicillin-resistant Staphylococcus aureus,MRSA)是感染的主要病原菌之一,由于其耐药性的产生,导致临床治疗困难,降低其耐药性是临床治疗的重要途径之一[1]。万古霉素是临床上治疗MRSA的首选药,但其不合理使用会导致耐万古霉素菌株的菌株产生,从而导致MRSA感染的治疗变得十分困难[2]。细菌耐药性与生物膜的形成有关,生物膜是病原体在体内外黏附于物体表面,通过细菌和胞外多聚物、细胞外基质连接形成的高度组织化结构。有研究表明中药具有抗MRSA生物膜产生的作用,可降低其耐药性[3],如桂皮中的桂皮醛、黄芩中的黄芩苷以及人参中的人参皂苷Rh2等。桂皮醛能显著增强万古霉素抗MRSA生物膜的作用[4],黄芩苷能破坏金黄色葡萄球菌生物膜的形成,增强万古霉素对其清除作用[5]。而人参皂苷Rh2是人参的主要有效成分,其不仅有着改善记忆、神经保护等药理作用,还具有抑菌活性和抑菌生物膜的功能[6-7],且人参皂苷Rh2单体能抑制金黄色葡萄球菌生物被膜的形成[8]。本实验旨在研究人参皂苷Rh2联合万古霉素对万古霉素耐药型耐甲氧西林金黄色葡萄球菌生物膜和抑菌效果的影响。
1 材料与方法
1.1 材料
1.1.1 试剂及培养基人参皂苷Rh2购自上海融禾医药科技发展有限公司,批号:150108,纯度:>98%;注射用盐酸万古霉素购自重庆莱美药业股份有限公司,批号:160814,规格:500 mg;胰蛋白胨大豆肉汤培养基(TSB)购自武汉纯度生物科技有限公司,货号:CD-B2007S-PYJ。
1.1.2 仪器及试剂盒逆转录试剂盒及荧光定量PCR试剂盒购自北京百奥莱博科技有限公司,货号:WE0149-NXR;ELX808酶标仪购自美国Bio-Tek公司;BS-MFL-01麦氏比浊仪购自北京金洋万达科技有限公司;Bio-rad分光光度计购自北京赛百奥科技有限公司。
1.2 万古霉素耐药型耐甲氧西林金黄色葡萄球菌的诱导收集本院临床分离并鉴定的耐甲氧西林金黄色葡萄球菌(methicillin-resistant Staphylococcus aureus,MRSA),用接种环挑取单个菌落于含万古霉素浓度为1μg/mL的TSB培养基中,于35℃下培养24 h,选取生长的菌落用下一浓度(比前一次增加1μg/mL)的万古霉素TSB培养基培养,同时每一浓度连续传代4次以稳定万古霉素耐药特征,直至在含16μg/mL的万古霉素的培养上仍能生长的菌落作为万古霉素耐药型耐甲氧西林金黄色葡萄球菌(vancomycinresistant S.aureus,VRSA);原始分离的命名为万古霉素敏感型耐甲氧西林金黄色葡萄球菌(vancomycinsensitive S.aureus,VSSA)。
1.3 细胞处理与分组VRSA分别用10μg/mL、30μg/mL、90μg/mL人参皂苷Rh2处理,作为不同浓度人参皂苷Rh2处理组;VRSA分别用1μg/mL、4μg/mL、16μg/mL万古霉素处理,作为不同浓度万古霉素处理组;10μg/mL人参皂苷Rh2和1μg/mL万古霉素共同作用VRSA记为10μg/mL人参皂苷Rh2+1μg/mL万古霉素组;不作处理的VRSA作为空白对照组;原始分离的对万古霉素敏感型的耐甲氧西林金黄色葡萄球菌作为VSSA组。
1.4 生物膜形成实验挑取单个菌落于4 mL TSB培养基中35℃,120 r/min震荡培养24 h,将菌液调至0.5麦氏浊度,然后吸取10μL至含190μL TSB培养液的96孔板中,35℃培养24 h后每孔用蒸馏水轻轻漂洗3次,干燥固定1 h后加入100μL结晶紫溶液室温染色10 min,蒸馏水洗去过量染料,待干燥后用酶标仪检测590 nm处吸光度值(A),实验重复3次,每次设3个复孔。
1.5 实时荧光定量PCR(RT-qPCR)检测fnbA、atlA表达水平各组菌液培养至对数生长期时用Trizol试剂提取RNA,逆转录后进行PCR,其反应体系总共为25μL,其中EvaGreen 2×qPCR MasterMix-ROX 12.5μL,上下游引物各0.5μL,cDNA 2μL,ddH2O 9.5μL。反应条件为:95℃预变性3 min,94℃变性30 s,60℃退火30 s,72℃延伸30 s,共35个循环。以16s RNA为内参,采用2-△△Ct法计算相对表达量。fnbA上游引物序列:5'-TGGTGTCGGTGGCGTTGGTG-3',下游引物序列:5'-GCGAAGCAGGTCACGTTGGAG-3';atlA上游引物序列:5'-AACAGCACCAACGGATTAC-3',下游引物序列:5'-CATAGTCAGCATAGTTATTCATTG-3';16sRNA上游引物序列:5'-CGTGCTACAATGGACAATACAAA-3',下游引物序列:5'-ATCTACGATTACTAGCGATTCCA-3'。
1.6 菌活性检测各实验组分别挑取单个菌落于TSB培养液中在35℃、120 r/min条件下震荡培养24 h,用分光光度计检测600 nm处吸光度值(A),实验重复3次,每次设3个复孔。
1.7 统计学方法应用SPSS20.0软件进行数据统计学分析。计量资料以均数±标准差(±s)表示,两两比较行两独立样本t检验,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 VSSA组与VRSA组的生物膜形成能力及生物膜形成相关基因比较与VSSA组比较,VRSA组生物膜的光密度值及fnbA、atlA的表达水平均明显升高,差异有统计学意义(P<0.05),见表1。
表1 VSSA组与VRSA组的生物膜形成能力及生物膜形成相关基因比较(±s,n=9)Table 1 Comparison of biofilm formation ability and biofilm formation related genes between VSSA group and VRSA group(±s,n=9)
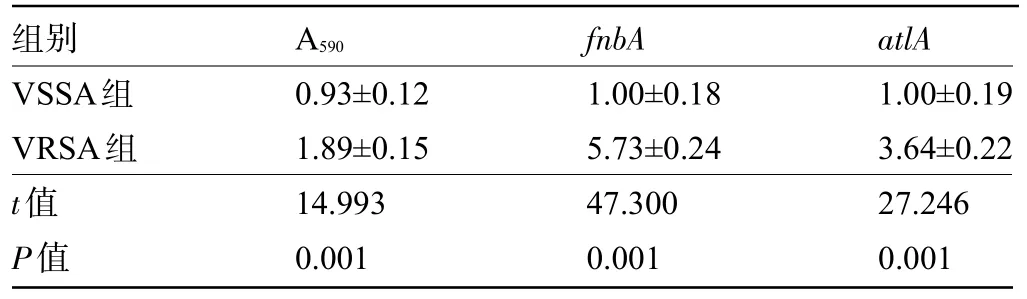
表1 VSSA组与VRSA组的生物膜形成能力及生物膜形成相关基因比较(±s,n=9)Table 1 Comparison of biofilm formation ability and biofilm formation related genes between VSSA group and VRSA group(±s,n=9)
组别VSSA组VRSA组t值P值A 590 0.93±0.12 1.89±0.15 14.993 0.001 fnbA 1.00±0.18 5.73±0.24 47.300 0.001 atl A 1.00±0.19 3.64±0.22 27.246 0.001
2.2 人参皂苷Rh2和万古霉素单用及联用对VRSA增殖活性的影响与空白对照组比较,不同浓度人参皂苷Rh2处理的VRSA增殖活性差异无统计学意义(P>0.05)。16μg/mL万古霉素及10μg/mL人参皂苷Rh2+1μg/mL万古霉素处理的VRSA增殖活性明显降低;而10μg/mL人参皂苷Rh2+1μg/mL万古霉素处理的VRSA增殖活性明显低于不同浓度人参皂苷Rh2处理组,且明显高于4μg/mL万古霉素处理者,差异均有统计学意义(P<0.05),见表2。
表2 人参皂苷Rh2和万古霉素单用及联用对VRSA增殖活性的影响(±s,n=9)Table 2 Effects of Ginsenoside Rh2 and Vancomycin alone and in combination on proliferation of VRSA(±s,n=9)

表2 人参皂苷Rh2和万古霉素单用及联用对VRSA增殖活性的影响(±s,n=9)Table 2 Effects of Ginsenoside Rh2 and Vancomycin alone and in combination on proliferation of VRSA(±s,n=9)
注:与空白对照组比较,a P<0.05,b P<0.05;与10μg/m L人参皂苷Rh2+1μg/mL万古霉素组比较,c P<0.05,d P<0.05,e P<0.05,f P<0.05,g P<0.05。Note:Compared with blank control group,a P<0.05,b P<0.05;Compared with 10μg/mL ginsenoside Rh2+1μg/mL vancomycin group,c P<0.05,d P<0.05,e P<0.05,f P<0.05,g P<0.05.
2.3 不同浓度人参皂苷Rh2对VRSA生物膜形成及相关基因表达的影响与空白对照组比较,不同浓度人参皂苷Rh2处理的VRSA生物膜的光密度值明显降低,fnbA、atlA的表达水平明显降低,差异均有统计学意义(P<0.05),见表3。
表3 不同浓度人参皂苷Rh2对VRSA生物膜形成及相关基因表达的影响(±s,n=9)Table 3 Effects of different concentrations of ginsenoside Rh2 on VRSA biofilm formation and related gene expression(±s,n=9)
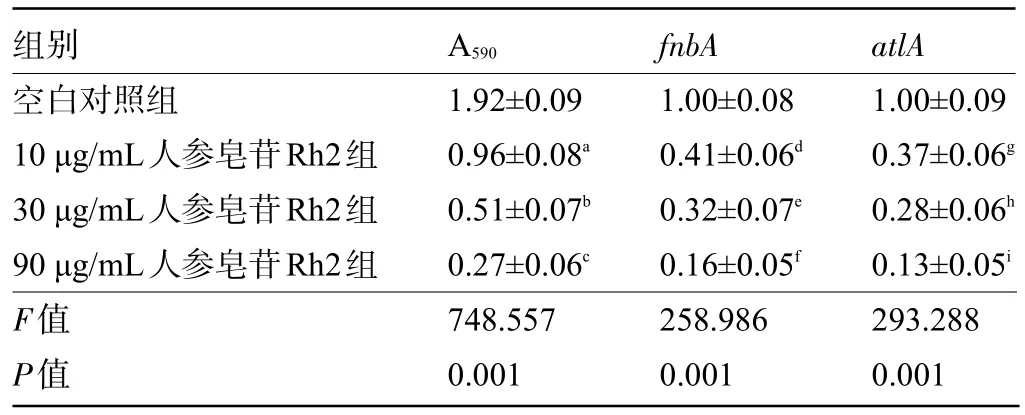
表3 不同浓度人参皂苷Rh2对VRSA生物膜形成及相关基因表达的影响(±s,n=9)Table 3 Effects of different concentrations of ginsenoside Rh2 on VRSA biofilm formation and related gene expression(±s,n=9)
注:与空白对照组比较,a P<0.05,b P<0.05,c P<0.05,d P<0.05,e P<0.05,f P<0.05,g P<0.05,h P<0.05,i P<0.05。Note:Compared with the blank control group,a P<0.05,b P<0.05,c P<0.05,d P<0.05,e P<0.05,f P<0.05,g P<0.05,h P<0.05,i P<0.05.
2.4 不同浓度万古霉素对VRSA生物膜形成及相关基因表达的影响与空白对照组比较,不同浓度万古霉素处理的VRSA中fnbA、atlA表达水平明显升高;4μg/mL和16μg/mL万古霉素处理的VRSA生物膜的光密度值明显升高,差异均有统计学意义(P<0.05),见表4。
表4 不同浓度万古霉素对VRSA生物膜形成及相关基因表达的影响(±s,n=9)Table 4 Effects of different concentrations of vancomycin on VRSA biofilm formation and related gene expression(±s,n=9)
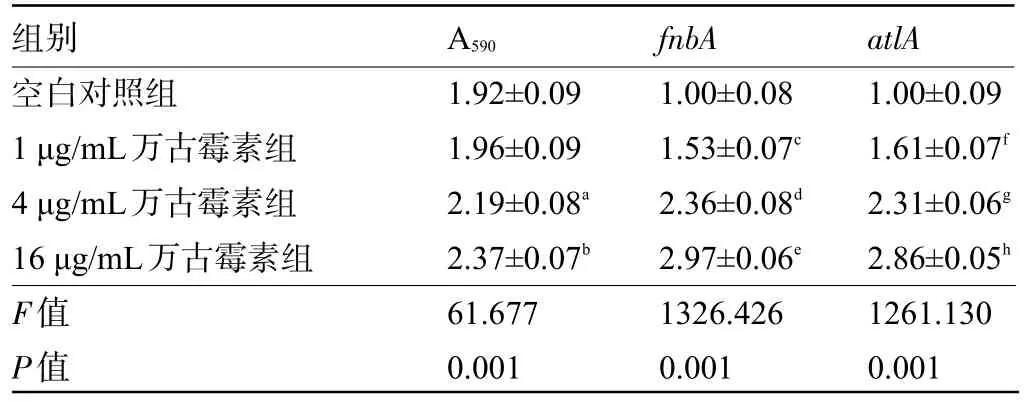
表4 不同浓度万古霉素对VRSA生物膜形成及相关基因表达的影响(±s,n=9)Table 4 Effects of different concentrations of vancomycin on VRSA biofilm formation and related gene expression(±s,n=9)
注:与空白对照组比较,a P<0.05,b P<0.05,c P<0.05,d P<0.05,e P<0.05,f P<0.05,g P<0.05,h P<0.05,i P<0.05。Note:Compared with the blank control group,a P<0.05,b P<0.05,c P<0.05,d P<0.05,e P<0.05,f P<0.05,g P<0.05,h P<0.05,i P<0.05.
2.5 人参皂苷Rh2和万古霉素联用对VRSA生物膜形成及相关基因表达的影响与空白对照组比较,10μg/mL人参皂苷Rh2组及10μg/mL人参皂苷Rh2+1μg/mL万古霉素组VRSA生物膜的光密度值及fnbA、atlA的表达水平明显降低,差异均有统计学意义(P<0.05),而1μg/mL万古霉素组VRSA生物膜的光密度值无显著变化,差异无统计学意义(P>0.05)。fnbA、atlA的表达水平明显升高;10μg/mL人参皂苷Rh2+1μg/mL万古霉素组VRSA生物膜的光密度值及fnbA、atlA的表达水平均明显高于10μg/mL人参皂苷Rh2组,但明显低于1μg/mL万古霉素组,差异均有统计学意义(P<0.05),见表5。
表5 人参皂苷Rh2和万古霉素联用对VRSA生物膜形成及相关基因表达的影响(±s,n=9)Table 5 Effects of ginsenoside Rh2 combined with vancomycin on VRSA biofilm formation and related gene expression(±s,n=9)
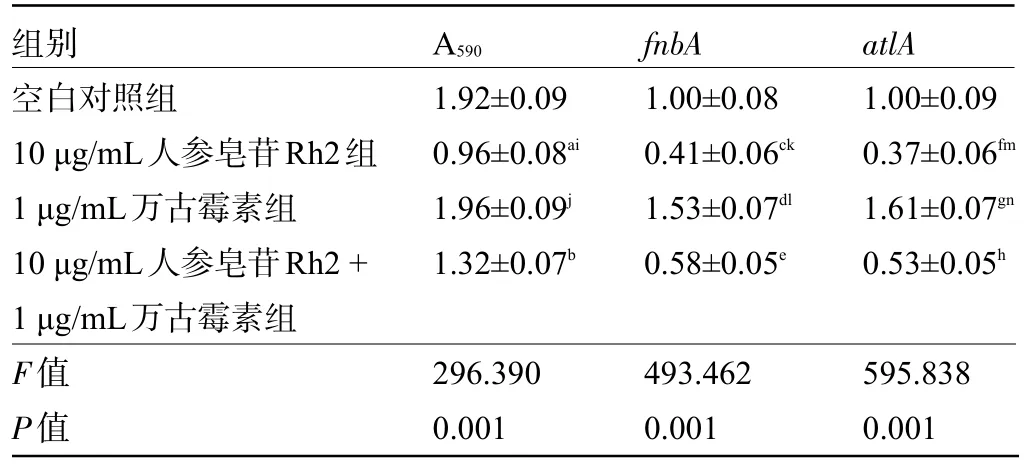
表5 人参皂苷Rh2和万古霉素联用对VRSA生物膜形成及相关基因表达的影响(±s,n=9)Table 5 Effects of ginsenoside Rh2 combined with vancomycin on VRSA biofilm formation and related gene expression(±s,n=9)
注:与空白对照组比较,a P<0.05,b P<0.05,c P<0.05,d P<0.05,e P<0.05,f P<0.05,g P<0.05,h P<0.05;与10μg/mL人参皂苷Rh2+1μg/mL万古霉素组比较,i P<0.05,j P<0.05,k P<0.05,l P<0.05,m P<0.05,n P<0.05。Note:Compared with the blank control group,by LSD-t test,a P<0.05,b P<0.05,c P<0.05,d P<0.05,e P<0.05,f P<0.05,g P<0.05,h P<0.05;And 10μg/mL ginsenoside Rh2+1μg/mL vancomycin group,i P<0.05,j P<0.05,k P<0.05,l P<0.05,m P<0.05,n P<0.05.
3 讨论
MRSA是造成感染的主要病原体,随着抗菌药物的长期使用和滥用,其耐药性日益严重,给临床治疗带来巨大困难,增加MRSA菌株对抗生素的敏感性对临床治疗具有重要意义[9]。生物膜能够阻滞抗生素和机体防御系统对膜内细菌的杀伤,所以生物膜的形成是造成细菌耐药的重要原因,抑制生物膜的形成是增强药物敏感性的重要途径[10]。fnbA基因可以编码fnbA蛋白,fnbA蛋白主要负责金黄色葡萄球菌与宿主细胞和细胞外基质进行黏附和生物被膜的形成。而atlA基因可以编码产生细菌自溶素[11]。本实验通过用不同浓度的万古霉素诱导MRSA形成VRSA,与VSSA比较,VRSA中生物膜的光密度值显著升高,fnbA、atlA表达水平明显升高。说明VRSA的耐药性可能与生物膜形成有关。
万古霉素是MRSA感染患者的一线用药[12]。本实验用1μg/mL、4μg/mL、16μg/mL万古霉素处理VRSA,结果显示,万古霉素可上调fnbA、atlA表达,4μg/mL、16 μg/mL万古霉素可促进生物膜形成。而万古霉素对VRSA抑菌作用较弱,仅浓度为16μg/mL的万古霉素具有较强的抑菌效果。研究发现中药提取物对MRSA具有抑菌作用,可调节其耐药敏感性[13]。研究报道人参皂苷Rb1对金黄色葡萄球菌有一定的抑菌作用,浓度越高抑菌作用越强[14]。人参皂苷对金黄色葡萄球菌生物被膜具有显著的抑制作用,随着药物浓度的增加,其抑制率显著增加[15]。人参皂苷Rh2能在体外抑制致龋菌生物膜形成[16]。人参皂苷Rh2通过抑制NorA联合环丙沙星增强其对金黄色葡萄球菌的抑菌作用[17]。本实验结果显示,不同浓度人参皂苷Rh2对VRSA菌活性无明显影响,但人参皂苷可抑制VRSA生物膜形成和fnbA、atlA表达。说明人参皂苷Rh2可抑制VRSA生物膜形成,但抑菌效果不明显。且本实验用10μg/mL人参皂苷Rh2联合1μg/mL万古霉素作用可抑制VRSA生物膜形成和fnbA、atlA表达,且其比单独万古霉素处理,菌活性降低,说明两者联合作用可增强万古霉素对VRSA的抑菌作用。
综上所述,人参皂苷Rh2可抑制VRSA生物膜形成,但不抑菌;万古霉素可抑菌但不能抑制生物膜形成,而两者联用能抑制生物膜形成且人参皂苷Rh2可增强万古霉素的抑菌作用,其联合作用机制仍有待进一步的研究证实。
