基于蛋白质组学的缺血预适应心肌保护相关机理研究*
2023-03-10尼鲁帕尔谢甫开提阿曼古丽如则唐婧赵翎赵帮豪高晓明
尼鲁帕尔·谢甫开提, 阿曼古丽·如则△, 唐婧, 赵翎, 赵帮豪, 高晓明,2△
基于蛋白质组学的缺血预适应心肌保护相关机理研究*
尼鲁帕尔·谢甫开提1, 阿曼古丽·如则1△, 唐婧1, 赵翎1, 赵帮豪1, 高晓明1,2△
(1省部共建中亚高发病成因与防治国家重点实验室,新疆医科大学第一附属医院心内科,新疆医学动物模型研究重点实验室,新疆 乌鲁木齐 830054;2新疆医科大学临床医学研究院,新疆 乌鲁木齐 830054)
缺血预适应(IPC)是强有力的对抗心肌缺血/再灌注(I/R)损伤的心肌保护措施,但其保护作用相关的机制仍不完全清楚。本研究旨在识别缺血预适应处理后小鼠心肌差异表达蛋白,为缺血预适应进一步的基础及临床研究提供新思路。用雄性成年C57BL/6小鼠建立心肌I/R损伤模型(缺血60 min/再灌注24 h)和IPC模型[3个(缺血5 min/再灌注5 min)循环的预适应+缺血60 min/再灌注24 h],用伊文思蓝和2,3,5-三苯基氯化四氮唑双重染色的方法测量心肌梗死面积。提取各组心肌总蛋白,通过将串联质谱标签、高效液相色谱分级技术以及基于质谱的定量蛋白质组学技术相结合,以差异表达量变化>1.2倍作为显著上调的阈值,<1/1.2作为显著下调的阈值,筛选差异表达蛋白。对差异表达蛋白进行同源蛋白簇功能分类统计。分别用qPCR和Western blot技术对差异显著的蛋白β-羟丁酸脱氢酶1(Bdh1)进行mRNA及蛋白水平上的验证。与单纯I/R组相比,IPC干预后心梗面积降低33%(0.05)。定量蛋白质组学结果显示,与假手术组比较,I/R组表达下调的蛋白有91个,其中酮体氧化代谢关键酶Bdh1在下调蛋白中的表达倍数为0.708(<1/1.2);与I/R组相比,IPC组表达上调的蛋白有14个,其中Bdh1差异表达倍数最高(1.95倍)。qPCR及Western blot验证实验表明,与假手术组相比,I/R组Bdh1的mRNA及蛋白水平明显降低;IPC组Bdh1的mRNA及蛋白表达水平较I/R组明显升高,进一步验证了蛋白组学结果。I/R损伤显著降低心肌Bdh1的mRNA及蛋白表达水平,而IPC处理显著恢复了Bdh1的mRNA及蛋白表达,表明酮体氧化代谢可能参与了缺血预适应介导的缺血心肌的保护。
缺血预适应;缺血再灌注;蛋白质组学;β-羟丁酸脱氢酶1
缺血性心脏病(ischemic heart disease)是当今严重危害人类健康的主要疾病之一,为发达国家和发展中国家导致死亡的主要原因,可以引起心肌梗死、心力衰竭、心律失常及猝死等严重并发症[1]。2019 年在《中国循环杂志》发表的一项研究报告显示,2016年我国居民因心血管疾病死亡人数为397.5万,较1990年增加了近150万,其中缺血性心脏病增加了111.7万[2]。对于心肌缺血性损伤,临床上常采用各种方法及早恢复并重建血流,以便挽救缺血的心肌减少不可逆的心肌坏死。然而缺血心肌的血流突然恢复,往往会导致缺血/再灌注(ischemia/reperfusion, I/R)损伤,心肌I/R损伤可导致心肌顿抑,出现变性、坏死,细胞内无氧代谢加强,血浆中高密度脂蛋白增加[3],无复流现象、致死性再灌注损伤以及再灌注性心律失常等反而降低了心肌再灌注的疗效。因此,如何减轻心肌I/R损伤,保护心脏功能成为目前心血管基础及临床研究的重要导向及研究热点。经过多年临床及基础研究探索出多种减轻心肌I/R损伤的措施,缺血预适应(ischemic preconditioning, IPC)就是其中一种。IPC是指在持续缺血前多次、反复、短暂的缺血/再灌注刺激对心肌产生一定保护效应的一种内源性保护措施[4-5]。Murry等[6]于1986年首次提出IPC的概念,他们在开胸实验犬模型中发现持续缺血前几个循环的短暂、间歇的冠脉阻断与开放可以减轻因长时间缺血造成的心肌损伤以及显著减小心梗面积达75%,IPC是通过增加心肌缺血损伤时的“损害阈值”,减小心肌梗死面积,从而保护心脏功能[7-9]。急性心肌梗塞事件是不可预测的,但IPC必须在缺血开始前实施,所以大多数IPC的临床应用仅限于各种心血管外科手术,其中也存在老年患者心脏手术期间通过重复夹闭主动脉而使钙化或动脉粥样硬化斑块脱落而导致中风的风险。因此,探索能够模拟IPC保护而不产生不良反应的新靶点已成为现代心脏病学的挑战[10]。本研究通过分析并验证小鼠心肌IPC处理后的差异表达蛋白,从蛋白组学角度探索IPC对心肌的保护机制,为IPC的进一步研究以及临床应用提供新的思路。
材料和方法
1 实验动物
选择10~12周龄、体重24~30 g的雄性C57BL/6小鼠作为研究对象,购自新疆医科大学实验动物中心,所有动物实验程序均经新疆医科大学第一附属医院伦理委员会批准,符合实验动物照料和使用原则(伦理委员会审批号:IACUC-20200318-95)。
2 主要试剂与仪器
RIPA裂解液和串联质谱标签(tandem mass tag, TMT)试剂盒(Thermo);BCA蛋白定量试剂盒(碧云天);蛋白电泳Marker(Fermentas);氯仿(北京百泰克公司);RNA提取(TRIzolTM)试剂和β-羟丁酸脱氢酶1(β-hydroxybutyrate dehydrogenase 1, Bdh1)抗体(Abcam);GAPDH抗体(Cell Signaling Technology);胰酶(Promega);三氟乙酸(Sigma-Aldrich)。小动物687型呼吸机(Harvard),组织匀浆机(PRO Scientific);数字化凝胶成像分析仪(Bio-Rad);外科实体双目显微镜(上海精密光学仪器公司);凝胶电泳装置(Bio-Rad);7900实时荧光定量PCR仪(ABI)。
3 实验方法
3.1实验动物分组C57BL/6小鼠随机分为3组:(1)假手术(sham)组:小鼠麻醉后打开胸腔随即缝合,无任何特殊处理;(2)缺血/再灌注(I/R)组:缺血60 min,再灌注24 h;(3)缺血预适应(IPC)组:在60 min持续缺血及24 h再灌注之前,实施3个循环的5 min缺血,5 min再灌注;每组样本量为20只,具体实验条件见图1。
Figure 1. Schematic diagram of experiment. (5 min/5 min)×3 cycles: ischemia for 5 min and reperfusion for 5 min, 3 cycles in total.
3.2小鼠心肌缺血再灌注损伤及缺血预适应模型的建立采用我们前期已建立的在体小鼠I/R损伤及IPC保护模型[10]。(1)I/R模型建立:小鼠用4%~5%的异氟烷吸入进行诱导麻醉后,在1%~1.5%的流量下维持麻醉。在呼吸机辅助下,左侧开胸暴露心脏(左心室前壁),在距离左心耳下缘2 mm处,用7-0无损伤丝线贯穿左前降支冠状动脉的下方心肌层,在结扎线的两端各穿入一个5-0丝线做成的松解环,然后用活节结扎冠状动脉造成缺血,然后逐层关胸并复苏小鼠。待实施缺血1 h后,在体外通过牵拉两个松解环,松解结扎线实施再灌注24 h完成I/R模型的建立。(2)IPC+I/R模型建立:小鼠麻醉开胸后,采用7-0丝线贯穿左前降支冠状动脉的下方心肌层,通过交叉两端结扎线形成心肌对冠状动脉的临时挤压造成5 min短暂缺血,然后解除交叉恢复血流灌注5 min,这样重复3次(共30 min)完成IPC实施,之后进行1 h持续缺血及24 h再灌注(手术持续同前)完成IPC+I/R模型建立。
3.3心肌梗死面积测定24 h再灌注结束后,麻醉小鼠,开胸暴露心脏并行升主动脉远端插管1 mm逆行灌注生理盐水1 mL,冲洗心肌内的残存血液。在原位结扎左前降支冠状动脉。经主动缓慢推注5% Evans蓝染料以蓝染正常灌注的心肌并勾勒出主要位于左心室前壁的缺血心肌轮廓。随后立刻取下心脏,生理盐水冲洗干净。显微镜下分离左心室并置于干冰上冷冻。从心尖到心底以1 mm的厚度持续切6~8片,浸入1%的TTC溶液中放置在37 ℃恒温箱孵育45 min。染色后的心脏薄片夹压于两个载玻片中,数字成像。黑蓝色区为正常心肌,苍白色区为梗死区,红色区为缺血但仍存活心肌。用ImageJ软件测定左不同染色区域的面积分析心肌梗死范围[10]。风险区域(area at risk,AAR)面积,以非蓝染区占整个左心室切片的面积百分比表示。心肌梗死面积(infarct size,IS)以梗死区域(苍白区)面积/缺血区域(红色区+苍白区)的百分比表示[10]。
3.4心肌差异表达蛋白的筛选另一组小鼠在24 h再灌注结束后,取出心脏,分离左心室,提取心肌总蛋白,利用BCA试剂盒进行蛋白浓度测定。蛋白通过胰酶酶解过夜,酶解的肽段用Strata X C18(Phenomenex)除盐后真空冷冻干燥。以0.5 mol/L TEAB溶解肽段,根据TMT试剂盒操作说明标记肽段。肽段用高pH反向HPLC分级,随之用液相色谱流动相A相溶解后使用EASY-nLC 1000超高效液相系统进行分离,再经由超高效液相系统分离后被注入NSI离子源中进行电离然后Q Exactive TM质谱进行分析,通过质谱定量分析检测出肽段对应在每个样本中的定量值。两个不同样本之间蛋白定量值取比值作为比较组差异表达量(Ratio)。计算该蛋白在两个样本中的差异表达显著性值,首先将两个样本中蛋白对应特异性肽段的定量值取log2(以使得数据符合正态分布),然后用双样本双尾检验方法计算值。当<0.05时,以差异表达量变化>1.2倍作为显著上调的变化阈值,小于1/1.2倍作为显著下调的变化阈值。基于鉴定到和定量到的关键蛋白质数据,对这些蛋白的功能、特征等,从基因本论(gene ontology, GO)、蛋白结构域、KEGG通路、同源蛋白簇(clusters of orthologous of proteins, COG/KOG)功能分类以及亚细胞结构定位等方面进行了详细的注释。
3.5实时荧光定量PCR检测差异表达蛋白mRNA表达水平取24 h再灌注后的左心室,用TRIzol法提取心肌总RNA,紫外分光光度计测定其浓度和纯度。按照逆转录试剂盒说明书将RNA反转成cDNA,使用实时荧光定量PCR检测试剂盒扩增基因片段,反应条件:95 ℃ 10 min; 95 ℃ 15 s,60 ℃ 1 min,循环40次。以18S作为内参照,采用2-ΔΔCt法进行计算。其中所用引物:β-羟丁酸脱氢酶1(β-hydroxybutyrate dehydrogenase 1,Bdh1)上游引物为5’-TCTCGGACTGCCTGCGCTAT-3’,下游引物为5’-ACCGCTGTTGCAGTAGGTTT-3’; 18S上游引物为5’-TTGACGGAAGGGCACCACCAG-3’ ,下游引物为5’-GCACCACCACCCACGGAATCG-3’。
3.6Western blot 验证差异表达蛋白水平取24 h再灌注后的左心室,提取心肌总蛋白,BCA法测定蛋白浓度。100 ℃煮沸使蛋白变性。取40 μg蛋白提取液,室温下SDS-PAGE分离蛋白。用湿转法将蛋白电转到PVDF膜上。5%脱脂奶粉封闭液中封闭1 h,0.1% TBST洗膜3次。随后孵育相应Ⅰ抗,Bdh1(1∶1 000)及GAPDH(1∶2 000),4 ℃孵育过夜。TBST洗膜3次,孵育Ⅱ抗(1∶3 000)2 h,并进行碱性磷酸酶试剂显色。用Image Lab 图像分析系统对Western blot图片进行分析,目的蛋白的表达采用其与内参照蛋白GAPDH条带的灰度比值表示。
4 统计学处理
使用Graph Pad 7.0软件统计数据,计量资料以均数±标准误(mean±SEM)表示。两组间比较用独立样本检验;多组间均数比较采用单因素方差分析或多因素方差分析,两两比较采用SNK-检验。以˂0.05为差异有统计学意义。
结果
1 I/R与IPC组心肌梗死面积比较
通过测量各组心肌梗死面积,发现在各组冠状动脉结扎水平相当的前提下,即各组AAR之间没有差别时,60 min缺血及24 h复灌造成45.3%左心室(LV)梗死。在I/R之前,实施3个循环5 min缺血5 min复灌的IPC措施后,心梗面积为30 %,较单纯I/R损伤减少了33%(˂0.05),证明IPC能够显著减小缺血再灌注损伤导致的心梗面积,见图2。
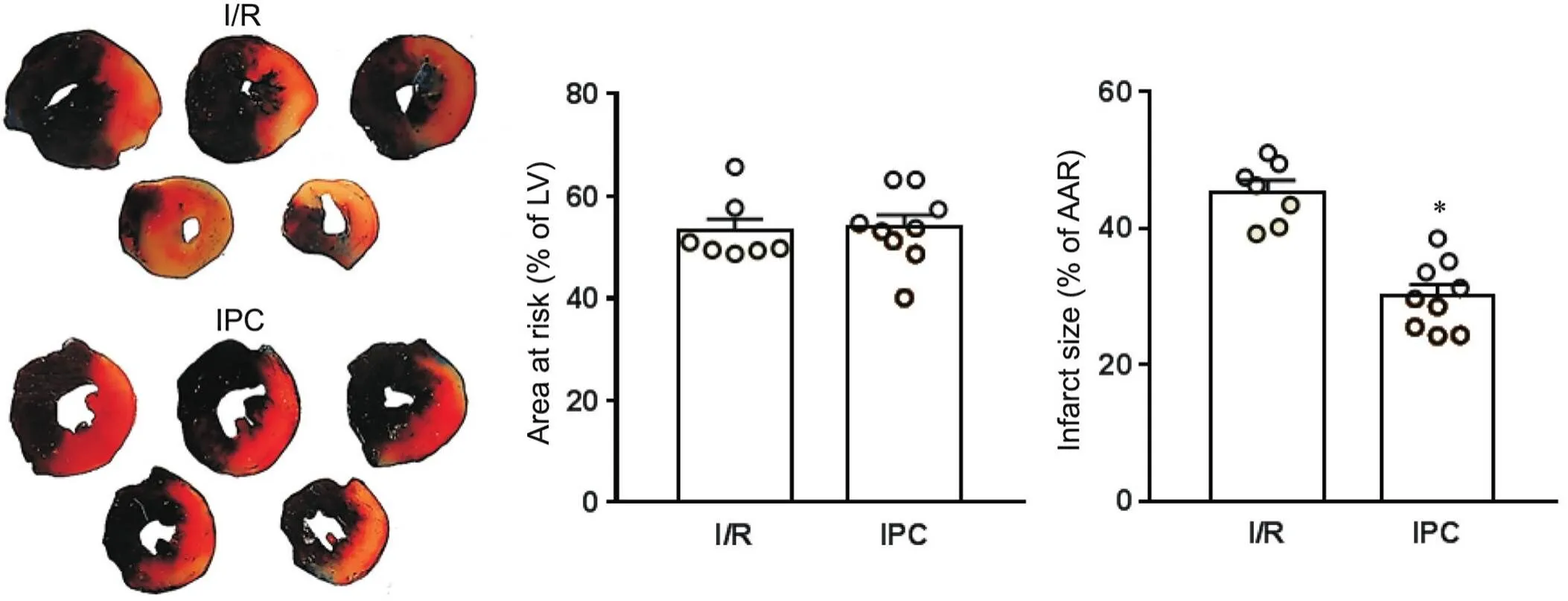
Figure 2. Infarct size measurement in ischemia/reperfusion (I/R) and ischemic preconditioning (IPC) groups. Representative left ventricular (LV) sections stained by Evans blue and TTC (the dark blue area is normal myocardium, the pale area is infarcted myocardium, and the red area is ischemic myocardium) were shown. Mean±SEM. n=7~9. *P<0.05 vs I/R group.
2 差异表达蛋白筛选及亚细胞结构定位
通过将TMT、高效液相色谱分级技术以及基于质谱的定量蛋白质组学技术相结合,以差异表达量变化>1.2倍作为显著上调的变化阈值,<1/1.2作为显著下调的变化阈值。其中,与sham组比较,I/R组上调的蛋白47个,下调的蛋白91个,其中Bdh1在下调蛋白中,表达倍数为0.708(<1/1.2,<0.05),差异表达蛋白火山图见图3A。与I/R组比较IPC组表达上调的蛋白14个,差异倍数最高的蛋白Bdh1(1.95倍,<0.05),表达下调的蛋白16个。上调与下调前10的蛋白见表1,差异表达蛋白火山图见图3A。针对差异蛋白的亚细胞结构定位预测和分类结果显示,sham组与I/R组分类结果如图3B所示,差异表达蛋白主要位于细胞质(28.3%)、细胞外基质(23.2%)和细胞核(23.2%)和线粒体(13.0%)等;I/R组与IPC组分类结果如图3B所示,差异表达蛋白主要位于细胞质(43.3%)、细胞外基质(26.7%)、细胞核(10.0%)和线粒体(6.7%)等。
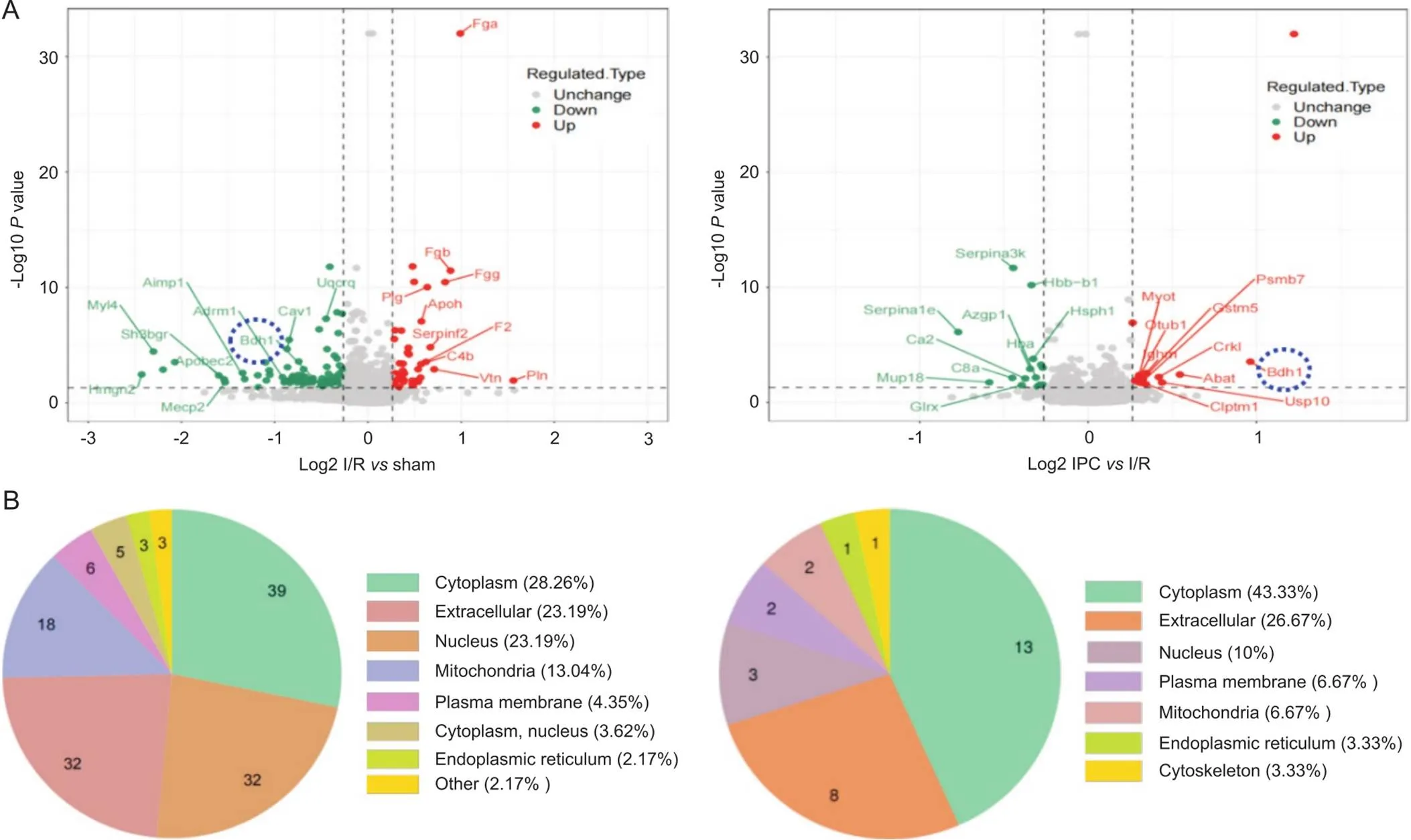
Figure 3. Volcano plot and subcellular localization chart of differentially expressed proteins. A (I/R vs sham and IPC vs I/R): the X-axis is the difference in multiple, the base number is 2, and the logarithm value is taken; the Y-axis is the P value, with 10 as the base, and the value of negative logarithm is taken. B (I/R vs sham and IPC vs I/R): localization and distribution of subcellular structure.
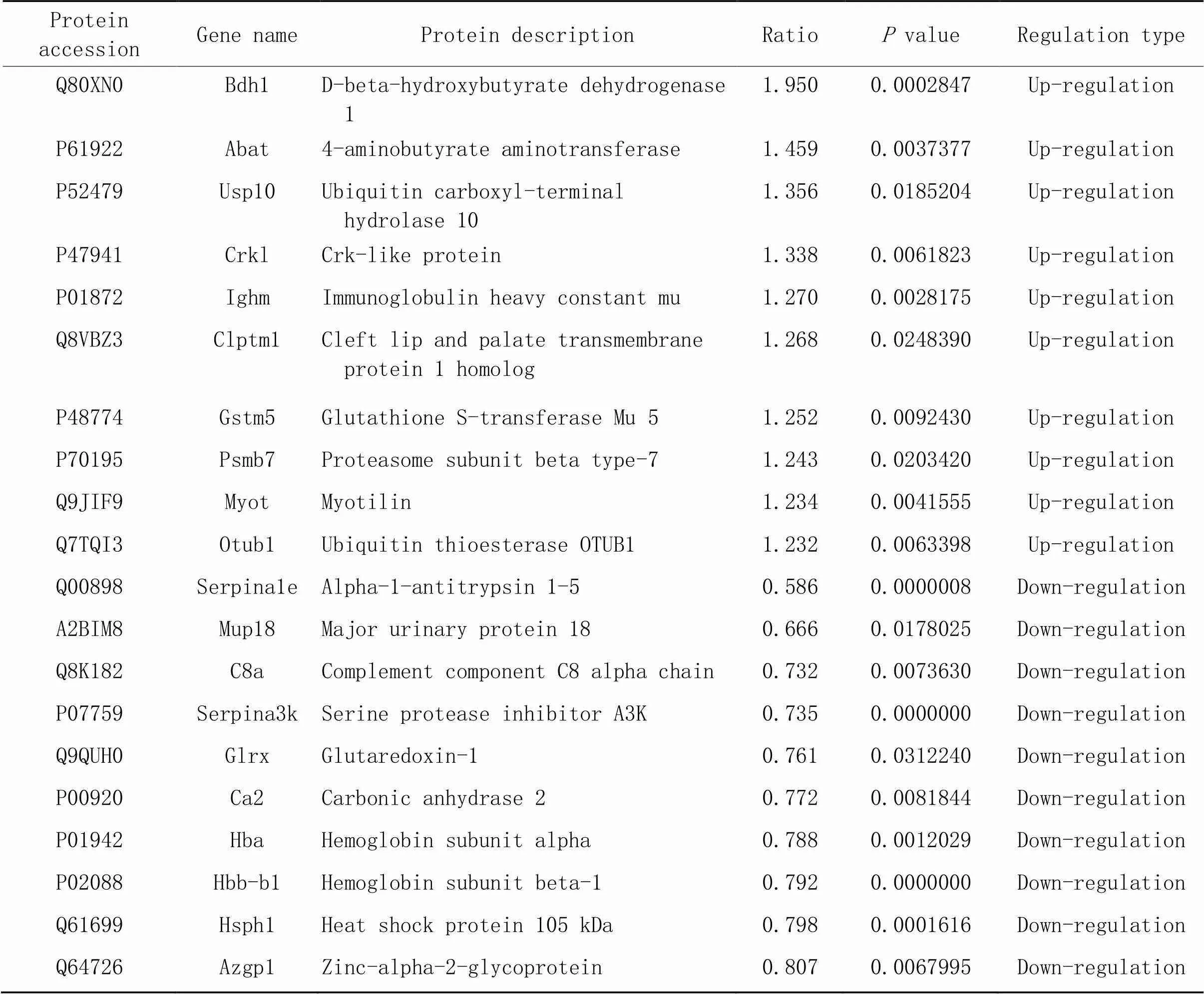
表1 IPC与I/R组心肌上调、下调前10位的差异蛋白
3 差异表达蛋白的GO注释及COG/KOG功能分类
通过GO数据库对差异表达蛋白进行GO功能注释,从生物学过程,细胞成分和分子功能三个不同角度进行分析(图4A)。结果显示,分子功能主要富集在NADPH结合、细胞黏附分子结合、ATP结合、硫醇依赖性泛素特异性蛋白酶活性、抗氧化活性、Bdh活性等;生物学过程主要富集在抗氧化调控、细胞代谢过程的正向调控、白细胞的激活调控、跨膜运输调控等;细胞成分主要富集在细胞膜、细胞外区域、线粒体内膜等。为进一步分析数据中检测和定量的蛋白质,我们对差异表达蛋白进行了COG/KOG功能分类统计,sham组与I/R组分类,见图4B。I/R组与IPC组分类见图4C。结果显示,COG/KOG功能分布主要涉及能量生成和转换、氨基酸转运和代谢、翻译后修饰、蛋白转换、分子伴侣、信号传导机制等。
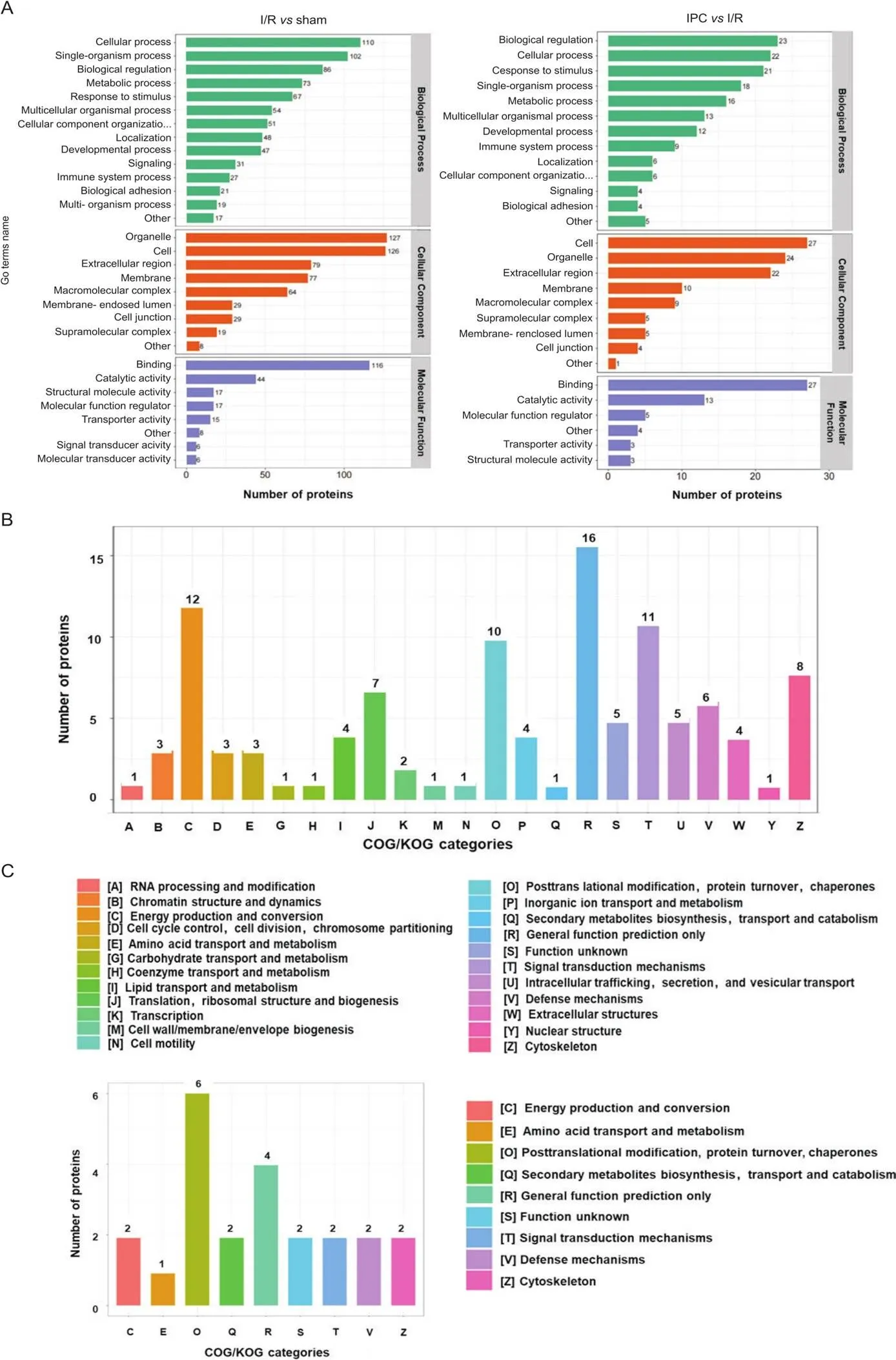
Figure 4. Distribution chart of differentially expressed proteins under GO and COG/KOG functional classification. A: classification and statistical results of biological processes, cell composition and molecular function between sham and I/R groups or between IPC and I/R groups. B(I/R vs sham) and C(IPC vs I/R): the X axis is the letter number of COG classification, each letter represents COG classified individual biological function which is given in the legend; the Y-axis represents the number of differential proteins involved in the denoted biological functions.
众所周知,生理状态下的心脏主要依靠脂肪酸和葡萄糖的氧化代谢来提供能量。然而,在心肌梗死、心肌肥厚、心力衰竭等各种病理状态下,心肌细胞内的脂肪酸和葡萄糖的代谢路径出现障碍,心肌细胞能量供应不足,直接导致心肌不可逆坏死以及心脏的病理性重构。心脏重构往往伴随着能量代谢的病理性重构,即脂肪酸和葡萄糖的氧化利用率明显下降,而其他能量底物来补充心脏做功时所需的能量供应,包括酮体、乳酸及氨基酸等。其中,酮体氧化代谢在疾病心脏中的能量供给是近几年来心脏代谢重构的研究热点。特别地,本研究对sham,I/R及IPC组心脏差异表达蛋白的检测及功能富集分析结果发现,与I/R组相比,IPC组酮体氧化代谢过程中的关键线粒体蛋白Bdh1显著上调,差异表达倍数最高(1.95倍;˂0.01),而与sham组相比,I/R组Bdh1的表达明显下调,差异倍数为0.708(<1/1.2;˂0.05)。此结果表明,发生I/R损伤时,Bdh1表达显著降低,而在给予IPC处理后,Bdh1的表达明显恢复。提示Bdh1可能是IPC介导的缺血心肌保护中的关键蛋白。因此,下一步实验中,我们将对该分子进行mRNA及蛋白水平上表达的验证。
4 差异表达蛋白mRNA及蛋白水平上的验证
qPCR结果显示,相比sham组,I/R组Bdh1 mRNA表达水平下调79%(<0.05);而IPC组Bdh1 mRNA表达水平比I/R组上调75%(<0.05)。Western blot 检测结果显示,相比sham组,I/R组Bdh1蛋白表达水平降低43%(<0.05);而IPC组Bdh1蛋白表达水平比I/R组升高25%(<0.05)。见图5。
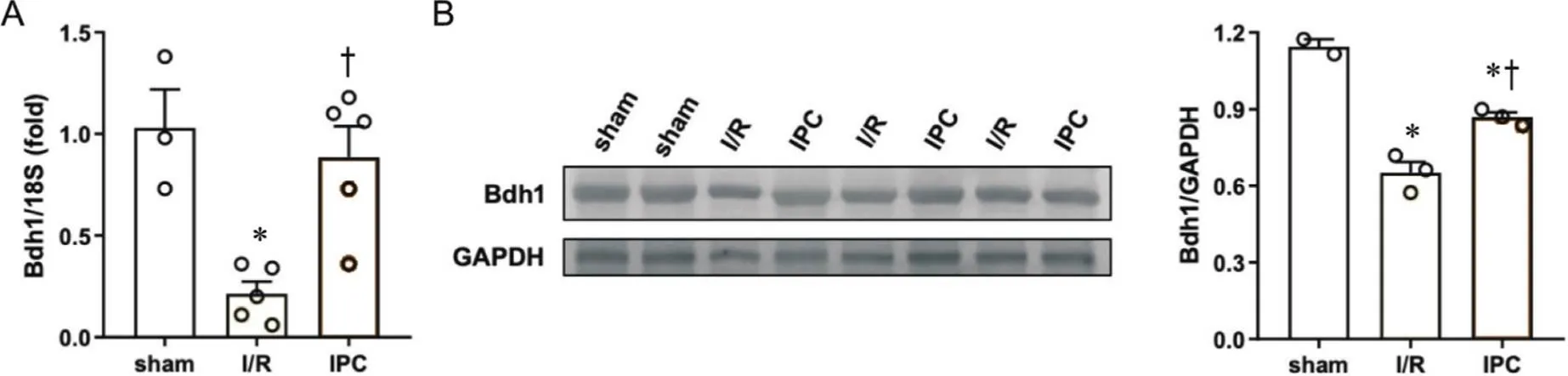
Figure 5. The mRNA (A) and protein (B) expression of Bdh1 in sham, I/R and IPC groups. Mean±SEM. n=2~5. *P<0.05 vs sham group; †P<0.05 vs I/R group.
讨论
本研究通过将串联质谱标记、高效液相色谱分级技术以及基于质谱的定量蛋白质组学技术相结合,筛选了假手术组、心肌I/R损伤和IPC处理后的小鼠心肌差异表达蛋白,并用qPCR和Western blot验证了目标差异表达蛋白Bdh1的 mRNA及蛋白水平的变化差异。
IPC保护功效已在实验动物包括鼠、兔、狗、猪等哺乳动物以及病人群体得到了验证,其可有效减少心肌缺血所致心肌梗死范围,降低室性心律失常发生频率及严重程度并能够改善缺血后左心室功能,是如今已经证实的强有力的内源性保护机制[11]。因此,近十年来引起了研究人员极大的兴趣,针对其保护作用机制的研究已成为心肌保护领域的一个热点。随着最初的IPC保护的发现,临床应用的关注点在直接施加缺血于心脏或间接作用于其它相关脏器所产生的潜在风险,应运而生的是广泛探索药理性诱发IPC保护。迄今为止基础研究已经发现了许多药理性因素具有诱发IPC保护的能力。这些药理性因子,具有相当的临床相关性[10-12];后续的研究发现,在应用上述药理性因子所产生的保护未能完全达到直接施加IPC所产生的减少心梗面积的最大效果,这一现象说明其它分子机制介入IPC保护的可能性。
在用蛋白组学研究检测到的差异蛋白中,我们关注Bdh1的原因诸多,首先与I/R组相比,IPC组心脏组织中该蛋白的差异表达倍数最高(1.95倍),qPCR与Western blot结果也证实,Bdh1在IPC干预后明显增高。其次,Bdh1是一种线粒体蛋白,在肝脏通过脂肪酸氧化的乙酰辅酶A合成,参与酮体底物 β-羟丁酸与乙酰乙酸的转化,为酮体的生成和利用过程中的关键氧化还原酶[13-14]。酮体作为重要的补充功能物质,为能量缺乏的衰竭心脏提供能量[15]。研究表明,小鼠心衰早期阶段,心脏组织中的酮体氧化代谢关键酶Bdh1表达显著升高。相应地,琥珀酸、乙酰肉碱及羟丁酸酰基肉碱等酮体代谢衍生产物含量也随之升高[14],提示在心衰早期,心脏可能是借助酮体的分解代谢来代偿心肌收缩及舒张时所需的能量。除此之外,近年来的多项研究发现,酮体氧化代谢通过减轻心肌细胞的氧化应激反应、阻断活性氧的过度生成和堆积、改善线粒体功能等过程,促进心肌ATP合成效率,从而减轻心肌梗死及心肌缺血再灌注损伤对心脏造成的损伤[16],提示酮体代谢也可能参与心肌缺血时的能量供给。此外,心脏特异性Bdh1过表达会使小鼠心肌酮体利用率增加,减轻主动脉缩窄诱导的心肌纤维化及氧化损伤程度、改善心肌收缩功能[15, 17]。这些结果提示能量缺乏的心脏依靠酮体作为其主要的替代能源的重要性。
综上所述,我们的蛋白组学筛选及验证结果证明IPC抑制了心肌因缺血再灌注损伤导致的酮体氧化代谢关键酶Bdh1的表达下调及降解破坏,提示酮体氧化代谢可能参与缺血预适应介导的缺血心肌的保护。当然,这一假设需要更深入缜密的研究来证明,我们在后续的实验中,将在在体动物模型中利用基因干预小鼠进一步验证Bdh1在IPC中对心肌的保护作用及分子机制,探讨其能否成为缺血心肌保护药物研发的作用靶点,为其临床应用提供新思路。
[1] Razani Z, Dastani M, Kazerani HR. Cardioprotective effects of pomegranate () juice in patients with ischemic heart disease[J]. Phytother Res, 2017, 31(11):1731-1738.
[2] Li Y, Liu S, Zeng X, et al. Report on burden of cardiovascular diseases from 1990 to 2016 in China[J]. Chin Circ J, 2019, 34(8):729-740.
[3]李茹冰, 付泳航, 蒋月宏, 等. 心肌肽素对大鼠心脏缺血-再灌注损伤的治疗作用[J]. 中国病理生理杂志, 2002, 18(5):556-557.
Li RB, Fu YH, Jiang YH, et al. Therapeutic effect of cardiac peptide on myocardial ischemia-reperfusion injury in rats [J]. Chin J Pathophysiol, 2002, 18(5):556-557.
[4] Sanada S, Komuro I, Kitakaze M. Pathophysiology of myocardial reperfusion injury: preconditioning, postconditioning, and translational aspects of protective measures[J]. Am J Physiol Heart Circ Physiol, 2011, 301(5):H1723-H1741.
[5]黄雪珊, 廖崇先, 陈道中. 缺血预处理前加用腺苷对未成熟兔心肌再灌注损伤的影响[J]. 中国病理生理杂志, 2003, 19(5):639-641.
Huang XS, Liao CX, Chen DZ. Effect of adenosine infusion before ischemic preconditioning on immature myocardial reperfusion injury in neonatal rabbits[J]. Chin J Pathophysiol, 2003, 19(5):639-641.
[6] Murry CE, Jennings RB, Reimer KA. Preconditioning with ischemia: a delay of lethal cell injury in ischemic myocardium[J]. Circulation, 1986, 74(5):1124-1136.
[7] Vinten-Johansen J, Zhao ZQ, Jiang R, et al. Preconditioning and postconditioning: innate cardioprotection from ischemia-reperfusion injury[J]. JAppl Physiol(1985), 2007, 103(4):1441-1448.
[8] Dow J, Bhandari A, Simkhovich BZ, et al. The effect of acute versus delayed remote ischemic preconditioning on reperfusion induced ventricular arrhythmias[J]. J Cardiovasc Electrophysiol, 2012, 23(12):1374-1383.
[9] Yang X, Cohen MV, Downey JM. Mechanism of cardioprotection by early ischemic preconditioning[J]. Cardiovas Drugs Ther, 2010, 24(3):225-234.
[10] Ruze A, Chen B, Liu F, et al. Macrophage migration inhibitory factor plays an essential role in ischemic preconditioning-mediated cardioprotection[J]. Clin Sci (Lond), 2019, 133(5):665-680.
[11] Downey JM, Cohen MV. Why do we still not have cardioprotective drugs?[J]. Circ J, 2009, 73(7):1171-1177.
[12] Krieg T, Qin Q, Philipp S, et al. Acetylcholine and bradykinin trigger preconditioning in the heart through a pathway that includes Akt and NOS[J]. Am J Physiol Heart Circ Physiol, 2004, 287(6):H2606-H2611.
[13] Cotter DG, Schugar RC, Crawford PA. Ketone body metabolism and cardiovascular disease[J]. Am J Physiol Heart Circ Physiol, 2013, 304(8):H1060-H1076.
[14] Kolwicz SC, Jr. Ketone body metabolism in the ischemic heart[J]. Front Cardiovasc Med, 2021, 8:789458.
[15] Al-Zaid NS, Dashti HM, Mathew TC, et al. Low carbohydrate ketogenic diet enhances cardiac tolerance to global ischaemia[J]. Acta Cardiol, 2007, 62(4):381-389.
[16] Puchalska P, Crawford PA. Multi-dimensional roles of ketone bodies in fuel metabolism, Signaling, and therapeutics[J]. Cell Metab, 2017, 25(2):262-284.
[17] Zou Z, Sasaguri S, Rajesh K G, et al.-3-Hydroxybutyrate administration prevents myocardial damage after coronary occlusion in rat hearts[J]. Am J Physiol Heart Circ Physiol, 2002, 283(5):H1968-H1974.
Proteomic-based study to explore cardioprotective mechanism of ischemic preconditioning in mice
XIEFUKAITI Nilupaer1, RUZE Amanguli1△, TANG Jing1, ZHAO Ling1, ZHAO Banghao1, GAO Xiaoming1,2△
(1,,,,,830054,;2,830054,)
Ischemic preconditioning (IPC) is an endogenous protection strategy against myocardial ischemia/reperfusion (I/R) injury, but the mechanism related to its protective effect is still unclear. The purpose of this study is to identify the myocardial differentially expressed proteins after IPC and provide a new idea for further basic and clinical studies of IPC.Male adult C57BL/6 mice were used to establish myocardial I/R injury (ischemia for 60 min and reperfision for 24 h) and IPC (3 cycles of ischemia for 5 min and reperfusion for 5 min, plus ischemia for 60 min and reperfision for 24 h) models. The myocardial infarct size was measured by Evans blue and 2,3,5-triphenyltetrazolium chloride double staining. Tandem mass tag, high-performance liquid chromatography and mass spectrometry based quantitative proteomics were conducted to screen the differentially expressed proteins. The threshold to determine significantly up- or down-regulated proteins was defined as the expression level of proteins more than 1.2-fold or less than 1/1.2-fold between groups. The differentially expressed proteins were classified into clusters of orthologous proteins for functional analysis. Real-time quantitative PCR and Western blot were used to verify identified proteins.Compared with I/R group, IPC intervention significantly reduced the infarct size by 33% (<0.05). Quantitative proteomics results showed that 91 proteins were down-regulated in I/R group compared with sham group, among which β-hydroxybutyrate dehydrogenase 1 (Bdh1), a key enzyme of ketone body oxidative metabolism, had 0.708-fold decreased expression (<1/1.2-fold). Fourteen proteins were up-regulated in IPC group compared with I/R group, among which Bdh1 had the highest expression (1.95-fold). The qPCR and Western blot results showed that Bdh1 mRNA and protein expression levels were significantly lower in I/R group compared with sham group, and were significantly higher in IPC group compared with I/R group, further validating the proteomic results.The I/R injury significantly reduced Bdh1 expression, while IPC significantly restored the mRNA and protein expression of Bdh1 in the myocardium. Ketone body oxidation may be involved in IPC-mediated protection of ischemic myocardium.
ischemic preconditioning; ischemia/reperfusion; proteomics; β-hydroxybutyrate dehydrogenase 1
R541.4; R363.2
A
10.3969/j.issn.1000-4718.2023.02.003
1000-4718(2023)02-0212-08
2022-09-05
2022-12-22
[基金项目]国家自然科学基金资助项目(No. 82060073; No. 81870272);省部共建中亚高发病成因与防治国家重点实验室开放课题项目(No. SKL-HIDCA-2020-46; No. SKL-HIDCA-2021-XXG1);新疆重点实验室开放课题项目(No. 2020D04027; No. 2021D04020)
高晓明 Tel: 15899267691; E-mail: xiaominggao2017@163.com; 阿曼古丽·如则 Tel: 18599084656; E-mail: P4919627@xjmu.edu.cn
(责任编辑:余小慧,李淑媛)
