P53/P21通路在电针抑制骨质疏松大鼠模型成骨细胞衰老中的机制
2023-03-09钟培瑞何晓艳廖瑛孙光华刘静周君李书枝刘媛屈萌艰
钟培瑞 何晓艳 廖瑛 孙光华 刘静 周君 李书枝 刘媛 屈萌艰
南华大学衡阳医学院附属第一医院1康复医学中心,2康复医学科,3康复医学实验室(湖南衡阳 421001);4衡阳市第一人民医院呼吸内科(湖南衡阳 421001)
骨质疏松(osteoporosis,OP)好发于高龄人群,为临床工作中常见疾病[1]。它可导致全身慢性疼痛、生存质量下降、显著增加骨折风险,病理特征表现为骨量丢失、脆性增加及骨显微结构紊乱等[2-5]。OP 发病率呈逐年上升趋势,已经严重威胁到中老年人群的身体健康及生存质量,且其病因复杂、缺乏理想有效的阻断或逆转疾病进展的干预措施,进一步探讨其发病及治疗机制显得尤为重要[6]。成骨细胞骨形成作用与破骨细胞的骨吸收作用在骨组织的稳态结构维持过程中发挥着不可替代的作用,其中成骨细胞衰老为OP 的关键因素之一[7-9]。P53/P21 信号通路与成骨细胞衰老有着一定的联系[10-11]。近年来传统治疗措施针灸已逐渐得到临床认可,其可有效缓解疼痛、增加骨密度[12],并具有副作用少、经济、高效等优点。但它是否能够调控P53/P21 信号通路介导的成骨细胞衰老,并以此来发挥抗OP 作用,目前鲜有报道。本研究重点在于探讨电针对高龄OP 大鼠的影响,并以OP 为出发点,进一步明确电针、P53/P21 信号通路、成骨细胞衰老之间的关系。
1 材料与方法
1.1 实验动物24 只雄性SD 大鼠由青年大鼠(n= 8,6月龄)和老年大鼠(n= 16,27月龄)两部分组成。实验大鼠均购自成都达硕实验动物有限公司,许可证号:SCXK(川)2020-030。
1.2 实验设备高速冷冻离心机(湖南湘仪实验室仪器开发有限公司,H1650R)、荧光定量RCP 仪(美国Thermo,SPL0960)、化学发光成像系统(中国勤翔,ChemiScope6100)、生物样品均质仪(中国杭州奥盛,BioPrep-24)、转膜仪(中国北京六一,DYCZ-40D)、磁力搅拌器(中国雷磁,JB-13)、电泳槽(中国北京六一,DYCZ-24DN)、旋涡混合器(中国江苏其林贝尔,GL-88B)、Micro-CT(广州中科恺盛医疗科技有限公司)。
1.3 实验主要试剂mRNA 逆转录试剂盒(中国北京康为世纪,CW2569)、ELISA 试剂盒(武汉华美生物工程有限公司,CSB-E12776r、CSB-E08081r)、P53 抗体(美国proteintech、10442-1-AP)、P21 抗体(美国proteintech、10355-1-AP)、HRP goat anti-mouse IgG 抗体(美国proteintech、SA00001-1)。
1.4 实验分组及标本采集6月龄大鼠设为青年组[n= 8,(564.0 ± 52)g)],27月龄大鼠分别设为老年组[n= 8,(672.0 ± 40)g]、电针治疗组[n= 8,(672.0 ± 40)g]。电针干预穴位选择:“肾俞”,双侧“血海”、“足三里”,“太溪”、“阳陵泉”。每周干预5 次,每次干预30 min,总共8 周,干预参数:强度为1 mA,疏密波,频率3/15Hz(参照课题组前期研究[13-14])。处死大鼠后,眼眶采血5 mL,离心30 min 后取血清500 μL,行ELISA 检测。取右侧股骨远端(长度0.5 ~1 cm)行PCR、WB 检测。取左侧股骨近端(长度0.5 ~1 cm)+腰5 椎体用于骨密度检测(bone mineral density,BMD)。取右侧胫骨近端(长度0.5 ~1 cm)+腰4 椎体行Micro-CT 扫描及微结构定量分析。
1.5 检测方法
1.5.1 ELISAⅠ型胶原C末端肽(c-terminal crosslinking telopeptide of type I collagen,CTX-Ⅰ)、Ⅰ型胶原羧基端前肽(procollagen type I carboxy terminal peptide,PICP)等骨代谢指标使用ELISA 试剂盒检测。
1.5.2 Micro-CTMicro-CT 检测左侧股骨近端、腰5 椎体BMD。从以下几个方面对右侧胫骨近端骨组织+腰4 椎体行微结构定量分析:(1)骨体积分数(bone volume fraction,BV/TV);(2)骨小梁量(trabecular number,Tb.N);(3)骨小梁厚度(trabecular thickness,Tb.Th);(4)骨小梁分离度(trabecular separation,Tb.Sp)。
1.5.3 RT-qPCR取右侧股骨远端,Trizol 提取总RNA,组织总mRNA 为模板,逆转录cDNA,在NCBI上搜索目的基因的序列,运用primer5 软件进行引物设计,引物序列见表1,其中β-actin 为内参,加入靶基因,上下游引物进行扩增。荧光染料SYBR法,定量PCR 扩增程序:95 ℃10 min,95 ℃15 s、60 ℃30 s、总计40 个循环,60 ~95 ℃行溶解曲线分析,计算基因相对表达量。
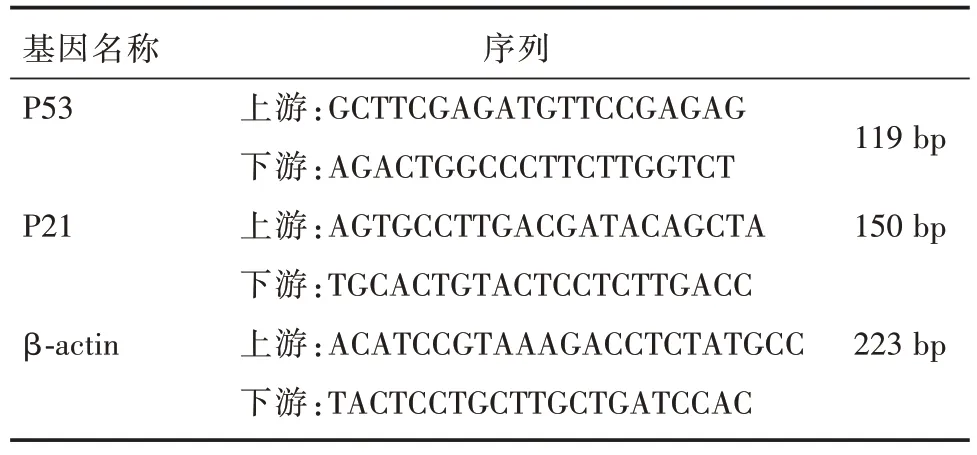
表1 引物信息Tab.1 Primer sequence
1.5.4 Western blot取右侧股骨远端骨组织,预冷PBS 洗组织,加入300 μL RIPA 裂解液于生物样品均质仪中充分研磨,离心15 min(相关参数:4 ℃,12 000 r/min)。取上清液,并移至1.5 mL 离心管中。经制胶,电泳,转膜,封闭,一、二抗孵育,显色/曝光,底片扫描后使用quantity one 专业灰度分析软件进行分析。
1.6 统计学方法本实验使用SPSS 22.0 软件进行统计分析,所获数据均采用均数±标准差表示,组间比较采用单因素方差分析,P<0.05 为差异有统计学意义。
2 结果
2.1 骨代谢指标ELISA 结果显示:相对于青年组大鼠,老年组大鼠血清CTX-I 水平显著高,PICP水平显著低,差异有统计学意义(P<0.01);电针可降低老年大鼠CTX-I 水平,并增加PICP 水平(P<0.01)。见表2。
表2 各组血清CTX-I、PICP 水平表达比较Tab.2 Comparison of serum CTX-I and PICP levels in each group±s

表2 各组血清CTX-I、PICP 水平表达比较Tab.2 Comparison of serum CTX-I and PICP levels in each group±s
注:与青年组比较,#P <0.01,##P <0.05;与老年组比较,*P <0.01,**P <0.05
指标CTX-I(pg/mL)PICP(ng/mL)青年组79.13±9.56 4.51±0.80老年组117.81±20.84#1.58±0.37#电针治疗组89.66±9.40*3.96±0.40*F值15.630 61.525 P值<0.001<0.001
2.2 软骨下骨及定量分析Micro-CT 显示:相对于青年组大鼠,老年组大鼠椎体及胫骨骨小梁稀疏,在空间结构上呈现出紊乱分布表现。而通过电针治疗后,大鼠骨组织中骨小梁相对稠密,空间分布也相对规则。定量分析:与青年大鼠比较,老年大鼠股骨、腰椎BMD 均显著降低,差异有统计学意义(P<0.01)。而电针治疗可增加老年大鼠股骨、腰椎BMD(P<0.01、P<0.05)。与青年大鼠比较,老年大鼠胫骨及腰椎BV/TV、Tb.N 均降低(P<0.01),Tb.Sp 增高(P<0.01)。而电针治疗可增加老年大鼠胫骨及腰椎BV/TV、Tb.N(P<0.01),降低Tb.Sp(P<0.01)。老年组腰椎Tb.Th 低于青年组(P<0.01),电针治疗组腰椎Tb.Th 较老年组增高,差异有统计学意义(P<0.01)。见图1 和表3、4。
表3 股骨及腰椎BMDTab.3 BMD of lumbar spine and femur in groups±s

表3 股骨及腰椎BMDTab.3 BMD of lumbar spine and femur in groups±s
注:与青年组比较,#P <0.01;与老年组比较,*P <0.01,**P <0.05
股骨BMD(g/cm2)腰椎BMD(g/cm2)青年组0.32 ± 0.03 0.22 ± 0.02老年组0.26 ± 0.01#0.10 ± 0.02#电针治疗组0.29 ± 0.02*0.13 ± 0.02**F 值16.849 71.931 P 值<0.001<0.001
表4 软骨下骨微结构定量分析Tab.4 Bone histomorphometry results in groups±s
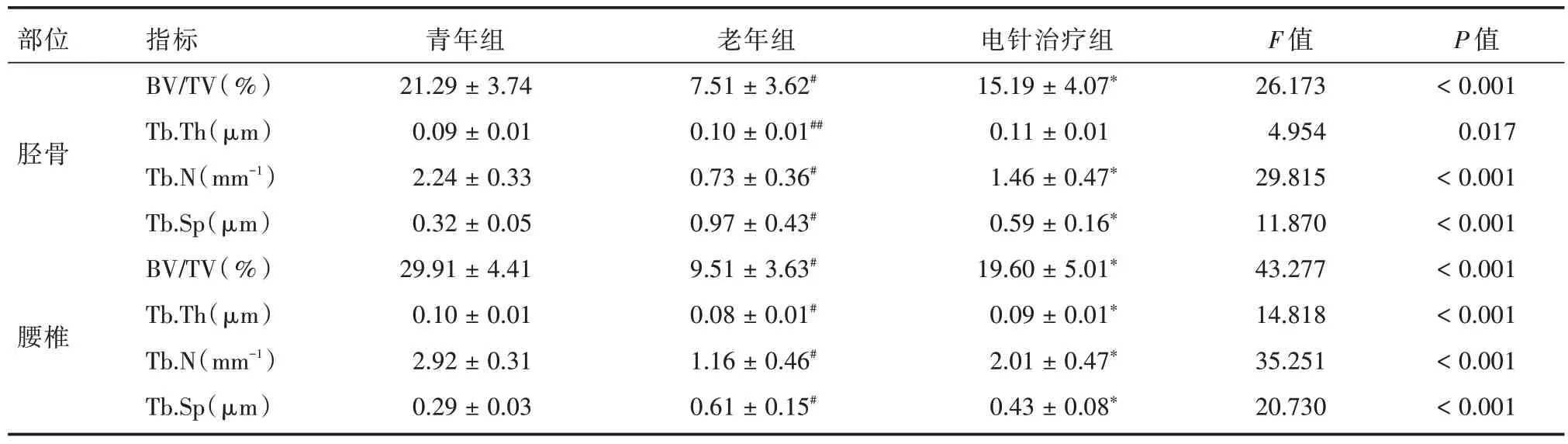
表4 软骨下骨微结构定量分析Tab.4 Bone histomorphometry results in groups±s
注:与青年组比较,#P <0.01,##P <0.05;与老年组比较,*P <0.01
部位胫骨腰椎指标BV/TV(%)Tb.Th(μm)Tb.N(mm-1)Tb.Sp(μm)BV/TV(%)Tb.Th(μm)Tb.N(mm-1)Tb.Sp(μm)青年组21.29 ± 3.74 0.09 ± 0.01 2.24 ± 0.33 0.32 ± 0.05 29.91 ± 4.41 0.10 ± 0.01 2.92 ± 0.31 0.29 ± 0.03老年组7.51 ± 3.62#0.10 ± 0.01##0.73 ± 0.36#0.97 ± 0.43#9.51 ± 3.63#0.08 ± 0.01#1.16 ± 0.46#0.61 ± 0.15#电针治疗组15.19 ± 4.07*0.11 ± 0.01 1.46 ± 0.47*0.59 ± 0.16*19.60 ± 5.01*0.09 ± 0.01*2.01 ± 0.47*0.43 ± 0.08*F 值26.173 4.954 29.815 11.870 43.277 14.818 35.251 20.730 P 值<0.001 0.017<0.001<0.001<0.001<0.001<0.001<0.001
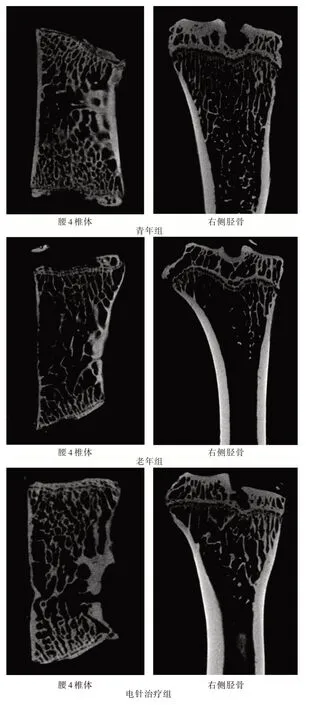
图1 腰椎及胫骨Micro-CTFig.1 Micro-CT images of the proximal tibia and lumbar vertebra
2.3 P53/P21 mRNA 及蛋白表达水平老年组大鼠P53、P21 mRNA 及蛋白相对表达量较青年组明显增加,差异有统计学意义(P<0.01);而电针能显著降低老龄大鼠P53、P21 mRNA 表达(P<0.01),相应的P53、P21 蛋白相对表达量也均有下降(P<0.01),见图2、表5。

图2 P53、P21 mRNA 及蛋白表达水平Fig.2 The relative mRNA and protein expression of P53/P21
表5 P53、P21 mRNA 及蛋白表达水平Tab.5 The relative mRNA and protein expression of P53/P21±s

表5 P53、P21 mRNA 及蛋白表达水平Tab.5 The relative mRNA and protein expression of P53/P21±s
注:与青年组比较,#P <0.01;与老年组比较,*P <0.01,**P <0.05
mRNA Western blot指标P53 P21 P53 P21青年组0.77 ± 0.28 1.25 ± 0.33 0.29 ± 0.07 0.24 ± 0.03老年组4.38 ± 0.52#4.92 ± 0.71#0.60 ± 0.04#0.42 ± 0.05#电针治疗组2.15 ± 0.63*2.19 ± 0.65*0.41 ± 0.05*0.34 ± 0.04**F 值80.712 63.417 49.481 25.039 P 值<0.001<0.001<0.001<0.001
3 讨论
高龄为OP 的重要高危因素之一,OP 不但能导致患者全身疼痛、脊柱畸形等,还会显著增加骨折风险[15-16]。在老年人群中,髋部骨质疏松性骨折严重的影响着患者的运动功能,且患者在1年内的病死率甚至可高达21% ~30%[17-18]。鉴于OP给中老年人群心身健康带来的影响,更深入的探索OP 治疗新机制十分重要。
OP 治疗贯穿于患者的整个生命过程,其治疗存在多样化。针灸为传统治疗措施,近年来逐渐受到重视,有效性已得到临床广泛认可[19]。Micro-CT检测可直观地反映出骨组织吸收与形成情况。本实验中,我们发现与青年组大鼠比较,老年组大鼠腰椎及胫骨的骨小梁均呈现出分布紊乱稀疏、变薄等明显骨吸收表现,而通过电针治疗后,这种骨吸表现得到了有效的改善。相应的微结构定量分析也显示:高龄可降低骨组织BMD、BV/TV、Tb.N,增加Tb.Sp。电针治疗能增加骨组织BMD、BV/TV、Tb.N,降低Tb.Sp。老年组腰椎Tb.Th 低于青年组,电针治疗组中腰椎Tb.Th 较老年组增高,直观地反映了电针能够有效减少高龄所致的骨量丢失,改善OP。同时,在本研究中发现老年组大鼠血清CTX-I 水平较青年组明显增高,而血清PICP 水平较青年组明显降低。众所周知,CTX-1 为反映骨吸收的重要骨代谢指标,PICP 则是反映成骨细胞活性及骨转换的特异性指标[20-21],这间接提示高龄可能降低了大鼠成骨细胞的活性、增加骨吸收、抑制骨形成和导致骨量丢失。而通过对老年大鼠予以电针干预后,血清CTX-I 水平明显降低,PICP水平显著增加。上述实验结果提示:电针治疗可能通过提高老年大鼠成骨细胞活性来促进骨形成,抑制骨吸收。
细胞活性的降低伴随着衰老,OP 的发病与P53/P21 信号通路介导的成骨细胞衰老之间有着密切联系[10-11,22]。P53 可诱导细胞周期阻滞,并能激活下游基因P21[23-24]。P21 基因编码的蛋白可与增殖细胞核抗原相结合,从而抑制DNA 的合成[25]。P21 为至关重要的周期蛋白依赖激酶抑制因子,其可通过结合CDK4-Cyclin 复合物使其激酶活性丧失,最终使细胞周期停滞[26-27]。衰老细胞中的P53、P21 等相关基因表达显著增加[28],下调P21 可减少成骨细胞凋亡、加速成骨细胞增殖周期G1期进程,抑制成骨细胞衰老[10,29-31]。本实验中,老年组大鼠P53、P21 mRNA 及蛋白相对表达量较青年组明显增加,这提示高龄可能加速了细胞衰老。而电针治疗降低了P53、P21 mRNA 及蛋白相对表达量,这反映电针治疗能够抑制因高龄所导致的细胞衰老。结合上述电针能够增加成骨细胞活性、促进骨形成、减少骨量丢失的研究结果,这提示电针可能通过调控P53/P21 信号通路来缓解成骨细胞衰老,并通过增加成骨细胞活性来增加骨形成、减少骨量丢失。
综上所述,本实验中发现高龄可能降低了骨组织中成骨细胞的活性,并因此使骨形成率减少。同时,发现高龄能够使衰老相关基因P53、P21 等呈现出高表达,而细胞的逐步衰老会直接降低细胞的活性。通过电针干预高龄大鼠后,大鼠骨密度增加、骨量丢失减少,相关衰老基因表达下降,反映成骨细胞活性的PICP 也随之增加。因此,在本实验现有的研究基础上,推测电针有可能通过抑制P53/P21 信号通路介导的成骨细胞衰老来增加成骨细胞活性,最终改善高龄所致的OP。
【Author contributions】ZHONG Peirui and HE Xiaoyan performed the experiments and wrote the article. SUN Guanghua,LIU Jing,LI Shuzhi and LIU Yuan performed the experiments. LIAO Ying and QU Mengjian revised the article. ZHOU Jun designed the study and reviewed the article. All authors read and approved the final manuscript as submitted.
