胰高血糖素样肽1受体基因遗传变异对利拉鲁肽治疗2型糖尿病患者疗效的影响
2023-03-09任丽君高红红宋瑞捧
任丽君 高红红 宋瑞捧
河南省直第三人民医院内分泌科(郑州 450002)
2 型糖尿病(T2DM)作为一种以慢性高血糖为特征的慢性多因素代谢紊乱症,有研究预测到2030年全球大约有3.66 亿人患有糖尿病,其中90%以上为T2DM[1]。糖尿病及其并发症的发生率出现逐年升高的趋势,给临床治疗带来了更大的挑战,也对患者的生活质量和心理健康等多方面的改善提出了更高的要求[2]。
胰高血糖素样肽1 受体(GLP1R)是GLP-1 与胰腺β 细胞上的特异性受体[3]。既往研究结果表明GLP1R 中最常见的变异是G168S(rs6923761)和A131P(rs3765467)[4],这些遗传变异与糖尿病的发病机制、肥胖以及对不同糖尿病药物的反应调节有关[5]。此外,该基因的遗传变异的临床意义可能具有种族差异,比如日本人群中的研究表明GLP1R 基因多态性可能是糖尿病发病机制中的一个促进因素,然而高加索人群的研究中GPL1R 的遗传变异与脂质代谢和T2DM 没有显著关联[5]。利拉鲁肽作为一种GLP-1 类似物,特异性和GLP1R结合从而发挥促进胰岛素分泌等一系列的体内生物学效应。然而,利拉鲁肽的临床治疗过程中发现了不同患者的疗效会表现出较大的个体差异[6]。因此,很有必要从遗传变异角度探讨影响利拉鲁肽疗效的生物标记物。
目前在中国的T2DM 患者中尚无大样本的关于GLP1R 基因遗传变异和利拉鲁肽治疗T2DM 疗效的关联研究。因此本研究旨在探讨真实世界中GLP1R 基因遗传变异对利拉鲁肽单药治疗T2DM患者的疗效的影响。
1 对象与方法
1.1 研究设计及入排标准由于利拉鲁肽在中国上市多年,已经有较多的T2DM 患者在临床上接受了利拉鲁肽的治疗。因此,本研究设计为回顾性临床研究,纳入从2018年1月至2022年3月在河南省直第三人民医院内分泌科接受利拉鲁肽单药治疗的T2DM 患者。本研究的具体纳入标准包括:(1)患者为早期T2DM,既往未使用过GLP-1类似物进行治疗;(2)年龄≥18 岁;(3)体质指数(BMI)>24 kg/m2;(4)患者的空腹血糖(FPG)≥7.0 mmol/L,或餐后2 h血糖(2h PG)≥11.1 mmol/L,糖化血红蛋白(HbA1c)≥6.5%;(5)研究前的3 个月内未进行减肥节食;(6)患者接受利拉鲁肽单药治疗超过12 周。排除标准:(1)经临床诊断的其他类型的糖尿病;(2)有甲状腺髓样癌既往史或家族史的患者以及2 型多发性内分泌肿瘤综合征的患者;(3)在使用利拉鲁肽进行治疗的同时合并其他降血糖的药物治疗的患者。本研究的研究流程图如图1 所示,最终共计219 例的患者符合研究目的并纳入本研究进行分析。
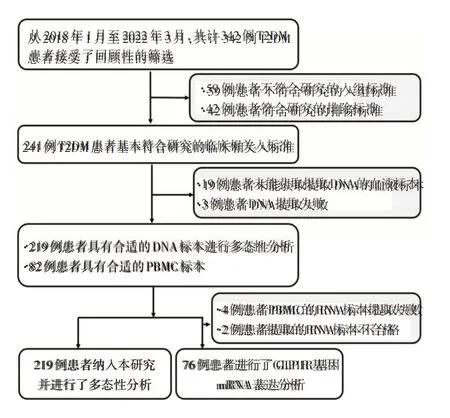
图1 本回顾性临床研究的流程图Fig.1 Flow chart of the retrospective study
本研究得到河南省直第三人民医院伦理委员会审核通过,所有纳入研究的患者均知晓本研究方案并签署知情同意书。
1.2 治疗方案及观察指标所有患者均进行皮下注射利拉鲁肽[诺和诺德(中国)制药有限公司分包装,国药准字J20160037,规格:3 mL:18 mg]进行治疗,初始剂量0.6 mg/d,1 周后调整剂量为1.2 mg/d,治疗期间可根据不同患者的血糖水平变化进行剂量调整,最大剂量为1.8 mg/d[7]。
患者在接受利拉鲁肽治疗前和接受利拉鲁肽12 周治疗后检查患者的FPG、HbA1c、体质量、BMI和腰臀比(WHR)。此外,12 周后根据HbA1c 的情况评估HbA1c 的达标率(HbA1c <7.0% 的患者比例)[8]。
1.3 DNA 提取及基因分型在患者检查FPG 等相关指标时留取患者外周静脉血大约5 mL,采用MiniBEST 全血DNA 提取试剂盒(货号:9781;Takara)从全血中提取DNA,保存在-20 ℃冰箱中备用。在Applied Biosystems 7900 Fast Real-Time PCR 系统中,按照说明书,使用TaqMan®试剂盒C_1340370_10(货号:4351379;Thermo Fisher Scientific)进行基因分型。
根据既往文献报道和NCBI 数据库中GLP1R基因的在中国人群中的多态性位点,本研究选取GLP1R基因的两个遗传变异位点A131P(rs3765467)和G168S(rs6923761)进行多态性分析。后续的关联分析只发现了A131P 位点和疗效的显著关联性,因此本研究只展示了A131P 位点的关联分析结果。
1.4 GLP-1R基因mRNA表达分析收集部分患者的新鲜外周血标本提取外周血单核细胞(PBMC)。最终收集82 例新鲜外周血标本用淋巴细胞分离液Histopaque-1077 对样本进行PBMC 的提取。用Trizol 试剂提取PBMC 当中的RNA,real-time PCR仪器进行GLP-1R 基因的mRNA 表达分析,引物序列的上游引物:5′-ACGGTGTCCCTCTCAGAGAC-3′,下游引物5′-ATCAAAGGTCCGGTTGCAGAA-3′。用GAPDH 的mRNA 表达作为内部参照[9]。分析中4 例患者的PBMC 标本中的RNA 提取失败,2 例患者提取的RNA 标本不合格。因此只有76 例患者纳入了GLP1R 基因的mRNA 表达分析。mRNA 用相对定量法采用2-△△Ct进行计算。
1.5 统计学方法本研究中所有的数据均采用SPSS 25.0 软件进行相应的统计分析。离散型的变量和rs2297136 位点不同基因型的分布采用χ2检验。符合正态分布的连续型的变量和rs2297136位点不同基因型的分析用()表示,组间均值比较采用t检验,治疗前后的指标使用配对t检验。不符合正态分布的连续型变量和rs2297136 位点不同基因型的分析用非参数检验中的Mann-WhitneyU检验进行分析,P<0.05 为差异有统计学意义。
2 结果
2.1 219 例患者中GLP1R 基因A131P 位点不同基因型患者的基线临床资料本研究入组的219 例T2DM 患者的基线临床资料如表1 所示,既往接受其他降糖药物治疗的患者一共186 例(84.9%)。既往降糖药物中接受二甲双胍方案患者114 例(61.3%),接受胰岛素方案患者39 例(21.0%),接受其他降糖药物方案患者33 例(17.7%)。
表1 219 例患者中A131P 位点不同基因型患者的基线临床资料对比Tab.1 Comparison of the baseline characteristics of 219 patients according to genotype status of A131P polymorphism ±s

表1 219 例患者中A131P 位点不同基因型患者的基线临床资料对比Tab.1 Comparison of the baseline characteristics of 219 patients according to genotype status of A131P polymorphism ±s
指标总计(n = 219)χ2/t/U 值P 值年龄[M(P25,P75),岁]性别[例(%)]46(21,68)GLP1R A131P GG(n = 158)45(21,67)GA/AA(n = 61)46(23,68)-0.485 0.618 0.486男女121(55.3)98(44.7)85(53.8)73(46.2)36(59.0)25(41.0)既往降糖药物治疗史[例(%)]0.581 0.446有无糖尿病病程(年)FPG(mmol/L)HbA1c(%)体质量(kg)BMI(kg/m2)WHR 186(84.9)33(15.1)2.2 ± 1.9 11.3 ± 1.1 8.2 ± 0.7 78.2 ± 5.3 28.3 ± 3.5 0.98 ± 0.06 136(86.1)22(13.9)2.2 ± 2.3 11.2 ± 1.2 8.2 ± 0.9 78.1 ± 4.1 28.3 ± 4.4 0.98 ± 0.09 50(81.9)11(18.1)2.3 ± 1.4 11.4 ± 0.9 8.1 ± 1.0 78.2 ± 6.7 28.2 ± 3.9 0.97 ± 0.07-0.317-1.179 0.765-0.134 0.155 0.781 0.376 0.240 0.445 0.447 0.438 0.436
A131P 位点的基因分型结果为:GG 型158 例(72.1%),GA 型56 例(25.6%),AA 型5 例(2.3%),最小等位基因频率为0.15,基因型患者例数符合哈迪温伯格平衡(P=0.988)。后期分析中将GA 和AA 基因型患者合并。基线临床资料对比结果如表1 所示,该位点不同基因型患者在基线临床资料中的分布基本均衡(P>0.05)。
2.2 利拉鲁肽在T2DM患者中的降糖和减重疗效如表2 所示,纳入研究的患者在接受利拉鲁肽12 周后治疗后,血糖和肥胖相关指标均有明显的改善,与治疗前比较差异均有统计学意义(P<0.001)。
表2 219 例T2DM 患者接受利拉鲁肽治疗前后的疗效对比Tab.2 Comparison of the efficacy in the 219 patients with T2DM before and after liraglutide treatment ±s
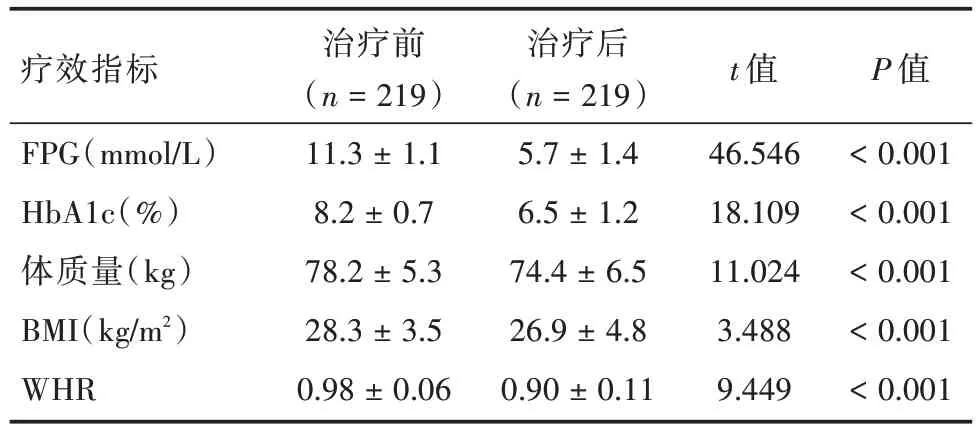
表2 219 例T2DM 患者接受利拉鲁肽治疗前后的疗效对比Tab.2 Comparison of the efficacy in the 219 patients with T2DM before and after liraglutide treatment ±s
疗效指标FPG(mmol/L)HbA1c(%)体质量(kg)BMI(kg/m2)WHR治疗前(n = 219)11.3 ± 1.1 8.2 ± 0.7 78.2 ± 5.3 28.3 ± 3.5 0.98 ± 0.06治疗后(n = 219)5.7 ± 1.4 6.5 ± 1.2 74.4 ± 6.5 26.9 ± 4.8 0.90 ± 0.11 t 值46.546 18.109 11.024 3.488 9.449 P 值<0.001<0.001<0.001<0.001<0.001
2.3 GLP1R 基因A131P 多态性对利拉鲁肽降糖和减肥疗效的影响降糖指标如表3所示,158例GG型患者和61 例GA/AA 基因型患者接受利拉鲁肽治疗后FPG分别为(5.5±1.7)mmol/L和(6.2±1.3)mmol/L(t= -2.903,P= 0.002)。GG 基因型和GA/AA 基因型的FPG 变化值分别为(-6.1 ± 1.6)mmol/Lvs.(-4.3±1.1)mmol/L,差异有统计学意义(t=-8.075,P<0.001)。两组基因型患者的HbA1c 分别为(6.3 ± 1.8)%和(7.1 ± 1.1)%,差异同样有统计学意义(t= -3.243,P<0.001)。此外,接受12 周的利拉鲁肽治疗后共计129 例HbA1c 达标(58.9%)。不同基因型患者的HbA1c 达标情况如图2 所示,GG 型和GA/AA 基因型患者的HbA1c 达标率分别为64.6%(95%CI:56.6%~72.0%)和44.3%(95%CI:31.5% ~57.6%),差异有统计学意义(χ2= 7.488,P= 0.006)。
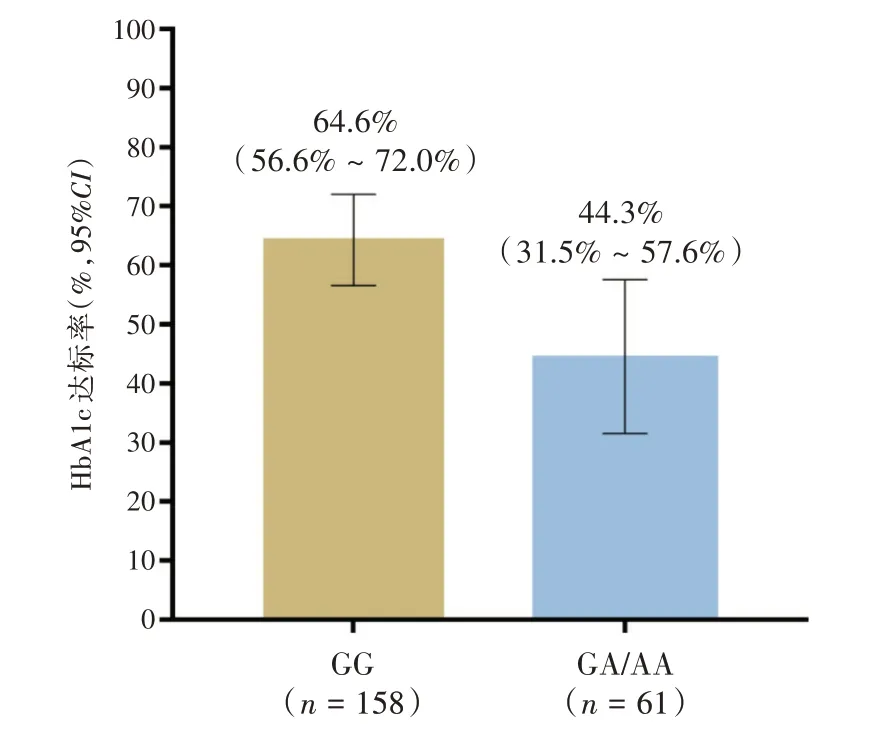
图2 接受12 周利拉鲁肽治疗后不同基因型患者的HbA1c 达标率对比Fig.2 Comparison of target HbA1c achievement rate of patients after 12 weeks liraglutide treatment according to A131P genotype status
接受利拉鲁肽治疗后的减重指标结果如表3所示,158 例GG 型患者和61 例GA/AA 基因型患者12 周后的体质量分别为(73.5 ± 7.1)kg 和(76.7 ±6.9)kg(t=-3.013,P=0.001)。GG 基因型和GA/AA基因型的体质量变化值分别为(-4.5 ± 3.1)kgvs.(-1.5 ± 1.1)kg,差异有统计学意义(t= -7.372,P<0.001)。两组基因型患者12 周后的BMI 分别为(26.6±3.1)kg/m2和(27.7±2.7)kg/m2(t=-2.437,P= 0.008)。GG 基因型和GA/AA 基因型的BMI 变化值分别为(-1.7±1.5)kg/m2vs.(-0.5±0.9)kg/m2,差异有统计学意义(t=-5.850,P<0.001)。两组基因型患者12 周后的WHR 分别为0.89±0.09 和0.93±0.11,差异有统计学意义(t= -2.766,P= 0.003)。
表3 A131P 多态性不同基因型患者接受利拉鲁肽治疗12 周后的疗效对比Tab.3 Comparison of the efficacy in the patients after 12 weeks liraglutide treatment according to A131P genotype status ±s

表3 A131P 多态性不同基因型患者接受利拉鲁肽治疗12 周后的疗效对比Tab.3 Comparison of the efficacy in the patients after 12 weeks liraglutide treatment according to A131P genotype status ±s
疗效指标FPG(mmol/L)HbA1c(%)体质量(kg)BMI(kg/m2)WHR GG(n = 158)5.5 ± 1.7 6.3 ± 1.8 73.5 ± 7.1 26.6 ± 3.1 0.89 ± 0.09 GA/AA(n = 61)6.2 ± 1.3 7.1 ± 1.1 76.7 ± 6.9 27.7 ± 2.7 0.93 ± 0.11 t 值-2.903-3.243-3.013-2.437-2.766 P 值0.002<0.001 0.001 0.008 0.003
2.4 GLP1R基因A131P位点对GLP1R基因mRNA表达的影响76 例T2DM 患者纳入GLP1R 基因mRNA 表达分析,A131P 位点的基因型分布情况为55 例患者是GG 基因型(72.4%),19 例患者是GA基因型(25.0%),2 例患者是AA 基因型(2.6%)。因此,MAF 值同样为0.15。三种基因型的分布频率和219 例T2DM 患者中的基因型分布基本一致(P>0.05)。A131P 位点不同基因型患者的GLP1R基因mRNA 表达如图3 所示,GG 基因型和GA/AA基因型患者的GLP1R 基因mRNA 相对表达量分别为2.38 ± 0.50 和1.88 ± 0.43,差异有统计学意义(t= 4.081,P<0.001)。
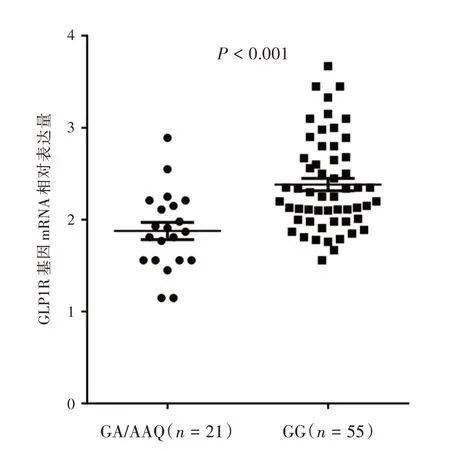
图3 A131P 位点不同基因型的GLP1R 基因mRNA 相对表达情况Fig.3 Relative expression level of GLP1R gene mRNA according to GLP1R A131P genotype status
3 讨论
GLP1 是由回肠/结肠黏膜中的L 细胞合成,研究发现GLP1 作为一种神经内分泌激素,在维持血糖水平、饮食摄入和其他代谢活动中起着重要的生理作用,GLP1R 为GLP1 的主要受体,在血糖稳态和T2DM 治疗中发挥重要作用,该受体长463 个氨基酸,包含7 个跨膜结构域,属于G 蛋白偶联受体家族成员[10]。GLP1 在体内的主要作用过程为食物摄入后,GLP-1 从回肠细胞分泌到血液循环中,作用于不同组织(脑、胰岛、心脏、肾脏和胃肠道),以减轻摄入富含碳水化合物食物后血糖水平的升高。控制血糖水平的机制主要通过改善葡萄糖诱导的胰岛素分泌、刺激胰岛素分泌β 细胞生长、延缓胃排空(从而减少餐后血糖偏移)以及降低食欲[11]。利拉鲁肽作为一种GLP-1 激动剂,目前已经在临床上大范围应用于T2DM 的血糖和体质量控制。然而,由于人体内的遗传变异的影响,利拉鲁肽临床应用过程中疗效出现相对较大的个体差异。需要进一步探索可以影响利拉鲁肽疗效的生物标记物[12]。
考虑到合并用药可能会影响患者疗效的判断,因此本研究纳入了219 例接受利拉鲁肽单药治疗的T2DM 患者,从而可以更明确地判断GLP1R基因多态性和利拉鲁肽疗效的关联[13]。研究纳入的219 例患者为临床常见的T2DM 患者,其中186 例患者既往曾接受过其他降糖药物的治疗,且219 例患者纳入研究时的平均HbA1c 为9.2%,平均BMI(28.3 kg/m2)也提示这些患者为轻度肥胖的T2DM 患者,因此这些患者接受利拉鲁肽单药的治疗也是符合临床治疗规范的[14]。219 例患者在接受利拉鲁肽治疗12 周后FPG、HbA1c 以及HbA1c 达标率(<7%)等血糖指标和体质量,BMI 以及WHR等肥胖指标均有显著的下降,研究结果和既往利拉鲁肽在真实世界中对T2DM 伴轻度肥胖患者的疗效基本一致[15]。然而,需要注意的是,本研究中FPG 指标和HbA1c 的平均下降幅度较其他研究相对较多,原因可能是本研究纳入的是相对早期的T2DM 患者,既往接受的降糖药物治疗相对不多,可能对利拉鲁肽更为敏感,所以降糖效果更为明显[16]。基因多态性分析结果A131P 位点在研究患者中的MAF 为0.15,这和NCBI 数据库中中国患者的该位点分布频率基本一致,也和既往的研究结果相符[17]。本研究结果表明接受12 周的利拉鲁肽治疗后,与GG 基因组相比,A 等位基因携带患者的FPG、HbA1c、体质量、BMI 和WHR 下降幅度均较低。而且GG 基因型患者的HbA1c 达标率显著高于GA/AA 基因型患者(64.6%vs.44.3%,P=0.006)。研究结果和既往GUAN 团队的研究结果保持一致。他们的研究纳入了176 例接受GLP1 激动剂(艾塞那肽和利拉鲁肽)治疗的T2DM 患者,分析了GLP1R 多态性rs10305420 和rs3765467 两个位点和疗效的关联[18]。结果也发现了rs3765467 基因型的GG 型患者HbA1c 下降幅度更大,且HbA1c 达标率更高(50.9%vs.23.8%)。然而,由于GUAN 团队纳入的患者接受的治疗不均一,除了利拉鲁肽外还有别的降糖药物,这可能会影响多态性和疗效结果的判断。本研究纳入的患者均接受了利拉鲁肽单药的治疗,且进一步探讨了该位点和体质量、BMI 以及WHR 的关联,结果进一步确认了该位点可能成为预测利拉鲁肽疗效的生物标记物。同样,既往DE 团队在西班牙的糖尿病患者中分析了GLP1R 基因多态性的临床意义[19]。研究纳入了90例接受利拉鲁肽治疗的糖尿病患者分析了GLP1R基因的多态性,结果发现rs6923761 位点和利拉鲁肽的减肥指标(体质量和BMI)显著相关。然而,在中国人群中rs6923761 位点非常保守,几乎不存在遗传变异。因此,以上的多态性研究结果也都提示了GLP1R 基因遗传变异可能会在一定程度上影响该受体的功能从而干扰了利拉鲁肽的临床治疗效果。
为了进一步探讨A131P 位点影响利拉鲁肽疗效的可能原因,本研究在76 例患者中进行了GLP1R 基因mRNA 表达分析,结果提示GA/AA 基因型患者伴随了相对较低的GLP1R 基因mRNA表达。结果提示了A131P 位点可能在体内通过改了该基因的mRNA 表达可能一定程度上影响了该受体的功能。既往LI 团队的研究结果提示rs3765467 位点可能因为基因型的改变影响了β 细胞胰岛素的分泌从而降低了GLP1 激动剂的疗效[20]。这在一定程度上也和本研究中的结果基本一致。然而,在体内A131P 位点具体通过什么途径影响利拉鲁肽的疗效尚需要机制研究进一步探讨。
当然,本研究也存在一定的局限性。首先,本研究只纳入了本院接受治疗的患者,大部分患者是当地居民,遗传学特征相对较为单一,多态性分析尚需要在遗传学更丰富的人群中进一步探讨。此外,研究的样本量偏小,后期未进行长期的随访,试验结果可能存在一定的偏倚。然而,本研究通过相对丰富的数据确定了GLP1R 基因多态性位点A131P 对利拉鲁肽治疗T2DM 的疗效具有潜在的影响。研究结果也初步表明GLP1R 基因A131P位点可能可以用作预测利拉鲁肽降糖和减重疗效的潜在的生物标记物。未来尚需要进一步开展机制研究去探索A131P 位点影响利拉鲁肽临床疗效的潜在机制。
【Author contributions】REN Lijun performed the experiments and wrote the article. GAO Honghong performed the experiments. REN Lijun and SONG Ruipeng revised the article. SONG Ruipeng designed the study and reviewed the article. All authors read and approved the final manuscript as submitted.
