1 例肺原发性微小脑膜瘤样结节临床病理分析并文献分析
2023-03-05杨阳吕培勇杨宇龙张功学
杨阳,吕培勇,杨宇龙,张功学
(枣阳市第一人民医院1 病理科,2 呼吸与危重症医学科,湖北 枣阳,441200)
肺微小脑膜瘤样结节(minute pulmonary menin‐gothelial‐like nodules,MPMN)由 David K 等学者于1960 年首次报道[1]。 因病变极小,术前检查多不易发现,通常在因其他疾病而行肺手术切除标本中偶然发现,以女性较常见,通常伴发腺癌。检索国内外相关文献,报道均较少,临床及病理医师对其了解甚少,现结合我院近期发现的一例MPMN,查阅相关文献,总结其相关临床及病理组织学特征、病理鉴别诊断及其预后,提高临床医师和病理医师对该类型少见疾病的认识。
材料与方法
1 临床资料
患者,男,61 岁,发现肺结节半年余。患者半年余前检查发现肺结节,无咳嗽、咳痰,无发热及胸闷不适,2022 年10 月10 日来院复查发现右肺上叶磨玻璃结节较前增大。胸部增强CT:右肺上叶磨玻璃结节,肿瘤性病变不除外,左肺上叶少许纤维灶,双肺少许感染性病变,头部CT 未见异常。无脑膜瘤病史。术中右肺上叶磨玻璃结节送冰冻诊断为炎性病变。
2 方法
标本经4%中性缓冲甲醛液固定,常规脱水,石蜡包埋,4 μm 厚切片,HE 染色,光镜下观察。免疫组织化学一抗为即用型抗体,包括Vim、EMA、PR、CD56、SSTR2a、CgA、SY、CK‐P、TTF‐1,采用EnVision 两步法,DAB 显色,操作按说明书进行。
结 果
1 病理学特征
切除之右肺上叶组织大小17 cm×10.5 cm×3 cm,一侧见长5.5 cm 吻合缘,支气管断端长0.6 cm,直径2 cm,系线处见直径0.5 cm 红褐区,余切面未见明显结节。原系线区周围常规取材,发现直径2 mm非典型腺瘤样增生,其旁镜下发现一直径0.5 mm 界清结节。低倍镜下,病变区界限清晰,由上皮样或短梭形上皮样细胞构成,围绕薄壁小血管呈漩涡状生长(图1A)。高倍镜下细胞界限不清,胞浆红染,染色质细腻,均匀,未见核分裂(图1B)。
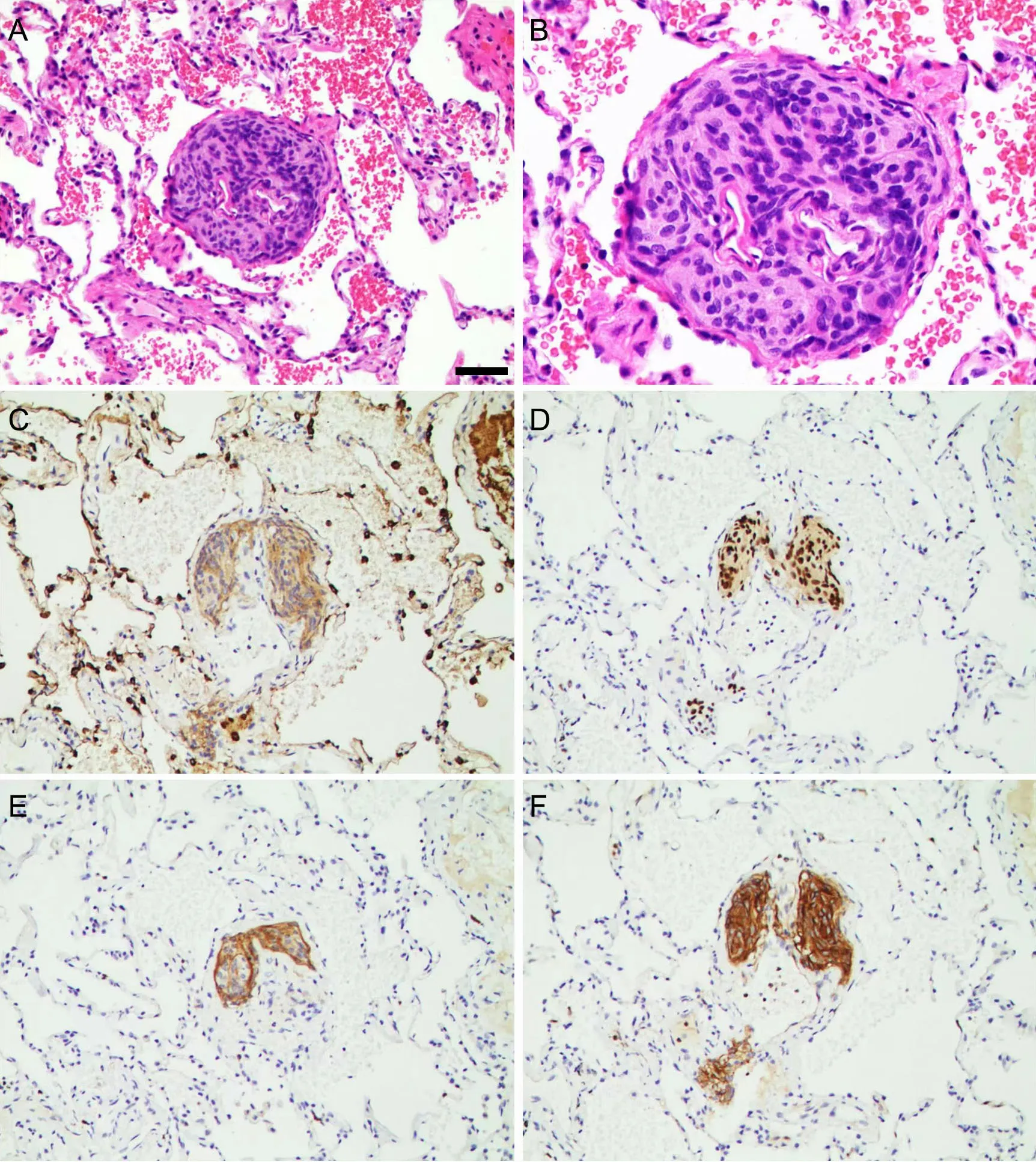
图1 肺原发性微小脑膜瘤样结节组织学及免疫组织化学特征。A,结节由上皮样或短梭形上皮样细胞构成,围绕薄壁小血管呈漩涡状生长;B,细胞界限不清,胞浆红染,染色质细腻,均匀,未见核分裂;C,病变区细胞EMA 阳性;D,病变区细胞PR 阳性;E,病变区细胞CD56 阳性;F,病变区细胞SSTR2a 阳性。A 和B,HE 染色;C—F,免疫组织化学染色。比例尺,50 μmFig. 1 Histopathological and immunohistochemical features of minute pulmonary meningothelial‐like nodule (MPMN). A, MPMN was consisted of epithelioid or short spindle epithelioid cells, which grew in a whirlpool shape around thin‐walled small blood vessels; B, the cell boundaries were not clear, the cytoplasm was dyed red, the chromatin was delicate and uniform, and no mitosis was observed; C, the cells in the lesion area showed positive for EMA; D, the cells in the lesion area showed positive for PR; E, the cells in the lesion area showed positive for CD56; F, the cells in the lesion area showed positive for SSTR2a. A and D, HE staining; C to F, immunohistochemical staining. Scale bar, 50 μm
2 免疫组织化学特征
病变区细胞Vim、EMA(图1C)、PR(图1D)、CD56(图1E)、SSTR2a(图1F)均阳性,CgA、SY、CK‐P、TTF‐1 均阴性。
3 病理诊断
(右肺上叶)肺非典型腺瘤样增生(直径2 mm)合并微小脑膜瘤样结节。
4 随访
患者于术后定期于我院复诊,随访时间截止到2023 年5 月,随访时间7 个月,目前患者一般情况较好,未见转移和复发。
讨 论
1 临床特征
1988 年由Gaffey 等学者研究发现某些肺结节缺乏神经内分泌特征,与脑膜上皮细胞非常相似,开始提出“微小的脑膜上皮样结节”这一术语[2]。尸检或手术切除时的检出率约为0.3%~9.5% 。手术切除的大体标本中,发病率达到7%~13.8% ,如果对肺叶切除术的标本进行广泛取材后的检出率为 48%[3]。因此,我们认为MPMN 的实际发病率可能高于报告的发病率。MPMN 细胞对孕激素受体PR 表达呈阳性,孕酮刺激可能会促进肺腺癌和MPMN 中的细胞生长,因此与其他原发性肺部恶性肿瘤相比,肺腺癌患者更常发现伴发MPMN,在女性中比在男性中更常见[4]。但本例患者为男性,临床表现为右肺上叶磨玻璃结节,双肺少许感染性病变。
2 组织学起源及发病机制
MPMN 组织学与脑膜瘤类似,但组织学起源可能不同。2004 年Ionescu 等利用杂合性缺失基因对比分析1 组MPMN 与脑膜瘤病例,结果发现孤立的MPMN 缺乏突变损伤,而脑膜瘤出现最高频率的杂合性缺失,主要存在于染色体22q、14q 和1p,进而从分子病理学层面支持MPMN 组织学起源与脑膜瘤并不相同[5]。MPMN 可能代表反应性和肿瘤性增殖之间的转变[3]。 MPMN 可能与肺血栓栓塞、间质性肺炎等慢性肺部疾病、充血性心力衰竭有关。这些慢性肺部疾病可能会刺激肺部外部微环境改变并诱发MPMN 的形成,例如肺泡间隔的拉伸或硬化,或缺氧、缺血、实质破坏等[3]。目前,关于MPMN的发病机制尚不明确。
3 组织病理学特征
MPMN 的典型特征是无包膜,边界清晰,围绕肺间质的小静脉排列呈“Zellballen”模式,这些细胞与正常的蛛网膜细胞和脑膜瘤细胞类似,细胞卵圆形或短梭形呈漩涡状排列,可沿肺泡间隔或血管周围生长,细胞无明显异型,胞质嗜酸,染色质细腻、核仁不明显、核分裂象罕见,部分细胞可有明显的核内包涵体,细胞团之间可见丰富的薄壁小血管[6]。本例患者镜下病变区界限清晰,由上皮样或短梭形上皮样细胞构成,围绕薄壁小血管呈漩涡状生长,胞浆红染,染色质细腻,均匀,未见核分裂,与文献描述一致。
4 免疫组织化学表型
MPMN 可阳性表达PR、EMA、Vim、CD56,与脑膜瘤的免疫组化表达类似,Tao等学者于2019年对19 例MPMN 病灶的研究均显示SSTR2a 呈现强而弥散的胞浆表达,且SSTR2a 在MPMN 中的的阳性率明显高于脑膜瘤常规标志物,因此,MPMN 再次显示出与脑膜上皮细胞类似的免疫表型[7]。本例瘤细胞Vim、PR、SSTR2a 均强阳性表达,CD56 中等强度表达,EMA 弱阳性表达细胞膜,结合典型HE 特征,以及患者无脑膜瘤病史,头部CT 未见异常,最终诊断为肺原发性微小脑膜瘤样结节(MPMN)。
5 鉴别诊断
①转移性脑膜瘤:影像学显示颅腔内有原发灶或有脑膜瘤病史,脑膜瘤可出现杂合性缺失,MPMN缺乏突变损伤。
②肺微瘤型类癌:肿瘤直径<0.5cm,与终末细支气管密切相关,器官样生长方式[8],纤维血管间隔丰富,瘤细胞椒盐样核染色质,免疫组织化学染色CK‐P、Syn、CgA 阳性,SSTR2a、vimentin、PR阴性。
③肺淋巴管平滑肌瘤病(pulmonary lymphan‐gioleiomyomatosis, PLAM):二者一致的梭形细胞或上皮样细胞呈束状无规律地排列,沿淋巴管、血管及细支气管分布或围绕肺囊性边缘,核分裂不易见[6]。PLAM 上皮样细胞ER、PR 可阳性表达[8],同时表达SMA 等肌源性标记和黑色素细胞标记物HMB‐45[10],而MPMN 则不表达肌源性和黑色素细胞标记物。
④原位腺癌:间质增生的原位腺癌有贴壁样结构,低倍下与MPMN 在肺泡间隔内增生需要鉴别,高倍镜下原位腺癌增生的肺泡上皮呈靴钉样,有中度异型性,MPMN 为间质细胞的增生[11]。
6 治疗与预后
MPMN 临床少见,通常是良性病程,可长期随诊,避免过度诊疗。本例患者于术后定期于我院复诊,随访至今一直情况良好,未见转移和复发。但随着影像学检查技术提高,MPMN 在以后的实际工作中出现的频率会逐渐提高,临床及与病理医生需加强对该疾病认识。在肺内结节,特别是微小结节,应将MPMN 纳入鉴别诊断中。然而我们也不能过于轻视MPMN,因MPMN 易伴发肺部恶性肿瘤,后续还需收集更多的病例,总结经验,揭示MPMN 发病机制,更加准确评估MPMN 的预后。
