超氧化物歧化酶1 基因与果蝇寿命和攀爬能力的关系
2023-03-05石玉霞曹旭婷朱凯耿磊陈冬生
石玉霞,曹旭婷,朱凯,耿磊,陈冬生
(安徽师范大学生命科学学院,芜湖 241000)
超氧化物歧化酶1(superoxide dismutase 1,SOD1)普遍存在于需氧生物体内是一种结合Cu/Zn的酶,该酶的主要功能是催化超氧化物并在过氧化氢酶的作用下将有毒物质转化为氧气和水[1]。氧化自由基(reactive oxygen species, ROS)是呼吸作用产生的一类超氧自由基且该物质的过度积累会引发细胞的损伤,最终引起生物体的衰老[2]。SOD1 作为生物体内抗氧化酶系的重要成员,其通过与超氧阴离子直接结合将自由基(ROS)氧化成H2O2,从而维持细胞内适宜的ROS 浓度,进而达到保护机体的作用[2‐3]。
果蝇,又称黑腹果蝇隶属于昆虫纲双翅目果蝇科,其发育方式属于完全变态发育,主要包括四个时期,即:卵→幼虫→蛹→成虫。果蝇具有遗传背景清晰、易培养、繁殖快等优点,为衰老的研究提供了便利[4]。此外,果蝇基因高度保守,为人类衰老与发育生物学研究提供了一个理想的模型[5‐6]。
衰老是生物体内基因和环境共同决定的一种生理现象,寿命是衡量衰老最直观、确切的指标,同一物种的最长寿命相差不大[7‐8]。改变果蝇所处条件可以不同程度的延缓或加速衰老的进程,例如降低温度(20 ℃)培养可延长果蝇寿命,而提高温度(29℃)会加速衰老、缩短果蝇寿命[9]。目前关于衰老的假说主要有氧化自由基学说、端粒学说、免疫学说等[10‐11]。本研究主要涉及氧化自由基学说,该学说阐述了细胞内的氧化因子(如ROS)和抗氧化因子(如SOD1)含量不平衡时,会导致前者的积累,进而引起各种生物大分子氧化损伤,最终导致个体的衰老乃至死亡[12‐13]。
已有研究表明,SOD1 基因sod1在真核生物中高度保守[14],该基因与多种疾病相关,如肌萎缩侧索硬化、帕金森病、唐氏综合症[15‐17]。但目前关于sod1基因调控衰老的报道较少。本研究以果蝇为实验材料,通过下调或上调sod1的表达,统计果蝇的寿命,测量其攀爬能力,以揭示sod1与衰老及运动能力之间的相关性,希望为人类衰老机制的研究提供有价值的分子资料。
材料与方法
1 果蝇品系
购自Bloomington Drosophila Stock Center:野生型W1118(Bloomington 3605);转基因DNA(定点插入)工具株:{y1 v1P{nos-phiC31int.NLS}X;P{-CaryP}attP40(Bloomington 25709);gal工具株:tub-gal4(Bloomington 5138)、tub-gal80ts(Blooming‐ton 7019);购自清华果蝇RNAi 品系库:sod1-RNAi-THattp2(THU 3207);实验室自制转基因果蝇:ATBsod1P4K-GFP-sod1-3’UTR;UAS-attB-sod1-3’UTR。
2 实验试剂及仪器
DNA Polymeras、溴化乙锭(EB)、DNA 纯化试剂盒、LB 固(液)体培养基、胶回收试剂盒、酚/氯仿、氨苄青霉素、dNTP(10 mmol/L)、RNase A酶、普通DNA 产物纯化试剂盒等;体视显微镜、离心机、PCR 扩增仪、恒温水浴锅、恒温箱、摇床、紫外分光光度计、Sutter P97 拉针仪、显微注射仪、酶标仪、荧光显微镜等。
3 果蝇重组载体构建
使用Sequence Builder 软件设计ATB-sod1P4KGFP-sod1-3’UTR、UAS-attB-sod1-3’UTR引 物(表1)并由生物公司合成;利用PCR 扩增分别获得目的基因sod1、3’UTR、GFP、sod1-P4K;再利用重叠PCR 获得基因片段sod1‐3’UTR、GFP-sod1-3’UTR;经过PCR 产物纯化、DNA 与载体同时酶切、连接、菌液PCR、小提质粒等步骤获得以上两个重组质粒;最后,对质粒进行酶切鉴定及生物公司测序验证构建成功后方可留种保存或继续实验。

表1 PCR 所用引物Tab. 1 Primers for PCR
将鉴定成功的质粒菌液用含有氨苄的LB 液体培养基过夜培养,再利用大提质粒的方法,提取高浓度、高纯度的质粒。
4 制备转基因果蝇
通过显微注射方法将得到的2 个质粒载体,分别注射于工具果蝇(y1 w*P{nos--phiC31int.NLS}X;PBac{y+-attP-3B}VK00040,BDSC: 35568)新产的卵中。注射结束后的卵置于涂有酵母的平板中,然后将平板放于25 ℃恒温箱培养2 d 左右,待卵发育成蠕虫状态,将其转移至搅碎的培养基中培养。最后,将其成虫与工具果蝇(w;sp/Cyo;bam△86/TM3)杂交,后代眼色为橘黄色的果蝇即为转基因果蝇。
5 免疫组织化学染色
将ATB-sod1P4k-GFP-sod1-3’UTR转 基 因 果 蝇肠道剖出并经过固定、漂洗、封闭后加入含有GFP抗体的溶液置于4 ℃冰箱摇床摇晃过夜;第2 d 将组织经漂洗后加入被荧光标记的二抗溶液避光摇床摇晃3 h;而后对二抗进行漂洗,最后将组织压片后在荧光显微镜下观察、拍片。
6 果蝇杂交
将tub-gal80ts;tub-gal4果蝇与UAS-sod1-RNAi-THattp2果蝇杂交,后代基因型tub-gal80ts;tubgal4>UAS-sod1 RNAi即为全身性敲低sod1基因的果蝇;将UAS-attB-sod1-3’UTR转基因果蝇与tubgal4果蝇杂交,后代表型为长毛的即为全身性过表达sod1基因的果蝇。
7 果蝇寿命统计和爬行能力的检测
收集羽化48 h 内的果蝇并将其转移至新的培养基中培养(培养温度:29 ℃),之后每2 d 为果蝇更换新的培养基,并记录在此期间死亡的果蝇只数和死亡的天数,直至所有果蝇死亡;在寿命统计的第10 d、20 d 和30 d 分别进行运动能力测试,实验步骤为:首先,在距离果蝇管子底部5 cm 处标记刻度线,随后将20 只果蝇转入空管中并震荡管壁,使果蝇全部落于管底,最后记录15 s 内爬过 5 cm 刻度线的果蝇只数并计算出其所占百分比;将所得寿命、运动能力数据输入到软件Graph prism 8 中,最后生成生存曲线图、平均寿命柱状图及运动能力曲线图。
结 果
1 重组载体构建与转基因果蝇制备
首先,PCR 扩增分别得到目的基因sod1(462 bp)、3’UTR(272 bp)、GFP(714 bp)(图1A)和sod1基因4 kb 启动子(sod1P4k)(图1B)。利用重叠PCR 扩增得到sod1-3’UTR(734 bp)、GFPsod1-3’UTR(1448 bp)(图1C)。片段纯化后与载体(UAS和ATB)酶切,经连接、转化获得UASsod1-3’UTR和ATB-sod1P4k-GFP-sod1-3’UTR两 种果蝇转基因载体。重组载体经测序确认构建成功,经显微注射获得两种转基因果蝇品系。

图1 PCR 扩增目的基因。A,PCR 扩增sod1 编码区、3’非翻译区和GFP 编码区;B,PCR 扩增sod1 4kb 启动子;C,重叠PCR 扩增sod1‐3’UTR、GFP‐ sod1‐3’UTRFig. 1 The target gene was amplified by PCR. A, PCR amplification of sod1, 3’UTR, GFP; B, PCR amplification of sod1P4K; C, overlap PCR amplifi‐cation of sod1‐3’UTR、GFP-sod1-3’UTR
2 sod1 表达产物在细胞质中高表达
转 基 因 果 蝇ATB-sod1P4k-GFP-sod1-3’UTR细胞中GFP基因与sod1为融合表达,取转基因果蝇的肠道,采用GFP 蛋白抗体对果蝇肠道进行免疫荧光染色并拍照。利用GFP 特异性追踪sod1表达产物的亚细胞定位,同时通过DAPI 染色定位细胞核。结果所示,sod1表达产物仅在细胞质中高表达,在细胞核中不表达(图2)。sod1表达产物的表达定位与其在细胞质中承担着清除自由基的功能相一致。

图2 ATB‐sod1P4k‐GFP-sod1-3’UTR 转基因果蝇肠道细胞中sod1 表达检测。细胞核:DAPI 染色;细胞质:GFP 抗体染色,箭头显示细胞质高表达;比例尺,10 μmFigure 2 Detection of sod1 expression in intestinal cells of transgenic fly with the genetype of ATB-sod1P4k-GFP-sod1-3’UTR. Nucleus: DAPI staining;Cytoplasm: GFP staining, the arrows show high expression in the cytoplasm; Scale bar, 10 μm
3 敲低sod1 表达显著缩短果蝇的寿命
首先,通过杂交并低温(18℃)培养获得基因型为tub-gal80ts;tub-gal4>UAS-sod1 RNAi的子代果蝇。gal80ts 是一种温度敏感型蛋白,低温下(18℃)与gal4蛋白结合并抑制其蛋白活性,高温下(29℃)解除对gal4的抑制,从而允许gal4结合UAS位点,启动UAS下游基因的表达。tub-gal4>UAS-sod1 RNAi基因型中:tub-gal4为广谱表达(tub表示管家基因tubulin启动子),诱导UAS-sod1 RNAi产生全身型干扰sod1的表达。
然后,将刚羽化后果蝇tub-gal80ts;tub-gal4>UAS-sod1 RNAi转移至29℃下培养,分雌雄进行寿命统计。结果显示:在29℃ 培养条件下,雄性亲本tub-gal80ts;tub-gal4(对照组)平均寿命约为39.45 d(n=148),而tub-gal80ts;tub-gal4>UAS-sod1 RNAi雄性果蝇平均寿命仅约为22.8 d(n=156)(图3A)。与对照组相比,实验组雄性果蝇平均寿命缩短了42.2%(P<0.0001)。同样条件下,雌性亲本对照平均寿命约为39.13 d(n=165),sod1RNAi雌性果蝇平均寿命为33.8 d(n=147)(图3B),平均寿命缩短了5.33 d(P<0.01)。结果表明:敲低sod1显著缩短果蝇寿命。

图3 sod1 敲低对果蝇寿命的影响。A,雄性果蝇生长曲线(左)和平均寿命统计学分析(右);B 雌性果蝇生存曲线(左)与平均寿命统计学分析(右);****,P<0.0001;**,P<0.01Fig. 3 The effect of sod1‐knocking down on the lifespan of flies. A, the survival curve of male flies (left) and statistical analysis of mean longevity (left); B, the survival curve of female flies (left) and statistical analysis of mean lon‐gevity (left); ****, P<0.0001; **, P<0.01
4 过表达sod1 基因显著延长果蝇寿命
首先,通过杂交获得基因型为tub-gal4>UASsod1-3’UTR的子代果蝇。然后,将其培养于29℃条件下,分雌雄进行寿命统计。结果显示:雄性亲本tub-gal4果蝇(对照组)平均寿命约为29.56 d,而sod1基因过表达组雄性果蝇平均寿命约为40.26 d(图4A)。与对照组相比,过表达组果蝇平均寿命延长了36.2%(P<0.0001);同样,雌性对照组果蝇平均寿命约为31.71 d,过表达组雌性果蝇平均寿命约为37.88 d(图4B),后者比前者平均寿命延长了6.17 d(P<0.0001)。结果表明:无论雌雄,过表达sod1基因均可显著延长果蝇的寿命。
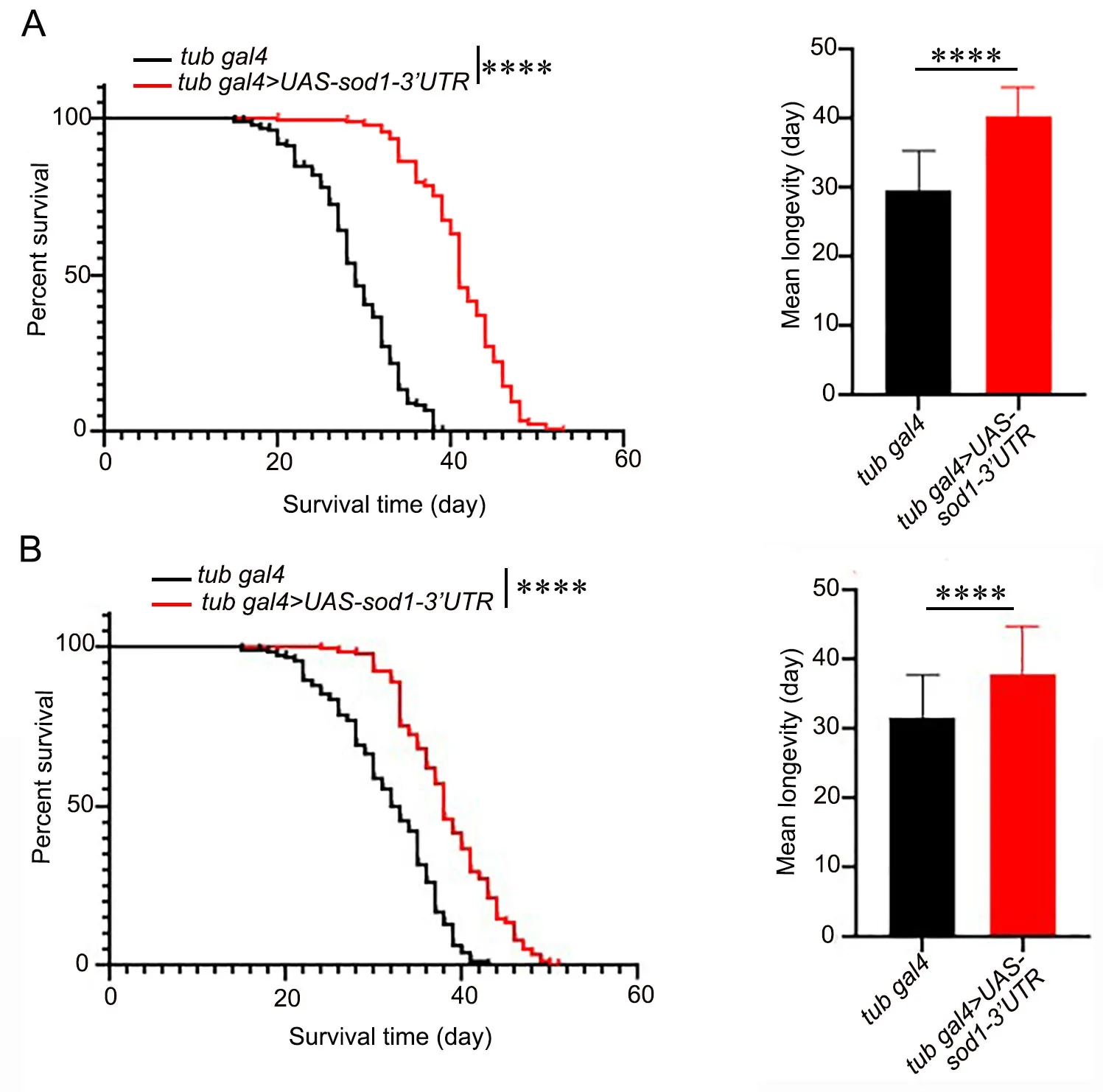
图4 sod1过表达对果蝇寿命的影响。A,雄性果蝇生长曲线(左)和平均寿命统计学分析(右);B 雌性果蝇生存曲线(左)与平均寿命统计学分析(右);****,P<0.0001;**,P<0.01Fig. 4 The effect of sod1 overexpression on the lifespan of flies. A, the survival curve of male flies (left) and statistical analysis of mean longevity (left); B, the survival curve of female flies (left) and statistical analysis of mean lon‐gevity (left); ****, P<0.0001; **, P<0.01
5 sod1 调控果蝇运动能力
果蝇的运动能力随着其衰老程度的增加逐渐衰退[19],因此运动能力可以反映其衰老的进程。通过在培养管上设置标志线,统计一段时间内爬过刻度线的昆虫数量来检测sod1敲低及过表达对果蝇运动能力的影响。结果显示:与对照组果蝇相比(图5A、5B),敲低组雌、雄果蝇运动能力均显著下降(P<0.05)。反之,过表达组雌、雄果蝇运动能力均显著增强(P<0.05)(图5C、5D)。结果表明,sod1基因调控果蝇运动能力。

图5 sod1 敲低和过表达对果蝇攀爬力的影响。A 和B,sod1 敲低对雄性(A)和雌性(B)果蝇攀爬力的影响;C 和D,sod1 过表达对雄性(C)和雌性(D)果蝇攀爬力的影响;与tub‐gal80ts; tub‐gal4 组(A 和B)或tub‐gal4 组(C 和D)比较: *,P<0.05Fig. 5 The effect of knockdown and overexpression of sod1 on the climbing ability of Drosophila. A and B, the effect of knockdown of sod1 on the climbing ability of male (A) and female (B) Drosophila; C and D, the effect of sod1 overexpression on the climbing ability of male (C) and female (D)Drosophila; *, P<0.05, compared with tub‐gal80ts; tub-gal4 group (A and B) or tub‐gal4 group (C and D)
讨 论
SOD 作为生物体内抗氧化酶系的重要成员,可以通过氧化ROS,维持机体氧化系统和还原系统的平衡[20],从而保护机体。目前共发现3 种SOD 基因,即sod1和sod3(编码结合Cu/Zn 离子的SOD蛋白)和sod2(编码结合Mn 离子的SOD 蛋白)。sod1主要定位于细胞质,sod2定位于线粒体基质,sod3分泌至细胞外发挥功能[21‐22]。本文通过构建ATB-sod1P4K-GFP-sod1-3’UTR转基因果蝇,以肠道为研究对象检测sod1的亚细胞定位,免疫荧光染色结果提示sod1可能仅在细胞质中发挥功能。
Phillips 等报道,利用甲基磺酸乙酯诱变果蝇获得Cu/Zn‐SOD(sod1编码)缺失突变体,发现雄性果蝇的平均寿命显著缩短,并且增强了对白叶枯的敏感性[23]。Fleming 等报道,将牛Cu/Zn‐SOD 的cDNA通过显微注射制备转基因果蝇,高表达牛SOD 蛋白果蝇的平均寿命显著延长,同时证明了sod的高度保守特性[24]。黄晓峰等在饲料中添加SOD 酶能显著延长雌雄果蝇的平均寿命[11]。本研究利用RNAi 干扰技术,获得sod1敲低果蝇品系;同时利用显微注射方法制备sod1转基因果蝇。结果发现敲低sod1可以显著缩短雄性、雌雄果蝇的寿命且运动能力均会发生明显的下降,过表达sod1可显著延长雄性、雌性果蝇寿命并展现出更强的运动能力。上述结果与前人sod1突变体结果相一致,也表明sod的功能无性别差异。
此外,本研究发现无论是敲低sod1或是过表达sod1,雄性果蝇寿命变化程度都更加显著,雌性果蝇则展现出相对温和的变化。我们推测这种不同,可能是由于雌性果蝇体内有更多的激素参与了果蝇的衰老,从而减弱了sod1对果蝇衰老的调控。
