纤维蛋白原通过激活EGFR 信号通路抑制体外低糖低氧损伤神经元轴突再生
2023-03-05曾雯谭玲娟周胜强刘芳
曾雯,谭玲娟,,周胜强,刘芳
(1 湖南中医药大学,长沙 410000;2 湖南省中医药研究院附属医院,长沙 410006)
缺血性脑卒中是目前常见的疾病之一,该病具有高致死率、高致残率的特点[1]。缺血性脑卒中的首选治疗方法是溶栓治疗,即使目前的医疗水平较过去有大幅度提升,但囿于时间窗的限制,大部分患者不能得到及时的治疗[2]。大脑正常功能运行依赖于神经元之间的交互作用,轴突的损伤可能中断神经元与其下游靶标的连接,导致神经功能缺损[3]。因此,轴突再生对于脑缺血损伤后受损神经元以及神经功能的恢复至关重要,但成人中枢神经系统的神经元轴突再生和突触新生能力有限,脑缺血会引起中枢神经系统的神经元轴突损伤,最终引起功能永久性缺损[2,4],增加了社会、经济与护理的负担,降低了患者的生活质量。因此,如何促进卒中后神经元轴突再生、重建神经回路是目前亟待解决的科学问题。
神经元轴突再生是一个复杂的多因素调节过程,受到胞内环磷酸腺苷、胞外神经营养因子、轴突再生抑制因子以及胶质瘢痕等诸多内外环境因素的精确调控[5]。既往研究证实,即使改善神经元内在再生能力,神经元的轴突再生水平依然十分有限,而少突胶质细胞所分泌的髓鞘相关抑制因子、胶质瘢痕分泌的蛋白聚糖等神经系统合成的蛋白质被一直认为是影响脑梗死后轴突再生的决定因素[6‐8],但令人遗憾地是,临床上即使这些蛋白质被去除或者相关信号分子被抑制,大多数神经元仍然表现出很弱的轴突再生能力[9]。近年来,血液中一种重要凝血蛋白纤维蛋白原(fibrinogen,Fg)在中枢神经系统损伤与修复过程中的作用越来越受到科研工作者的广泛关注[10‐12]。科学家惊奇地发现Fg 竟然是抑制神经元轴突再生的一个“背后黑手”,由于其复杂的纤维结构且容易形成不溶性的纤维蛋白网而难以清除,可能在介导神经元轴突再生障碍过程中扮演着关键角色。既往研究证实,Fg 可作为配体与正常脊髓神经元整合素受体αvβ3 结合进而反式激活表皮生长因子受体(epidermal growth factor receptor,EGFR),调控轴突生长[13]。但Fg 对体外低糖低氧损伤皮层神经元轴突再生水平有何影响及其效应机制,目前尚不清楚。EGFR 信号通路与中枢神经轴突再生调控密切相关。EGFR 信号可以抑制轴突再生,阻碍神经功能恢复[14]。EGFR 信号通路激活后,p‐EGFR 的表达会随之升高[15],研究多采用观察p‐EGFR 的表达量以判定EGFR 通路是否被激活。轴突骨架蛋白CRMP‐2 和MAP‐1B 同属EGFR 信号通路下游调控蛋白,CRMP‐2、MAP‐1B 的mRNA 表达与轴突再生成正相关[16‐19]。
因此,本研究采用低糖低氧(low glucose and oxygen,LGO)损伤神经元模型模拟体内脑梗死周边神经元低灌注微环境,同时予以Fg 处理,通过免疫荧光、qPCR、WB 等生物学技术,结合EGFR 信号通路特异性阻断剂,评估神经元细胞轴突再生及EGFR 信号通路激活情况。旨在阐明Fg 对体外LGO损伤神经元轴突再生的影响及机制,为脑卒中后神经功能修复提供新的靶点与防治策略。
材料与方法
1 动物
出生24 h 内乳鼠(合格证号:No.4307272211017 53915),购自湖南斯莱克景达实验动物有限公司,SPF 级,均为雄性。实验过程中均按实验动物伦理学标准处置实验动物。
2 试剂与药物
神经元培养基(iCell‐0013)购自icell 公司;B27 添加剂(12587010)购自赛默飞公司;青链霉素(SV30010)购自碧云天公司;EGFR 抑制剂PD168393(HY‐13896‐10mg) 购 自MCE 公 司;Fg(NPA193Ra01)购自优尔生公司;重组水蛭素(H922245‐100U)购自麦克林公司;小鼠抗EGFR(66455‐1‐Ig)、β‐actin(66009‐1‐Ig)、MAP‐2(67015‐1‐Ig)一抗、CoraLite594 标记的羊抗小鼠IgG(SA00013‐3)均购自proteintech 公司;兔抗p‐EGFR(3777S)一抗购自CST 公司;小鼠抗Tuj‐1(ab78078)一抗购自Abcam;HRP 标记的山羊抗鼠IgG(AWS0001)、HRP 标记的山羊抗兔IgG(AWS0002)均购自Abiowell 公司;mRNA 逆转录试剂盒(CW2569)、UltraSYBR Mixture(CW2601)、DM2000 Plus DNA Marker(CW0632)均购自中国北京康为世纪公司。
3 主要仪器
YT‐CJ‐2NB 型超净工作台(北京亚泰隆);DH‐160I 型直热式二氧化碳培养箱(上海三藤仪器);DSZ2000X型倒置生物显微镜(北京中显恒业仪器);SL02 型低速离心机(知信仪器); PIKOREAL96 型荧光定量RCP 仪(美国Thermo);DYY‐2C 型电泳仪、DYY‐6C 型恒温箱、DYCZ‐24DN 型电泳槽(中国北京六一);ChemiScope6100 型化学发光成像系统(中国勤翔)。
4 皮层神经元原代培养与鉴定
将脱颈处死后的SD 乳鼠(出生24 h 以内)全身浸泡于75 %酒精中,消毒3 min 后,移入无菌操作台。超净工作台无菌分离胎鼠皮层组织,剪刀剪碎,将组织碎片装入15 mL 离心管中。加入5 mL 0.25 %胰酶消化液中,混匀,37 °C 消化15 min,每5 min颠倒离心管一次。加入等体积含10 % FBS的DMEM培养基终止消化,1000 r/min 离心5 min,弃上清。加入10 % FBS 的DMEM 培养基重悬,用巴士吸管轻轻吹打20 次制成细胞悬液,过70 μm 滤网,收集滤液。300 g 离心5 min,弃上清,沉淀用10 %FBS的DMEM 培养基重悬,接种于预先用多聚赖氨酸包被的6 孔板中。第2 d 全部换成神经元完全培养基(含有2 % B27),每2 d 半量换液,神经元细胞培养于专用培养基中,37 °C、5 % CO2饱和湿度培养箱中培养,至第7 d 细胞成熟。
细胞成熟后采用MAP‐2 免疫荧光法进行鉴定:将爬片用PBS 清洗3 次,4 %多聚甲醛固定30 min,PBS 冲洗。加入0.3 % Triton X‐100,在37 °C 下通透30 min,PBS 冲洗。在37 °C 下,使用5 % BSA封闭60 min。滴加50 μL MAP‐2 一抗(1 ∶100),4 °C 过夜,PBS 冲洗。滴加50 μL 二抗CoraLite594标记的羊抗小鼠IgG(1 ∶100),在37 °C 下孵育90 min,PBS 冲洗。37 °C 下DAPI 核染10 min,PBS冲洗,缓冲甘油封片,荧光显微镜观察。
5 细胞分组与给药
将提取的原代皮层神经元直接铺板在六孔板里面,待细胞贴壁后随机分为LGO 组、LGO+Fg 组及LGO+Fg+PD168393 组。3 组均予以2 % 氧气+5 mmol/L 葡萄糖低糖低氧处理,将放有细胞的缺氧小室放于培养箱孵育48 h,48 h 后对LGO+Fg 组及LGO+Fg+PD168393 组予以加药处理。LGO+Fg 组加入1 mg/mL Fg 和0.5 U/mL 水蛭素处理细胞24 h;LGO+Fg+PD168393 组加入1 mg/mL Fg、0.5 U/mL水蛭素和50 nmol/L PD168393 处理细胞24 h。
6 免疫荧光染色检测Tuj-1
取出爬片,PBS 清洗3 次,将爬片用4 % 多聚甲醛固定30 min,PBS 冲洗,加入0.3 %Triton X‐100,37 °C 30 min 通透。PBS 冲洗,5 % BSA 37 °C 封闭60 min。滴加50 μL Tuj‐1 一抗(1 ∶100),4 °C 过夜。PBS 冲洗,滴加50 μL 二抗CoraLite594 标记的羊抗小鼠IgG(1 ∶100),37 °C 孵育90 min,PBS冲洗;PBS 冲洗,DAPI 工作液37 °C 下染核10 min,PBS 冲洗,缓冲甘油封片,荧光显微镜下观察。荧光显微镜下观察Tuj‐1 染色后的神经元,每个爬片随机观察5 个视野(20 倍物镜),使用Image‐Pro Plus 6.0 软件计算每个视野中Tuj‐1 阳性突起的长度与数量,取平均值。
7 Western blot 检测EGFR、p-EGFR 在细胞中的表达
用冰预冷PBS 洗涤细胞1 次,加入200 μL RIPA裂解液,刮取细胞,超声破碎1.5 min,冰上裂解10 min。4 °C,12 000 r/min 离心15 min,将离心后的上清转移倒 1.5 mL 的离心管中,BCA 法测定蛋白浓度。取120 μL 蛋白上清,加入30 μL 5×上样缓冲液混匀,沸水煮5 min,放入冰盒中速冷备用。第一孔加入蛋白分子量标准品 2 μL,其它每孔上样20 μL已变性样品蛋白。凝胶电泳、转膜、封闭后,滴加一抗EGFR(1 ∶10000)、p‐EGFR(1 ∶1000)和β‐actin(1 ∶5000)孵育,室温放置90 min ,滴加二抗HRP 标记的山羊抗鼠IgG(1 ∶5000)、HRP山羊抗兔IgG(1 ∶5000),室温孵育90 min。ECL显色曝光,在凝胶成像系统成像,计算蛋白相对表达量。
8 实 时 荧 光 定 量PCR 检 测MAP-1B、CRMP-2 mRNA 表达
引物和内参设计在NCBI 上搜索目的基因的序列,运用primer5 软件设计引物,由北京擎科合成引物。内参β‐actin 上游引物序列为ACATCCGTA‐AAGACCTCTATGCC,下游引物序列为TACTCCT‐GCTTGCTGATCCAC,扩增产物为223 bp;MAP‐1B上游引物序列为GGTCTGCCTCTGTGTATGGT,下游引物序列为ATGTCTCAACACACAAGTGAAC,扩增产物为244 bp; CRMP‐2 上游引物序列为CCCTAGCTGGATCTGTGTTGG,下游引物引物序列为GGTACAATCCCTTAGCTGGTCT,扩增产物为106 bp。PCR 反应步骤:Trizol 提取细胞总RNA,并计算其浓度跟纯度,以细胞总mRNA 为模板,逆转录cDNA;SYBR 法定量PCR 扩增反应条件:95 °C预变性10 min,95 °C 变性15 s,60 °C 退火30 s,共40 个循环;2‐ΔΔCt反映各样品相对于正常组样品目的基因表达水平的比值。
9 统计分析方法
采用SPSS.26 统计分析处理数据,计量资料以均数±标准差表示,组间比较,使用单因素方差分析,如方差齐则用LSD 检测,如方差不齐,则应用Tamhane T2 检验,P<0.05 为差异有统计学意义。
结 果
1 原代皮层神经元生长良好
培育1 d 后显微镜下观察到细胞贴壁,呈椭圆形(图1A),培养3 d 时显微镜下观察到细胞明显增大,突起有延伸(图1B)。培养至第5 d 细胞可见光晕,呈椭圆形,形态欠规则,神经元之间纤维较前丰富(图1C)。培养至第7 d,细胞光晕明显,胞体丰满,呈三角形及多边形,可见清晰细胞核,神经元之间联系形成网络(图1D)。免疫荧光染色显示,原代培养皮层神经元正常表达MAP‐2(图2)。

图1 原代皮层神经元生长状况。A,培养1 d;B,培养3 d;C,培养5 d;D,培养7 d。白箭头示神经元胞体,黑箭头示神经元突起。比例尺,100 μm。Fig. 1 Primary cortical neurons growth status. A, cultured for 1 day; B, cultured for 3 days; C, cultured for 5 days; D, cultured for 7 days. White arrows indicate neuronal cell bodies, and black arrows indicate neuronal processes. Scale bars, 100 μm.
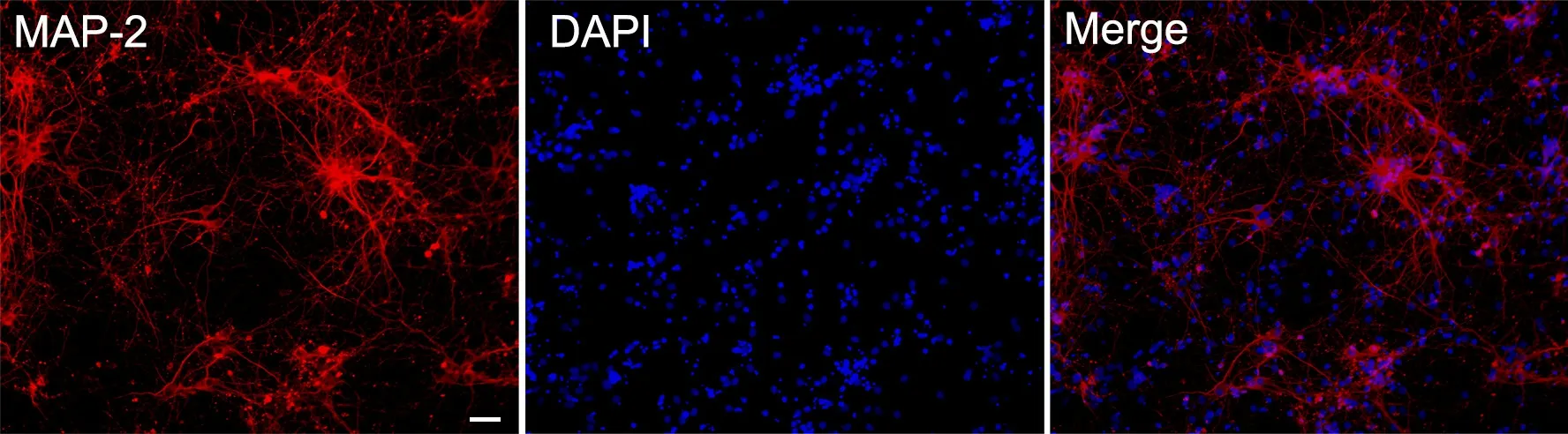
图2 原代皮层神经元MAP‐2 表达的免疫荧光检测。比例尺,50 µmFig. 2 Immunofluorescence examination of MAP‐2 expression in the cultured primary cortical neurons. Scale bar, 50 µm
2 EGFR 抑制剂减轻纤维蛋白原沉积对低糖低氧神经元轴突再生的抑制
对神经元轴突特异性标志物Tuj‐1 进行免疫荧光染色检测显示:与LGO 组比较,LGO+Fg 组神经元轴突长度较短,数量更少;与LGO+Fg 组相比,LGO+Fg+PD168393 组神经元轴突长度较长,数量更多(图3,表1)。由此表明,Fg 沉积抑制低糖低氧神经元轴突再生,该作用主要通过EGFR 实现。
表1 神经元轴突长度与数量定量分析(n=6,± s)Tab. 1 Comparison of neuron axon length and number in each group (n=6,± s)
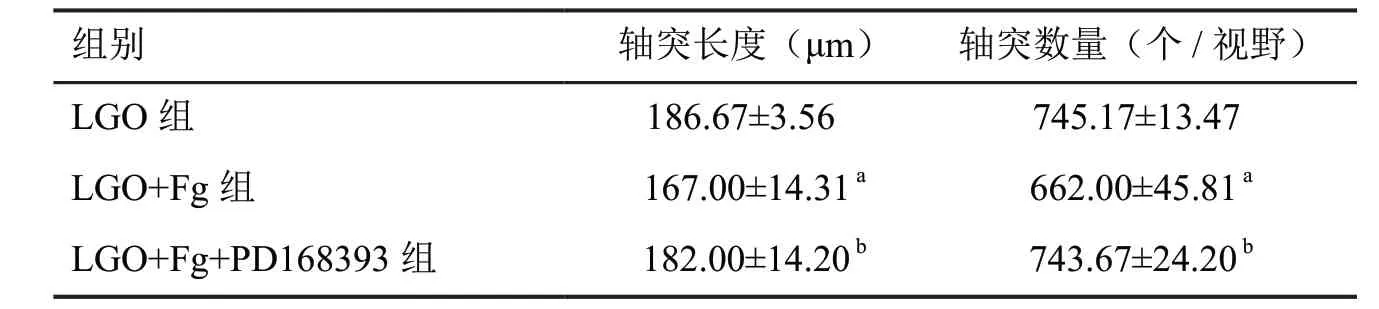
表1 神经元轴突长度与数量定量分析(n=6,± s)Tab. 1 Comparison of neuron axon length and number in each group (n=6,± s)
与LGO 组相比,aP <0.05;与LGO+Fg 组相比,bP <0.05;n=6 aP<0.05, compared with the LGO group; bP<0.05, compared with LGO+Fg group; n=6
组别 轴突长度(μm) 轴突数量(个/视野)LGO 组 186.67±3.56 745.17±13.47 LGO+Fg 组 167.00±14.31 a 662.00±45.81 a LGO+Fg+PD168393 组 182.00±14.20 b 743.67±24.20 b

图3 Tuj‐1 免疫荧光染色检测原代培养皮层神经元的轴突长度和数量。DAPI 复染细胞核;比例尺,50 µmFig. 3 Tuj‐1 immunofluorescence staining to detect the axonal length and number of primary cultured cortical neurons. Counterstaining of nuclei with DAPI; scale bar, 50 µm
3 纤维蛋白原沉积反式激活EGFR 信号通路
Western blot 检测各组神经元EGFR、p‐EGFR蛋白表达水平显示:与LGO 组相比,LGO+Fg 组的p‐EGFR 表达上调;与LGO+Fg 组相比,LGO+F‐g+PD168393 组的p‐EGFR 表达下调(图4,表2)。此结果表明,Fg 沉积可反式激活EGFR。

表2 神经元EGFR 信号通路关键分子EGFR 和p-EGFR 蛋白表达水平统计学分析Tab. 2 Statistical analysis of the expression levels of key molecules in the neuronal EGFR signaling pathway, including EGFR and p-EGFR proteins

图4 纤维蛋白原沉积对低糖低氧神经元EGFR 信号通路活性影响的代表性Western blot 检测结果Fig. 4 Representative Western blotting results of the effect of fibrinogen deposition on the activity of the EGFR signaling pathway in low glucose and low oxygen neurons
4 纤维蛋白原沉积抑制低糖低氧神经元MAP-1B和CRMP-2 mRNA 表达
qPCR 法检测各组神经元细胞骨架蛋白MAP‐1B 和CRMP‐2 mRNA 表达水平显示:与LGO 组相比,LGO+Fg 组MAP‐1B 和CRMP‐2 mRNA 表达下调;与LGO+Fg 组相比,LGO+Fg+PD168393 组MAP‐1B 和CRMP‐2 mRNA 表达上调(表3)。结果提示,Fg 的沉积可以抑制细胞骨架相关蛋白MAP‐1B、CRMP‐2 mRNA 表达。

表3 神经元细胞骨架蛋白MAP-1B 和CRMP-2 mRNA 表达水平统计学分析Tab. 3 Statistical analysis of mRNA expression levels of neuronal cytoskeletal proteins MAP-1B and CRMP-2
讨 论
Fg 是由肝细胞合成的凝血因子,是血浆与组织中直接参与凝血的重要物质。Fg 通常以水溶性形式存在,可在凝血酶酶解作用下转为不溶性纤维蛋白发挥凝血功能[20]。而神经元可以分泌凝血酶[21],因此,在本次研究中我们使用水蛭素与凝血酶结合,以抑制Fg 向纤维蛋白转化[22]。
Tuj‐1 常出现在未成熟神经元的轴突、轴突末端上,是评价轴突再生的标志物[23]。脑缺血后BBB 渗漏,Fg 在大脑内沉积,通过抑制髓鞘再生、介导神经毒性等途径,破坏神经环路的完整性引起神经功能的缺损[24]。课题组前期研究中发现,脑梗死大鼠脑内有大量Fg 沉积,但Fg 如何影响脑缺血后梗死周边神经元的轴突再生能力,仍未阐明。在本研究中,我们通过Tuj‐1 免疫荧光法检测轴突的数量、长度以观察轴突再生情况,发现加入Fg 抑制原代低糖低氧损伤神经元的轴突的生长以及轴突数量增加,表明Fg 沉积抑制轴突再生。
细胞骨架是细胞中由蛋白质构成的动态结构,主要分为微管、中间纤维、微丝3 种类型,几乎参与细胞的一切生命活动[25]。神经微管与调节其功能的多种微管蛋白相互作用,通过微管动力学、轴突运输等方式影响轴突再生,对神经元的轴突再生至关重要[26,27]。神经微丝在轴突中分布丰富,其与微丝凝集成神经原纤维,参与轴突的生长、轴浆运输[28]。微管、微丝等细胞骨架成分的动态平衡状态决定了轴突延伸和生长锥的形成,是轴突再生的先决条件之一[29]。EGFR 信号通路的激活与关闭对细胞骨架均有影响,激活该通路后可观察到神经细胞骨架的应力纤维聚合力降低,引起轴突再生障碍[30]。Liu 等人[31]通过动物实验发现,通过调节EGFR 信号通路可能修复受损中枢神经系统髓鞘,该通路可作为卒中后神经功能修复的新切入点。氯倍他所与吉非替尼均属于EGFR 抑制剂,Nocita[32]等人通过研究发现将两种药物联用应用于脱髓鞘疾病可能促进轴突再生。Li[33]等人发现可以通过抑制microRNA‐21 负调节EGFR 通路,促进轴突再生。而缺血性卒中后恢复神经功能的关键措施就是促进轴突的生长、芽生以期改善神经功能缺损症状[34]。EGFR 激活后引发信号通路丰富,ROCK 为EGFR 的下游信号,它对神经元轴突、髓鞘再生的细胞骨架蛋白CRMP‐2 与MAP‐1B 具有负向调节作用[16‐18]。本实验在低糖低氧损伤神经元细胞模型内加入EGFR 抑制剂PD168393,发现加入EGFR 抑制剂的神经元细胞p‐EGFR 蛋白表达下调,并且逆转Fg 对神经元轴突再生的抑制作用,表明Fg 通过激活EGFR 信号通路阻碍轴突再生。
综上所述,Fg 沉积可影响体外低糖低氧损伤神经元轴突再生能力,其作用机制与激活EGFR 信号通路有关。提示,临床或可通过靶向抑制Fg 沉积或EGFR 信号通路促进脑缺血后轴突再生与功能恢复防治脑梗死后遗症的治疗目的。但仍需进一步体内实验验证。
