Fe3O 4@海藻酸钠-壳聚糖固定化乳糖酶技术及其酶学性质研究
2023-03-04原卉卉杨孝成葛武鹏张琦张闹高秦艺
原卉卉,杨孝成,葛武鹏,张琦,张闹,高秦艺
(1.西北农林科技大学食品科学与工程学院,陕西 杨凌 712100;2.陕西金牛乳业有限公司,陕西 富平 711700;3.陕西省乳品工业协会,西安 710000)
0 引 言
β-半乳糖苷酶简称乳糖酶(Lactase),是一种安全的生物酶制剂,广泛存在于各种动物、植物及微生物中。乳糖酶可高效催化水解乳糖生成半乳糖和葡萄糖,主要用于低乳糖乳制品加工和乳糖不耐受症的治疗[1-5]。然而,游离酶在加工过程中存在稳定性差、外源蛋白影响产品质量、不能重复利用等缺点[6-7]。随着酶工程技术的不断发展,酶固定化技术优势明显,该技术可以实现酶的重复利用、有效分离,同时可提高酶的热稳定性、酸碱稳定性以及储藏稳定性[8-11]。近年来,各种固定化载体(如凝胶、无机材料和聚合物)已被成功用于酶的固定化,但这些载体单一使用时存在机械强度低、分离难度大,酶活回收率低等缺陷[12-14],因此有必要开发适合于乳糖酶酶学特性且性能优良的固定化复合载体。改性复合材料有效整合了单一材料的优缺点,能够提高酶活回收率及应用稳定性,是未来固定化酶领域的重要研究方向[15]。
海藻酸钠(Sodium Alginate,SA)是从褐藻类的海带或马尾藻中提取碘和甘露醇之后的副产物,壳聚糖(Chitosan,CS)主要来源于甲壳类动物的外壳[16]。二者均为天然多糖,来源丰富,具有优异的生物降解性、生物相容性和化学稳定性[17-19],在酶固定化领域引起了广泛关注。SA和CS的复合物带有大量的活性功能基团,如羧基、羟基、氨基等,它们能通过配位或静电作用实现酶的快速吸附;其次,其复合物空间网状结构赋予其更大的比表面积、多结合位点等特性,可大大提高吸附效能[20]、机械强度[21];在此复合材料中引入磁性材料Fe3O4,可制备磁性复合载体[22-23]。无机材料与有机材料直接结合形成的磁性复合载体具有制备工艺简单、无毒性、含有多种功能基团与酶直接作用等优点,且更有利于固定化酶的快速分离,可重复用于大规模工业连续生产。本试验采用磁性Fe3O4@SA-CS复合材料为载体,以CaCl2为硬化剂,对乳糖酶进行固定化并研究其酶学特性,旨在为乳糖酶的固定化技术在乳品工业中的规模化应用提供参考依据。
1 材料与方法
1.1 材料与试剂
乳糖酶(Nurica),丹尼斯克集团;海藻酸钠(SA),天津福晨化学试剂有限公司;壳聚糖(CS)(脱乙酰度85%~90%),国药集团化学试剂有限公司;纳米四氧化三铁(Fe3O4,CP),上海麦克林生化科技有限公司;无水氯化钙(CaCl2,AR)、磷酸氢二钠(AR)、磷酸二氢钠·12H2O(AR),广东光华科技股份有限公司;邻硝基苯酚、邻硝基苯-β-D-半乳糖苷(ONPG),北京索莱宝科技有限公司;无水碳酸钠(AR),西陇化工有限公司;醋酸钠(AR),天津科密欧化学试剂有限公司;50%NaOH溶液,赛默飞世尔(中国)科技有限公司。
1.2 仪器与设备
DK-S26型电热恒温水浴锅,上海森信实验仪器有限公司;PB-10型p H计,德国赛多利斯股份有限公司;ME303E型电子天平,梅特勒-托利多仪器有限公司;SB-5200DT型超声波清洗机,宁波新芝生物科技股份有限公司;UV-1900型紫外分光光度计,岛津;Vertex70型傅里叶变换红外光谱仪,德国Bruker公司;离子色谱仪(ICS5000+),岛津有限公司。
1.3 试验方法
1.3.1 乳糖酶固定化效率评价指标
酶活性采用分光光度法(GB/T 33409-2016)测定。乳糖酶的活性单位为在规定的反应条件下,每分钟催化一个微摩尔邻硝基苯-β-D-半乳糖苷的酶量。
本试验主要通过两种手段来评价乳糖酶的固定化效果:酶活回收率和相对酶活。公式如下:
1.3.2 固定化乳糖酶制备条件的优化
称取一定量SA和CS于三颈烧瓶中,加入一定蒸馏水加热搅拌,溶解30 min后加入一定量Fe3O4搅拌20 min,待混合液恢复至室温,加入一定量酶液,搅拌使酶液分散均匀。将混合了酶液的混合物用5 m L一次性注射器均匀滴入一定浓度的CaCl2溶液中交联形成球形包埋载体,硬化一段时间后用蒸馏水洗涤2~3次,置于4℃冰箱保存备用。在阅读大量文献基础上,确定了SA、CS、Fe3O4、CaCl2浓度、酶添加量以及固定化时间的大致范围,采用单因素试验设计,以相对酶活性为评价指标,依次对SA(1%~5%)、CS(0~2.5%)、Fe3O4(0~4%)、CaCl2浓度(1%~5%)、酶添加量(0.5%~2.5%)以及固定化时间(0.5~2.5 h)进行优化,确定固定化反应的较佳条件。
1.3.3 固定化载体表征
对被CaCl2硬化后的磁性复合材料(Fe3O4@Ca-SA/CS)及其原材料、以及固定化后的乳糖酶(Fe3O4@Ca-SA/CS/Lactase)进行表征。傅里叶红外光谱仪以4 cm-1和16次扫描的分辨率测量样品在4 000~400 cm-1范围内的红外吸收光谱,以KBr为空白背景;X射线衍射仪采用的光源是Cu-Kα射线,将粉末样品置于载玻片上,使用X射线衍射仪进行测试,范围为5~90°,扫描速率10°/min,管电压40 k V,电流40 mA。
1.3.4 固定化乳糖酶的酶学性质
将固定化酶凝胶颗粒用一次性培养皿封装,封上保鲜膜,防止水分蒸发,将其放置在4℃冰箱内保存,贮存30 d时测定其酶活力,评价其储存稳定性;随机称取1 g大小均匀、饱满的凝胶球状颗粒,置于10 mL离心管中,加入10 m L山羊乳,于37±1℃的恒温水浴锅中振荡保温,每次反应20 min之后,先用38℃蒸馏水冲洗,再用38℃缓冲液洗涤凝胶颗粒3次,然后测定残留酶活力,重复操作数次,评价其回收利用率;随机挑取40粒大小均匀、饱满的凝胶球状颗粒,置于250 mL无菌三角瓶中,加入20 m L山羊乳,于37±1℃的恒温水浴锅中振荡保温,反应60 min之后,先用38℃蒸馏水冲洗,再用38℃缓冲液洗涤凝胶颗粒3次,观察凝胶颗粒是否破裂,评价其机械操作稳定性。以ONPG为底物,分别在不同温度和不同p H底物中测定固定化酶以及游离酶的酶活力,以确定其最佳酶促反应温度与pH值;同时与游离酶对比,评价其热稳定性和p H稳定性;采用赖-布二氏(Lineweaver-Burk)法测定酶的表观动力学常数Km,以不同浓度ONPG为底物,加入等量酶稀释液,摇匀后在37±1℃水浴中准确保温10 min,测定其OD420值,计算酶的米氏常数Km。
1.3.5 乳糖含量检测
样品用0.2 mol/L磷酸缓冲液提取,使用HPAEC-PAD法测定低乳糖或无乳糖乳中的乳糖含量。
2 结果与分析
2.1 ONP标准曲线绘制
配置浓度分别为0.02、0.04、0.06、0.08、0.10、0.12、0.14 mmol/L的邻硝基苯酚溶液,使用1 cm的石英比色皿,用去离子水做空白,在420 nm处测定每个稀释液的吸光度,以邻硝基苯酚物质的量为横坐标,以稀释液的吸光度为纵坐标做标准曲线,如图1所示。
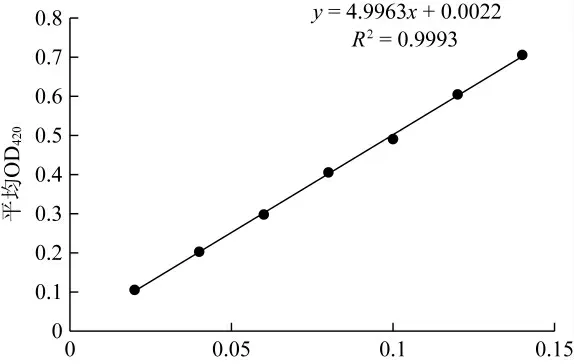
图1 ONP含量/(mmol·L-1)
2.2 乳糖酶固定化条件优化
2.2.1 SA质量分数的影响
如图2(a)所示,SA浓度过低时,固定化效果差,无法形成形状均匀、强度较好的凝胶颗粒;浓度过高,则会出现拖尾现象现象,且形状不规则,如图2(b);适宜的SA浓度能形成形状规则、大小均一且表面光滑的圆形小球,如图2(c)。
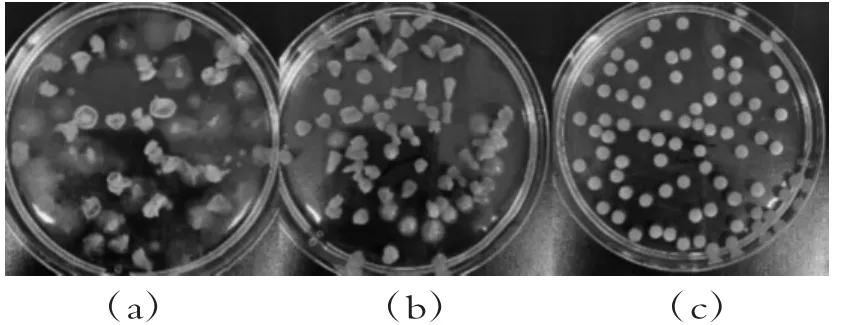
图2 海藻酸钠浓度对成球难易程度的影响
由图3可知,不同浓度的SA固定乳糖酶,酶活性有一定程度的损失,浓度较低时,由于清洗时,酶流失较多,因此酶活损失较大;浓度过高时,其微环境效应和物质扩散阻力对反应也有较大影响。综合考虑,确定SA的浓度为4.0%。

图3 海藻酸钠浓度对固定化酶酶活的影响
2.2.2 CS质量分数的影响
如图4所示,使用加入CS后的复合载体对酶进行固定化,乳糖酶的酶活回收率较未加壳聚糖的载体有所提高,随着CS质量分数的提高,固定化酶的相对酶活力呈现先升高后降低的趋势,当CS质量分数为为1%时,酶活回收率最高。当CS质量分数较低时SA-CS带有的大量的活性功能基团能通过配位或静电作用实现酶的快速吸附,但随着CS质量分数的继续增加,氢键作用随之增大,使得CS无法在凝胶中均匀分布,导致固定化效果下降[24-25]。因此,选择CS质量分数1%为最佳。
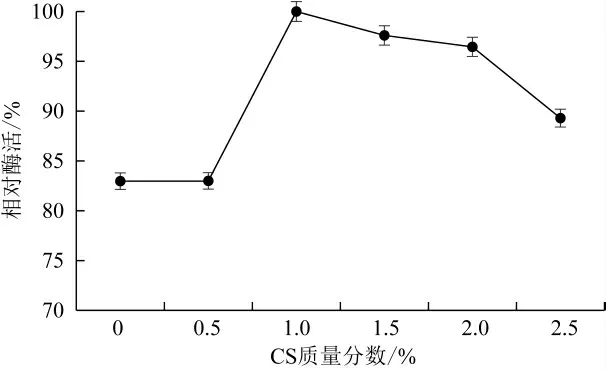
图4 壳聚糖浓度对固定化酶酶活影响
2.2.3 Fe3O 4质量分数的确定
将Fe3O4通过快速搅拌和超声分散的方式分散到SA-CS的复合凝胶中,再通过凝胶、絮凝、沉淀、物化等方式将二者结合在一起,主要利用了范德华力、氢键、配位键和共价键实现材料间的结合[26]。由于CS富含氨基和羟基,Fe原子的3 d空轨道与氨基的N原子上的孤对电子或羟基O原子作用形成配位键[27]。如图5,Fe3O4浓度为2%时酶活回收率最高。
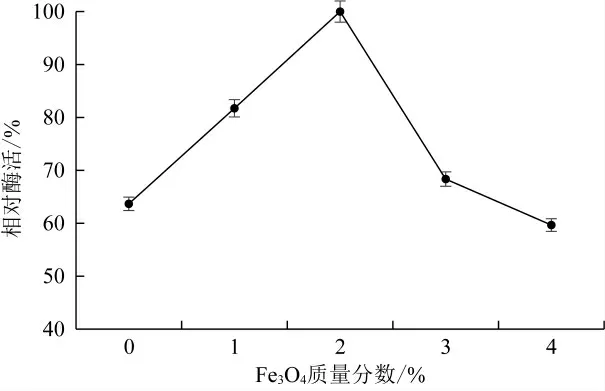
图5 Fe3O 4浓度对固定化酶酶活影响
2.2.4 CaCl2浓度的确定
由6可以看出,随着CaCl2浓度增加,固定化酶的相对活力先增高后下降,这是因为CaCl2质量分数较低时形成的凝胶网络机械强度较差,使得较多酶分子流失,虽然CaCl2可作为酶的激活剂,但当Ca2+浓度过高时,凝胶的通透性降低,影响了酶液的进入[28]。因此,选择4%浓度的CaCl2溶液固定酶,酶活回收率最高,因此确定CaCl2溶液的最适浓度为4%。
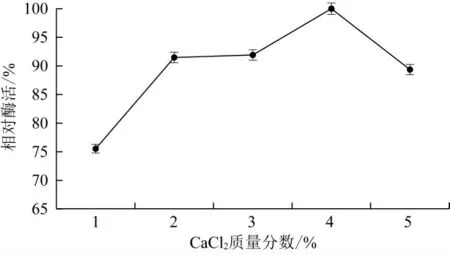
图6 CaCl2浓度对固定化酶酶活影响
2.2.5 酶添加量确定
由图7可看出,酶浓度不足时,固定化酶酶活回收率随着酶浓度的增加而增加,但当酶添加量超过3.5%时,酶活力回收率略有下降,这是由于载体的吸附能力有限,载体被饱和后,酶活回收率不再升高,反而有所下降[29-30]。因此确定酶添加量为3.5%。
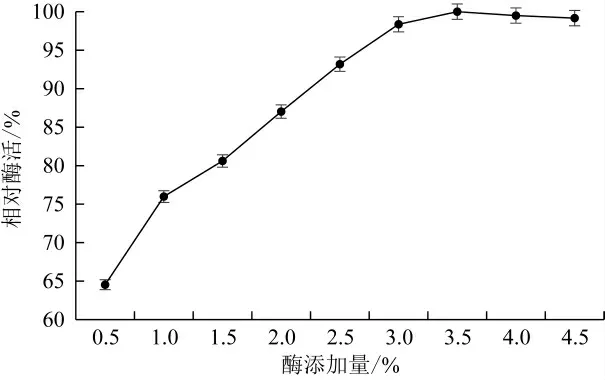
图7 酶添加量对固定化酶酶活回收率的影响
2.2.6 固定化时间确定
当固定化时间为0 h,固定化酶酶活回收率最高,但此时凝胶颗粒机械强度不高,容易破碎,不宜用于实际生产。随着固定化时间的延长,酶活力会因网络结构过密而下降[31]。由图8可以看出,在0.5~2.5 h内,当固定化时间为1 h时,酶活回收率最高,因此确定固定化时间为1 h。
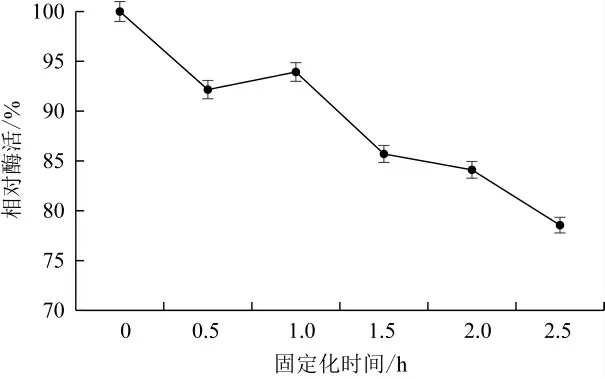
图8 固定化时间对固定化酶酶活影响
2.3 载体表征
2.3.1 FTIR分析
如图9所示,在SA光谱3 546 cm-1、CS光谱3 449 cm-1处均呈现—OH振动,这一位置在Fe3O4@Ca-SA/CS和Fe3O4@Ca-SA/CS/Lactase的光谱中移动到3 408 cm-1和3 411 cm-1处,可能是由于Fe3O4的加入。在SA光谱中,2 936 cm-1处出现的弱吸收峰为C-H的伸缩振动,1 623 cm-1和1 420 cm-1处的吸收峰值可归属于羧基的不对称和对称拉伸振动,1 134 cm-1处的宽峰为羧基的伸缩振动吸收峰;在CS光谱中,2 872 cm-1处的吸收峰为烷基的伸缩振动峰,1 596 cm-1处的吸收峰归属于伯胺中C=O的拉伸振动、1 643 cm-1处观察到的峰为N-H弯曲振动与酰胺II振动重叠,在1 420 cm-1、1 381 cm-1和1 321 cm-1处观察到的谱带是由—NH2基团的剪切振动和聚合物糖苷键的伸缩振动引起的,1 086 cm-1处的吸收峰为C-O-C拉伸振动。Fe3O4的红外谱图中,582 cm-1处的吸收峰为Fe-O键的正四面体伸缩振动;Fe3O4@Ca-SA/CS和Fe3O4@Ca-SA/CS/Lactase与SA、CS、Fe3O4的红外谱图相比,CS的吸收峰2 872 cm-1消失,可能是CS分子中的—NH 2被质子化成—NH3+,与SA分子中的—OH反应导致的;在2 939 cm-1和2 933 cm-1处出现了新的弱吸收峰,可能是由于SA和CS间的静电相互作用引起的。Fe3O4@Ca-SA/CS在569 cm-1处的吸收峰变宽,可能是Fe-O键与CS的—CH重叠峰;Fe3O4@Ca-SA/CS/Lactase在566 cm-1处出现明显的Fe-O键吸收峰,且较Fe3O4的Fe-O键吸收峰发生迁移,证明了包埋材料和酶分子间的化学键和氢键相互作用,乳糖酶被磁性复合材料成功包埋[32-38]。
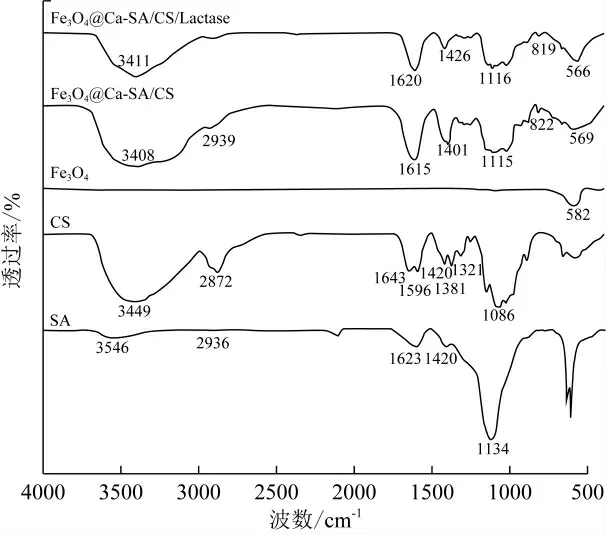
图9 载体的傅里叶红外变换光谱图
2.3.2 XRD分析
由图10可以看出,SA的特征衍射峰分别出现在2θ值为19.0、23.2、28.1、28.9、32.2、34.0、38.6、48.8、55.0、59.7°处,具有一定结晶度[39];CS在20.0°处出现较宽的衍射峰,判定其为无定形结构;Fe3O4的特征衍射峰出现在2θ值为30.0、35.5、43.0、56.9、62.6°,同文献报道的一致[40];在SA/CS衍射峰中,SA和CS的衍射峰部分消失,部分峰的强度有一定程度弱化和宽化,说明二者之间有一定的相互作用;Fe3O4@SA/CS复合材料在23.2、28.1、32.2、34.0°处出现SA/CS的衍射峰且变弱,同时出现Fe3O4的特征衍射峰,说明Fe3O4成功负载到Fe3O4@SA/CS上且与SA/CS之间存在相互作用;滴入CaCl2固化后的载体Fe3O4@Ca-SA/CS只保留了Fe3O4的特征峰,SA的衍射峰消失,说明Ca2+和SA分子链交联聚合形成了新的物质。
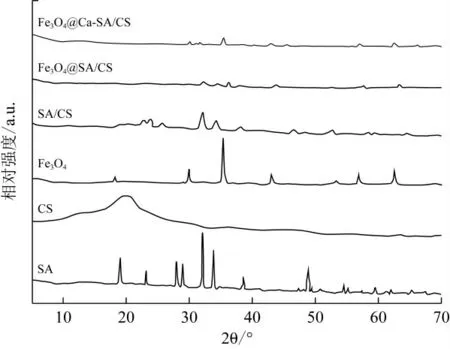
图10 样品的X射线衍射图
2.4 固定化乳糖酶的酶学特性
2.4.1 固定化酶的最适反应温度及其耐热性
由图11可知,当温度为35℃时,β-半乳糖苷酶的游离酶和固定化酶活性达到最高。当温度低于或高于35℃时,游离酶和固定化酶的活性都降低,但游离酶活性下降更显著,说明固定化酶具有更好的热稳定性。因为固定化载体与酶分子之间存在多种作用力,对酶的空间结构具有保护作用。
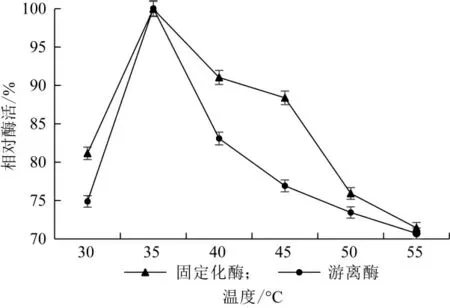
图11 温度对酶活力的影响
2.4.2 固定化酶的最适反应p H及其p H稳定性
由图12所示,酶固定化后,最适反应pH值向偏碱的方向移动,游离酶在p H值5.0时酶活力最高,且较适p H值范围较窄;而固定化酶在pH值6.0时酶活力最高,更接近液态乳的p H,且在p H值5.0~9.0的范围内均能保持较高的酶活力,这也说明固定化酶应用于工业化生产低乳糖乳具有很大优势。
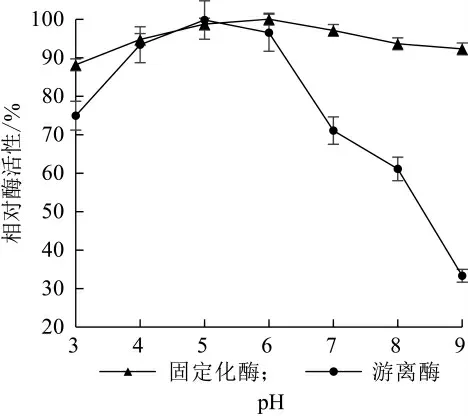
图12 pH对酶活性的影响
2.4.3 固定化酶的储存稳定性与操作稳定性
固定化酶储存30 d后酶活性仅损失7.5%。固定化后的乳糖酶可进行重复多次使用,由图13可知,随着操作次数增加,固定化β-半乳糖苷酶相对酶活缓慢降低。原因是连续操作使凝胶颗粒强度下降,酶分子流失过多,导致酶活性降低。固定化β-半乳糖苷酶连续操作7次后,相对酶活力损失21.73%,说明固定化β-半乳糖苷酶回收利用率较高;且固定化酶在乳中作用24 h后仍未破裂,机械操作稳定性良好。
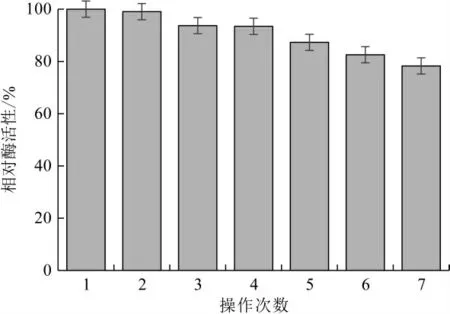
图13 固定化酶的回收利用率
2.4.4 米氏常数
米氏常数(Km)是酶的特征动力学常数之一,可以用来判断酶与底物的亲和力大小,每一种酶都有其特定的Km值,Km值越小,说明酶与底物的亲和力越大,对底物的催化性能也越好。采用赖-布二氏法(Lineweaver-Burk)法测定酶的表观动力学常数Km。
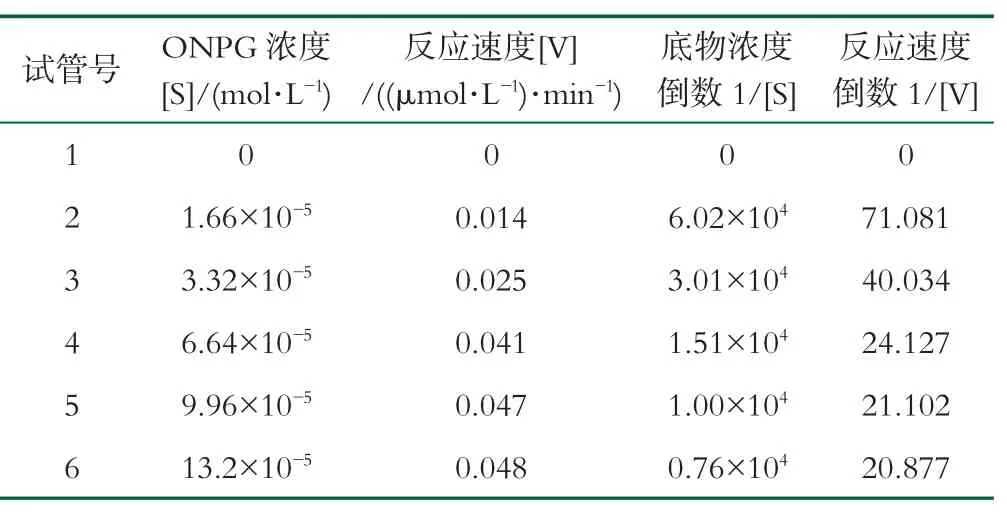
表1 游离酶Km和Vmax值的测定
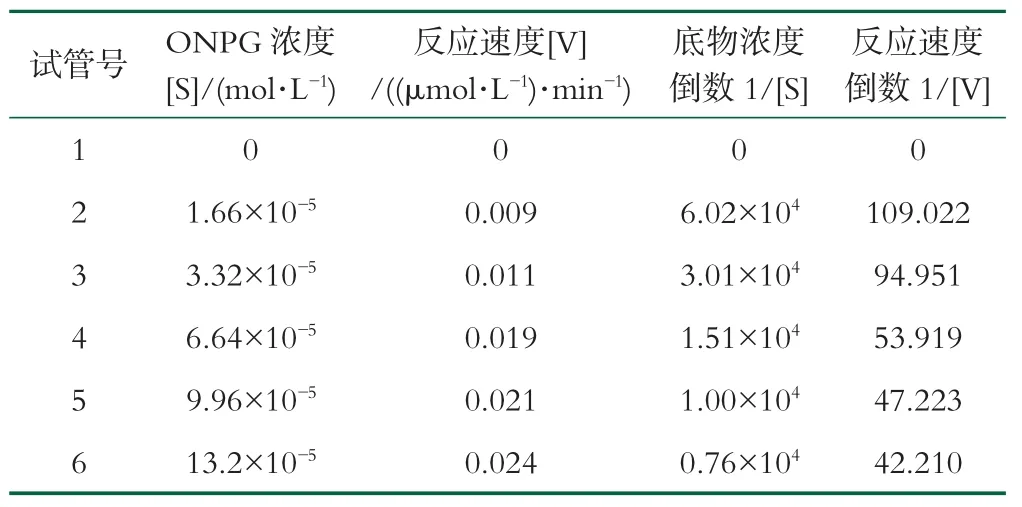
表2 固定化酶Km和Vmax值的测定
将米氏方程V=(Vm×S)/(Vm×Km)的形式改为1/V=(Km/Vm)×(1/S)+(1/Vm),这个方程相当于y=ax+b,其斜率为Km/Vm,截距为1/Vm,直线与1/S的交点等于-1/Km,如图14。游离酶和固定化酶的回归方程如图所示,计算得出二者的Km值分别为0.87和0.35,固定化酶的Km较游离酶有所下降,这是由于固定化酶附近微环境的溶液浓度大于主体溶液浓度;且固定化酶对底物的亲和力有所提高,可以使物质的转化反应更充分,有利于固定化酶的工业化应用[41]。

图14 以ONPG为底物时乳糖酶的双倒数图
2.5 固定化乳糖酶水解羊乳中乳糖的应用
模拟连续操作搅拌式反应器评价固定化酶的实际可操作性:根据2.2.5中确定的固定化工艺中酶的质量分数(即100 g固定化酶中含有3.5 mL游离酶)以及游离酶在UHT乳中的建议添加量(2~3.5 g/L),确定固定化酶在乳中的添加量为10%。因此称取固定化乳糖酶10 g,游离酶0.3 g,分别以100 mL新鲜山羊乳为底物,在35℃恒温摇床中连续反应数小时;定时取样并测定乳糖水解率;如表3所示,游离酶和固定化酶分别在反应2 h和3 h后达到无乳糖水平(≤0.5%),固定化酶最高水解率达92.80%,说明此固定化酶能有效降低乳中乳糖含量,达到无乳糖宣称,解决乳糖不耐症问题。
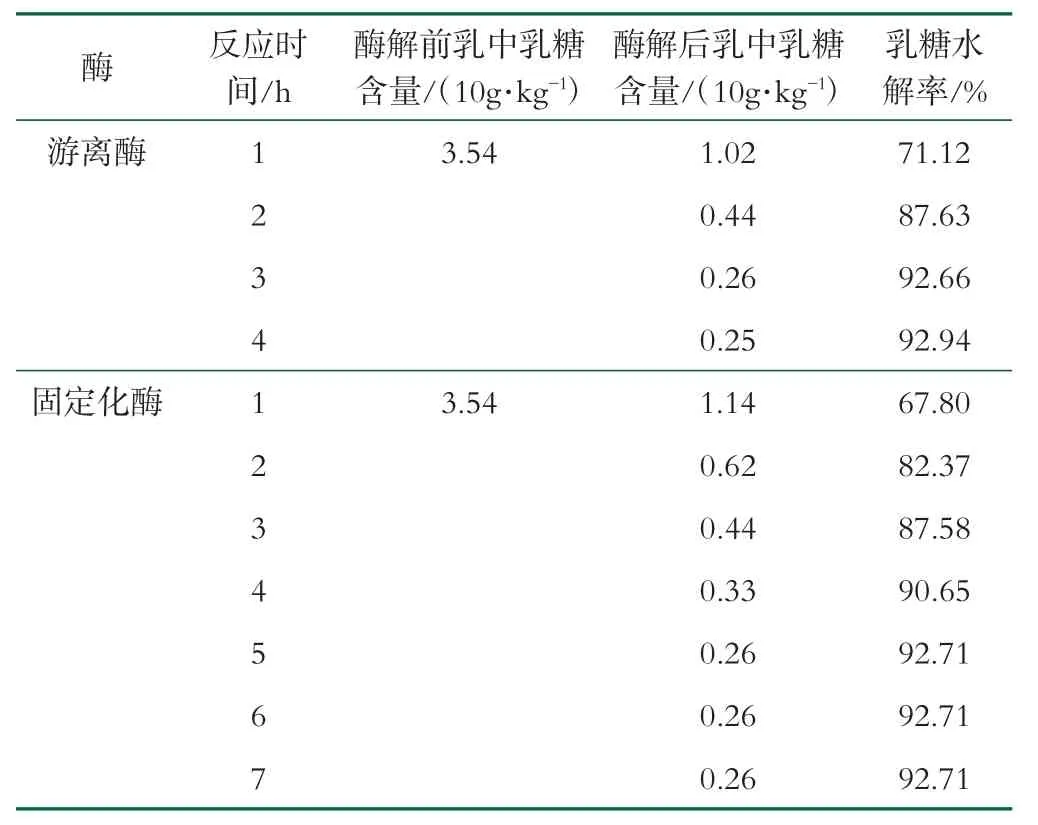
表3 乳糖水解率
3 结 论
以绿色环保、来源广泛的SA、CS为原料,引入磁性材料Fe3O4,将三者进行复合制备出机械强度高、比表面积大、结合位点多、性质稳定、易分离的磁性复合凝胶载体。采用包埋法对乳糖酶进行固定化,得出固定化酶的最适制备条件为ω(SA)=4%、ω(CS)=1%、ω(Fe3O4)=2%、ω(CaCl2)=4%、ω(酶液)=3.5%,固定化时间1 h。固定化后的乳糖酶最适反应温度未改变,最适反应pH值从5.0提高至6.0,且耐热性与p H耐受性均高于游离酶,具有良好的储存稳定性和重复操作稳定性,除此之外与底物的亲和力也有所提高,可在反应3 h后使山羊奶达到无乳糖水平,最高乳糖水解率达92.80%。固定化酶更好地实现了酶反应过程的可控制化,大大简化了生产工艺,降低了生产成本,适宜于在食品工业生产中推广应用。
