用食品安全级载体
——壳聚糖固定化乳糖酶条件的优化
2018-06-28吴巧丽
付 雪,隋 琳,吴巧丽,谷 伟,钱 方
(大连工业大学食品学院,辽宁大连 116034)
0 引言
乳糖酶即β-D-半乳糖苷半乳糖水解酶(β-D-galactoside galacto-hydrolase),是一类催化特殊类型糖苷键-β-半乳糖苷类化合物中β-半乳糖苷键发生水解断裂的酶[1]。它广泛应用于食品工业中,用乳糖酶水解牛乳中乳糖可以满足乳糖不适症患者需要,还可提高乳制品甜度,减少甜味剂用量;可防止冷冻乳制品易结晶析出;用乳糖水解物还可生产乳清饮料、糖浆、食品添加剂等[2-6]。但由于乳糖酶成本过高等因素制约了其应用。而固定化乳糖酶可以反复使用,且能缩短时间、节约成本,同时固定化乳糖酶对酸、碱有较强的耐受力,热稳定性也较好。国外已有相当规模工业化生产固定化乳糖酶[7]。壳聚糖是由广泛存在于自然界的几丁质脱乙酰得到的一种天然高分子生物材料,因其相容性、安全性、微生物降解性等优良性能被各行各业所关注,在很多领域已经取得了进展,而在固定化酶并保持酶活性方面有独特优点。2004年,毛跟年等人[8]研究了强化海藻酸钙固定化β-半乳糖苷酶的方法及固定化酶的性质,并用于制备低聚半乳糖。2006年,潘晓亚等人[9]以明胶为载体包埋固定乳糖酶,优化了固定化条件。2011年,钱婷婷等人[10]用改性磁性壳聚糖微球固定乳糖酶。与前人研究不同的是试验考虑到食品安全选择食品安全级的壳聚糖为载体固定乳糖酶,研究其固定化酶的优化条件。
1 试验方法
1.1 材料
壳聚糖(脱乙酰度≥90%)食品级,大连鑫蝶甲壳素有限公司提供;乳糖酶(3 000 L HP-G),诺维信(中国)生物技术有限公司提供;血糖测定试剂盒,保定长城临床试剂公司提供;邻硝基酚(ONP)、邻硝基酚-β-半乳糖苷(ONPG)、戊二醛、磷酸氢二钾等。
1.2 仪器
pHS-3C型精密pH计,上海雷磁仪器厂产品;722型光栅可见分光光度计,山东高密彩虹分析仪器有限公司产品;UV-1900型双光束紫外可见分光光度计,北京普析通用仪器有限责任公司产品。
1.3 方法
(1)壳聚糖载体制备[11]。将质量浓度20.0 g/L壳聚糖溶液滴入终质量分数20%NaOH和30%甲醇的凝结液中,液滴刚滴入凝结液时不搅拌,即得壳聚糖载体,取壳聚糖载体0.2 g进行固定化条件研究。
(2) 乳糖酶活力测定。采用ONPG法[12]。
(3) 酶活力回收率[13]。
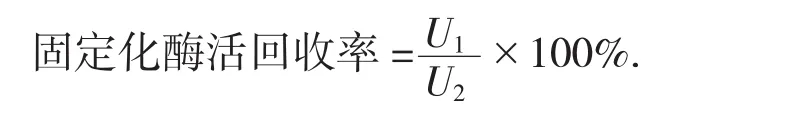
式中:U1——固定化酶总活力,U/g;
U2——加入游离酶总活力,U/g。
(4)蛋白含量的测定。采用紫外吸收法[14]。
2 结果与讨论
2.1 固定化顺序确定
酶固定化方法分2种:一种是先将载体与酶作用,再用戊二醛交联(即先固定后交联);另一种是载体先经戊二醛活化后,再与酶作用(即先交联后固定)。为达到更好的固定化乳糖酶效果,研究了固定化顺序对乳糖酶活力的影响。
固定化顺序对固定化效果的影响见图1。
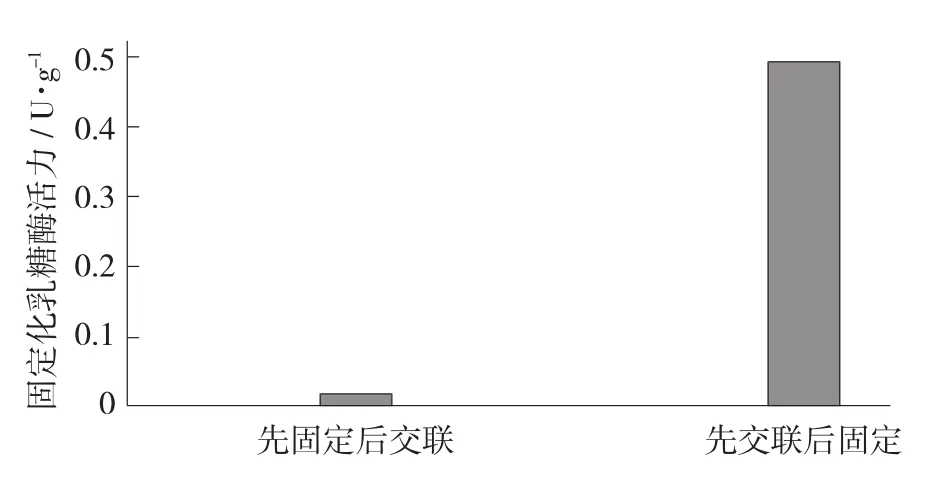
图1 固定化顺序对固定化效果的影响
由图1可知,先交联后固定法制得固定化乳糖酶活力为0.495 U/g,而先固定后交联法制得固定化乳糖酶活力仅为0.018 U/g。可见,载体经过戊二醛交联活化后可以与酶牢固结合。
2.2 戊二醛质量分数确定
戊二醛是双官能团试剂,既是交联剂又是蛋白质变性剂[15]。戊二醛质量分数低时,没能将足够的酶交联到载体上;而戊二醛质量分数高时,戊二醛作为变性剂又能使酶失活。所以,研究戊二醛质量分数对酶活力影响,以期达到最高固定化酶活力。
戊二醛质量分数对固定化酶活力的影响见图2。
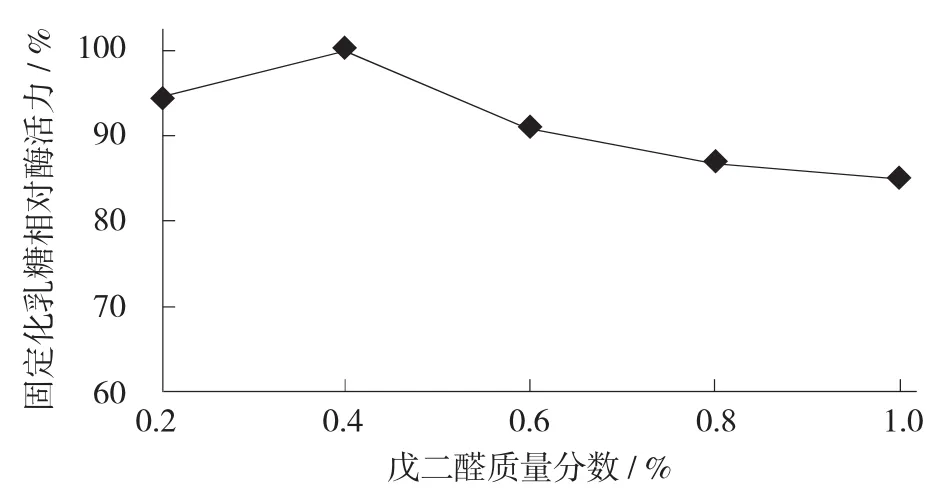
图2 戊二醛质量分数对固定化酶活力的影响
由图2可知,戊二醛质量分数0.4%时,固定化乳糖酶活力最高,乳糖酶活力回收率为2.08%。当戊二醛质量分数低于0.4%时,壳聚糖载体上活性基团相对较少,固定化乳糖酶活力较低,壳聚糖分子中被活化氨基数量随着戊二醛质量分数增加而增加,故固定化乳糖酶活力也升高;当戊二醛质量分数高于0.4%时,壳聚糖载体上形成过多的活性醛基,导致酶分子与载体之间形成多点结合,产生空间结构障碍,使酶活性中心结构发生改变,固定化乳糖酶活力则有所下降。因此,选择戊二醛适宜质量分数为0.4%,此时固定化酶活力最大。
2.3 戊二醛用量确定
戊二醛用量对固定化酶活力的影响见图3。
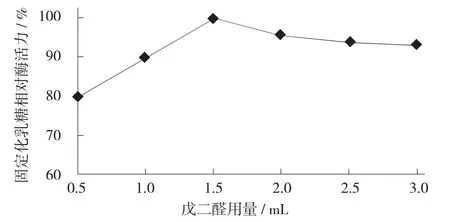
图3 戊二醛用量对固定化酶活力的影响
由图3可知,当质量分数0.4%戊二醛溶液用量为1.5 mL时,固定化乳糖酶活力最高。当戊二醛用量少于1.5 mL时,固定化乳糖酶活力随着戊二醛用量的增加而升高;当高于1.5 mL时,固定随着戊二醛用量的增加而降低。因此,选择戊二醛适宜用量为1.5 mL,此时固定化酶活力最大。
2.4 交联温度确定
交联温度影响载体的活化程度,也直接影响载体与酶的固定。
交联温度对固定化酶活力的影响见图4。
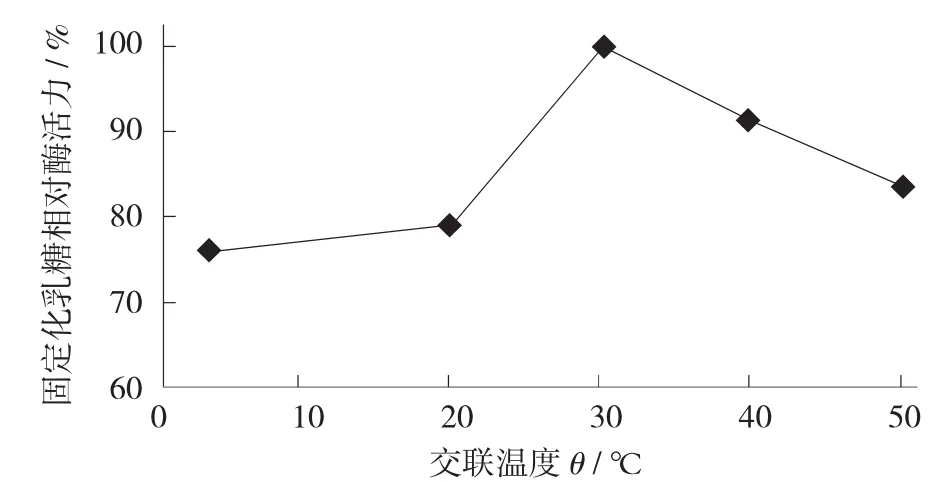
图4 交联温度对固定化酶活力的影响
由图4可知,4℃低温时固定化乳糖酶活力较低,说明低温不利于乳糖酶与壳聚糖载体的交联;随着交联温度的升高,固定化乳糖酶活力逐渐增大;当交联温度达到30℃时,固定化乳糖酶活力最高;当交联温度高于30℃时,固定化乳糖酶活力开始迅速下降,这可能是由于温度升高使得游离乳糖酶的活力有所降低。因此,选择30℃作为交联温度。
2.5 交联时间确定
交联时间即戊二醛与壳聚糖载体接触时间,也是载体被活化的时间,也影响固定化酶活力。
交联时间对固定化酶活力的影响见图5。

图5 交联时间对固定化酶活力的影响
由图5可知,固定化乳糖酶活力随着交联时间的延长而增大;当交联时间达到16 h时,固定化乳糖酶活力最高;交联时间超过16 h,固定化乳糖酶活力迅速下降,24 h时酶活下降了10%。可能由于戊二醛对酶有一定变性作用,随着交联时间延长,固定化乳糖酶活力有所下降。因此选择交联时间为16 h。
2.6 交联pH值确定
酶分子本身带有许多氨基酸残基,氨基酸残基包括酸性和碱性,所以pH值变化会影响残基侧链基团的解离状态,从而影响底物的结合和催化反应。
交联pH值对固定化酶活力的影响见图6。
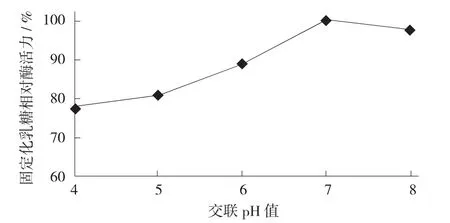
图6 交联pH值对固定化酶活力的影响
由图6可知,固定化会影响酶的空间结构,从而影响酶活力。随着交联pH值的增加,固定化乳糖酶的活力逐渐增大;当pH值为7时,固定化乳糖酶活力达到最高;当pH值为8时,固定化乳糖酶活力又有所下降。因此,选择pH值为7作为交联pH值。
2.7 固定化温度确定
固定化温度对固定化酶活力的影响见图7。
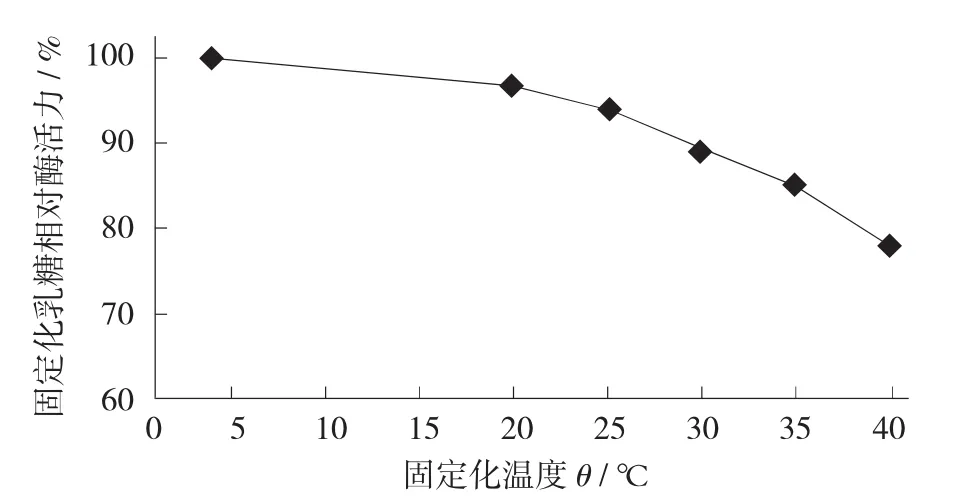
图7 固定化温度对固定化酶活力的影响
由图7可知,固定化温度对固定化乳糖酶活力的影响较大。4℃固定时,固定化乳糖酶活力最高;当固定化温度由20℃升高到40℃时,固定化乳糖酶活力随着固定化温度的升高而迅速下降。因此,选择4℃作为乳糖酶的固定化温度。
2.8 固定化时间确定
固定化时间对固定化酶活力的影响见图8。

图8 固定化时间对固定化酶活力的影响
由图8可知,当固定化时间少于9 h时,固定化乳糖酶活力随着固定化时间的延长而升高;当固定化时间达到9 h时,固定化乳糖酶活力达到最大;当固定化时间大于9 h,固定化乳糖酶活力迅速下降,这可能是由于固定化时间延长,固定在载体上的乳糖酶量越多,造成载体上结合酶的空间位阻,使固定化乳糖酶活力下降。因此,选择9 h作为乳糖酶固定化时间。
2.9 乳糖酶用量确定
乳糖酶用量对固定化效果的影响见图9。
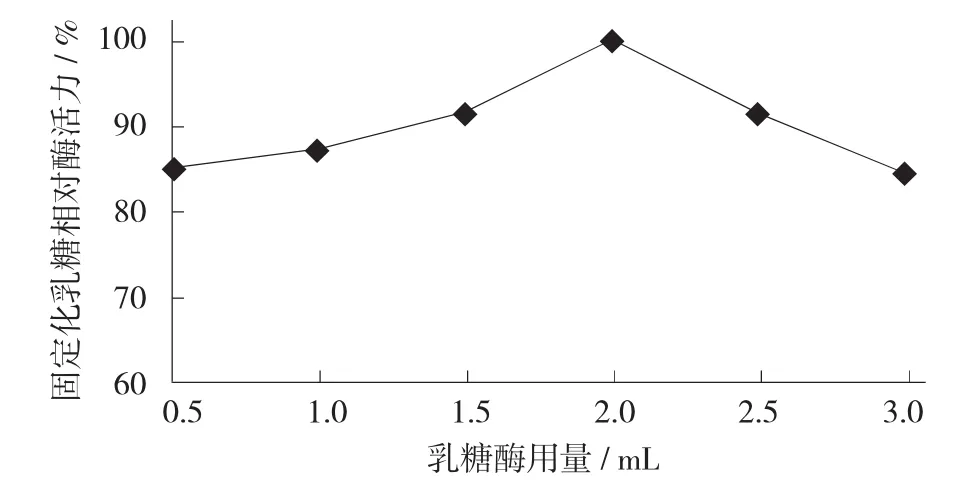
图9 乳糖酶用量对固定化效果的影响
由图9可知,当乳糖酶用量为2.0 mL时,固定化乳糖酶活力达到最高;当酶用量多于2.0 mL时,固定化乳糖酶活力迅速降低。可见,定量球形壳聚糖其活性基团是一定的,在结合位点未饱和前,固定化乳糖酶活性随着用量的增加而升高,当结合位点饱和后,增加乳糖酶用量不能提高固定化酶活力,反而使其固定化乳糖酶活力下降。试验表明,当乳糖酶用量为2.0 mL时,固定化乳糖酶活力最高,此时酶活力回收率为1.94%。
2.10 最优条件下固定化乳糖酶活力
将1.0 g壳聚糖载体(前面是0.2 g载体) 先用0.4%戊二醛溶液7.5 mL,于30℃条件下交联16 h;再用1.0%乳糖酶溶液10.0 mL,于4℃条件下固定9 h,此条件下制得的固定化乳糖酶活力为0.735 U/g,酶活力回收率为2.45%。
3 结论
研究表明,用先交联后固定的固定化方法可将乳糖酶很好地固定在壳聚糖载体上,即先用戊二醛交联使壳聚糖载体活化,后将壳聚糖载体与乳糖酶进行固定制备固定化乳糖酶。将1.0 g壳聚糖载体先用0.4%戊二醛溶液7.5 mL,于30℃条件下交联16 h;再用10 mL 1.0%乳糖酶溶液于4℃条件下固定9 h,此条件下制得的固定化乳糖酶活力为0.735 U/g。
[1]Rahim K A,Lee B H.Specificity,inhibitory studies,and oligosaccharide formation by β -galactosidase from psychrotroph ic Bacillus subtilis KL88[J].Journal of Dairy Science,1991(6):1 773-1 781.
[2]李玉强,王昌禄,顾小波,等.β-半乳糖苷酶的研究与应用 [J].中国食品添加剂,2001(2):30-34.
[3]吴晖,牛晨艳,黄巍峰,等.乳糖不耐受症的现状及解决方法 [J].现代食品科技,2006,22(1):152-155.
[4]王衍鑫,刘兴华,陈琛,等.β-半乳糖苷酶产生菌的筛选及发酵条件优化 [J].农产品加工,2015(4):15-17.
[5]Pivarnik L F,Senecal A G,Rand A G.Hydrolytic and transgalactosylic activities of commercial β-galactosidase(lactas e) in food processing[J].Advances in Food and Nutrition Research,1995(5):1-102.
[6]Gekas V,Lopez-leiva M.Hydrolysis of lactase:A literature review[J].Process Biochemistry,1985,20 (1):2-12.
[7]陈海涛.低乳糖乳制品 [J].中国食品,1999(10):29-31.
[8]毛跟年,范金波,许牡丹,等.海藻酸钙固定化β-半乳糖苷酶催化合成低聚半乳糖 [J].食品科技,2004(10):5-7.
[9]潘晓亚,马力,周黎黎.固定化乳糖酶的研究 [J].中国乳品工业,2006,34(3):13-15.
[10]钱婷婷,杨瑞金,华霄,等.改性磁性壳聚糖微球固定乳糖酶 [J].食品与机械,2011,27(1):7-10.
[11]吴巧丽,张少凡,孙洋,等.食品安全及固定化载体——壳聚糖微球制备的条件[J].食品机械与设备,2012,28 (1):26-28.
[12]王永峰.生物高分子固定化β-半乳糖苷酶的研究 [D].兰州:西北师范大学,2004.
[13]陈陶声,居乃琥,陈石根.固定化酶理论与应用 [M].北京:轻工出版社,1987:173-177.
[14]丛峰松.生物化学实验 [M].上海:上海交通大学出版社,2005:117-118.
[15]朱祥瑞,徐俊良.家蚕丝素固定化α-淀粉酶的制备及其理化特性 [J].浙江大学学报(农业与生命科学版),2002,28(1):64-69.◇
