牛乳与山羊乳中乳桥蛋白的比较研究
2023-03-04罗元理于雪窦宇琪任向楠张立实朱婧
罗元理,于雪,窦宇琪,任向楠,张立实,朱婧
(1.四川大学华西公共卫生学院,成都 610041;2.北京市科学技术研究院北京市营养源研究所,北京 100069;3.北京大学公共卫生学院,北京 100089;4.中国疾病预防控制中心营养与健康所,北京 100050)
0 引 言
乳源性骨桥蛋白(osteopontin,OPN),也称乳桥蛋白(lactopontin,LPN)[1-2],最初发现存在于骨组织中[3-4],之后发现具有两种形式:细胞内OPN[5]和分泌型OPN[6]。人乳中LPN是分泌型OPN,含量远高于其他组织和分泌物[7]。研究发现乳汁中LPN在婴儿早期发育中可能发挥多种作用[8],特别是在婴儿早期肠道、大脑和免疫发育中显示出生物活性[9]。
不同物种LPN间存在结构相似性,均含有谷氨酸-甘氨酸-天冬氨酸构成的特殊结构序列,以及酶解后可暴露的隐蔽基序,可与细胞上整合素蛋白结合[10]。人乳和牛乳LPN在氨基酸序列、磷酸化和糖基化修饰位点等方面具有许多相似性[7],比如牛乳LPN中有25个磷酸化位点与人乳LPN相同[3,11]。临床研究发现添加牛乳LPN试验组的婴儿发热发生率、血浆促炎症细胞因子TNF-α水平以及外周血T细胞比例与纯母乳喂养组无差别[12-13],该研究结果提示人乳和牛乳LPN可能具有相似的生物活性。
有研究认为山羊乳的较低致敏性及易消化性适合牛乳不耐受或患有胃肠道疾病的婴幼儿[14],因此山羊乳正成为越来越多婴幼儿配方粉的乳源选择。山羊乳中可检测到LPN含量比牛乳略低[15]。目前关于山羊乳LPN的研究较少,山羊乳LPN与牛乳LPN结构,特别是其磷酸化修饰是否存在差异,还未见相关报道。本研究通过对山羊乳和牛乳中LPN进行序列相似度分析,并进行富集和测定,比较两者磷酸化修饰的差异,探讨两者结构的异同,为山羊乳LPN的应用开发提供依据。
1 材料与方法
1.1 序列比对(sequence alignment)
在Uniport数据库(https://www.uniprot.org/)中输入关键词“osteopontin“,获得蛋白质氨基酸序列,选择人(Homo sapiens,human)、牛(Bos taurus,bovine),山羊(Capra hircus,goat),Uniprot ID分别为P10451,P31096,A9YUB7,去除信号肽(signal peptide)后分别为P10451|17-314,P31096|17-278,A9YUB7|17-277。通过Uniprot自带的CLUSTALO程序,分别进行人和牛、人和山羊、牛和山羊的氨基酸序列比对,计数完全相同的氨基酸位点(identical positions),相同氨基酸位点比例(identity),相似氨基酸位点(similar positions)。
1.2 材料
实验样品:新鲜牛奶和新鲜山羊奶(200 m L)分别采集自内蒙古和陕西牧场,采集后迅速保存于-20°C冰箱,通过冷链快递运输至实验室保存于-80°C冰箱。
试剂与耗材:如无特殊说明,均购自Thermo Fisher,纯度为分析纯。Pierce磷酸化蛋白富集试剂盒(内含离心柱、洗涤缓冲液、洗脱缓冲液和超滤柱),蛋白酶和磷酸酶抑制剂,Oasis PRiME HLB 96孔板(Waters),Glu-C蛋白酶(Thermo Fisher,MS级),胰蛋白酶(Thermo Fisher,MS级),胃蛋白酶(Sigma Aldrich),嗜热菌蛋白酶(Sigma Aldrich);盐酸(HCl),氯化钙(CaCl2),碳酸氢铵(NH4HCO3),脱氧胆酸钠(sodium deoxycholate,SDC),三(羟甲基)氨基甲烷(Tris),三(2-羧乙基)膦(Tris(2-carboxyethyl)phosphine,TCEP),2-氯乙酰胺(2-Chloroacetamide,CAA),三氟乙酸(Trifluoroacetic acid,TFA),乙腈(Sigma Aldrich,色谱纯),甲酸(Sigma Aldrich,色谱纯)。
1.3 仪器与设备
低温高速离心机,Sigma Aldrich;真空离心浓缩仪,赫西;负压萃取器,Waters;Nanodrop,Thermo Fisher;Easy nLC 1200系统,Thermo Fisher;Orbitrap Fusion Lumos Tribrid质谱仪,Thermo Fisher。
1.4 试验方法
1.4.1 LPN富集及浓缩
由于LPN是高度磷酸化蛋白,可采用Pierce磷酸化蛋白富集试剂盒对其进行富集。但由于牛、山羊乳中高丰度的酪蛋白也是磷酸化蛋白,在使用Pierce磷酸化蛋白富集试剂盒前,需先沉淀并去除酪蛋白。将牛乳和山羊乳样品于4℃解冻并充分混匀后,各取2 mL,分别调节p H至4.3和CaCl2的终浓度至60 mmol/L,并以1 500 g在4℃离心30 min沉淀酪蛋白,取上清1 mL,按照Pierce磷酸化蛋白富集试剂盒的说明,通过离心柱吸附、洗涤缓冲液洗涤非磷酸化蛋白、洗脱缓冲液洗脱磷酸化蛋白,并将洗脱的磷酸化蛋白溶液通过超滤柱浓缩至150~200μL。
1.4.2 蛋白酶解
用Nanodrop测定浓缩后的磷酸化蛋白的浓度,每管取20 ng蛋白后使用超滤管将溶液置换为200 mmol/L NH4HCO3后,加入终浓度为1%(w/v)SDC,100 mmol/L Tris,5 mmol/L TCEP和30 mmol/L CAA使蛋白变性及二硫键还原和烷基化,分别采用5种加酶方式消化以增加鉴定的肽段覆盖率。管1加入胰蛋白酶0.4 ng于37℃消化14 h;管2加入Glu-C蛋白酶0.8 ng于37℃消化14 h;管3先加入胰蛋白酶0.4 ng于37℃消化14 h后加入Glu-C蛋白酶0.8 ng继续在37℃消化4 h;管4加入嗜热菌蛋白酶0.8 ng于70℃消化14 h;管5加入1 mol/L HCl调节p H至2.0,加入胃蛋白酶1 ng于37℃消化3 h。之后加入TFA至其终浓度为0.5%以停止酶解,20 000 g于室温离心10 min,保留上清,采用Oasis PRiME HLB 96孔板对其中的肽段脱盐后,在真空离心浓缩仪中干燥后保存于-80℃冰箱待液相色谱-串联质谱分析。
1.4.3 液相色谱-串联质谱分析
冻干的肽段用10%甲酸回溶后进行液相色谱-串联质谱(liquid chromatography-tandem mass spectrometry,LC-MS/MS)分析。采用配备Acclaim Pep Map 100-C18捕集柱(Thermo Fisher)和Acclaim Pep Map RSLC-C18分析柱(Thermo Fisher)的Easy nLC 1200系统(Thermo Fisher)分离肽,流动相由0.1%甲酸水溶液(流动相A)和乙腈(流动相B)组成。梯度洗脱时间为60 min,流速为300 nL/min,3 min内从3%B增加到8%B,随后在45 min内增加到35%B,之后在5 min内增加到100%B,并保持7 min。通过与LC系统耦合的Orbitrap Fusion Lumos Tribrid质谱仪(Thermo Fisher)进行分析,电喷雾电压2.0 k V。肽段的分析在数据依赖型采集(data-dependent acquisition,DDA)模式下使用高能碰撞解离(higher energy collision dissociation,HCD)进行MS/MS碎裂。MS1扫描范围为350~2 000 m/z,在200 m/z的分辨率为60 000,自动增益控制(automated gain control,AGC)设置为4e5,最大进样时间(maximum injection time,MIT)为50 ms。筛选强度>3e4的2+至6+电荷状态的母离子用于MS/MS(隔离窗口:1.6 m/z)。使用10 ppm排除窗口设置60 s动态排除,循环时间为2 s。M S/M S扫描采用HCD破碎,归一化碰撞能量为30%,Orbitrap检测的扫描从100 m/z开始,在200 m/z的分辨率为15 000,AGC为5e4,MIT为22 ms。使用相同的设置并行分析相同的样品,不同之处在于触发电子转移解离(electron-transfer dissociation,ETD)。
1.5 数据处理
数据库搜索采用Byonic软件(版本3.10.2,Protein Metrics Inc.),使用UniProt Swiss-Prot数据库进行搜索(牛:Bos Taurus、山羊:Capra Hircus),固定修饰为Cys位点脲甲基化(carbamidomethylation),可变修饰为Met位点氧化(oxidation)、肽段N端的Met损失和乙酰化(acetylation)、Ser,Thr,Tyr位点磷酸化(phosphorylation)、O-聚糖(6种常见O聚糖)。搜索设置的切割特异性根据文件选择不同的蛋白酶切位点。仅保留|log Prob|≥2.0且Byonic分数≥100的肽段,并使用Skyline(版本20.2.0.286,华盛顿大学)获得肽段母离子的提取离子流色谱图(extracted ion chromatogram,XIC)对肽段进行定量。将同一修饰位点的肽段的定量值,以100%为总值,计算各个位点该修饰的位点覆盖率。当不同的蛋白酶处理肽段均可计算位点覆盖率时,计算不同处理的均值作为位点覆盖率。
2 结果与分析
2.1 序列相似性比较
人和牛、人和山羊、牛和山羊的氨基酸序列比对分析结果见表1所示。其中人乳LPN由298个氨基酸构成,牛乳LPN由262个氨基酸构成,山羊乳LPN由261个氨基酸构成。人乳LPN与牛乳LPN有173个氨基酸位点完全相同,相同氨基酸位点比例(identity)为58.05%,相似氨基酸位点为59个,具有较高的序列相似性。人乳LPN和山羊乳LPN的序列相似性结果显示,有169个氨基酸位点完全相同,identity为56.71%,相似氨基酸位点为57个,也表现出较高的序列相似性。而牛乳和山羊乳LPN的序列高度相似,两者有238个氨基酸位点完全相同,identity高达90.94%,相似氨基酸位点为17个。
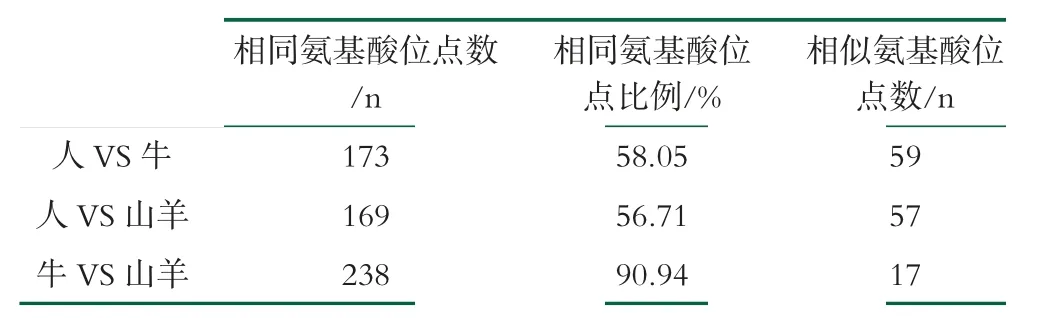
表1 不同物种乳桥蛋白序列相似性比较
图1对牛乳与山羊乳乳源性骨桥蛋白的氨基酸序列进一步进行内源酶切位点(虚线箭头标示)、整合素结合序列(下划线标示,红色:牛乳,绿色:山羊乳)、磷酸化修饰位点(红色加粗字体:牛乳中有实验数据证实的磷酸化修饰,蓝色加粗字体:牛乳中可能但未被实验数据证实的磷酸化修饰,绿色加粗字体:根据序列相似性推测的山羊乳中磷酸化修饰位点)和O-糖基化修饰位点(黄色加粗字体:牛乳,绿色加粗字体:山羊乳中根据序列相似性推测的位点)的比对。结果显示,牛乳LPN和山羊乳LPN在内源酶切位点上存在高度的相似性,第一个酶切位点均为Lys(K),第二个酶切位点牛乳LPN为Arg(R),山羊乳为Lys(K),但R和K均为乳中最主要的内源性蛋白酶纤溶酶(Plasmin)的酶切位点[16]。牛乳LPN和山羊乳的LPN的整合素结合序列,RGD序列和隐蔽基序(SVAYGLK)则完全一致。从可能的磷酸化修饰位点和O-糖基化修饰位点来看,山羊乳LPN在牛乳LPN所有的可能位点处都具有相同的氨基酸。因此,牛乳LPN和山羊乳LPN从序列相似度、内源酶切位点、整合素结合序列、可能的磷酸化修饰位点和O-糖基化修饰位点等多方面,均具有明显的相似性。

图1 牛乳与山羊乳乳桥蛋白氨基酸序列及关键位点
2.2 肽段覆盖率比较
山羊乳LPN的修饰位点仅根据与牛乳LPN的相似性推测,还未有实验相关数据证实,因此本研究通过LC-MS/MS比较山羊乳LPN和牛乳LPN在修饰位点的差异。由于两种LPN的氨基酸序列特点和磷酸化位点密集,需要使用多种蛋白酶提高肽段覆盖率和分开成簇的磷酸化位点。根据不同蛋白酶的特异性消化位点,此次研究采用了5种不同的蛋白酶解方式,使得肽段覆盖率比使用单种酶时得到了极大的提高。表2对5种酶解方式和合计的肽段覆盖率进行了描述。牛乳LPN和山羊乳LPN在同一蛋白酶处理时肽段覆盖率相似,且将所有蛋白酶切肽段合并时,肽段覆盖率均较单一蛋白酶提高。
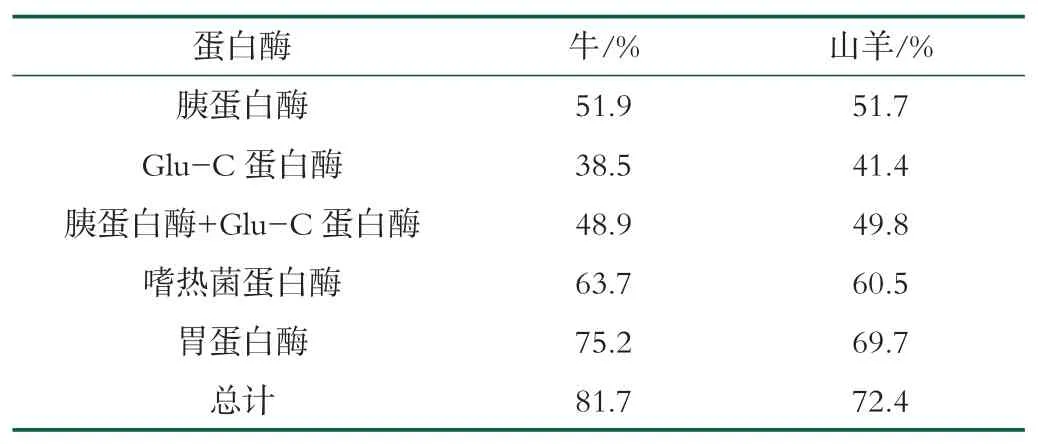
表2 不同蛋白酶处理下乳桥蛋白的肽段覆盖率
2.3 蛋白质修饰位点及位点覆盖率比较
根据Uniprot,牛乳LPN中有28个磷酸化修饰位点(27个磷酸丝氨酸位点,1个磷酸苏氨酸位点)和3个O-糖基化修饰位点曾在过往研究中被证实存在[17],根据相似性还有8个可能的磷酸化位点但尚未被证实。而山羊乳LPN还未报道过磷酸化修饰位点或O-糖基化修饰位点,但根据与牛乳LPN的序列的高度相似性,山羊乳LPN也在同样的位置可能具有蛋白质修饰位点。通过对酶解后肽段的鉴定和XIC的提取,对牛乳LPN和山羊乳LPN的各个蛋白质修饰位点的修饰位点覆盖率进行了计算和比较,见表3。需要特别指出的是,由于一些包含修饰位点的肽段没有被鉴定,一些位点无法计算位点覆盖率。还有一些肽段中包含多个可能的修饰位点,从谱图无法区分每个位点的覆盖情况时,对于磷酸化修饰,对该肽段的多个位点按照P0(均无修饰)、P1(其中1个位点存在修饰)、P2(其中2个位点存在修饰)和P3(其中3个位点存在修饰)的方式来表示;而对于O-糖基化修饰,则采用G0、G1、G2的方式表示。
对于O-糖基化位点而言,山羊乳LPN的3个可能O-糖基化位点未鉴定到相关的修饰肽段,而牛乳LPN的T 124和T129的其中1个位点存在O-糖基化修饰,其中糖链结构为Hex(1)HexNAc(1)NeuAc(1)的肽段占20.6%,Hex(1)HexNAc(1)NeuAc(2)占79.4%。对于磷酸化修饰位点而言,当牛乳LPN的位点为无磷酸化修饰(P0接近100%)和完全磷酸化修饰(P1接近100%)时,山羊乳LPN与牛乳LPN完全一致,如山羊乳LPN的S171、S182分别与牛乳LPN的S172、S183的位点覆盖率一致;当牛乳LPN的位点上同时存在无磷酸化修饰和不同数量的磷酸化修饰时,山羊乳LPN的部分位点与牛乳LPN不同,如山羊乳T161位点,46.7%为无磷酸化修饰,53.3%为具有磷酸化修饰,而相对应的牛乳T162位点则分别为24.1%和75.9%,具有更高的磷酸化修饰比例。总体而言,山羊乳LPN未识别到O-糖基化修饰;与牛乳LPN的磷酸化修饰相比,山羊乳LPN的修饰位点与牛乳LPN存在高度的一致性,但一些位点的磷酸化修饰在两者间略有差异。

(续表3)
3 讨论
LPN在生命早期的作用近年来受到许多关注,特别已经有许多研究通过一些体外、动物和临床试验等方式对牛乳LPN的作用进行了探讨。如体外实验表明,牛乳LPN可上调肠道上皮细胞(Caco-2)白介素-18的分泌并促进Caco-2的分化[18]。对于新生恒河猴的动物实验表明,添加牛乳LPN比普通配方喂养的肠道转录组更接近恒河猴母猴母乳喂养组[19]。添加牛乳LPN可促进乳猪的大脑体积和神经结构发育[20]。对健康足月儿的临床研究中也发现牛乳LPN的添加对于免疫相关的自诉症状、细胞因子、免疫细胞水平等具有益处[12-13]。而山羊乳作为我国重要的动物乳源,对其LPN的研究还较少。
牛乳LPN的生理功能与其结构密切相关,特别RGD序列和酶解后可暴露的隐蔽基序,是其发挥作用促进细胞黏附的特有结构,可与细胞表面的αvβ3等整合素结合或CD44受体结合,并介导一系列细胞代谢过程[21]。在生命早期,LPN有助于促进大脑、肠道以及免疫发育,这些作用中有许多是通过LPN与整合素结合介导的,特别是αvβ3整合素受体[22]。山羊乳和牛乳LPN在RGD序列和隐藏基序方面完全一致,表明山羊乳LPN也应该具有同样的整合素或CD44受体结合能力。根据序列比对结果,山羊乳和牛乳LPN在序列上存在高度的一致性,表现在完全相同的氨基酸比例高达90.94%。同时,在比较人乳LPN与山羊乳和牛乳LPN的序列后发现,完全相同的氨基酸比例均超过一半,呈现出较高的相似性,可能提示两者与人乳LPN之间具有相似的生物活性。
牛乳LPN是高度磷酸化并具有O-糖基化修饰的蛋白质[17]。研究表明,磷酸化和糖基化修饰的改变可影响不同来源的OPN与细胞表面受体的结合从而影响功能。比如,破骨细胞抗酒石酸酸性磷酸酶导致的部分去磷酸化的OPN对破骨细胞的细胞黏附活性降低[23]。正常大鼠肾细胞分泌的磷酸化和非磷酸化形式的OPN表现出不同的细胞表面相互作用和可溶性纤连蛋白的复合物形成情况[24]。只有磷酸化形式的OPN与整合素αvβ3结合并诱导巨噬细胞中的白介素-12表达[25]。而糖基化修饰不仅影响磷酸化,还影响LPN的细胞黏附活性[26]。本次研究结果显示,山羊乳LPN和牛乳LPN的磷酸化修饰存在较高的一致性,表现在可能的磷酸化位点完全一致,并且对于完全磷酸化的位点、完全无磷酸化修饰的位点的位点覆盖率完全一致,但是需要注意的是,一些存在不同程度磷酸化的位点在山羊乳LPN和牛乳LPN间存在位点覆盖率的不同。并且山羊乳LPN未鉴定到O-糖基化修饰,而牛乳LPN可鉴定到1个O-糖基化修饰位点。在氨基酸序列、结合序列、修饰位点基本一致的情况下,部分位点覆盖率和少数的修饰位点不同,是否会影响山羊乳LPN和牛乳LPN的生物活性还需要进一步的研究。
4 结 论
研究结果显示,山羊乳和牛乳LPN在序列上存在高度的一致性,表现在完全相同的氨基酸比例高达90.94%,均存在同样的整合素蛋白结合序列,磷酸化修饰位点基本一致。当位点为无磷酸化修饰和完全磷酸化修饰时,山羊乳LPN与牛乳LPN完全一致,但当位点上同时存在无磷酸化修饰和不同数量的磷酸化修饰时,山羊乳LPN和牛乳LPN的一些位点存在差异。此外,山羊乳LPN未鉴定到O-糖基化修饰,而牛乳LPN可鉴定到1个O-糖基化修饰位点。这些结果提示,尽管山羊乳LPN和牛乳LPN的部分蛋白质修饰具有一定的程度差异,但主要的功能序列和大多数磷酸化修饰具有较高的相似性,山羊乳LPN可能具有与牛乳LPN相似的生物活性。
