沉默T-cadherin对ox-LDL诱导人绒毛膜滋养层细胞HTR-8/SVneo生物学行为的影响
2023-02-09王海娇何红美祁麟崔玉娇肖春辉王毅
王海娇,何红美,祁麟,崔玉娇,肖春辉,王毅△
人绒毛膜滋养层细胞来自胚胎外滋养层,具有滋养功能,调节胚胎形成、植入,对顺利妊娠具有重要作用[1-2]。滋养层细胞异常凋亡、侵袭可引起胎儿生长受限、流产[3]、妊娠期肝内胆汁淤积症[4]、子痫[5]等疾病。研究滋养层细胞的行为学功能对于探究上述疾病的发病机制及治疗具有重要意义。T-钙黏蛋白(T-cadherin)是附着在细胞膜上的非经典黏附因子,通过调节钙介导的细胞极性、细胞黏附等方式参与细胞间信号传导及识别,与肿瘤细胞的增殖、迁移联系密切[6]。T-cadherin在人胃癌、宫颈癌细胞中低表达,T-cadherin 过表达可显著抑制癌细胞的增殖、侵袭及迁移[7-8]。因此推测T-cadherin 的表达可能与人绒毛膜滋养层细胞的增殖、迁移等存在关联。氧化低密度脂蛋白(ox-LDL)是低密度脂蛋白中大量不饱和脂肪酸在氧化作用下生成的脂质过氧化产物,在子痫前期患者体内呈现高表达[9]。研究发现ox-LDL可致人绒毛膜滋养层细胞增殖、侵袭能力受损,细胞异常凋亡等,与子痫等疾病密切相关[10-11]。本研究通过分析T-cadherin 对ox-LDL 诱导人绒毛膜滋养层细胞增殖、凋亡等异常生物学行为的影响,为保证胎盘正常功能和胎儿正常生长发育提供理论依据。
1 材料与方法
1.1 材料 人绒毛膜滋养层细胞HTR-8/SVneo(批号CL-0599)购自武汉普诺赛生命科技有限公司。T-cadherin 小干扰RNA(siRNA)、T-cadherin siRNA 阴性对照由武汉益普生物科技有限公司设计并合成;Lipofectamine 3000 转染试剂盒、逆转录试剂盒、膜联蛋白V-异硫氰酸荧光素/碘化丙啶(Annexin V-FITC/PI)凋亡检测试剂盒、BCA 蛋白试剂盒、SYBR 实时荧光定量PCR(qPCR)试剂盒均购自美国Invitrogen公司;RPMI 1640培养液、RNA提取试剂盒、四甲基偶氮唑盐(MTT)试剂盒、RIPA裂解液均购自北京索莱宝科技有限公司;结晶紫染液、蛋白提取试剂盒均购自上海碧云天公司;兔源胱天蛋白酶-3(Caspase-3)、B淋巴细胞瘤-2(Bcl-2)、Bcl-2 相关X 蛋白(Bax)、基质金属蛋白酶(MMP)-2、MMP-9、GAPDH 抗体、羊抗兔二抗均购自英国Abcam 公司;CO2细胞培养箱、qPCR仪、酶标仪、流式细胞仪均购自上海百典仪器设备有限公司;细胞计数器、凝胶成像仪均购自莱普特科学仪器(北京)有限公司;倒置显微镜购自日本Nikon公司。
1.2 方法
1.2.1 细胞培养 将HTR-8/SVneo 细胞株于37 ℃恒温水浴锅中复苏后转移到无菌离心管中,反复吹打细胞,待其充分悬浮后接种在培养瓶中,用RPMI 1640培养液(含1%的青链霉素混合液、10%胎牛血清)在37 ℃、5%CO2的培养箱中进行培养,每2 d 更换1 次培养液;待细胞长满培养瓶后利用0.25%胰蛋白酶进行消化传代。
1.2.2 细胞分组 取对数生长期HTR-8/SVneo 细胞并调整细胞密度为4×106个/mL,取2 mL 接种于细胞培养瓶培养24 h,将细胞随机分为空白对照组(用RPMI 1640培养液常规培养细胞)、ox-LDL组(用RPMI 1640培养液常规培养的基础上给予100 mg/L ox-LDL[11]处理48 h 诱导细胞)、T-cadherin siRNA 阴性对照组和T-cadherin siRNA 组。T-cadherin siRNA 阴性对照组和T-cadherin siRNA 组先通过Lipofectamine 3000转染试剂盒分别转染T-cadherin siRNA阴性对照、T-cadherin siRNA,然后给予100 mg/L ox-LDL 处理48 h诱导细胞。收集各组HTR-8/SVneo细胞进行后续实验,每组均重复6次。
1.2.3 qPCR 法检测HTR-8/SVneo 细胞中T-cadherin mRNA表达 提取各组细胞的总RNA,根据逆转录试剂盒要求得到cDNA,然后按照qPCR 试剂盒说明书进行反应。以U6 作为内参。T-cadherin 引物序列:上游5'-TTCAGCAGAAAGTGTTCCATAT-3',下游5'-GTGCATGGACGAACAGAGT-3';U6 引物序列:上游5'-CTCGCTTCGGCAGCACA-3',下游5'-AACGCTTCACGAATTTGCGT-3'。反应体系:ddH2O 8 μL,SYBR qPCR mix 10 μL,上下游引物各0.5 μL,cDNA 模板1 μL。反应条件:95 ℃预变性5 min,然后进行40 个循环(95 ℃变性10 s、60 ℃退火延伸20 s,72 ℃延伸10 s)。根据2-ΔΔCt法进行T-cadherin mRNA表达水平分析。
1.2.4 MTT 法检测HTR-8/SVneo 细胞增殖情况 收集各组细胞,调整细胞密度为1×104个/孔并接种于96 孔板,培养细胞48 h后加入10 μL MTT 试剂,继续培养4 h,离心去除上清液,加入110 μL Formazan溶解液并摇匀,于酶标仪490 nm波长处测定各孔吸光度值,计算细胞增殖抑制率,细胞增殖抑制率=(1-各处理组吸光度值/空白对照组吸光度值)×100%。
1.2.5 平板克隆形成实验检测HTR-8/SVneo 细胞克隆形成情况 取各组细胞,按照200 个/孔的细胞密度接种在24 孔板中,于CO2培养箱(37 ℃、5%)中培养14 d。期间每3 d更换1 次培养液,采用4%的多聚甲醛固定,1%的结晶紫进行染色,经PBS冲洗干净后进行拍照。根据公式计算克隆形成率(克隆形成率=克隆细胞数/接种细胞数×100%)。
1.2.6 流式细胞术检测HTR-8/SVneo 细胞凋亡情况 各组细胞用胰蛋白酶进行消化后经完全培养基终止消化,调整细胞密度为1×106个/mL 并转移至1 mL 无菌离心管中,用PBS清洗2 次后离心去除上清液,加入70%的乙醇溶液(4 ℃)固定过夜,经PBS溶液清洗后将细胞重悬,一次加入2 μL RNA酶(去除内源性RNA)、5 μL Annexin V-FITC(标记细胞),静置45 min后再加入2 μL PI 溶液避光染色1 h,于流式细胞仪观察细胞凋亡情况。
1.2.7 Transwell 实验检测HTR-8/SVneo 细胞侵袭能力 收集各组细胞,调整细胞密度至2×105个/mL,取200 μL细胞液加入预铺设好的Transwell小室的上室,用RPMI 1640培养液补至1 mL,下室仅加入600 μL完全培养基。培养48 h后轻轻拭去未过膜的细胞,将小室置于4%多聚甲醛中固定20 min后室温条件下风干,用结晶紫染液(1%)浸染20 min 后室温条件下风干,在光学显微镜下观察HTR-8/SVneo 细胞侵袭情况。随机读取6个视野,计算侵袭细胞数。
1.2.8 划痕实验检测HTR-8/SVneo 细胞迁移能力 收集各组HTR-8/SVneo 细胞置于恒温培养箱(37 ℃、5% CO2)中继续培养。待细胞铺满板内85%左右时,用200 μL 枪头垂直于6 孔板底部做直线划痕,之后细胞继续置于恒温培养箱(37 ℃、5%CO2)中培养24 h,于倒置光学显微镜下拍照观察,利用Image J软件测量划痕区域宽度,并计算细胞划痕愈合率,划痕愈合率=[1-(24 h时划痕宽度/0 h时划痕宽度)]×100%。
1.2.9 蛋白免疫印迹实验检测HTR-8/SVneo 细胞凋亡相关蛋白Caspase-3、Bax、Bcl-2 和侵袭迁移相关蛋白MMP-2、MMP-9表达情况 取各组细胞,调整密度为3×106个/mL,接种于24孔板中,加入RIPA 裂解液,裂解30 min 后离心,取上清液至无菌离心管中,根据BCA蛋白试剂盒操作步骤测定蛋白质含量。电泳分离等量蛋白质,湿转法转膜,加入封闭液封闭1 h,4 ℃下添加兔源Caspase-3、Bax、Bcl-2、MMP-2、MMP-9、内参GAPDH 一抗(均为1∶500)孵育过夜;用TBST缓冲液洗涤3 次,添加羊抗兔二抗(1∶1 000),常温孵育2 h,经凝胶成像仪对蛋白相对表达水平进行分析(目的蛋白/内参蛋白)。
1.3 统计学方法 采用SPSS 25.0 软件进行数据分析,计量资料以均数±标准差(±s)表示,多组间比较进行单因素方差分析,组间多重比较行SNK-q检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组HTR-8/SVneo 细胞T-cadherin mRNA 表达水平比较 空白对照组、ox-LDL 组、T-cadherin siRNA 阴性对照组和T-cadherin siRNA 组Tcadherin mRNA 表达水平分别为1.02±0.17、1.56±0.23、1.51±0.19 和1.09±0.05,差异有统计学意义(F=15.555,P<0.01);与空白对照组相比,ox-LDL 组和T-cadherin siRNA 阴性对照组T-cadherin mRNA 表达水平升高(P<0.05);与ox-LDL 组相比,Tcadherin siRNA 阴性对照组T-cadherin mRNA 表达水平差异无统计学意义,T-cadherin siRNA 组Tcadherin mRNA 表达水平降低(P<0.05);与Tcadherin siRNA 阴性对照组相比,T-cadherin siRNA组T-cadherin mRNA表达水平显著降低(P<0.05)。
2.2 各组HTR-8/SVneo细胞增殖抑制率、克隆形成率比较 与空白对照组相比,ox-LDL 组和Tcadherin siRNA阴性对照组增殖抑制率升高,克隆形成率降低(P<0.05);与ox-LDL 组相比,T-cadherin siRNA阴性对照组增殖抑制率和克隆形成率差异无统计学意义,T-cadherin siRNA 组增殖抑制率降低,克隆形成率升高(P<0.05);与T-cadherin siRNA 阴性对照组相比,T-cadherin siRNA 组增殖抑制率降低,克隆形成率升高(P<0.05)。见表1,图1。
Tab.1 Comparison of proliferation inhibition rate and clone formation rate between the four groups of HTR-8/SVneo cells表1 各组HTR-8/SVneo细胞增殖抑制率、克隆形成率比较(n=6,%,±s)
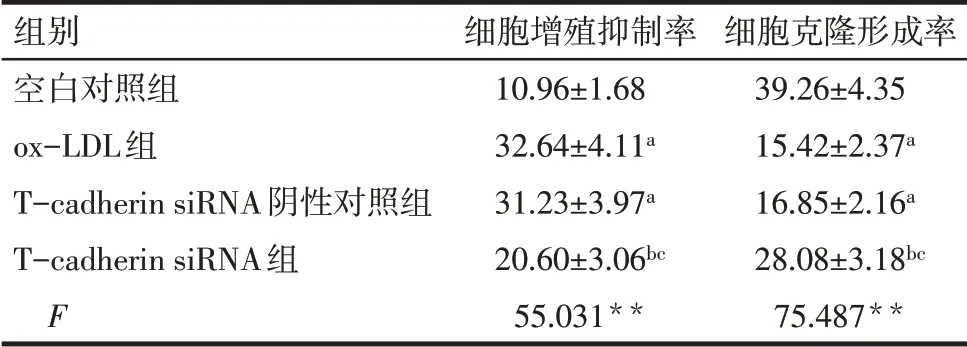
Tab.1 Comparison of proliferation inhibition rate and clone formation rate between the four groups of HTR-8/SVneo cells表1 各组HTR-8/SVneo细胞增殖抑制率、克隆形成率比较(n=6,%,±s)
**P<0.01;a 与空白对照组相比,b 与ox-LDL 组相比,c 与Tcadherin siRNA阴性对照组相比,P<0.05。
组别空白对照组ox-LDL组T-cadherin siRNA阴性对照组T-cadherin siRNA组F细胞增殖抑制率10.96±1.68 32.64±4.11a 31.23±3.97a 20.60±3.06bc 55.031**细胞克隆形成率39.26±4.35 15.42±2.37a 16.85±2.16a 28.08±3.18bc 75.487**
2.3 各组HTR-8/SVneo 细胞凋亡情况比较 空白对照组、ox-LDL 组、T-cadherin siRNA 阴性对照组、T-cadherin siRNA 组细胞凋亡率(%)分别为10.69±2.98、32.47±5.20、33.04±5.13 和21.06±3.98,差异有统计学意义(F=34.721,P<0.05)。与空白对照组相比,ox-LDL 组和T-cadherin siRNA 阴性对照组细胞凋亡率升高(P<0.05);与ox-LDL 组相比,Tcadherin siRNA 阴性对照组凋亡率差异无统计学意义,T-cadherin siRNA 组凋亡率降低(P<0.05);与T-cadherin siRNA 阴性对照组相比,T-cadherin siRNA组凋亡率降低(P<0.05)。见图2。
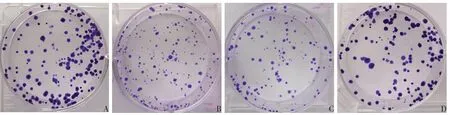
Fig.1 Morphological observation of HTR-8/SVneo cell clone formation in each group(crystal violet staining,×40)图1 各组HTR-8/SVneo细胞克隆形成形态学观察(结晶紫染色,×40)
2.4 各组HTR-8/SVneo 细胞侵袭和迁移能力比较 与空白对照组相比,ox-LDL 组和T-cadherin siRNA 阴性对照组侵袭细胞数、划痕愈合率降低(P<0.05);与ox-LDL 组相比,T-cadherin siRNA 阴性对照组细胞侵袭细胞数、划痕愈合率差异无统计学意义,T-cadherin siRNA 组侵袭细胞数、划痕愈合率升高(P<0.05);与T-cadherin siRNA 阴性对照组相比,T-cadherin siRNA 组侵袭细胞数、划痕愈合率升高(P<0.05)。见表2,图3、4。
2.5 各组HTR-8/SVneo 细胞Caspase-3、Bax、Bcl-2、MMP-2、MMP-9蛋白表达水平比较 与空白对照组相比,ox-LDL 组和T-cadherin siRNA 阴性对照组Caspase-3、Bax 蛋白表达水平升高,Bcl-2、MMP-2、MMP-9 蛋白表达水平降低(P<0.05);与ox-LDL 组相比,T-cadherin siRNA阴性对照组Caspase-3、Bax、Bcl-2、MMP-2、MMP-9蛋白表达水平差异无统计学意义,T-cadherin siRNA 组Caspase-3、Bax 蛋白表达水平降低,Bcl-2、MMP-2、MMP-9 蛋白表达水平升高(P<0.05);与T-cadherin siRNA阴性对照组相比,T-cadherin siRNA 组Caspase-3、Bax 蛋白表达水平降低,Bcl-2、MMP-2、MMP-9 蛋白表达水平升高(P<0.05)。见图5,表3。
Tab.2 Comparison of the number of invasive cells and scratch healing rate of HTR-8/SVneo cells between the four groups表2 各组HTR-8/SVneo细胞侵袭细胞数和划痕愈合率比较(n=6,±s)
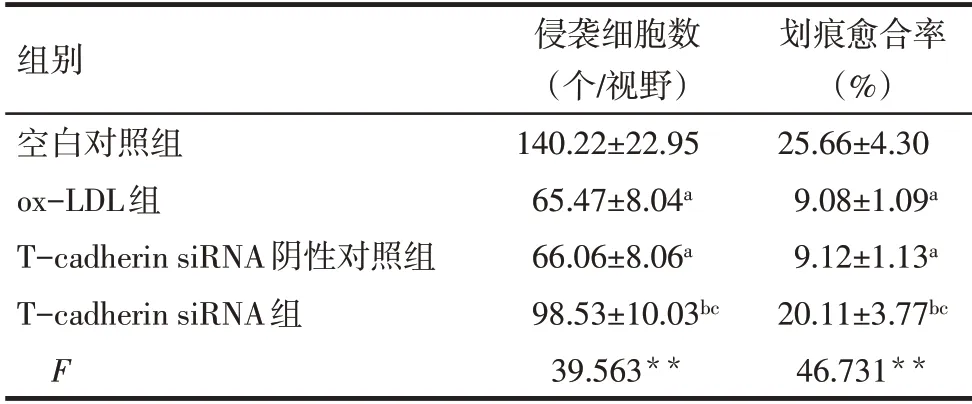
Tab.2 Comparison of the number of invasive cells and scratch healing rate of HTR-8/SVneo cells between the four groups表2 各组HTR-8/SVneo细胞侵袭细胞数和划痕愈合率比较(n=6,±s)
**P<0.01;a 与空白对照组相比,b 与ox-LDL 组相比,c 与Tcadherin siRNA阴性对照组相比,P<0.05。
组别空白对照组ox-LDL组T-cadherin siRNA阴性对照组T-cadherin siRNA组F侵袭细胞数(个/视野)140.22±22.95 65.47±8.04a 66.06±8.06a 98.53±10.03bc 39.563**划痕愈合率(%)25.66±4.30 9.08±1.09a 9.12±1.13a 20.11±3.77bc 46.731**
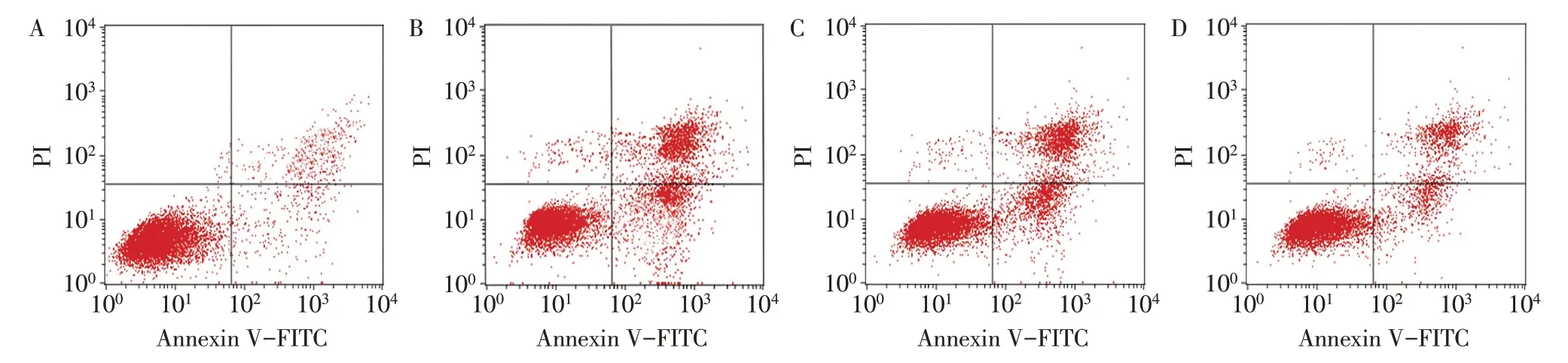
Fig.2 Apoptosis of HTR-8/SVneo cells in each group图2 各组HTR-8/SVneo细胞凋亡情况

Fig.3 Invasion of HTR-8/SVneo cells in each group(crystal violet staining,×200)图3 各组HTR-8/SVneo细胞侵袭情况(结晶紫染色,×200)

Fig.4 Migration of HTR-8/SVneo cells in each group(×100)图4 各组HTR-8/SVneo细胞迁移情况(×100)
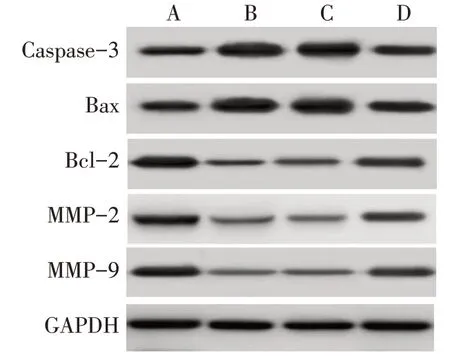
Fig.5 Western blot results of Caspase-3,Bax,Bcl-2,MMP-2 and MMP-9 protein of HTR-8/SVneo cells in each group图5 各组HTR-8/SVneo细胞Caspase-3、Bax、Bcl-2、MMP-2、MMP-9蛋白印迹图
3 讨论
ox-LDL是被氧化修饰后的低密度脂蛋白,具有极强的细胞毒性,是造成血管内皮损伤的关键。ox-LDL可增加细胞对低密度脂蛋白的通透性,进而损伤血管内皮细胞,诱导细胞凋亡[12-13]。研究表明ox-LDL同样可诱导滋养层细胞凋亡,并促进滋养层细胞中凋亡相关因子Caspase-3 等的表达[10]。本研究结果显示,经过ox-LDL诱导的HTR-8/SVneo细胞克隆形成能力、细胞侵袭及迁移能力显著下降,增殖抑制率、凋亡率显著升高,表明ox-LDL 具有诱导HTR-8/SVneo细胞凋亡,降低其侵袭能力的作用。
滋养层细胞具有类似肿瘤细胞的侵袭、迁移等能力,与胚胎着床及胚胎植入密切相关[14]。妊娠早期,滋养层细胞生长迅速,并可侵袭子宫内膜、螺旋小动脉、肌层等,使正常基质层减少,血管内皮细胞增加,血管阻力降低,形成高氧分压的血管网,并担负着母胎之间营养物质供应、气体交换等重任[15-16]。胎盘滋养层细胞分化、侵袭、黏附能力不足会导致胚胎血管生理性重铸障碍、胚胎浅着床、胎盘供血供氧不足等,引发局部氧化应激反应,产生大量炎症介质及毒性因子,引发胎儿血管内皮损伤、多系统受累等,最终导致不良妊娠结局的发生[17]。周小波等[18]研究发现子痫前期患者胎盘组织中滋养层细胞凋亡水平显著高于正常孕妇,其凋亡的发生与线粒体自噬密切相关。T-cadherin 是细胞黏附分子家族成员,具有调节细胞黏附、聚集、迁移、识别及信号传递等作用[19-20]。研究显示T-cadherin 是一种抑癌基因,在卵巢癌中表达降低,低表达的T-cadherin可促进卵巢癌细胞的增殖、侵袭、迁移等能力[21]。但关于T-cadherin 与人绒毛膜滋养层细胞的研究较少。本研究通过对HTR-8/SVneo 细胞转染T-cadherin siRNA,结果显示,与ox-LDL 组相比,T-cadherin siRNA 组HTR-8/SVneo 细胞中T-cadherin mRNA 表达水平显著降低,表明T-cadherin siRNA 转染效率较好,可进行后续实验。
细胞凋亡相关蛋白Caspase-3、Bax、Bcl-2 的表达可侧面反映细胞凋亡情况[22],侵袭迁移相关蛋白MMP-2、MMP-9表达水平与细胞的浸润程度密切相关,MMP-2、MMP-9 表达水平越高表明细胞侵袭能力越强[23]。本研究结果显示,与ox-LDL 组相比,Tcadherin siRNA组HTR-8/SVneo细胞增殖抑制率、凋亡率、Caspase-3、Bax 蛋白表达水平显著降低,克隆形成率、侵袭、迁移能力、Bcl-2、MMP-2、MMP-9 蛋白表达水平显著升高,提示低表达T-cadherin 可显著抑制由ox-LDL 诱导的HTR-8/SVneo 细胞异常凋亡,对于治疗妊娠期间HTR-8/SVneo 细胞异常凋亡引发的疾病具有一定的帮助。
综上所述,本研究初步明确沉默T-cadherin 可显著抑制ox-LDL 诱导的HTR-8/SVneo 细胞异常凋亡,并促进细胞的增殖、侵袭、迁移能力,但HTR-8/SVneo 细胞异常凋亡的机制复杂,关于维持HTR-8/SVneo细胞正常功能方面仍需深入研究。
Tab.3 Comparison of expression levels of Caspase-3,Bax,Bcl-2,MMP-2 and MMP-9 protein in HTR-8/SVneo cells between the four groups表3 各组HTR-8/SVneo细胞Caspase-3、Bax、Bcl-2、MMP-2、MMP-9蛋白表达水平比较 (n=6,±s)
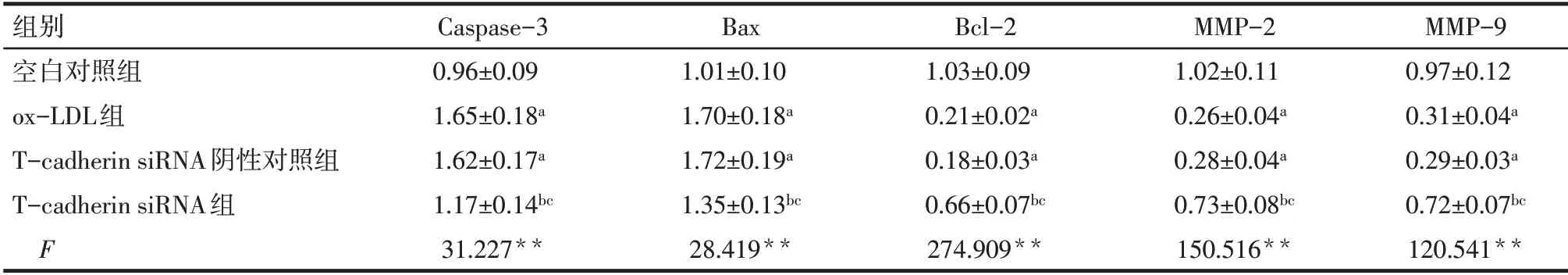
Tab.3 Comparison of expression levels of Caspase-3,Bax,Bcl-2,MMP-2 and MMP-9 protein in HTR-8/SVneo cells between the four groups表3 各组HTR-8/SVneo细胞Caspase-3、Bax、Bcl-2、MMP-2、MMP-9蛋白表达水平比较 (n=6,±s)
**P<0.01;a与空白对照组相比,b与ox-LDL组相比,c与T-cadherin siRNA阴性对照组相比,P<0.05。
组别空白对照组ox-LDL组T-cadherin siRNA阴性对照组T-cadherin siRNA组F Caspase-3 0.96±0.09 1.65±0.18a 1.62±0.17a 1.17±0.14bc 31.227**Bax 1.01±0.10 1.70±0.18a 1.72±0.19a 1.35±0.13bc 28.419**Bcl-2 1.03±0.09 0.21±0.02a 0.18±0.03a 0.66±0.07bc 274.909**MMP-2 1.02±0.11 0.26±0.04a 0.28±0.04a 0.73±0.08bc 150.516**MMP-9 0.97±0.12 0.31±0.04a 0.29±0.03a 0.72±0.07bc 120.541**
