miR-15b基因干扰在脑缺血再灌注损伤中的作用及机制研究
2023-02-09宋正锋刘媛媛戚鹏谈仙星马磊
宋正锋,刘媛媛,戚鹏,谈仙星,马磊
脑缺血是一种发病率、致残率和病死率均较高的脑血管疾病,在全球所有因病死亡原因排名中仅次于缺血性心脏病[1]。目前,临床常用的脑缺血治疗方法是及时恢复大脑血液灌注,但会造成脑缺血再灌注损伤[2]。有研究显示,在脑缺血再灌注损伤中,脑细胞的生物膜结构和线粒体功能被破坏,并触发线粒体途径、内质网应激途径和死亡受体途径的细胞凋亡[3]。研究表明,微小核糖核酸-15b(microRNA-15b,miR-15b)能够以凋亡抑制基因B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)为靶点,下调Bcl-2 的表达以促进细胞的凋亡过程[4]。而心肌缺血再灌注损伤会诱导miR-15b 的表达上调[5],但miR-15b在脑缺血再灌注损伤中的具体功能尚不清楚。本研究通过构建大鼠大脑皮层星形胶质细胞缺血再灌注损伤模型,探讨miR-15b 基因干扰对脑缺血再灌注损伤的影响及其作用机制。
1 材料与方法
1.1 材料 5只新生24 h内无特定病原体(SPF)级Wistar 乳鼠,雌雄不限,体质量(17.59±2.35)g,购自南通大禹生物技术有限公司[动物生产许可证号:SCXK(苏)2019-0008];293 T细胞购自美国Sciencell 公司(批号T191203);乳酸脱氢酶(lactate dehydrogenase,LDH)试剂盒购自广州兆康生物科技有限公司(批号1915142);兔抗鼠角质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)多克隆抗体购自美国Merck 公司(批号190417C);氮兰四唑盐(methyl tetrazolium salt,MTS)溶液购自上海羽哚生物科技有限公司(批号181203);聚合酶链反应(polymerase chain reaction,PCR)试剂盒购自日本TAKARA 公司(批号RR820A);兔抗鼠Bcl-2、胱天蛋白酶(Caspase)-3、Caspase-9 单克隆抗体,羊抗兔Bcl-2、Caspase-3、Caspase-9 多克隆抗体购自美国Merck 公司(批号190225A、181006A、191117C、180526A、190718B、191225C);pMiR-LucTM荧光素酶报告载体购自广州伯信生物科技有限公司(批号1915179)。HALO MPR-96 型酶标仪购自英国Dynamica 公司;LABOSPECT 006 型自动生化分析仪购自日本Hitachi公司;Attune NxT型流式细胞仪购自美国Invitrogen公司;S1000™384 Well 型PCR 仪购自伯乐生命医学产品(上海)有限公司;MSMINIONE 型电泳仪购自英国Cleaver 公司;ZF-258型凝胶成像分析系统购自上海嘉鹏科技有限公司。
1.2 大鼠大脑皮层星形胶质细胞原代培养、传代培养及鉴定
1.2.1 大鼠大脑皮层星形胶质细胞原代培养 取新生24 h以内的Wistar 乳鼠,碘伏消毒后,在无菌环境下剪开头皮和颅骨,分离出双侧大脑皮层,用预冷的磷酸盐缓冲液(phosphate buffered saline,PBS)清洗后将大脑皮层剪碎。用胰蛋白酶消化20 min,加入3 mL 含20%胎牛血清的DMEM培养液,1 000 r/min 离心5 min(离心半径6 cm),弃去上清液并加入DMEM培养液,反复吹打成单细胞悬液。经100目尼龙网过滤后,用培养液调整细胞密度至1.0×106个/mL,接种于培养瓶内,放入37 ℃、5%CO2培养箱内饱和湿度条件下培养50 min,更换培养瓶并弃去未贴壁细胞,继续培养50 min,24 h后换液去除悬浮死亡细胞,每3 d换液1次,经过9~11 d细胞融合为单层细胞即可传代培养。
1.2.2 大鼠大脑皮层星形胶质细胞传代培养 弃去原培养瓶内DMEM 培养基,用D-Hanks 液清洗2 次,加入0.1%的胰酶,倒置相差显微镜下观察。待细胞间隙增大、大部分细胞突起回缩且细胞形态略变圆时,弃去酶液,加入完全培养基以终止消化,反复吹打制成单细胞悬液。以1.0×104个/mL的细胞密度重新接种在新培养瓶中,每2~3 d换液1次,5~7 d后可再次传代,取第4代细胞(星形胶质细胞纯度较高)进行实验。
1.2.3 大鼠大脑皮层星形胶质细胞鉴定 GFAP是星形胶质细胞的特异性标志蛋白,故通过免疫细胞化学染色鉴定GFAP 表达[6]。取培养所得的第4 代细胞进行GFAP 免疫化学染色,显微镜下观察统计视野内GFAP 阳性细胞数与总细胞数的比例,阳性细胞占比大于95%即证实大鼠大脑皮层星形胶质细胞培养成功。
1.3 细胞分组及干预 取第4代细胞接种于96孔培养板,于37 ℃、5%CO2培养箱内饱和湿度条件下培养。待细胞培养至亚融合状态时将细胞分为对照组和模型组。对照组加入含20%胎牛血清的DMEM完全培养基培养至实验结束;模型组采用氧糖剥夺/再恢复法处理模拟体内脑缺血再灌注损伤,即在培养基内加入含5.0×10-4mol/L 的连二亚硫酸钠(Na2S2O4)的无糖Earle’s 液,1 h 后改为DMEM 完全培养基,继续培养24 h,模拟体内脑缺血再灌注损伤[7]。构建miR-15b 干扰腺病毒过表达载体(Ad miR-15b)、沉默载体(Ad as miR-15b)、过表达对照载体(Ad miR-15b-NC)和沉默对照载体(Ad as miR-15b-NC),送至杭州联川生物技术股份有限公司鉴定,将构建成功的载体分别转染上述模型组细胞,记为过表达组、沉默组、过表达对照组、沉默对照组,另设置空白组,每组各设置5个复孔。
1.4 各组细胞形态学变化和转染效率观察 各组细胞分组并培养24 h后,在倒置相差显微镜下观察其形态学变化。另在荧光显微镜下观察拍照,计算各组细胞转染效率=荧光显微镜下发光细胞数/普通显微镜下细胞数×100%。
1.5 各组细胞存活率、细胞活力及凋亡率检测 (1)MTS 检测细胞存活率。在培养于96孔板的各组细胞内每孔避光加入20 μL MTS溶液,设置空白对照组,于37 ℃、5%CO2培养箱内培养2 h。并用酶标仪检测各孔在490 nm波长处的光密度(OD)值,重复3 次取平均值,细胞存活率(%)=OD实验组/OD空白对照组×100%。(2)LDH 漏出率实验检测细胞活力。取培养于96 孔板的各组细胞,按照LDH 检测试剂盒说明书操作步骤,用自动生化分析仪分别检测各组细胞上清液和细胞内LDH活力。细胞活力(%)=上清液LDH活力/(上清液LDH活力+细胞内LDH活力)×100%。(3)流式细胞术检测细胞凋亡率。取各组细胞培养96 h 后,按1.0×105个/μL 置于流式管中,PBS冲洗2次,加入500 μL的结合缓冲液重悬细胞,加入Annexin V-FITC 和PI 各5 μL,室温避光孵育10 min,流式细胞仪检测,用FlowJo v10.8.1软件分析细胞凋亡率。
1.6 实时荧光定量聚合酶链反应(qPCR)检测各组细胞miR-15b 以及Bcl-2、Caspase-3、Caspase-9 mRNA 表达 取各组细胞,培养48 h后qPCR检测各目的基因mRNA的表达。用PureLink 纯化试剂盒提取总RNA,合成cDNA。引物由生工生物工程(上海)股份有限公司设计合成,miR-15b 引物:上 游 5'-TAGCTAGTCATGCTAAGC-3',下 游 5'-CATGTATAGCTAATGCAC-3',产物大小318 bp;Bcl-2 引物:上 游 5'-ATCTATAATGCGTACCCATG-3',下 游 5'-TTAGCTGACCAGTTACATTA-3',产物大小326 bp;Caspase-3 引物:上游5'-TGTTCATGCTAATGCACCTTGA-3',下游5'-GCAACTAGCATTACGGACAACT-3',产物大小330 bp;Caspase-9引物:上游5'-ATAACTGAATCGAACACT-3',下游5'-GCAACTACTGATACGTAC-3',产物大小314 bp。反应体系:SYBR®Premix Ex Taq™Ⅱ10 μL,上下游引物各0.8 μL,ROX Reference Dye Ⅱ(50×)0.4 μL,cDNA 模板2.0 μL,DEPC 水6.0 μL。反应过程:94 ℃3 min;94 ℃15 s,52 ℃1 min,72 ℃1 min,40 个循环。miR-15b 以U6 为内参,其余基因以β-actin 为内参,2-ΔΔCt法计算各目的基因的相对表达量。
1.7 Western blot 检测各组细胞Bcl-2、Caspase-3、Caspase-9蛋白表达 取各组细胞,培养48 h 后弃去培养液,冰浴条件下用200 W功率超声波破碎细胞5次,每次5 s,提取总蛋白。加入3 μL的上样缓冲液混合均匀,100 ℃热修复5 min。90 V电压电泳15 min 浓缩胶,120 V 恒压电泳1 h 分离胶。取凝胶,以湿转法转膜。1.5 h 后洗膜3 次,每次10 min;用5%脱脂牛奶封闭1 h再次以同法洗膜;加入一抗(1∶2 000),4 ℃孵育过夜,次日加入二抗(1∶2 000);加入400 μL化学发光试剂(enhanced chemiluminescence,ECL),室温避光孵育1 min,保鲜膜包好置于压片夹中,暗室显影、定影,标定Marker,扫描分析,计算各目标蛋白与β-actin灰度值的比值。
1.8 荧光素酶报告基因实验验证miR-15b 是否靶向调控Bcl-2 采用TargetScan 靶基因在线软件(http://www.targetscan.org/vert_72/)预测miR-15b的靶基因。将野生型和突变型Bcl-2 荧光素酶报告载体与Ad miR-15b、Ad miR-15b-NC共转染293 T细胞,以空载体作为空白对照组。弃去培养液,用100 μL 的PBS 冲洗各孔,每孔加入50 μL 细胞裂解液,于摇床上室温摇15 min裂解细胞,取10 μL上清液加入酶标板中,加入100 μL的LARⅡ检测试剂,静置2 s后用酶标仪检测数据。随后每孔加入100 μL 的淬灭剂,静置2 s 后再次检测数据。计算出前后2组数据的比值。
1.9 统计学方法 采用GraphPad Prism 8 软件进行数据分析。符合正态分布的计量资料以±s表示,多组间比较采用单因素方差分析,组间多重比较用SNK-q检验。P<0.05 为差异有统计学意义。
2 结果
2.1 大鼠大脑皮层星形胶质细胞的鉴定 GFAP阳性细胞胞体肥大,突起分支少,胞核呈空泡状,不显色,其中阳性细胞占比(98.12±2.05)%,大于95%,证实大鼠大脑皮层星形胶质细胞培养成功,见图1。

Fig.1 Identification of astrocytes in rat cerebral cortex(immunochemical staining,×200)图1 大鼠大脑皮层星形胶质细胞鉴定(免疫化学染色,×200)
2.2 各组细胞形态学变化和转染效率观察 (1)形态学变化。对照组细胞贴壁生长,细胞体积较大,突起粗壮,具有折光性,胞间联系紧密;空白组、过表达对照组和沉默对照组细胞明显可见贴壁细胞减少,细胞缩小变圆,细胞间隙变大,分布松散,折光性差;过表达组细胞数量进一步减少,分布更加稀疏,可见有明显细胞漂浮于培养液中;沉默组细胞数量较空白组和沉默对照组增加,但仍低于对照组,细胞有轻微缩小。(2)转染效率。除对照组和空白组外,各组细胞转染效率均在85%以上,其中对照组和空白组转染效率为0;过表达对照组转染效率为(89.26±5.13)%;沉默对照组转染效率为(90.21±6.70)%;过表达组转染效率为(92.04±6.55)%;沉默组转染效率为(88.18±5.82)%,见图2。
2.3 各组细胞存活率、细胞活力及凋亡率比较 与对照组比较,空白组、过表达对照组和沉默对照组细胞存活率降低,细胞活力和细胞凋亡率升高(P<0.05);与空白组和过表达对照组比较,过表达组细胞存活率降低,细胞活力和细胞凋亡率升高(P<0.05);与空白组和沉默对照组比较,沉默组细胞存活率升高,细胞活力和细胞凋亡率降低(P<0.05),见图3,表1。

Fig.2 Cell morphology and transfection efficiency of each group(×100)图2 各组细胞形态学及转染效率(×100)

Fig.3 Analysis of apoptosis rate in each group图3 各组细胞凋亡率分析
Tab.1 Analysis of cell survival rate,cell viability and apoptosis rate in each group表1 各组细胞的存活率、细胞活力及凋亡率比较(n=3,%,±s)

Tab.1 Analysis of cell survival rate,cell viability and apoptosis rate in each group表1 各组细胞的存活率、细胞活力及凋亡率比较(n=3,%,±s)
**P<0.01;a与对照组比较,b与空白组比较,c与过表达对照组比较,d与沉默对照组比较,P<0.05。
组别对照组空白组过表达对照组沉默对照组过表达组沉默组F存活率95.62±6.39 29.51±5.84a 28.94±5.73a 26.45±6.86a 9.12±1.02abc 55.23±8.04abd 76.586**细胞活力1.85±0.33 52.27±9.02a 49.58±9.23a 51.14±9.55a 77.25±11.78abc 27.36±5.15abd 28.127**凋亡率4.55±0.81 40.26±7.04a 42.55±7.30a 41.93±7.55a 64.54±10.06abc 21.18±2.03abd 28.700**
2.4 各组细胞miR-15b 以及Bcl-2、Caspase-3、Caspase-9 mRNA 表达比较 与对照组比较,空白组、过表达对照组和沉默对照组细胞miR-15b、Caspase-3、Caspase-9 mRNA表达升高,Bcl-2 mRNA表达降低(P<0.05);与空白组和过表达对照组比较,过表达组细胞miR-15b、Caspase-3、Caspase-9 mRNA 表达升高,Bcl-2 mRNA 表达降低(P<0.05);与空白组和沉默对照组比较,沉默组细胞miR-15b、Caspase-3、Caspase-9 mRNA表达降低,Bcl-2 mRNA表达升高(P<0.05),见表2。
2.5 各组细胞Bcl-2、Caspase-3、Caspase-9 蛋白表达比较 与对照组比较,空白组、过表达对照组和沉默对照组细胞Caspase-3、Caspase-9蛋白表达升高,Bcl-2 蛋白表达降低(P<0.05);与空白组和过表达对照组相比较,过表达组细胞Caspase-3、Caspase-9蛋白表达升高,Bcl-2蛋白表达降低(P<0.05);与空白组和沉默对照组比较,沉默组细胞Caspase-3、Caspase-9 蛋白表达降低,Bcl-2 蛋白表达升高(P<0.05),见图4,表3。
2.6 荧光素酶基因报告实验结果 TargetScan 软件预测发现,Bcl-2 的3'-UTR 序列中含有miR-15b 的结合位点,表明Bcl-2 可能是miR-15b 的靶基因,见图5。在转染野生型Bcl-2细胞中,Ad miR-15b细胞的荧光素酶相对活性低于Ad miR-15b-NC 细胞(0.55±0.09vs.1.06±0.18,t=4.389,P<0.05);在转染突变型Bcl-2 细胞中,Ad miR-15b 细胞的荧光素酶相对活性与Ad miR-15b-NC 细胞荧光素酶相对活性差异无统计学意义(1.01±0.17vs.0.98±0.15,t=0.229,P>0.05)。
Tab.2 Analysis of relative expression levels of miR-15b,Bcl-2,Caspase-3 and Caspase-9 mRNA in cells of each group表2 各组细胞的miR-15b以及Bcl-2、Caspase-3、Caspase-9 mRNA相对表达量比较(n=3,±s)

Tab.2 Analysis of relative expression levels of miR-15b,Bcl-2,Caspase-3 and Caspase-9 mRNA in cells of each group表2 各组细胞的miR-15b以及Bcl-2、Caspase-3、Caspase-9 mRNA相对表达量比较(n=3,±s)
**P<0.01;a与对照组比较,b与空白组比较,c与过表达对照组比较,d与沉默对照组比较,P<0.05。
组别对照组空白组过表达对照组沉默对照组过表达组沉默组F miR-15b 1.03±0.18 1.78±0.31a 1.85±0.34a 1.82±0.33a 2.98±0.52abc 1.11±0.19bd 16.952**Bcl-2 1.01±0.20 0.52±0.09a 0.50±0.09a 0.47±0.08a 0.18±0.03abc 0.87±0.16abd 30.145**Caspase-3 0.98±0.17 2.05±0.38a 2.01±0.35a 1.99±0.36a 3.26±0.57abc 1.24±0.21bd 21.377**Caspase-9 1.00±0.19 1.62±0.28a 1.59±0.26a 1.65±0.30a 2.74±0.51abc 1.07±0.16bd 14.108**
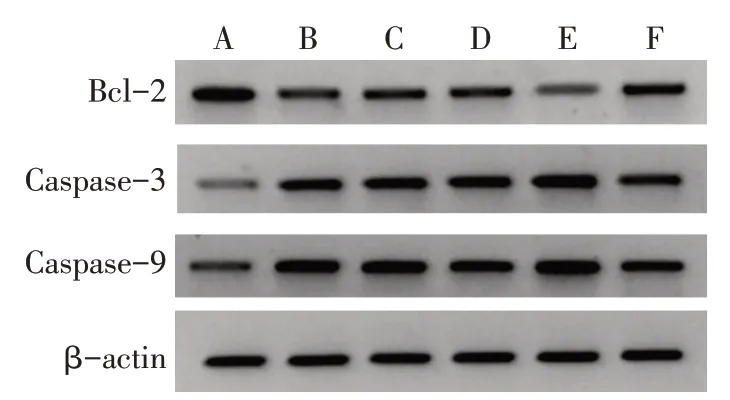
Fig.4 The expression levels of Bcl-2,Caspase-3 and Caspase-9 protein in cells of each group图4 各组细胞Bcl-2、Caspase-3、Caspase-9蛋白表达
Tab.3 Analysis of relative expression levels of Bcl-2,Caspase-3 and Caspase-9 proteins in cells of each group表3 各组细胞的Bcl-2、Caspase-3、Caspase-9蛋白相对表达量分析(n=3,±s)

Tab.3 Analysis of relative expression levels of Bcl-2,Caspase-3 and Caspase-9 proteins in cells of each group表3 各组细胞的Bcl-2、Caspase-3、Caspase-9蛋白相对表达量分析(n=3,±s)
**P<0.01;a与对照组比较,b与空白组比较,c与过表达对照组比较,d与沉默对照组比较,P<0.05。
组别对照组空白组过表达对照组沉默对照组过表达组沉默组F Bcl-2 1.71±0.27 0.79±0.12a 0.76±0.12a 0.80±0.13a 0.30±0.08abc 1.26±0.18abd 26.973**Caspase-3 0.52±0.08 1.51±0.25a 1.55±0.28a 1.46±0.24a 2.31±0.37abc 0.78±0.14bd 20.052**Caspase-9 0.48±0.07 1.15±0.21a 1.22±0.22a 1.06±0.18a 1.85±0.31abc 0.51±0.12bd 19.406**

Fig.5 Binding site of miR-15b in Bcl-2图5 miR-15b在Bcl-2的结合位点图
3 讨论
miR-15b位于SMC4基因的第5内含子中,广泛参与了细胞的增殖、分化、凋亡以及周期调控等重要细胞生物学过程[8]。有研究显示,miR-15b 在肺癌、肝癌和胃癌细胞中均参与了调控细胞凋亡过程[9-10]。在新生大鼠的心肌细胞中,miR-15b被证实可以通过活化Caspase 信号通路和调控细胞凋亡线粒体途径,从而诱导大鼠心肌细胞凋亡[11]。本研究中,各组细胞转染效率均在85%以上,说明miR-15b成功转染大鼠大脑皮层星形胶质细胞;与空白组和过表达对照组相比,过表达组细胞存活率降低,细胞活力和细胞凋亡率升高;与空白组和沉默对照组相比,沉默组细胞存活率升高,细胞活力和细胞凋亡率降低,表明miR-15b 过表达会降低细胞活力并诱导细胞凋亡,miR-15b 沉默则有增加细胞活力并减少细胞凋亡的作用。
脑缺血再灌注损伤诱导神经细胞凋亡的途径包括线粒体途径、内质网应激途径和死亡受体途径[12]。Caspase-3是这3种凋亡途径共同的下游效应分子,是凋亡蛋白酶级联反应的必经之路。有研究显示,在正常人脑神经细胞中Caspase-3蛋白几乎无表达,在脑缺血状态下Caspase-3 蛋白表达明显升高,且Caspase-3 蛋白表达的变化趋势与脑缺血再灌注损伤后细胞凋亡的变化趋势保持一致[13]。Bcl-2 基因被广泛认为是一种内源性凋亡抑制基因,对维持脑缺血再灌注后神经细胞的生存有重要作用。Bcl-2蛋白是一种主要存在于线粒体外膜的稳定蛋白,能够保护线粒体内外膜的稳定性。线粒体是细胞凋亡线粒体途径的控制中心,线粒体外膜被破坏后释放的细胞色素C等凋亡诱导因子,能够激活Caspase-9和Caspase-3并诱导细胞凋亡[14]。Caspase-9是细胞线粒体凋亡途径中的重要起始因子,当线粒体发出促凋亡信号后,被活化的Caspase-9通过激活下游的Caspases,进一步放大级联反应,促进细胞凋亡[15]。另有研究显示,在大鼠脑缺血再灌注损伤模型中,可以通过诱导Bcl-2 基因的表达,抑制Caspase-3 活性,减轻大鼠脑缺血再灌注损伤,保护脑组织[16]。本研究中,与空白组和过表达对照组相比,过表达组细胞Bcl-2 mRNA和蛋白的表达降低,miR-15b表达以及Caspase-3、Caspase-9 mRNA 和蛋白表达升高;与空白组和沉默对照组比,沉默组细胞Bcl-2 mRNA和蛋白的表达升高,miR-15b 表达以及Caspase-3、Caspase-9 mRNA和蛋白表达降低,表明miR-15b过表达能降低Bcl-2的表达,增加Caspase-3、Caspase-9 的表达,miR-15b 沉默则升高Bcl-2 的表达,抑制Caspase-3、Caspase-9 的表达,推测miR-15b 是通过降低Bcl-2 的表达,增加Caspase-3、Caspase-9 的表达以实现降低细胞活力并诱导细胞凋亡的效果,进一步加重脑缺血再灌注损伤。
miRNA 作用于靶基因的3'-UTR 起作用,故把目的基因的3'-UTR 区域构建于荧光素酶报告基因载体中,可通过比较过表达或者干扰miRNA 前后,检测萤光素酶活性变化以反映miRNA 对目的基因的靶向作用[17]。有研究显示,山奈酚可通过激活胞内磷脂酰肌醇激酶(phosphatidylinositol-3-kinase,PI3K)/蛋白激酶B(protein kinase B,AKT)途径下调miR-15b的表达,下调的miR-15b靶向作用于Bcl-2并通过调节Bcl-2 的表达减少氧-葡萄糖剥夺引起的细胞凋亡,缓解缺血性心脏病病情[18]。本研究中,在转染野生型Bcl-2 细胞中,Ad miR-15b 细胞的荧光素酶相对活性低于Ad miR-15b-NC 细胞,说明miR-15b 与Bcl-2 的3'-UTR 序列有结合位点,miR-15b转染进入细胞后抑制了该靶点的荧光素酶活性,干扰Bcl-2 的3'-UTR 序列结合位点后,荧光强度基本恢复正常,证实了miR-15b可靶向调控Bcl-2。
综上所述,miR-15b 沉默是通过线粒体凋亡途径增加Bcl-2 的表达,降低Caspase-3、Caspase-9 的表达,从而抑制细胞凋亡,减轻脑缺血再灌注损伤。这为miR-15b运用于脑缺血再灌注损伤治疗提供了理论依据。
