miR-891a-5p通过CPEB1调控结肠癌细胞生物过程的机制研究
2023-02-09张新燕赵国栋
张新燕,赵国栋
结肠癌是消化系统常见的恶性肿瘤之一。研究显示近年来结肠癌的发病率上升,发病年龄降低,对人类生命和健康构成严重威胁[1-2]。结肠癌在发病早期无特定症状,不易被发现。大多数患者在确诊时已至晚期,预后较差。转移性结肠癌患者的5年生存率远低于非转移性结肠癌患者[3-4]。寻找早期治疗结肠癌的潜在靶点具有重要意义。微小RNA(miRNA)是一种内源性保守的18~25个核苷酸组成的单链RNA分子,其可抑制mRNA的转录或蛋白翻译过程,调控蛋白的表达,参与人类多种癌症的发生发展过程[5-6]。miR-891a-5p 是新近发现的肿瘤相关miRNA,在黑色素瘤[7]中具有抑癌作用,在前列腺癌[8]中发挥促癌作用。细胞质多聚腺苷酸化元件结合蛋白(cytoplasmic polyadenylation element binding protein,CPEB)的抑癌功能已被证实[9],但其与miR-891a-5p 间是否存在相互作用尚不明确。本研究拟通过观察miR-891a-5p 在结肠癌组织、细胞中的表达及其对结肠癌细胞存活、凋亡、迁移和侵袭的影响,揭示其作用机制与CPEB1 之间的关系,以期为结肠癌治疗提供理论支持。
1 材料与方法
1.1 标本来源 结肠癌组织及癌旁组织来自海口市人民医院2019年2月—2021年9月经结肠镜检查联合病理学活检诊断为结肠癌并接受手术切除的患者。排除标准:合并其他肿瘤者;预计存活时间小于3个月者;1个月内进行过外科手术者;可测量病灶不足2个者。共纳入79例,年龄38~67岁,平均(54±3)岁,男40例,女39例。所有患者及家属均签署知情同意书,本研究经本医院医学伦理委员会批准[院科伦审:(2019)伦审第(9号)]。
1.2 主要试剂及仪器 人正常结肠上皮细胞NCM460、人结肠癌细胞LOVO、SW480、HCT116均购自美国菌种保藏中心;DMEM 培养液购自美国Gibco 公司;胎牛血清购自杭州四季青生物工程材料有限公司;LipofectamineTM3000 转染试剂盒购自美国Promega 公司;TRIzol 液购自美国赛默飞世尔科技公司;实时荧光定量逆转录聚合酶链反应(qPCR)试剂盒(Mir-X miRNA qRT-PCR)购自日本Takara公司;细胞计数试剂盒(CCK-8)购自日本同仁化学研究所;Annexin V-FITC/PI细胞凋亡检测试剂盒购自上海碧云天生物科技有限公司;兔抗人甘油醛-3-磷酸脱氢酶(GAPDH)单抗、兔抗人细胞周期蛋白D1(Cyclin D1)多抗购自美国Cell Signaling Technology公司;兔抗人活化的胱天蛋白酶-3(C-caspase-3)单抗、兔抗人胱天蛋白酶-3 酶原(Pro-caspase-3)单抗购美国Bio Vision;兔抗人CPEB1多抗、兔抗人N-钙黏蛋白(N-cadherin)多抗、兔抗人上皮细胞钙黏蛋白(E-cadherin)多抗和兔抗人波形蛋白(Vimentin)多抗均购自美国Proteintech 公司;辣根过氧化物酶(HRP)标记的山羊抗兔二抗购自美国赛默飞世尔科技公司;Transwell 小室购自美国Corning 公司;双荧光素酶报告基因检测试剂盒购自美国Biotium 公司;miR-con、miR-891a-5p、anti-miR-con、anti-miR-891a-5p、si-con、si-CPEB1序列及引物的设计、合成均委托上海吉玛基因股份有限公司完成。倒置显微镜购自日本Nikon 公司;凝胶成像系统、电泳仪、转膜仪购自美国Bio-Rad 公司;流式细胞仪购自美国赛默飞世尔科技公司。
1.2 方法
1.2.1 细胞培养 NCM460、LOVO、SW480、HCT116 细胞使用DMEM 培养液(含10%胎牛血清+1%青霉素-链霉素混合液)于37 ℃、5%CO2的饱和湿度恒温细胞培养箱中培养,每隔2 d更换1次新鲜培养液。
1.2.2 qPCR 检测miR-891a-5p 表达 TRIzol 液提取组织和细胞总RNA,并将其反转录为cDNA后进行PCR反应。20 μL反应体系,hsa-miR-891a-5p 引物上游5'-GTGCAACGAACCTGAGC-3',下游5'-GACCTGAACCTGAACCTGAA-3',产物大小22 bp;U6 引物上游5'-CTCGCTTCGGCAGCACA-3',下游5'-AACGCTTCACGAATTTGCGT-3',产物大小13 bp。反应条件为:95 ℃预变性10 min;95 ℃变性30 s,60 ℃退火38 s,72 ℃延伸15 s,40 个循环。以U6 为内参,2-ΔΔCt法计算目的基因miR-891a-5p的相对表达水平。
1.2.3 分组与处理 依据1.2.2 筛选miR-891a-5p 表达水平最高的细胞LOVO 用于后续实验。将LOVO 细胞分为A 组(不做任何处理)、B 组(转染anti-miR-con)、C 组(转染antimiR-891a-5p)、D 组(共转染anti-miR-891a-5p 和si-con)、E组(共转染anti-miR-891a-5p 和si-CPEB1)、F 组(转染miRcon)、G组(转染miR-891a-5p),用Lipofectamine 3000脂质体转染12 h后更换新培养液继续培养48 h。
1.2.4 CCK-8法检测细胞增殖率 收集细胞,用培养液调至0.5×105个/mL,取200 μL置于96孔板,37 ℃培养10 h,取出细胞。每孔加入10 μL 的CCK-8 反应液,震荡混匀,避光孵育20 min。在490 nm 波长下检测细胞的光密度(OD490)。细胞增殖率=实验组OD490/对照组OD490×100%。
1.2.5 Annexin V-FITC/PI法检测细胞凋亡率 收集细胞,用预冷的PBS洗涤5次,再用500 μL结合缓冲液悬浮细胞。加入5 μL Annexin V/FITC,震荡混匀,避光孵育15 min,再加入5 μL PI,振荡混匀,孵育15 min。流式细胞仪分析细胞凋亡情况。
1.2.6 蛋白免疫印迹实验检测细胞蛋白表达 收集细胞,冰上RIPA裂解30 min,提取总蛋白。BCA法测定蛋白浓度,沸水浴变性,取上清液上样。SDS-PAGE 蛋白电泳,恒压45 V电泳至条带距离下缘1 cm,120 V 电泳至分离胶下缘结束电泳。用转膜仪将凝胶上的蛋白转移至NC 膜,整个转膜过程需维持在0 ℃。转膜结束后,用2.5%脱脂奶粉的封闭液将膜37 ℃封闭处理2 h。CPEB1(1∶1 500)、Cyclin D1(1∶1 000)、Pro-caspase-3(1∶2 500)、C-caspase-3(1∶2 000)、N-cadherin(1∶1 000);E-cadherin(1∶1 000)、Vimentin(1∶1 000)、GAPDH(1∶1 000),4 ℃孵育过夜。次日充分洗膜,山羊抗兔二抗(1∶500),37 ℃孵育2 h。充分洗膜,用ECL 发光液显影曝光。Image J 软件分析蛋白条带的灰度值,以GAPDH 为内参,目的蛋白与内参的比值表示蛋白的相对表达水平。
1.2.7 Transwell实验检测细胞迁移、侵袭 将待检测的细胞用无血清的DMEM 培养液饥饿培养24 h。用无血清培养基调至5×106个/mL,取200 μL 均匀涂抹在Transwell 小室的上室。下室中加入500 mL 含10%血清的培养基,置于37 ℃培养箱中继续培养至48 h。拭去上层未发生穿膜的细胞,将穿膜的细胞用结晶紫染色,显微镜下观察细胞,5点法计数,取平均值。细胞侵袭能力的检测使用带有基质胶的Transwell小室检测,具体操作步骤同上。
1.2.8 双荧光素酶报告基因实验检测细胞的荧光活性 通过靶基因在线预测网站miRDB(http://mirdb.org/)预测miR-891a-5p 与CPEB1 靶向关系。根据预测到的CPEB1 结合位点化学合成含有CPEB1 3'-UTR 结合位点的序列(WTCPEB1)和不含CPEB1 3'-UTR 结合位点的序列(MUTCPEB1),并将其插入荧光载体pEGFPN1,构建荧光报告基因载体pEGFPN1-WT-CPEB1、pEGFPN1-MUT-CPEB1。将上述荧光报告基因载体与miR-con、miR-891a-5p、anti-miRcon、anti-miR-891a-5p 共转染至细胞,双荧光素酶报告基因检测试剂盒检测细胞的荧光活性。以海肾荧光活性为内参,萤火虫荧光活性与海肾荧光活性之比表示细胞的荧光强度。
1.3 统计学方法 采用SPSS 22.0软件进行数据分析。计量资料采用均数±标准差(±s)表示。多组间比较用单因素方差分析,组间多重比较采用LSD-t检验。2 组数据比较用独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 miR-891a-5p在结肠癌组织和细胞中的表达情况 与癌旁组织相比,结肠癌组织miR-891a-5p 表达升高(4.46±1.11vs.1.08±0.14,n=79,t=26.852,P<0.01)。LOVO、SW480、HCT116组细胞miR-891a-5p分别为6.42±0.51、5.66±0.66 和4.82±0.85,均显著高于NCM460 细胞(1.06±0.12),其中LOVO 最高(n=9,F=54.091,P<0.05)。
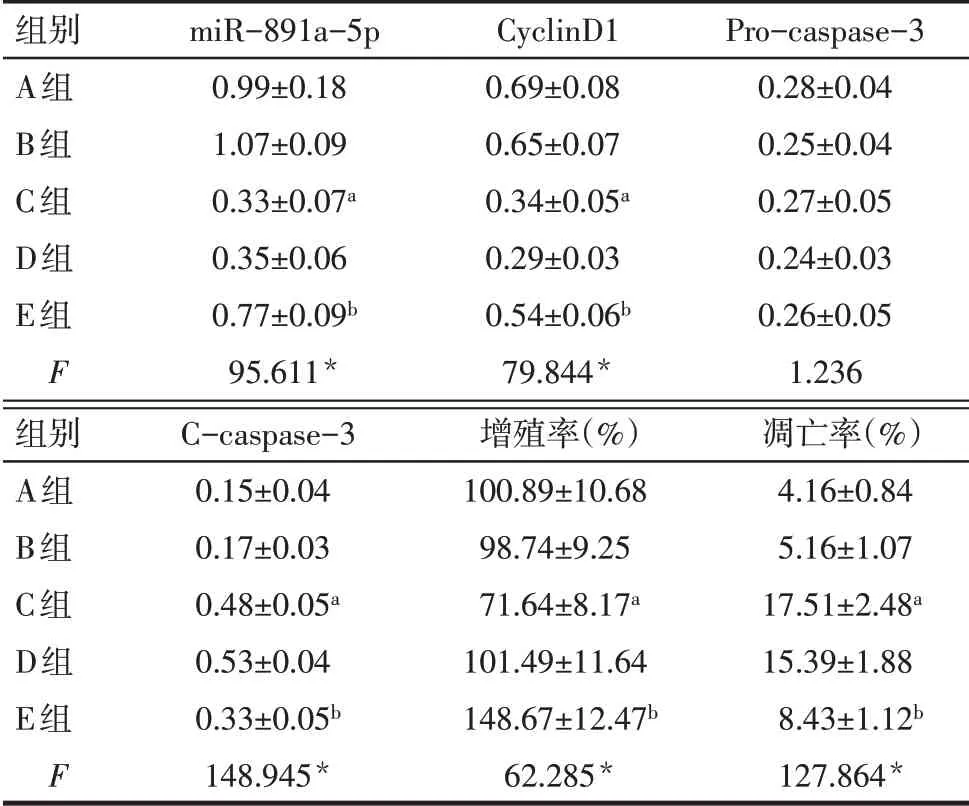
2.2 各组细胞增殖和凋亡情况比较 与B 组相比,C 组miR-891a-5p、CyclinD1 蛋白表达和增殖率降低,C-caspase-3蛋白表达和凋亡率升高(P<0.05);与D 组相比,E 组miR-891a-5p、Cyclin D1 蛋白表达和增殖率升高,C-caspase-3蛋白表达和凋亡率降低(P<0.05);各组Pro-caspase-3 蛋白表达差异无统计学意义。见图1、2,表1。
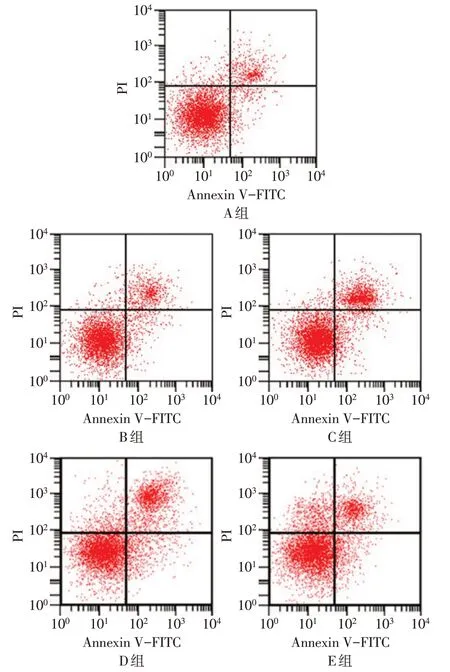
Fig.1 Changes of apoptosis levels in each group图1 各组细胞凋亡水平变化
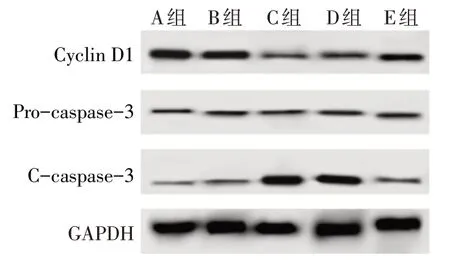
Fig.2 Western blot results of Cyclin D1,Pro-caspase-3 and C-caspase-3 in each group图2 各组细胞Cyclin D1、Pro-caspase-3、C-caspase-3蛋白印迹
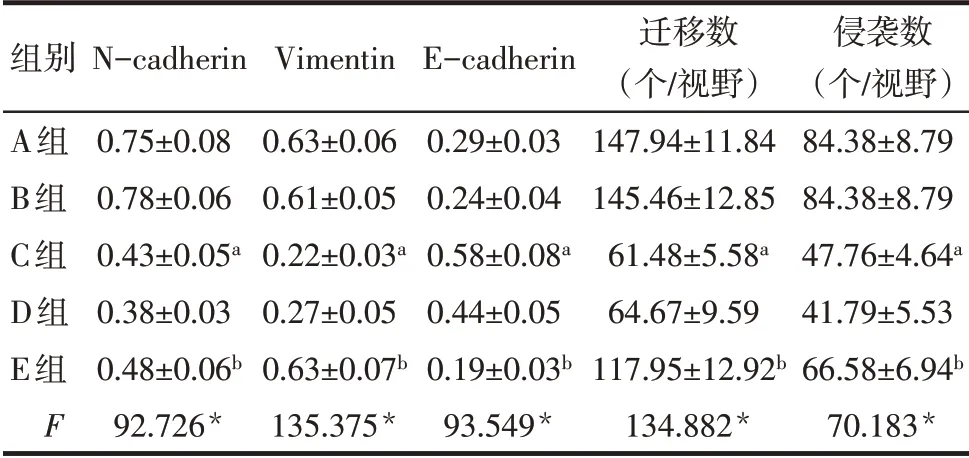
2.3 各组细胞迁移、侵袭情况比较 与B组相比,C组N-cadherin、Vimentin 蛋白表达水平下降,细胞迁移、侵袭数量均降低,E-cadherin蛋白表达升高(P<0.05)。与D 组相比,E 组N-cadherin、Vimentin 的蛋白表达水平升高,细胞迁移、侵袭数量均升高,Ecadherin蛋白表达降低(P<0.05)。见表2,图3、4。
2.4 miR-891a-5p 靶向调控CPEB1 miR-891a-5p与CPEB1的3'-UTR存在连续的6个互补结合位点,见图5。与F 组相比,G 组WT-CPEB1 荧光活性和CPEB1 蛋白表达降低(P<0.05);与B 组相比,C 组WT-CPEB1 荧光活性和CPEB1 蛋白表达升高(P<0.05),见表3、图6。
Tab.1 Comparison of miR-891a-5p,Cyclin D1,Procaspase-3 and C-caspase-3 protein expression levels and proliferation and apoptosis rates between the five groups表1 各组miR-891a-5p、Cyclin D1、Pro-caspase-3、Ccaspase-3蛋白表达水平及增殖、凋亡率比较(n=9,±s)
Tab.1 Comparison of miR-891a-5p,Cyclin D1,Procaspase-3 and C-caspase-3 protein expression levels and proliferation and apoptosis rates between the five groups表1 各组miR-891a-5p、Cyclin D1、Pro-caspase-3、Ccaspase-3蛋白表达水平及增殖、凋亡率比较(n=9,±s)
*P<0.05;a与B组比较,b与D组比较,P<0.05。
组别A组B组C组D组E组F miR-891a-5p 0.99±0.18 1.07±0.09 0.33±0.07a 0.35±0.06 0.77±0.09b 95.611*CyclinD1 0.69±0.08 0.65±0.07 0.34±0.05a 0.29±0.03 0.54±0.06b 79.844*Pro-caspase-3 0.28±0.04 0.25±0.04 0.27±0.05 0.24±0.03 0.26±0.05 1.236组别A组B组C组D组E组F C-caspase-3 0.15±0.04 0.17±0.03 0.48±0.05a 0.53±0.04 0.33±0.05b 148.945*增殖率(%)100.89±10.68 98.74±9.25 71.64±8.17a 101.49±11.64 148.67±12.47b 62.285*凋亡率(%)4.16±0.84 5.16±1.07 17.51±2.48a 15.39±1.88 8.43±1.12b 127.864*
Tab.2 Comparison of N-cadherin,E-cadherin and Vimentin protein expression levels and migration and invasion numbers between the five groups表2 各组N-cadherin、E-cadherin、Vimentin蛋白表达和迁移、侵袭细胞数比较(n=9,±s)
Tab.2 Comparison of N-cadherin,E-cadherin and Vimentin protein expression levels and migration and invasion numbers between the five groups表2 各组N-cadherin、E-cadherin、Vimentin蛋白表达和迁移、侵袭细胞数比较(n=9,±s)
*P<0.05;a与B组比较,b与D组比较,P<0.05。
组别A组B组C组D组E组F N-cadherin 0.75±0.08 0.78±0.06 0.43±0.05a 0.38±0.03 0.48±0.06b 92.726*Vimentin 0.63±0.06 0.61±0.05 0.22±0.03a 0.27±0.05 0.63±0.07b 135.375*E-cadherin 0.29±0.03 0.24±0.04 0.58±0.08a 0.44±0.05 0.19±0.03b 93.549*迁移数(个/视野)147.94±11.84 145.46±12.85 61.48±5.58a 64.67±9.59 117.95±12.92b 134.882*侵袭数(个/视野)84.38±8.79 84.38±8.79 47.76±4.64a 41.79±5.53 66.58±6.94b 70.183*
3 讨论
大量研究已证明,miRNA 参与多种癌症的发病机制,部分miRNA表现出与癌基因或抑癌基因相似的功能。miR-891a-5p是近两年新发现的癌症相关miRNA,其在不同癌症中的功能各不相同[10-12]。Wan 等[13]发现,miR-891a-5p 在非小细胞肺癌(NSCLC)患者血清和细胞中表达明显升高,且miR-891a-5p高表达与患者肿瘤的转移、临床分期有关,过表达miR-891a-5p 还可促进癌细胞的增殖、迁移和侵袭,验证了miR-891a-5p 在NSCLC 中的致癌功能。Jia等[14]基于TCGA数据库进行Cox回归分析发现,hsa-miR-891a-5p 在结肠癌组织中高表达与早期原发性肿瘤的发生相关,证实了其在结肠癌患者临床中的诊断价值。本研究通过qPCR 实验发现,miR-891a-5p在结肠癌组织和细胞中的表达均显著升高,且抑制miR-891a-5p 能明显降低结肠癌细胞的存活、迁移、侵袭能力,促进癌细胞的凋亡,下调增殖促进蛋白Cyclin D1、迁移侵袭促进蛋白Ncadherin 和Vimentin 表达,上调促凋亡蛋白Ccaspase-3、迁移侵袭抑制蛋白E-cadherin表达,表明miR-891a-5p具有促进结肠癌细胞表型进一步恶化的作用,提示miR-891a-5p 抑制剂在结肠癌中的潜在治疗价值。进一步研究发现,miR-891a-5p 可靶向负调控CPEB1 的表达,这可能与miR-891a-5p 在结肠癌细胞中的作用具有一定关系。
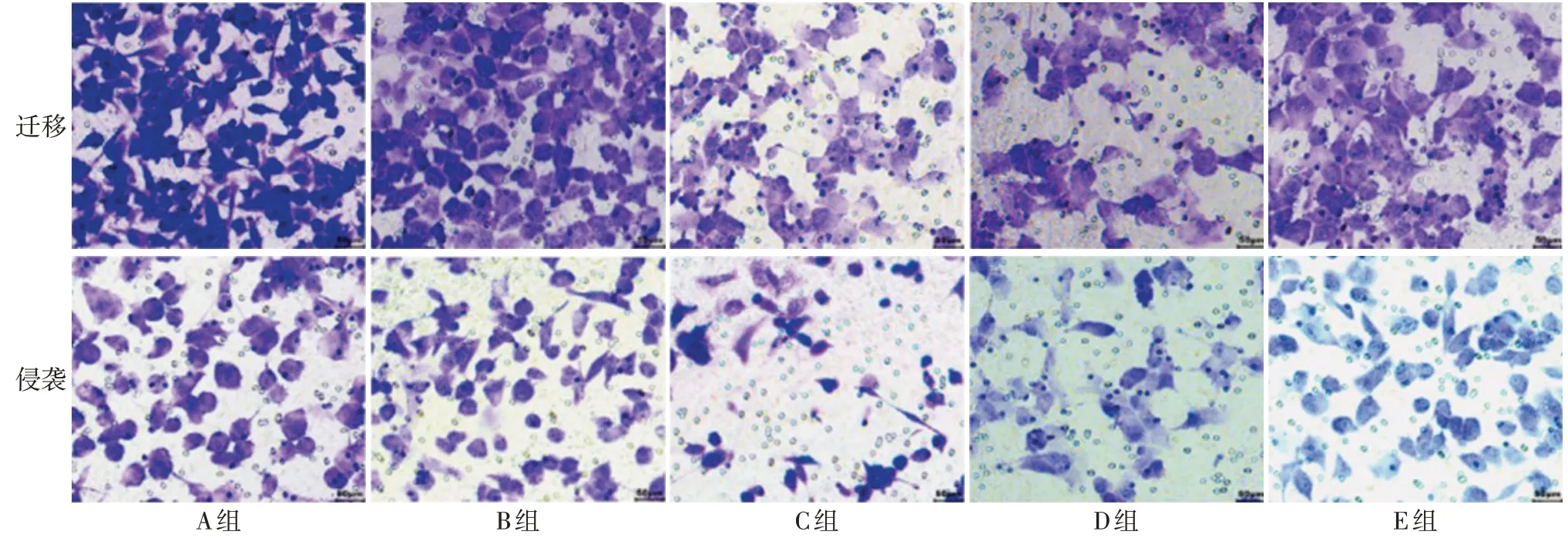
Fig.3 Migration and invasion of each group of cells(crystal violet staining,×200)图3 各组细胞迁移、侵袭情况(结晶紫染色,×200)
CPEBs 作为RNA 结合蛋白,通过转录后调控恶性转化相关基因的表达[15-17]。Shao等[18-19]研究结果显示,CPEB1在癌组织中发生高度甲基化,表现为基因的沉默,该基因可抑制大肠癌的肿瘤生长、侵袭、转移,呈现出抑癌作用。Fang 等[20]研究发现,结肠癌组织中CPEB3表达降低,且与结肠癌患者的预后不良密切相关;敲减CPEB3 可促进结肠癌细胞增殖、迁移和侵袭,其机制为CPEB3 作为RNA 结合蛋白与酪氨酸蛋白激酶1(JAK1)mRNA 的3'-UTR 结合,诱导JAK-转录的信号转导活化蛋白质(STAT)信号传导,从而促进结肠癌细胞的增殖、迁移和侵袭,表明CPEB3 可通过对JAK/STAT 信号通路的转录后调节抑制结肠癌的恶性发展。然而,CPEB1 在结肠癌中的上游调控因子尚未进行深入研究。本研究发现,CPEB1作为miR-891a-5p下游的靶基因,可能参与了miR-891a-5p在结肠癌中的功能调控。敲减CPEB1 能够逆转抑制miR-891a-5p 对结肠癌细胞表型的恶化的控制,促进Cyclin D1、N-cadherin和Vimentin 表达,抑制C-caspase-3、E-cadherin 表达,这验证了miR-891a-5p 与CPEB1 之间的靶向关系。不足的是,这些实验结果未在动物体内得到验证,但是该结果可为下一步的动物实验奠定基础。
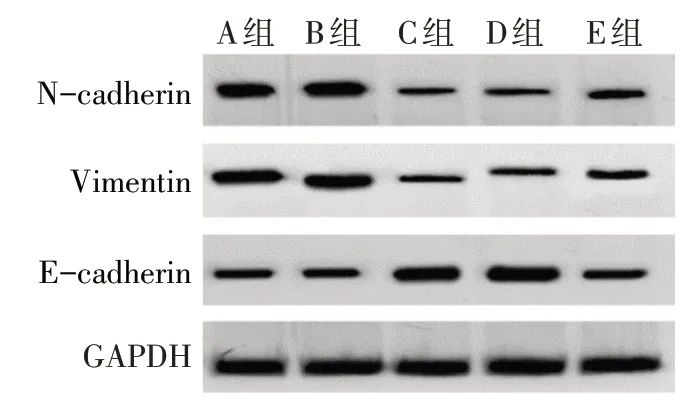
Fig.4 Western blot results of N-cadherin,E-cadherin and Vimentin in each group图4 各组细胞N-cadherin、E-cadherin和Vimentin的蛋白印迹结果

Fig.5 Nucleotide sequences complementary to miR-891a-5p in the 3'-UTR of CPEB1图5 CPEB1的3'-UTR中与miR-891a-5p互补的核苷酸序列
Tab.3 Comparison of fluorescence activity of WTCPEB1 and MUT-CPEB1 and CPEB1 protein expression levels between the four groups表3 各组WT-CPEB1、MUT-CPEB1荧光活性和CPEB1蛋白表达水平比较(n=9,±s)
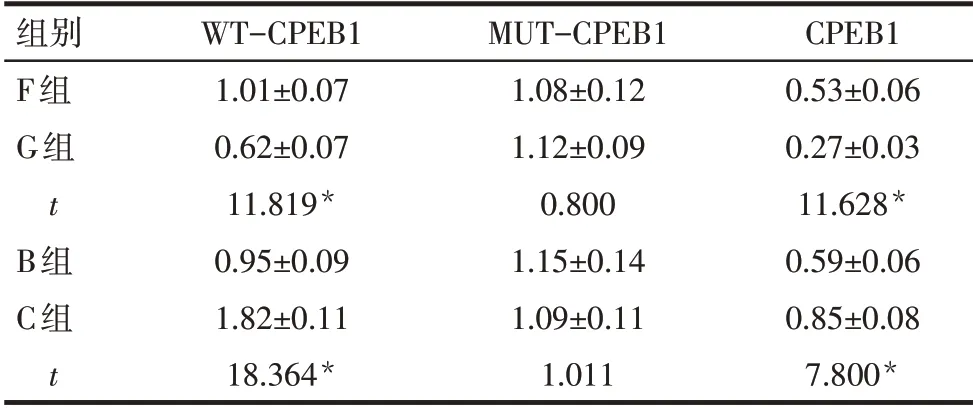
Tab.3 Comparison of fluorescence activity of WTCPEB1 and MUT-CPEB1 and CPEB1 protein expression levels between the four groups表3 各组WT-CPEB1、MUT-CPEB1荧光活性和CPEB1蛋白表达水平比较(n=9,±s)
*P<0.05。
组别F组G组t B组C组t WT-CPEB1 1.01±0.07 0.62±0.07 11.819*0.95±0.09 1.82±0.11 18.364*MUT-CPEB1 1.08±0.12 1.12±0.09 0.800 1.15±0.14 1.09±0.11 1.011 CPEB1 0.53±0.06 0.27±0.03 11.628*0.59±0.06 0.85±0.08 7.800*
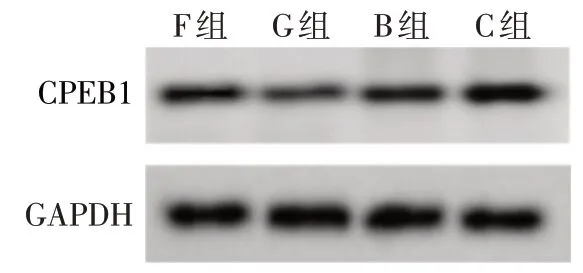
Fig.6 Western blot results of CPEB1 in each group图6 各组细胞CPEB1蛋白印迹结果
综上所述,miR-891a-5p在结肠癌中高表达,可促进结肠癌细胞的增殖、迁移和侵袭,抑制凋亡,产生这种作用的潜在机制与靶向抑制CPEB1 密切相关,本研究为结肠癌的靶向治疗提供新靶点。
