基于钙超载探讨自主神经调控对HFpEF大鼠心肌结构重塑、电重塑及纤维化的影响
2023-02-09彭明李玉凯王岚黄粮成忠肖杰
彭明,李玉凯,王岚,黄粮,成忠,肖杰
慢性心力衰竭(CHF)是由于存在心脏结构和(或)功能异常,引起心输出量下降和(或)心内压力增高,从而导致一系列相关临床表现的综合征。2016年欧洲心血管学会(European Society of Cardiovascular Diseases,ESC)心力衰竭管理指南依据左心室射血分数(left ventricular ejection fraction,LVEF)将心力衰竭分为射血分数降低心力衰竭(heart failure with reduced ejection fraction,HFrEF,LVEF<0.4)、射血分数保留心力衰竭(heart failure with preserved ejection fraction,HFpEF,LVEF>0.5)以及射血分数中间范围心力衰竭(heart failure with mid-range ejection fraction,HFmrEF,LVEF 0.4~0.5)[1]。近年来HFpEF 发病率逐年增长,成为心力衰竭患者中比例最高的分型[2-3]。HFpEF 的发病机制尚未被完全阐明,亦无有效治疗方案,其发病率和死亡率与HFrEF相比没有明显的改善[4-5]。因此,仍需要进一步研究HFpEF 的病理生理机制以寻找新的有效治疗方案。自主神经功能紊乱在CHF 发生与发展过程中起着重要的作用,表现为交感神经亢进以及迷走神经活性低下。自主神经调控旨在改善这种状态,带来心血管方面的获益。本研究主要针对大鼠HFpEF 模型进行经皮耳缘迷走神经刺激(transcutaneous vagus nerve stimulation,tVNS),观察自主神经调控对HFpEF大鼠模型的治疗作用,并对此作用机制进行探讨。
1 材料与方法
1.1 实验动物 SPF 级健康12 周龄SD 大鼠44 只,雌雄各半,体质量(250±50)g,购自浙江维通利华实验动物技术有限公司,实验动物合格证编号:20210428Aazz0619000445;生产许可证号:SCXK(浙)2019-0001。
1.2 主要试剂及仪器 B 型尿钠肽前体(NT-proBNP)酶联免疫吸附测定(ELISA)试剂盒、二喹啉甲酸(BCA)蛋白定量试剂盒、SDS-聚丙烯酰胺凝胶试剂盒、ECL 显色试剂盒购于武汉华美生物工程有限公司;基质金属蛋白酶-9(MMP-9)、金属蛋白酶组织抑制因子-1(TIMP-1)、肌浆网Ca2+-ATP 酶(sarcoplasmic reticulum Ca2+-ATP enzyme,SERCA)2a 及其调节蛋白受磷蛋白(phospholamban,PLB)、甘油醛-3-磷酸脱氢酶(GAPDH)兔抗鼠抗体以及辣根过氧化物酶标记的亲和纯羊抗兔二抗均购自英国Abcam公司;胎牛血清、HE染液套装及Masson 染液套装购于武汉赛维尔生物科技有限公司;DEPC水购于碧云天生物公司;Trizol购于合肥博美生物科技有限公司;cDNA 逆转录试剂盒购于美国Thermo 公司;SYBR®Premix Ex TaqTM(Tli RNaseH Plus)购于大连宝生物科技有限公司。
病理切片机购于上海徕卡仪器有限公司;正置荧光显微镜、正置光学显微镜购于日本尼康公司;PCR 仪购于杭州安杰思生物科技有限公司;微量分光光度计购于杭州奥盛仪器有限公司;凝胶成像系统购于上海天能科技有限公司;动物专用超声仪购于加拿大VisualSonics 公司;心脏电生理刺激仪购于苏州东方电子仪器厂。
1.3 实验动物造模、分组及干预 44只SD大鼠采用随机数字表法抽取10只作为对照组,余34只用于建立HFpEF模型。其中30只大鼠建模成功,4只死亡。建模成功的大鼠按照随机数字表法分为3 组,每组10 只:模型组、自主神经调控组(调控组)及自主神经调控+乙酰胆碱M2受体拮抗剂组(调控+拮抗组)。除对照组外,其余各组大鼠均进行造模手术。第1次手术,麻醉大鼠后剖腹,钝性分离肾动脉和髂分叉之间的主动脉和下腔静脉的覆盖外膜,并将针头插入2根血管创建分流,建立瘘道后用氰基丙烯酸酯进行粘合。通过观察下腔静脉颜色变红,证实瘘管的形成。2周后进行第2次手术,结扎动静脉瘘。通过心脏彩超结合NT-proBNP的测定结果,确定存在心室壁增厚合并舒张功能不全,且LVEF 大于0.5,符合《2021年ESC 急慢性心力衰竭诊断和治疗指南》中HFpEF的诊断标准[6],确定HFpEF模型构建成功。调控组在模型组基础上将刺激电极固定于大鼠双侧耳廓的耳屏内侧的迷走神经,设置刺激程序参数为1 mA 方波、脉宽1 ms、刺激频率20 Hz,每日刺激30 min,持续刺激6周。调控+拮抗组在调控组基础上,每天尾静脉注射乙酰胆碱M2受体拮抗剂美索曲明(0.5 mg/kg),直至实验结束。
1.4 心肌结构重塑、电重塑以及心力衰竭指标测定 将各组大鼠麻醉后仰卧固定,使用心脏超声仪检测LVEF、二尖瓣舒张早期/二尖瓣舒张晚期血流速度最大峰值(peak value of mitral flow velocity in early diastole/peak value of mitral flow velocity in late diastole,E/A)、舒张末期左心室后壁厚度(left ventricular posterior wall end-diastolic dimension,LVPWD-D)及舒张末期室间隔厚度(interventricular ventricular septum end-diastolic dimension,IVS-D)。在各组大鼠深度麻醉状态下开胸暴露其心脏,将一对双极导丝电极头端用无创针缝合在左心室处,两电极间距为2~3 mm,接通临时起搏器,进行心室电刺激,记录有效不应期(effective refractory period,ERP)和单向动作电位时程(monophasic action potential duration,MAPD),具体参照温霞等[7]方法进行。处死大鼠后,取血清标本,用ELISA 法检测血清NT-proBNP 水平。取出心肌组织,一部分制成石蜡切片,另一部分液氮冷冻备用。
1.5 心肌组织HE 染色及Masson 染色观察心肌组织细微结构 大鼠心肌组织石蜡包埋切片、脱蜡至水、组织透化进行HE染色,显微镜下观察心肌组织结构、心肌细胞排列以及炎性细胞浸润情况。Masson染色观察心肌纤维化程度,胶原纤维呈蓝色,心肌组织呈红色。
1.6 RT-PCR 检测MMP-9、TIMP-1、SERCA2a 及PLB mRNA的表达 心肌组织进行匀浆,Trizol法提取总RNA,经逆转录合成第1 链cDNA,再进行PCR 反应。反应体系:SYBR·Mix 10 μL,上下游引物各0.4 μL,cDNA 2 μL,无核酸酶的双蒸水7.2 μL。PCR 反应条件:94 ℃预变性2 min;94 ℃变性20 s,58 ℃退火20 s,72 ℃延伸20 s,共循环40次。以GAPDH为内参,检测大鼠体内MMP-9、TIMP-1、SERCA2a 以及PLB mRNA 的表达。采用2-ΔΔCt法计算各目标基因mRNA 的表达情况,引物序列见表1。
1.7 Western blot 检测MMP-9、TIMP-1、SERCA2a 以及PLB蛋白的表达 取心肌组织冰上进行裂解1 h,BCA 法测总蛋白含量,对各组蛋白进行SDS-聚丙烯酰胺凝胶电泳,转膜后进行胎牛血清封闭,加入MMP-9、TIMP-1、SERCA2a、PLB 一抗(均1∶1 000稀释)以及内参蛋白GAPDH(1∶2 000稀释)抗体,在4 ℃下孵育过夜。孵育后洗膜3 次。二抗(1∶5 000 稀释)摇床孵育2 h。洗膜后加ECL 发光剂,避光显色5 min。Image J 软件分析各蛋白的表达,以目标蛋白与内参蛋白GAPDH灰度值的比值表示其相对表达量。

Tab.1 Primer sequence of PCR表1 PCR引物序列
1.8 统计学方法 采用SPSS 26.0 软件分析数据,计量数据以均数±标准差(±s)表示,多组间均数比较采用单因素方差分析,组间多重比较采用LSD-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 4 组大鼠心力衰竭指标、结构重塑及电重塑的比较 与对照组比较,模型组NT-proBNP、LVPWDD、IVS-D、ERP及MAPD值升高,而E/A值降低,差异有统计学意义(P<0.05)。与模型组比较,调控组NT-proBNP、LVPWD-D、IVS-D、ERP 及MAPD 值降低,E/A 值升高,差异有统计学意义(P<0.05)。调控+拮抗组上述各指标与模型组相比较差异均无统计学意义。对照组、模型组、调控组以及调控+拮抗组大鼠LVEF 值均>0.5,且各组间差异无统计学意义,见表2。
2.2 4 组大鼠心肌组织病理改变的比较 HE 染色显示对照组心肌细胞排列整齐,细胞间隙清晰可见,无明显炎性细胞浸润。与对照组比较,模型组心肌细胞排列紊乱,细胞间隙不够明显,伴有炎性细胞的浸润。调控组上述病理改变与模型组相比均明显减轻。而调控+拮抗组与模型组相比改善不明显,见图1。Masson染色可见对照组心肌纤维排列整齐,少有胶原纤维附着。与对照组比较,模型组心肌纤维排列紊乱,大量胶原纤维生成。调控组上述病理改变与模型组相比均明显减轻。而调控+拮抗组与模型组相比改善不明显,见图2。
2.3 4组大鼠心肌纤维化相关指标的比较 模型组MMP-9 mRNA 及蛋白表达高于对照组,TIMP-1 mRNA 及蛋白表达低于对照组,差异有统计学意义(P<0.05)。调控组MMP-9 mRNA 及蛋白表达低于模型组,TIMP-1 mRNA 及蛋白表达高于模型组,差异有统计学意义(P<0.05)。而调控+拮抗组上述指标与模型组比较差异无统计学意义,见表3,图3。
Tab.2 Comparison of indexes of heart failure,structural remodeling and electrical remodeling between four groups of rats表2 4组大鼠间心力衰竭指标、结构重塑及电重塑指标的比较(n=10,±s)
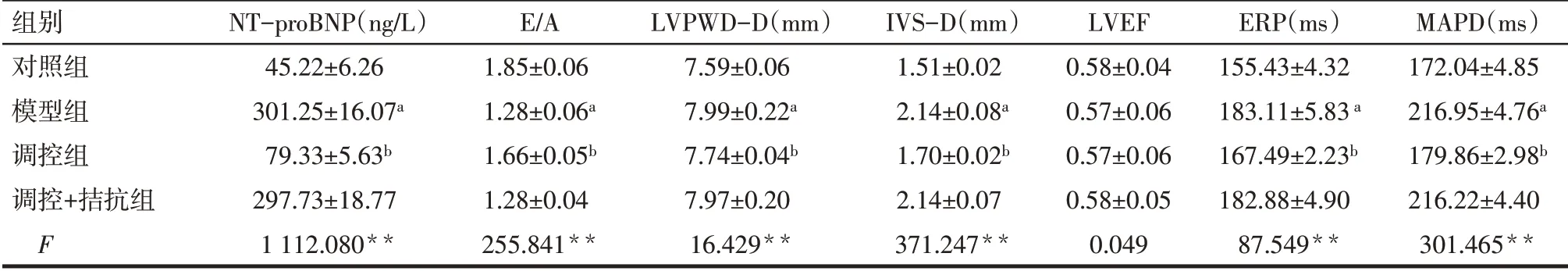
Tab.2 Comparison of indexes of heart failure,structural remodeling and electrical remodeling between four groups of rats表2 4组大鼠间心力衰竭指标、结构重塑及电重塑指标的比较(n=10,±s)
*P<0.05,**P<0.01;a与对照组比较,b与模型组比较,P<0.05。
组别对照组模型组调控组调控+拮抗组F NT-proBNP(ng/L)45.22±6.26 301.25±16.07a 79.33±5.63b 297.73±18.77 1 112.080**E/A 1.85±0.06 1.28±0.06a 1.66±0.05b 1.28±0.04 255.841**LVPWD-D(mm)7.59±0.06 7.99±0.22a 7.74±0.04b 7.97±0.20 16.429**IVS-D(mm)1.51±0.02 2.14±0.08a 1.70±0.02b 2.14±0.07 371.247**LVEF 0.58±0.04 0.57±0.06 0.57±0.06 0.58±0.05 0.049 ERP(ms)155.43±4.32 183.11±5.83a 167.49±2.23b 182.88±4.90 87.549**MAPD(ms)172.04±4.85 216.95±4.76a 179.86±2.98b 216.22±4.40 301.465**
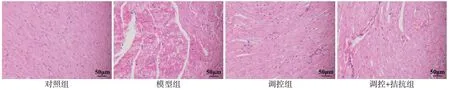
Fig.1 The pathological results of ventricular tissue in four groups of rats(HE staining,×400)图1 4组大鼠心室组织病理结果(HE染色,×400)
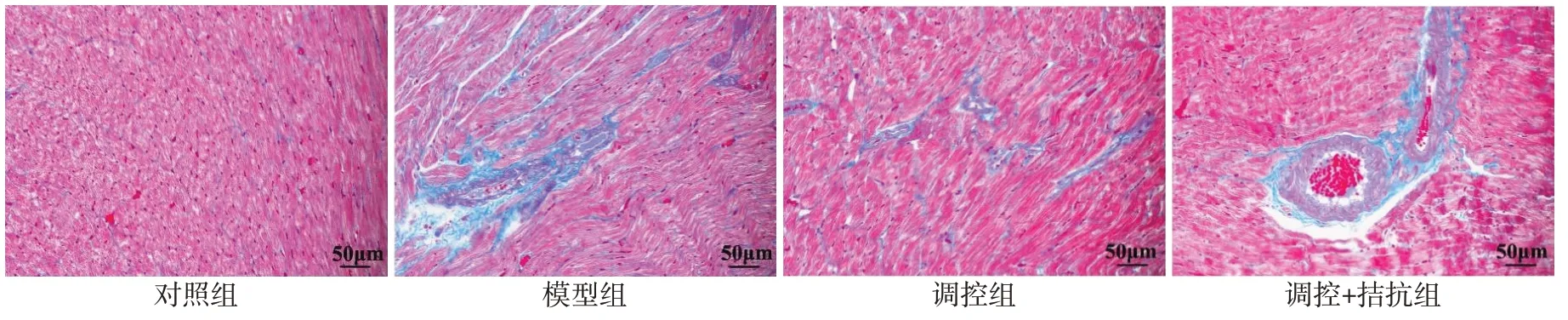
Fig.2 The pathological results of ventricular tissue in four groups of rats(Masson staining,×400)图2 4组大鼠心室组织病理结果(Masson染色,×400)
Tab.3 Comparison of related indexes of myocardial fibrosis between four groups of rats表3 4组大鼠心肌纤维化相关指标的比较(n=10,±s)
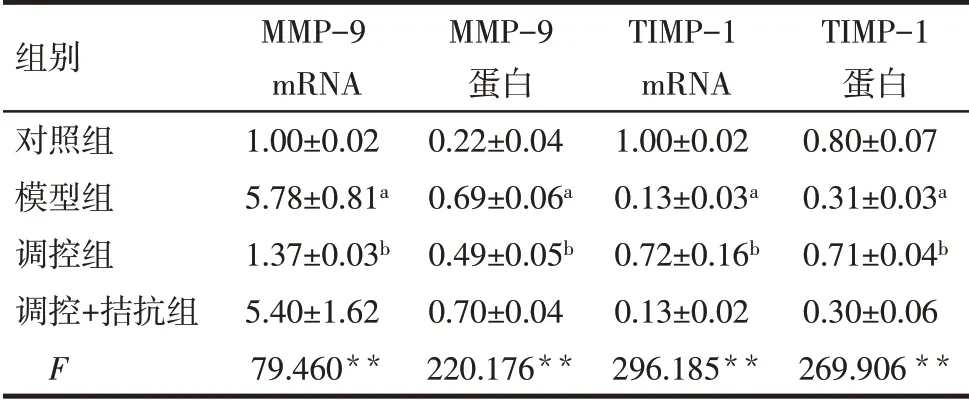
Tab.3 Comparison of related indexes of myocardial fibrosis between four groups of rats表3 4组大鼠心肌纤维化相关指标的比较(n=10,±s)
*P<0.05,**P<0.01;a 与对照组相比较,b 与模型组相比较,P<0.05。
组别对照组模型组调控组调控+拮抗组F MMP-9 mRNA 1.00±0.02 5.78±0.81a 1.37±0.03b 5.40±1.62 79.460**MMP-9蛋白0.22±0.04 0.69±0.06a 0.49±0.05b 0.70±0.04 220.176**TIMP-1 mRNA 1.00±0.02 0.13±0.03a 0.72±0.16b 0.13±0.02 296.185**TIMP-1蛋白0.80±0.07 0.31±0.03a 0.71±0.04b 0.30±0.06 269.906**
2.4 4 组大鼠心肌钙超载指标的比较 模型组SERCA2a mRNA 及蛋白表达低于对照组,PLB mRNA 及蛋白表达高于对照组,差异有统计学意义(P<0.05)。调控组SERCA2a mRNA 及蛋白表达高于模型组,PLB mRNA及蛋白表达低于模型组,差异有统计学意义(P<0.05)。而调控+拮抗组上述指标与模型组比较差异无统计学意义,见表4,图4。
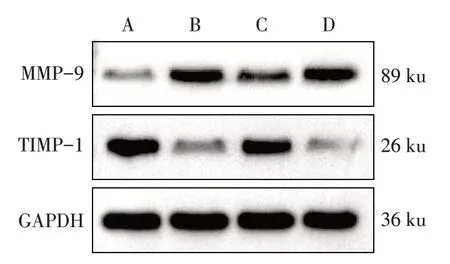
Fig.3 Typical Western blot results of MMP-9 and TIMP-1 proteins in myocardium of four groups of rats图3 4组大鼠心肌组织MMP-9、TIMP-1蛋白的典型免疫印迹图
Tab.4 Comparison of related indexes of calcium overload between four groups of rats表4 4组大鼠钙超载相关指标的比较(n=10,±s)
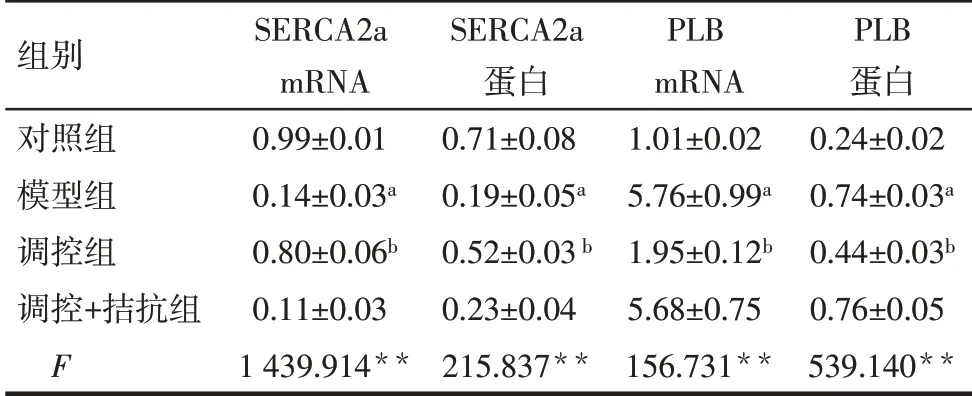
Tab.4 Comparison of related indexes of calcium overload between four groups of rats表4 4组大鼠钙超载相关指标的比较(n=10,±s)
*P<0.05,**P<0.01;a 与对照组相比较,b 与模型组相比较,P<0.05。
组别对照组模型组调控组调控+拮抗组F SERCA2a mRNA 0.99±0.01 0.14±0.03a 0.80±0.06b 0.11±0.03 1 439.914**SERCA2a蛋白0.71±0.08 0.19±0.05a 0.52±0.03b 0.23±0.04 215.837**PLB mRNA 1.01±0.02 5.76±0.99a 1.95±0.12b 5.68±0.75 156.731**PLB蛋白0.24±0.02 0.74±0.03a 0.44±0.03b 0.76±0.05 539.140**
3 讨论
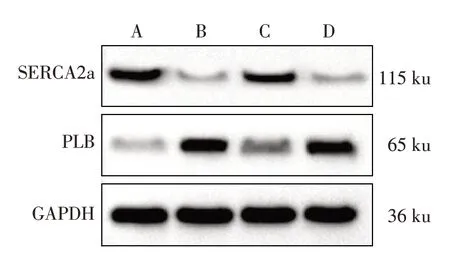
Fig.4 Typical Western blot results of SERCA2a and PLB proteins in myocardium of four groups of rats图4 4组大鼠心肌组织SERCA2a、PLB蛋白的典型免疫印迹图
HFpEF是以心脏出现向心性肥厚及舒张功能不全为特征性临床表现的综合征,其发病机制并未完全阐明。目前研究证实,钙超载与心力衰竭后心脏的结构重塑及电重塑关系密切。细胞质膜、内质网膜、线粒体膜上的Ca2+-ATP 酶活性的改变可以导致细胞内的钙超载,继而激活钙依赖性的蛋白水解酶,具有活性的蛋白水解酶可以溶解心肌蛋白,引起结构重塑[8]。细胞内的钙超载还引起动作电位时程延长、延迟后除极以及复极离散程度增大,引起心脏的电重塑,最终导致与触发及折返有关的心律失常的发生[9]。SERCA 和PLB 是维持细胞内Ca2+稳态的重要调节蛋白[10]。SERCA2a 是心肌细胞中SERCA 的主要亚型,其主要作用是心脏舒张时将细胞浆内的Ca2+泵入到肌浆网,降低细胞内的Ca2+浓度[11]。PLB是SERCA2a活性的关键调控蛋白,能抑制SERCA2a活性[12],故通过检测心肌组织内SERCA2a、PLB mRNA 及蛋白的表达可以反映机体内钙超载的情况。本研究中,模型组大鼠出现了以心脏室壁增厚及舒张功能降低为主要表现的心力衰竭,并且存在电重塑,这些结果可能与钙超载水平的升高相关。
钙超载还可以导致心肌细胞外基质的过度纤维化,进而引起左心室主动舒张功能障碍及被动僵硬度升高,这也和Ca2+-ATP 酶活性高度相关[13-15]。MMP-9能溶解心肌胶原基质,诱发心力衰竭后的间质纤维化,TIMP-1则能抑制MMP-9的活性,延缓心肌间质纤维化[16]。本研究中,相对于对照组,模型组MMP-9 mRNA 及蛋白表达升高,TIMP-1 mRNA 及蛋白表达降低,结合心肌病理切片Masson染色提示模型组大鼠心肌胶原纤维增生明显,说明模型组大鼠心肌纤维化水平明显升高,这种病理过程可能也与钙超载水平升高相关。
有研究显示,自主神经调控可以改善体内钙超载状态,交感神经活性增高会升高猪室性心律失常模型体内的钙水平,从而增加恶性心律失常发生的风险[17],而迷走神经刺激可以改善犬心房颤动模型体内的钙超载状态,从而减轻心脏的结构重塑及电重塑[18]。本研究中调控组相对于模型组,大鼠心肌的NT-proBNP 水平、结构重塑、电重塑、心肌纤维化以及钙超载的程度降低,说明迷走神经刺激改善了HFpEF 大鼠的心力衰竭状态,并且这种获益可能是通过降低钙超载水平实现的。
在本研究中,调控+拮抗组经阻断迷走神经传导后再予以迷走神经刺激,相比模型组,其NT-proBNP水平、心脏结构重塑、电重塑、钙超载以及心肌纤维化的程度均无明显改善,因此进一步验证了迷走神经刺激可以有效治疗HFpEF,自主神经调控有望成为HFpEF治疗的新选择。
本研究虽得出阳性结果,但对于自主神经调控对HFpEF 的干预作用后续仍需更大样本量的研究进行观察总结。对于自主神经调控对HFpEF 的作用机制,仍需更多的病理生理研究。
