ANA-12靶向抑制BDNF/TrkB信号缓解奥沙利铂诱导化疗大鼠的痛觉行为
2023-02-09赵佳佳万文军杨荷雨谢敏刘玲
赵佳佳,万文军,杨荷雨,谢敏,刘玲△
奥沙利铂(Oxaliplatin,OXA)是第3 代铂类衍生物化疗药物,临床上用于实体转移瘤的治疗,患者在化疗后会发生急性神经毒性,表现为四肢末梢远端感觉异常和疼痛等,遇冷刺激时症状明显加重[1]。目前对于化疗导致的神经疼痛潜在机制不明确,且缺乏相应的治疗药物。因此,研究化疗痛的发生机制对相关药物的开发具有必要性。神经炎症与多种病理性疼痛有关,包括炎性痛、神经痛、癌痛及药物治疗引起的疼痛等[2]。组织损伤会导致炎症介质释放,直接刺激或诱导中枢敏化,最终导致慢性疼痛的发生[3]。神经炎症的特点包括胶质细胞活化及炎症介质产生增加。脊髓胶质细胞是促炎细胞因子,如肿瘤坏死因子(TNF)-α和白细胞介素(IL)-1β的主要来源[4]。在关节炎性疼痛患者中,中和TNF-α 可阻断疼痛引起的中枢神经系统伤害性活动[5]。本课题组前期研究发现,在炎性痛模型大鼠中,脊髓炎症信号激活且促炎细胞因子表达增加[6]。脑源性神经营养因子(BDNF)可作为神经调质参与痛觉调控[7]。BDNF/酪氨酸激酶受体B(TrkB)信号参与伤害性信号传递是痛觉维持的基础,抑制TrkB可显著改善动物痛觉行为[8]。为研究BDNF/TrkB信号在化疗痛中的作用,本实验使用TrkB 蛋白阻断剂ANA-12 处理化疗痛大鼠,检测大鼠痛觉行为学、脊髓神经炎症及促炎细胞因子的表达变化,旨在明确抑制BDNF/TrkB 信号对化疗痛的缓解作用,并阐明其病理机制,为病理性疼痛的治疗提供新思路。
1 材料与方法
1.1 实验动物及分组 18 只雄性Sprague-Dawley(SD)大鼠购自湖北省实验动物中心,6~8 周龄,体质量200~250 g,动物生产许可证号:SCXK(鄂)2020-0018。大鼠饲养在室温为(22±2)℃的环境中,以12 h/12 h 昼夜节律变换并提供充足的食物和水。大鼠按照随机数字表法均分为3 组:对照组、OXA 组及OXA+ANA-12 组。本研究所有动物实验均经湖北科技学院实验动物伦理委员会批准,批准号2020-01-900。
1.2 主要试剂 蛋白酶抑制剂、RIPA裂解液、十二烷基苯磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶快速配制试剂盒、苏木素-伊红(HE)染色试剂盒、BCA 蛋白浓度测定试剂盒均购自上海碧云天生物技术有限公司;OXA和ANA-12购于Selleck。IL-1β 兔多抗(A1112)、TNF-α 兔多抗(A0277)、Iba1 兔多抗(A1527)、BDNF 兔单抗(A4873)、TrkB 兔单抗(A19832)和phospho-TrkB-Y705 兔多抗(AP0423)购于武汉爱博泰克生物科技有限公司;NF-κB p65兔多抗(AF5006)购于Affinity Biosciences。辣根过氧化物酶(HRP)标记的山羊抗兔IgG(H+L,AS014)和免疫荧光二抗异硫氰酸荧光素(FITC)标记的山羊抗兔IgG(H+L,AS011)购于武汉爱博泰克生物科技有限公司。
1.3 模型建立及药物处理 OXA溶于5%葡萄糖溶液,OXA组和OXA+ANA-12 组每只大鼠腹腔注射OXA 4 mg/kg,连续5 d,建立OXA 化疗痛大鼠模型。对照组大鼠注射相同体积的5%葡萄糖溶液。化疗痛模型建立后进行鞘内给药处理。具体方法如下:固定大鼠头部和背部,露出髂嵴以下腰部区域进行剃毛和皮肤消毒,轻轻按压确定注射部位,用无菌微量注射器垂直插入大鼠脊髓腰膨大(L5~6)处,当针碰到椎骨时,将进针角度调整到30°,并将针插入椎间隙。进针感觉到明显的突破感,且大鼠出现突然的甩尾现象或后腿出现反射性弹跳,表明成功插入椎间隙,缓慢注入药物,药物注射完成后滞留1 min取出注射器[9]。OXA+ANA-12组大鼠鞘内注射ANA-12(20 g/L),对照组和OXA 组大鼠鞘内注射等体积DMSO+生理盐水(体积比1∶1)。
1.4 大鼠行为学检测
1.4.1 自发性缩足反射次数 将不同组别大鼠置于30 cm×30 cm×30 cm 的透明有机玻璃盒内适应30 min,观察并记录每5 min内大鼠自发性缩足(或舔爪)反射次数来表征大鼠自发痛,每只记录3次,取平均值。
1.4.2 50%缩足阈值(PWT)检测 各组大鼠给药处理后0、2、4 和6 h,根据up-down 法检测50%PWT。方法如下:将动物置于行为测试笼内,待适应30 min后,用Von Frey纤维(触觉刺激力0.4~26 g)垂直剌激大鼠左侧后肢足底正中,持续时间≤5 s,出现舔足或者抬足等行为视为阳性反应,反之则为阴性反应。记录6次数据后结束检测。根据公式50%PWT(g)=(10[Xf+Kδ])/10 000计算各组大鼠的缩足阈值(Xf为本次行为学测试中使用的最后一个Von Frey 纤维的阶数,K 为痛觉阈校正系数,δ为相邻纤维刺激之间的差异)[10]。
1.5 免疫印迹法检测脊髓组织蛋白质表达 行为学记录结束后,每组随机抽取3只大鼠,过量麻醉处死后,分离脊髓组织,置于预冷的PBS 中。取腰段脊髓置于含有蛋白酶抑制剂的RIPA 裂解液中,在冰上进行组织匀浆。收集组织匀浆液于离心管中,4 ℃、12 000 r/min离心15 min。取上清液,加入1/3体积的4×上样缓冲液,沸水中加热10 min 变性。使用BCA蛋白分析试剂盒检测样品的蛋白质浓度。SDS-PAGE 分离蛋白质样品,将蛋白质电转至PVDF膜上,5%脱脂奶粉室温封闭l h,一抗4 ℃孵育过夜。所用一抗如下:TNF-α(1∶1 000)、
IL-1β(1∶1 000)、Iba1(1∶1 000)、BDNF(1∶1 000)、phospho-TrkB-Y705(1∶500)、TrkB(1∶1 000)、NF-κB(1∶1 000)。一抗孵育后洗膜3次,并用二抗室温孵育1 h,然后用LAS500凝胶成像系统扫描观察,Image J软件分析条带灰度值。
1.6 组织形态学检测 采用HE 染色法对脊髓组织切片进行形态学分析。每组剩余的3只大鼠在深度麻醉后,经心脏快速灌流肝素生理盐水,然后4%多聚甲醛固定。固定成功后取完整腰段脊髓进行脱水和石蜡包埋,切成厚度为4 μm的组织切片。选择形态完好的组织进行脱蜡和HE 染色,苏木素染色20 min,分化后返蓝,至核显深紫色,胞浆呈浅蓝色,用伊红染至胞浆呈红色,用不同浓度的乙醇透明,中性树胶封片,并在显微镜下观察,Image J 软件分析。脊髓炎症评分标准参考文献[11]:正常记0分,脑膜和血管周围的淋巴细胞浸润记1分,一个视野中有1~10个淋巴细胞记2分,有11~100个淋巴细胞记3分,有100个以上的淋巴细胞记4分。
1.7 免疫荧光染色 选取形态完整的脊髓组织脱蜡处理后进行抗原修复,用3%过氧化氢孵育10 min,PBS洗涤3次,免疫染色封闭液封闭1 h,加入IL-1β(1∶100)、Iba1(1∶100)、BDNF(1∶100)一抗,4 ℃条件下孵育过夜。荧光二抗室温下孵育1 h,用PBS 洗3 次,滴加抗荧光淬灭试剂封片并在荧光显微镜下观察,Image J软件分析荧光强度。
1.8 统计学方法 采用Graph pad prism 8.0.2 进行数据分析。所有数据以±s表示。2组间均数比较采用独立样本t检验,多组间均数比较采用单因素方差分析,组间多重比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 ANA-12对化疗痛大鼠痛觉行为的影响 行为学检测结果显示,与对照组相比,OXA 组大鼠机械缩足阈值显著降低,自发缩足次数显著增加;与OXA组相比,OXA+ANA-12组大鼠机械痛阈值显著增加,自发缩足次数显著降低(P<0.01),见表1。
Tab.1 Comparison of behavioral test results in rats between the three groups表1 3组大鼠行为学检测结果比较(n=3,±s)
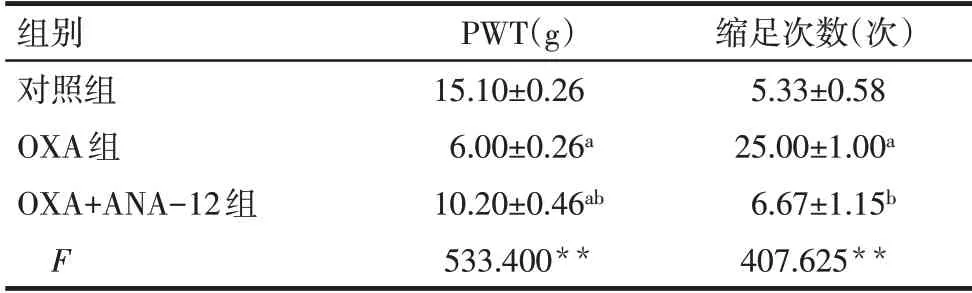
Tab.1 Comparison of behavioral test results in rats between the three groups表1 3组大鼠行为学检测结果比较(n=3,±s)
**P<0.01;a与对照组比较,b与OXA组比较,P<0.01。
组别对照组OXA组OXA+ANA-12组F PWT(g)15.10±0.26 6.00±0.26a 10.20±0.46ab 533.400**缩足次数(次)5.33±0.58 25.00±1.00a 6.67±1.15b 407.625**
2.2 ANA-12 对大鼠脊髓炎症的影响 脊髓HE 染色结果显示,与对照组相比,OXA 组大鼠脊髓背角炎性细胞浸润明显增加,炎症评分升高;与OXA 组相比,OXA+ANA-12 组炎性细胞浸润明显减少,炎症评分下降(P<0.01),见表2、图1。免疫荧光结果显示,与对照组相比,OXA 组大鼠脊髓背角图中绿染的IL-1β 荧光强度显著增强;与OXA 组相比,OXA+ANA-12组图中绿染的IL-1β荧光强度显著降低(P<0.01),见表2、图2。免疫印迹结果显示,OXA 组大鼠脊髓组织中TNF-α 和IL-1β 表达量均显著高于对照组;而与OXA 组相比,OXA+ANA-12组TNF-α和IL-1β表达量显著下调(P<0.01),见图3、表3。
Tab.2 Comparison of inflammatory score and fluorescence intensity of IL-1β in spinal cord of rats between the three groups表2 各组大鼠脊髓炎症评分和IL-1β荧光强度比较(n=3,±s)
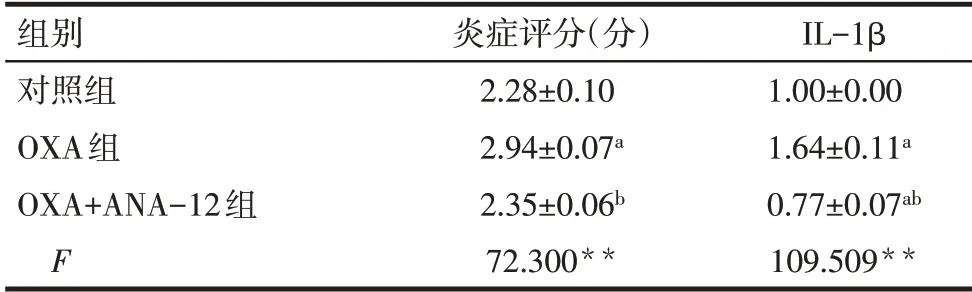
Tab.2 Comparison of inflammatory score and fluorescence intensity of IL-1β in spinal cord of rats between the three groups表2 各组大鼠脊髓炎症评分和IL-1β荧光强度比较(n=3,±s)
**P<0.01;a与对照组比较,b与OXA组比较,P<0.05。
组别对照组OXA组OXA+ANA-12组F炎症评分(分)2.28±0.10 2.94±0.07a 2.35±0.06b 72.300**IL-1β 1.00±0.00 1.64±0.11a 0.77±0.07ab 109.509**
2.3 ANA-12处理对小胶质细胞激活状态的影响 免疫荧光检测小胶质细胞标志物Iba1 显示,与对照组相比,OXA 组大鼠脊髓背角中绿染的Iba1荧光强度显著增强(P<0.05);与OXA 组相比,OXA+ANA-12组大鼠脊髓背角中绿染的Iba1 荧光强度显著降低(P<0.01),见图4、表4。免疫印迹结果显示,与对照组相比,OXA 组大鼠脊髓组织中Iba1蛋白表达量明显上调(P<0.05);而与OXA 组相比,OXA+ANA-12 组脊髓组织中Iba1 蛋白表达量显著下调(P<0.01),见图5、表4。
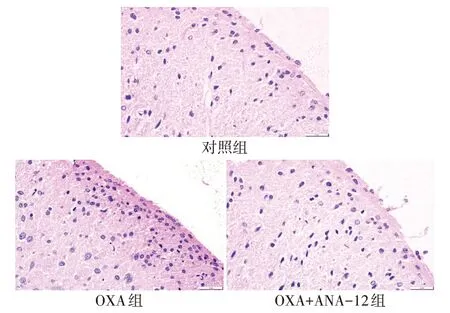
Fig.1 Inflammatory cell infiltration of spinal dorsal horn in each group(HE staining,scale bar=20 μm)图1 各组大鼠脊髓背角炎性细胞浸润情况(HE染色,标尺=20 μm)
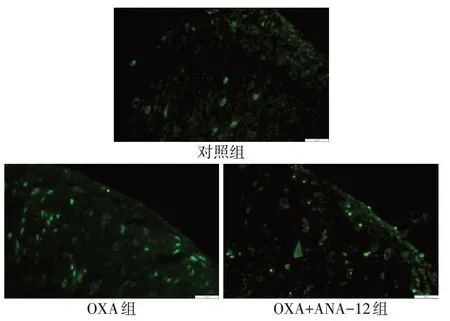
Fig.2 Expression of IL-1β in spinal dorsal horn of rats in each group(Immunofluorescent staining,scale bar=20 μm)图2 各组大鼠脊髓背角IL-1β的表达(免疫荧光染色,标尺=20 μm)
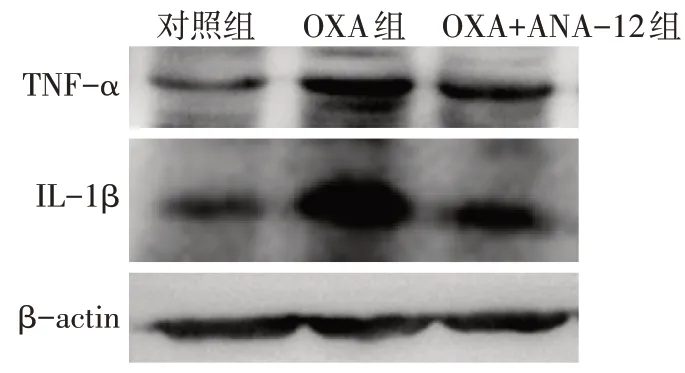
Fig.3 Expression levels of pro-inflammatory cytokines IL-1β and TNF-α in spinal cord of rats in each group detected by Western blot assay图3 Western blot检测各组大鼠脊髓组织促炎细胞因子IL-1β和TNF-α表达水平
Tab.3 Comparison of expression levels of IL-1β and TNF-α in spinal cord of rats between the three groups表3 各组大鼠脊髓组织中IL-1β和TNF-α表达水平比较(n=3,±s)

Tab.3 Comparison of expression levels of IL-1β and TNF-α in spinal cord of rats between the three groups表3 各组大鼠脊髓组织中IL-1β和TNF-α表达水平比较(n=3,±s)
**P<0.01;a与对照组比较,b与OXA组比较,P<0.01。
组别对照组OXA组OXA+ANA-12组F IL-1β 1.00±0.00 2.37±0.06a 1.57±0.09ab 355.028**TNF-α 1.00±0.00 2.04±0.14a 1.58±0.16ab 54.769**

Fig.4 Expressions of Iba1 in spinal dorsal horn of rats in each group(Immunofluorescent staining,scale bar=20 μm)图4 各组大鼠脊髓背角小胶质细胞标志物Iba1的表达(免疫荧光染色,标尺=20 μm)
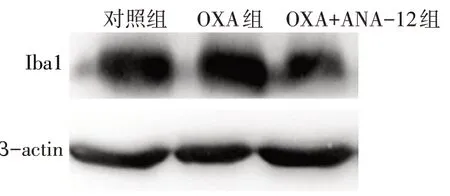
Fig.5 Expression levels of microglial marker Iba1 in spinal cord of rats in each group detected by Western blot assay图5 Western blot检测各组大鼠脊髓组织小胶质细胞标记物Iba1表达水平
Tab.4 Comparison of expression levels of Iba1 in spinal cord of rats between the three groups表4 各组大鼠脊髓组织中Iba1表达水平比较(n=3,±s)
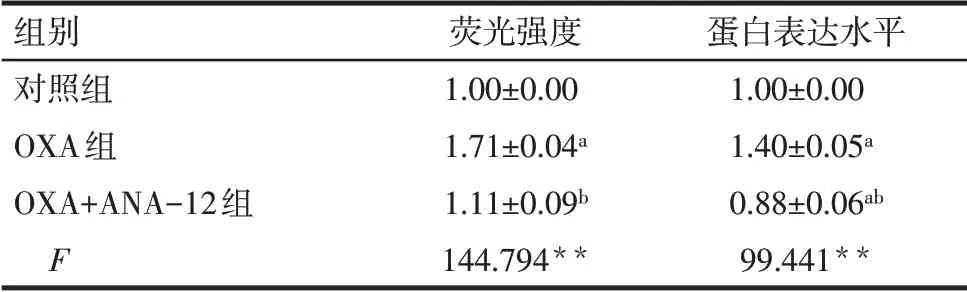
Tab.4 Comparison of expression levels of Iba1 in spinal cord of rats between the three groups表4 各组大鼠脊髓组织中Iba1表达水平比较(n=3,±s)
**P<0.01;a与对照组比较,b与OXA组比较,P<0.05。
组别对照组OXA组OXA+ANA-12组F荧光强度1.00±0.00 1.71±0.04a 1.11±0.09b 144.794**蛋白表达水平1.00±0.00 1.40±0.05a 0.88±0.06ab 99.441**
2.4 ANA-12 处理对BDNF/TrkB 信号活性的影响 与对照组相比,OXA 组大鼠脊髓组织中绿染的BDNF 荧光强度显著增强;与OXA 组相比,OXA+ANA-12 组脊髓组织中绿染的BDNF 荧光强度显著降低(P<0.01),见图6、表5。免疫印迹检测结果显示,与对照组相比,OXA大鼠脊髓组织中BDNF和磷酸化TrkB(Y705)表达水平上调(P<0.05);而与OXA 组相比,ANA-12 处理后BDNF 和磷酸化TrkB表达水平均显著降低(P<0.01),见图7、表5。
2.5 ANA-12 处理对NF-κB 信号活性的影响 免疫印迹检测结果发现,与对照组(1.00±0.00)相比,OXA 组脊髓组织中NF-κB 表达水平(1.52±0.02)增高(P<0.01);与OXA 组相比,OXA+ANA-12 组NFκB表达水平(0.91±0.03)降低(n=3,F=1 202.680,P<0.01),见图8。
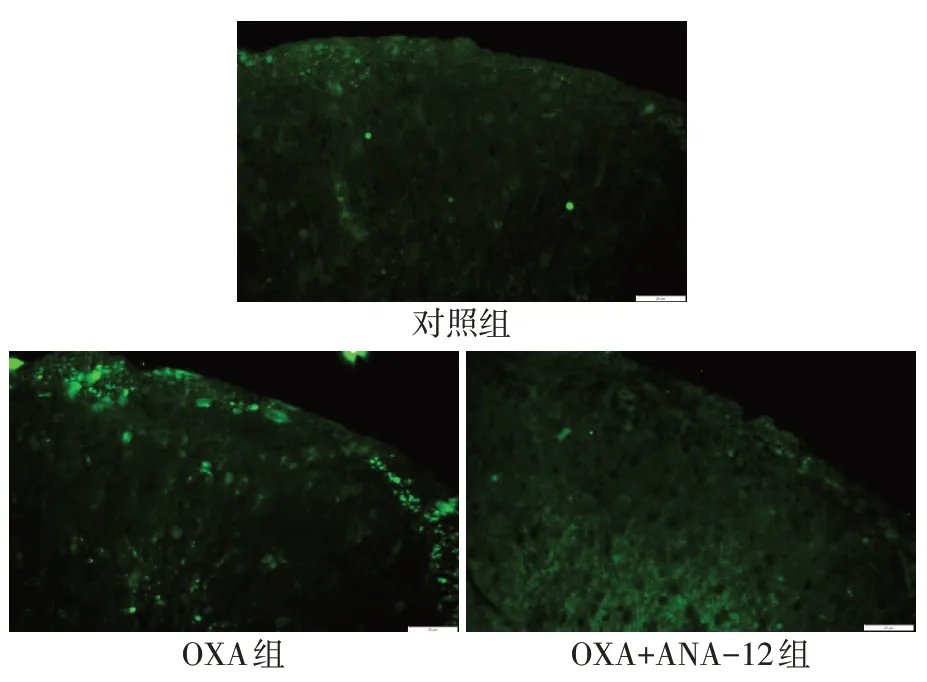
Fig.6 Expression of BDNF in spinal dorsal horn of rats in each group(Immunofluorescent staining,scale bar=20 μm)图6 各组大鼠脊髓背角BDNF的表达(免疫荧光染色,标尺=20 μm)
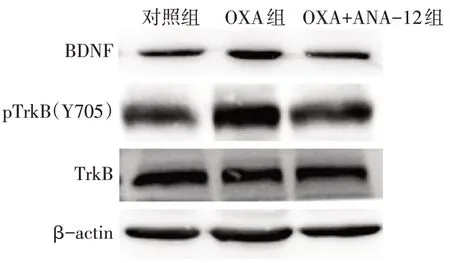
Fig.7 Expression levels of BDNF,phosphorylated TrkB(Y705)and total TrkB in spinal cord of rats in each group detected by Western blot assay图7 Western blot检测各组大鼠脊髓组织中BDNF、磷酸化TrkB(Y705)和总的TrkB表达水平
Tab.5 Comparison of expression levels of BDNF,phosphorylated TrkB(Y705)and total TrkB in spinal cord between three groups of rats表5 各组大鼠脊髓组织中BDNF、磷酸化TrkB(Y705)和总的TrkB表达水平的作用比较(n=3,±s)
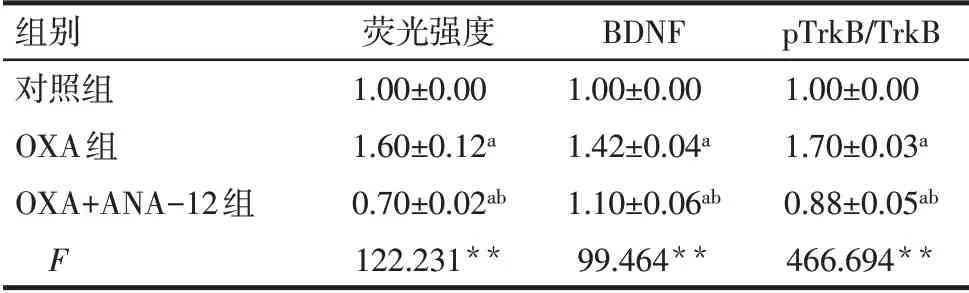
Tab.5 Comparison of expression levels of BDNF,phosphorylated TrkB(Y705)and total TrkB in spinal cord between three groups of rats表5 各组大鼠脊髓组织中BDNF、磷酸化TrkB(Y705)和总的TrkB表达水平的作用比较(n=3,±s)
**P<0.01;a与对照组比较,b与OXA组比较,P<0.05。
组别对照组OXA组OXA+ANA-12组F pTrkB/TrkB 1.00±0.00 1.70±0.03a 0.88±0.05ab 466.694**荧光强度1.00±0.00 1.60±0.12a 0.70±0.02ab 122.231**BDNF 1.00±0.00 1.42±0.04a 1.10±0.06ab 99.464**
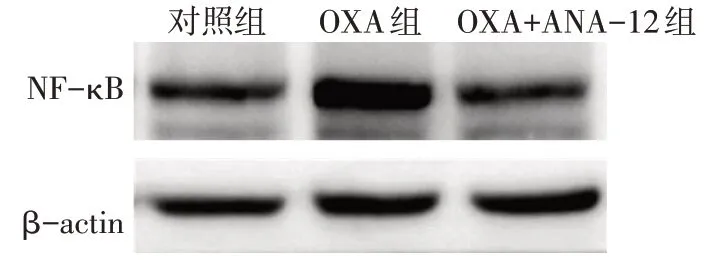
Fig.8 Expression levels of NF-κB in spinal cord of rats detected by Western blot assay图8 Western blot检测各组大鼠脊髓组织中NF-κB表达水平
3 讨论
3.1 OXA 过量使用诱导神经炎症 化疗是治疗癌症的一种常用的有效手段之一。第3代铂类抗癌药物OXA 可直接结合并交联于DNA 上,抑制细胞DNA 的复制和转录,从而抑制肿瘤细胞的增殖和转移,临床上用于治疗各类恶性肿瘤[12]。然而,当使用累积剂量达到300 mg/m2时会产生严重的不良反应,主要表现为神经损伤及病理性疼痛[13]。过量OXA诱导的神经损伤会造成外周伤害性信号上调,从而导致脊髓神经突触可塑性增强,进而使神经炎症增加[14]。神经炎症表现为小胶质细胞激活、促炎细胞因子水平增加、外周白细胞浸润和神经组织损伤,其中激活的小胶质细胞会产生高水平的促炎细胞因子[15]。小胶质细胞作为中枢神经系统中的巨噬样细胞,可快速响应外界伤害性变化,在受到外界伤害后几分钟内会发生快速的形态变化(如胞体增大和突起缩短),并分泌多种细胞因子(包括TNF-α 和IL-1β),参与疼痛的发生和维持[16]。据此,本研究中OXA 大鼠脊髓炎性因子表达上调的主要原因是外周伤害性信号诱导的脊髓小胶质细胞的激活。
3.2 抑制BDNF 信号缓解大鼠炎症痛 BDNF 具有多种生物学功能,包括调节神经元存活、生长和分化并维持突触可塑性以及在伤害性信号传递途径中发挥调控作用[17]。多种痛觉模型证明,BDNF 在痛觉传导区域过度表达。BDNF 是小胶质细胞发挥作用的关键信号分子。研究表明,外周损伤可诱发脊髓释放BDNF,从而介导炎症及疼痛[18]。用TrkB 抗体或者TrkB-Fc 阻断BDNF-TrkB 信号可有效防止小胶质细胞诱发的机械性痛觉过敏;siRNA敲低BDNF可缓解小胶质细胞诱发的疼痛行为[19]。炎症诱导的痛觉过敏研究显示,促炎刺激可上调脊髓背角BDNF/TrkB 通路;而阻断BDNF/TrkB 信号通路可降低炎性疼痛进展[20]。NF-κB 是炎症激活的主要因子之一,BDNF 与TrkB 受体结合后能够诱导NF-κB的表达。BDNF通过激活激酶Ikkα和Ikkβ诱导NFκB表达,同时这些激酶可以磷酸化并降解NF-κB的抑制单位IκBα,从而导致NF-κB 释放以及p50/p65二聚体的形成,p50/p65 二聚体与DNA 结合并诱导与神经元增殖、存活和炎症反应相关的基因表达[21]。NF-κB介导的促炎信号通路通过促进促炎细胞因子TNF-α和IL-1β的表达而参与炎症反应。在骨癌痛大鼠模型中,脊髓BDNF表达增强,阻断其信号可减弱热痛觉过敏和机械性痛觉超敏并抑制下游NF-κB通路[22]。在本研究中,OXA 大鼠脊髓BDNF/TrkB 信号活性上调并伴随NF-κB 表达上调,ANA-12 可显著减少上述蛋白的表达并缓解OXA 诱导的痛觉行为,表明抑制BDNF/TrkB 信号可通过降低OXA诱导的炎症信号而缓解化疗痛。
综上所述,TrkB 受体拮抗剂ANA-12 对OXA 诱导的痛觉行为具有显著的镇痛作用,主要是通过降低小胶质细胞的激活、抑制BDNF/TrkB 信号下游NF-κB介导的炎症信号,从而减少脊髓炎症,发挥镇痛效应。
