绿藻光合产氢的研究进展
2023-01-17张亚琴唐睿康马为民熊威徐旭荣
张亚琴,唐睿康,马为民,熊威,徐旭荣
绿藻光合产氢的研究进展
张亚琴1,2,唐睿康1,2,马为民3,熊威4,徐旭荣2*
(1.浙江大学 化学系,浙江 杭州 310027; 2.浙江大学 求是高等研究院,浙江 杭州 310027; 3.上海师范大学 生命科学学院,上海 200234; 4.南昌大学化学化工学院,江西 南昌 330031)
绿藻光合产氢具有能量转化效率高、环境友好、原料丰富等优势,在太阳能利用和氢能生产方面具有光明的应用前景。从绿藻光合产氢的生物学机理出发,分析了限制绿藻光合产氢的潜在因素,总结了各类提升绿藻光合产氢效率的方法,并简要评述了绿藻光合产氢实现商业化应用所面临的主要问题及发展趋势,为未来绿藻光合产氢的大规模应用提供参考。
绿藻;光合产氢;氢化酶;氧敏感性;电子源
0 引言
近年来,过度利用化石能源导致温室效应、空气污染等环境问题[1],开发安全的绿色能源以取代化石燃料显得尤为重要。太阳能具有清洁、广泛、可再生等优势,是实现碳达峰、碳中和目标,构建安全高效能源体系的重要组成部分[2]。为了克服太阳能的间歇性、能量密度低等缺陷,人类利用各种技术将太阳能转化为通用能源,包括热能、电能、生物质燃料和氢能(H2)[3]。其中,氢能具有易储存、能量密度高、应用广泛等优点[4-6],是未来可持续能源系统中利用和储存太阳能的理想载体[7]。其中,绿藻光合产氢将[FeFe]-氢化酶作为催化剂,直接以水为电子供体,利用太阳能合成氢能,是一种理想的氢能绿色生产方法[8]。
GAFFRON等[9]最早发现了绿藻的光合产氢现象。绿藻中的[FeFe]-氢化酶的催化活性很高,具备优异的产氢潜力。然而自然界中绿藻的光合产氢过程十分短暂,仅发生在绿藻光暗交替的几分钟[9]。这是因为绿藻在光照下会释放氧气(O2),一定浓度的O2会抑制氢化酶的活性,导致产氢过程停止。因此,规避绿藻中氢化酶的氧敏感性,是目前提升绿藻光合产氢效率的重点研究方向之一。此外,保证充足的电子源、高效利用光系统产生的光合电子等也是提升绿藻光合产氢效率的重要因素。本文拟阐述绿藻光合产氢的研究进展:首先重点分析限制绿藻光合产氢的氢化酶、电子竞争、环境条件等因素,然后总结各类提升绿藻光合产氢效率的方法,最后简要评述绿藻光合产氢实现商业化应用所面临的主要问题及发展趋势。
1 绿藻光合产氢途径及其限制因素
1.1 绿藻光合产氢途径
绿藻中2种与光合产氢有关的电子传递途径均需在光照条件下进行[10]。第1种是依赖光系统Ⅱ(PSⅡ)的直接生物光解途径。电子来源于PSⅡ中发生的水氧化反应,该反应包括PSⅡ吸收光量子的能量,将水分子电解,产生O2、电子(e-)和氢离子(H+)。电子传递过程需要2个光系统的参与(图1(a)途径1),PSⅡ产生的e-通过电子传递链传递,依次经过PSⅡ、质体醌(PQ)、Cyt6复合体,由光系统Ⅰ(PSⅠ)传递至铁氧还原蛋白(Fd),还原NADP+。同时此过程中产生的跨类囊体膜质子梯度(∆pH)可驱动三磷酸腺苷(ATP)合成酶合成ATP,这样的电子传递方式称为线性电子传递链(LET)。Fd是光合系统的最终电子中介,将电子分配给不同的代谢途径[11]。在厌氧条件下,一部分e-可由Fd传递至[FeFe]-氢化酶,在氢化酶的催化作用下与H+重组为H2[12]。
第2种是间接生物光解途径,电子来自细胞内有机物的氧化,而非PSⅡ。在NAD(P)H氧化还原酶作用下,叶绿体内的NAD(P)H脱氢变为NAD(P)+,释放出的电子直接进入PQ,再进入电子传递链,经过PSⅠ,最后由Fd传递至氢化酶进行产氢[13](图1(a)途径2)。
此外,莱茵衣藻中还存在第3种不依赖光的发酵产氢途径,电子来自绿藻在暗发酵条件下淀粉的分解代谢[14],类似于广谱厌氧和兼性厌氧细菌的异源发酵(图1(b)途径3)。在此过程中,淀粉被淀粉酶分解产生糖,然后通过糖酵解转化为丙酮酸。丙酮酸是莱茵衣藻发酵过程的底物,通过不同的代谢途径得到各种产物,例如有机酸、乙醇(C2H5OH)、二氧化碳(CO2)和H2[15]。与依赖光的途径相比,不依赖光的发酵途径其产氢效率较低[16]。

图1 绿藻产氢途径示意[12]
1.2 限制因素
虽然绿藻光合产氢的潜在能量转换效率理论值很高(约10%),但实际受限于多种因素,包括:(1)氢化酶的氧抑制,O2不仅会抑制氢化酶的活性,还会抑制氢化酶相关基因的表达和成熟因子;(2)碳同化等多种电子竞争途径;(3)环境条件的限制。
1.2.1氢化酶的氧抑制
绿藻中[FeFe]-氢化酶的活性很高,约为其他氢化酶的100倍,并且太阳能的转化效率相对较高(12%~14%)[10,17]。H-团簇是[FeFe]-氢化酶独特的活性中心,由一个[2Fe-2S]核心、硫桥和[4Fe-4S]簇组成[18-19]。[4Fe-4S]簇可以为[2Fe-2S]核心提供e-,[2Fe-2S]核心中的活性位点Fe原子捕获H+后,可将H+还原为H2。[2Fe]中心的每个Fe原子分别与2个双原子非蛋白配体CO—和CN—相连,2个铁原子通过CO—配体连接[20-21]。由于CO—和CN—配体对O2敏感,H-团簇的活性很容易被O2抑制[22]。如图2所示,O2与Fe原子活性位点结合,形成活性氧(ROS)。ROS可以直接氧化[4Fe-4S]簇,也可以使[4Fe-4S]簇发生键电子转移,从而发挥破坏性作用。
绿藻氢化酶的结构基因通常由几个同源基因组成,例如莱茵衣藻的1和2基因,分别编码2种结构相似的酶,目前相关的研究主要集中于1基因,因其酶活性显著高于2基因。MEUSER等[16]报道,在光照条件下莱茵衣藻约75%的H2由1催化得到。此外,[FeFe]-氢化酶的成熟还需同时表达和等基因,和是氢化酶辅酶蛋白的基因,主要负责H-团簇的合成和组装。O2不仅会破坏[FeFe]-氢化酶的活性,还会通过抑制基因的表达和成熟来抑制绿藻的氢化酶活性[18, 21, 23]。
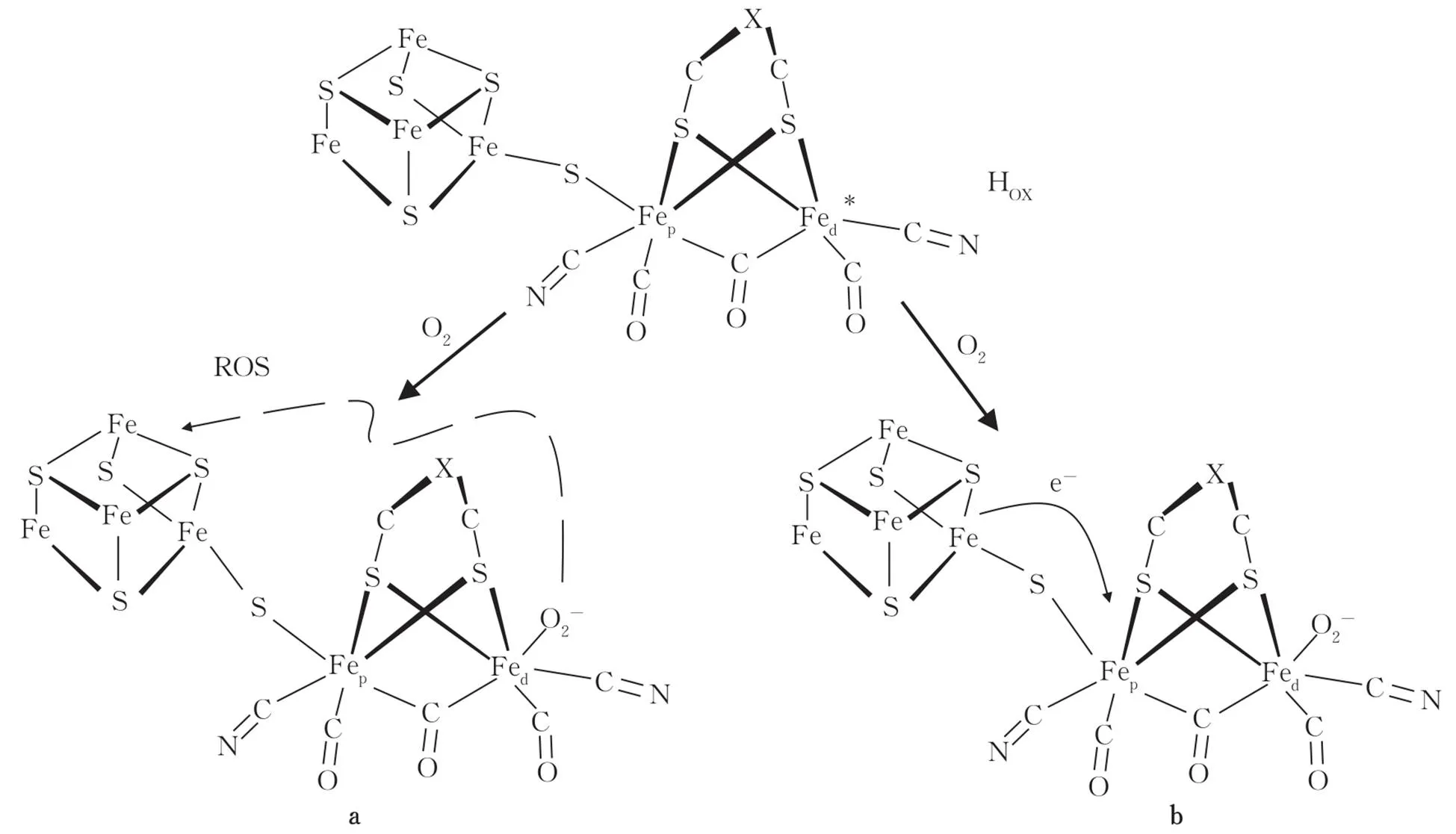
图2 CO、O2与H-团簇的氧化态(Hox)的反应模型示意[22]
1.2.2电子竞争
对绿藻而言,氢化酶可替代电子受体消除多余的还原当量,起到保护细胞的安全阀作用[24]。一般情况下,只有较少的电子被传递给氢化酶产氢,其他代谢途径竞争了大部分的电子。与氢化酶竞争电子的主要途径是碳同化过程。在光合作用过程中,PSⅡ产生的大部分电子被铁氧还原蛋白-NADP+氧化还原酶(FNR)用来将NADP+还原成NADPH,NADPH与ATP共同驱动卡尔文-本森(CBB)循环进行碳同化。此外,Fd还向其他途径,如围绕PSⅠ的环式电子传递(CEF)、调节碳同化作用的硫氧还原蛋白、其他叶绿体的氧化还原代谢等[25-26]提供电子。环式电子传递途径由PSⅠ单独驱动,电子经过PSⅠ后未被传递给NADP+,而是又经Cyt6/复合体或质体醌传递回到PSⅠ,传递过程中只产生用于合成ATP的跨膜质子梯度(∆pH),而不产生NADPH。一些研究认为,在氢化酶被氧气灭活之前,竞争电子途径已终止了产氢过程,这些竞争电子途径依次是碳同化、环式电子传递链和叶绿体内其他氧化还原反应[27-29]。
1.2.3环境因素
氢化酶的催化产氢过程可逆,在顶空氢气超压的情况下,该反应的平衡向吸收氢的方向移动[30]。因此在产氢过程中,顶空氢气分压也会影响产氢效率。研究发现,用氩气(Ar)等惰性气体不断扫除培养瓶中的气体[31-32]或采用较大顶空体积的产氢瓶[33],产氢效率会进一步提升。此外在对绿藻光合产氢培养条件的研究[34-37]中发现,光照强度、温度、pH、培养基营养成分以及细胞密度和细胞年龄等均会对绿藻光合产氢效率产生较大影响。
2 提升产氢效率的方法
针对这些限制因素,在过去的几十年间,人们不断地探究提升绿藻的光合产氢效率的方法,并取得了重要进展(表1)。目前,绿藻光合产氢的研究方向主要集中在解决氢化酶的氧抑制问题上,包括:
(1)去除绿藻产氢环境中的O2。例如用惰性气体吹扫排除O2[31-32]、添加消耗O2的除氧剂[50-52],以及利用共培养细菌代谢消耗O2[40]等。
(2)限制绿藻代谢过程中的O2产生。例如通过代谢调控手段抑制PSⅡ的活性[53-54],使绿藻无法通过光合作用释放O2。
(3)采用基因工程方法构建理想的产氢藻株。利用基因突变筛选耐氧性的藻株[45],构建减少电子竞争途径或者降低O2的突变体;通过基因改造定向修饰绿藻[48],将耐氧性高的细菌氢化酶基因植入绿藻中表达[55]。
然而,目前绿藻的太阳能—氢能转换效率尚低于理论值10%,绿藻光合产氢有很大的提升空间[43]。
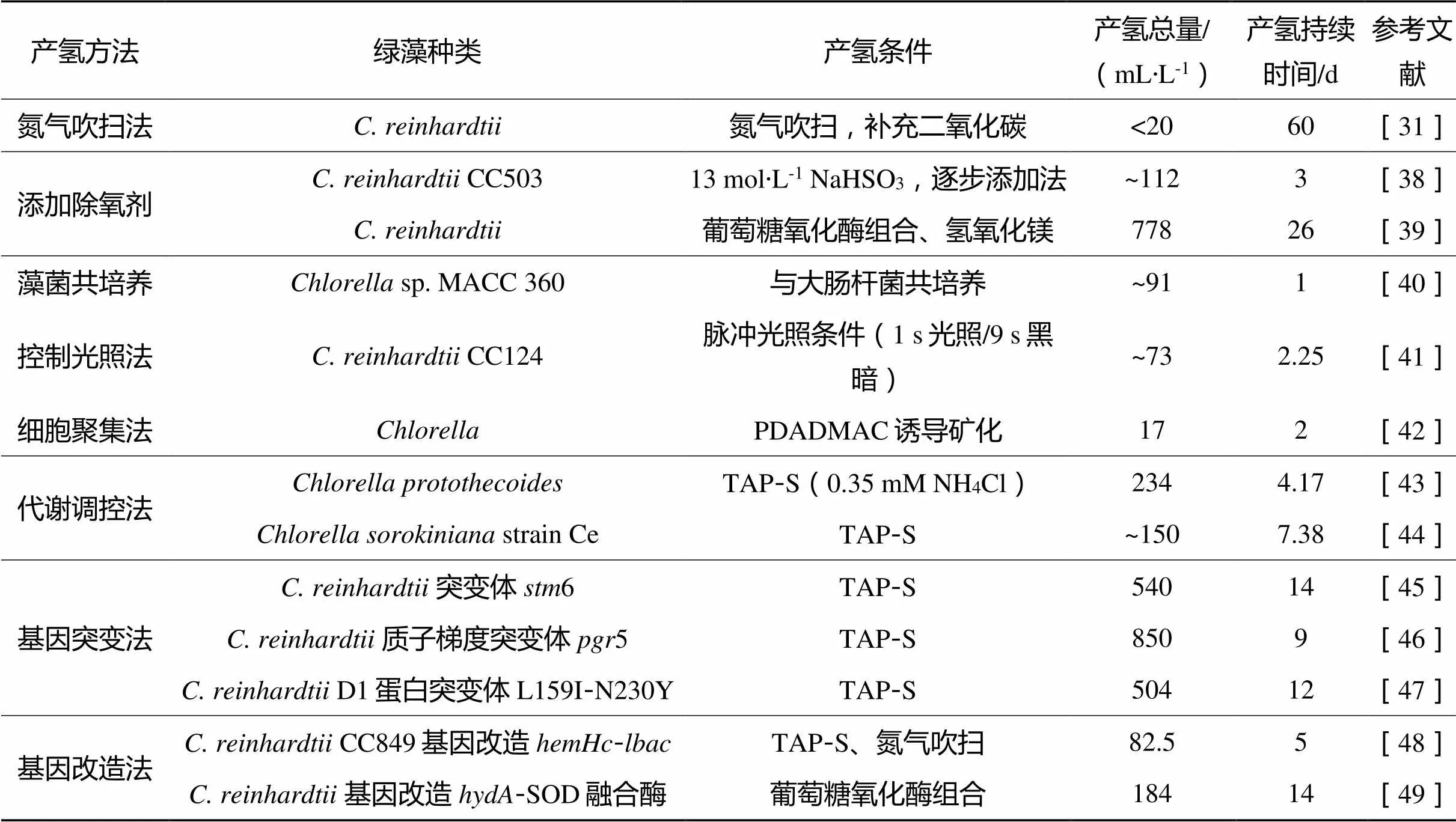
表1 各种光合产氢方法的产氢量
2.1 去除培养基中的O2
2.1.1气体吹扫法
最早采用惰性气体,如氦气(He)[56]、氮气(N2)[57]或氩气(Ar)[32]冲洗绿藻体系,物理去除培养基中的O2。GREENBAUM等[31]用氮气间歇性地吹扫密闭光生物反应器中的气体,并每隔一段时间添加CO2恢复绿藻的活力,产氢过程持续约60 d。然而,采用惰性气体吹扫这种物理手段去除O2并不彻底,更多被用于产氢的预处理厌氧阶段。
2.1.2添加除氧剂
一些酶及其催化底物也经常作为除氧剂使用。NAGY等[59]通过向培养物中加入葡萄糖、葡萄糖氧化酶和抗坏血酸盐去除O2。但是为了长期维持厌氧环境,需加入高浓度的葡萄糖氧化酶和葡萄糖,这会使培养体系迅速转化为酸性环境,导致氢化酶失活并严重破坏绿藻细胞活性。为解决这一问题,CHEN等[39]设计了一个由葡萄糖、葡萄糖氧化酶、过氧化氢酶和氢氧化镁组成的化学酶级联(CEC)系统。氢氧化镁的添加不仅解决了高浓度葡萄糖氧化酶和高浓度葡萄糖造成的培养液pH下降的问题,还能持续诱导绿藻细胞的絮凝,有助于长期维持厌氧环境。如图3所示,SU等[60]通过在单个细胞周围构建漆酶调节的厌氧层,利用蛋白核小球藻产氢建立了一个由多巴胺、漆酶和单宁酸组成的类似三明治厌氧层,实现了连续8 d产氢。
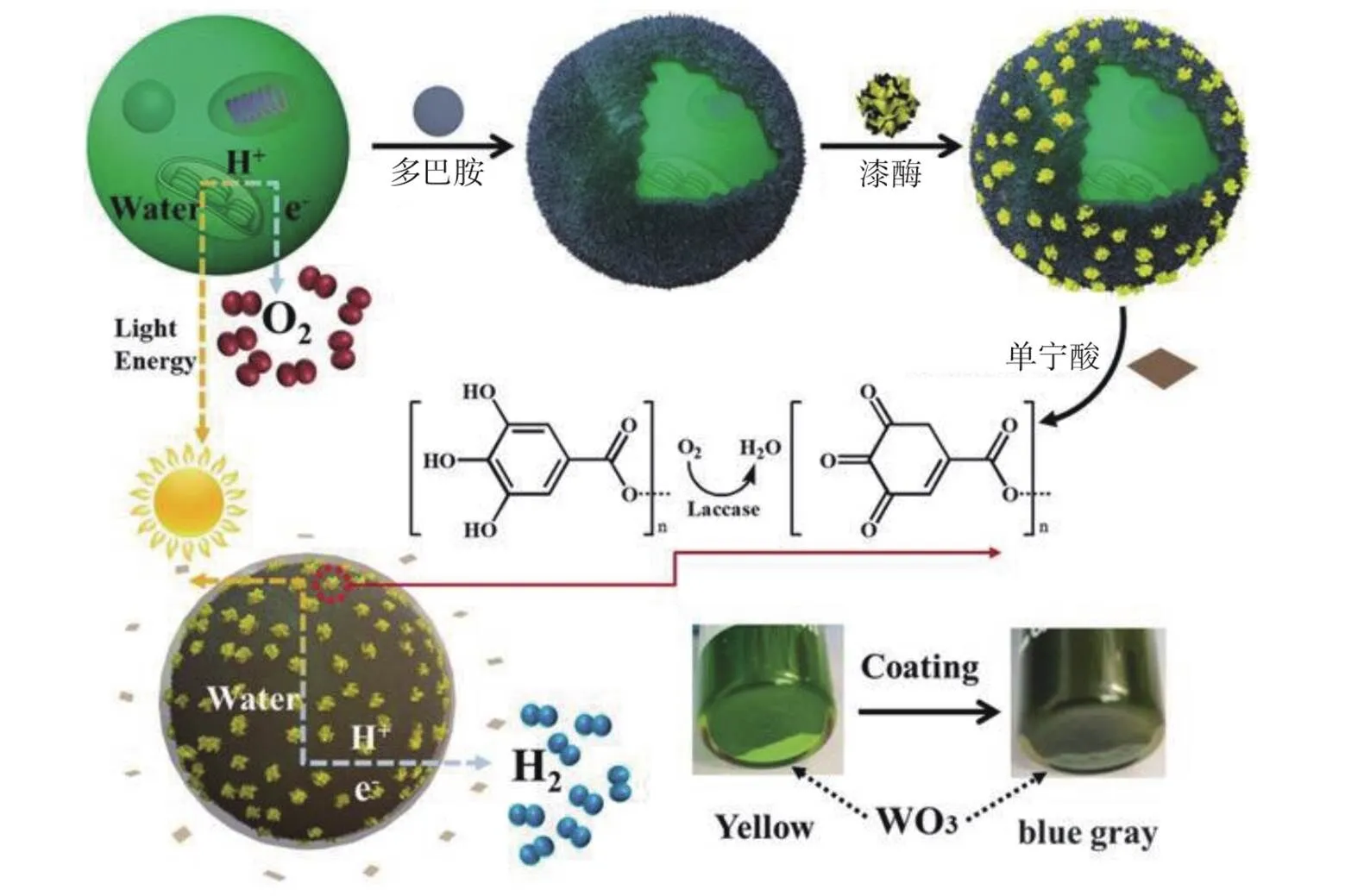
图3 通过构建漆酶调节的厌氧层,利用蛋白核小球藻产氢[60]
2.1.3绿藻-细菌共培养
“老姐姐,你也许知道我的心,十九岁守寡,守了几十年,守这个儿子;……我那些挨饿的日子呀!我跟孩子到山坡去割茅草,大雨来了,雨从山坡把娘儿两个拍滚下来,我的头,在我想是碎了,谁知道?还没死……早死早完事。”
绿藻和细菌的共培养可以通过细菌的呼吸作用建立厌氧条件。如图4所示,细菌可以在消耗O2的同时产生乙酸(CH3COOH),从而促进莱茵衣藻产氢,而藻类可以消耗乙酸的代谢物,从而有利于细菌生长,形成协同的产氢系统[40,61]。LAKATOS等[61]选用大肠杆菌和几种不同的绿藻进行共培养,探索了共培养过程中绿藻产氢的影响因素,并进一步发现气液比为1∶1,藻细胞密度为3.96×108个·mL-1,在50 μmol·m-2·s-1光照条件下产氢量最高。其中sp. MACC 360组的产氢量达88.98±2.19 mL·L-1·d-1(表1)。
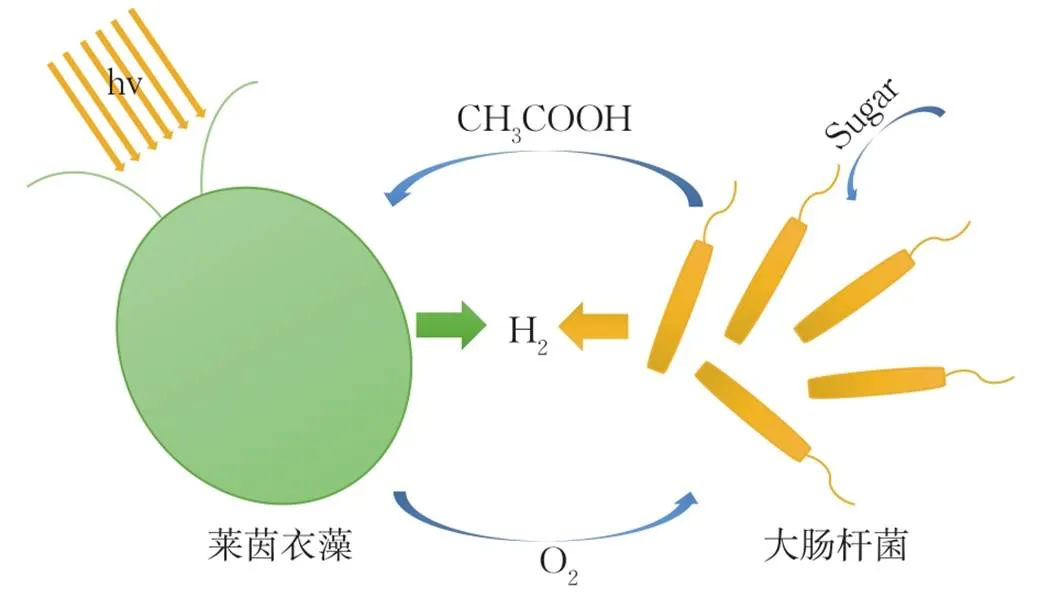
图4 藻-菌共培养物(衣藻和大肠杆菌共培养物)的光合和发酵产氢原理[61]
微生物群落的不稳定性是限制绿藻-细菌共培养可持续产氢的主要因素之一。因为大多数细菌的增殖速度比藻类快,细菌密度可能超过藻类密度,引发培养环境中度酸化和营养物质缺乏的风险,导致绿藻失活和产氢停止。此外,绿藻-细菌共培养物的产氢效率取决于其他参数,例如细菌种类、初始藻细胞浓度和气液体积比[62]。因此,藻菌共培养产氢需要为绿藻寻找合适的细菌伴侣以及优化生长条件。应用较多的有发酵细菌和光氧细菌,如大肠杆菌、红假单胞菌、红细菌属、红螺菌等[63-64]。
2.2 限制O2产生
2.2.1控制光照法
控制光照条件可抑制O2的释放,诱导绿藻光合产氢。例如,利用高强度光(2 000 μmol·m-2·s-1)抑制莱茵衣藻的光合放氧[65],利用特定光谱选择性激活PSⅠ和抑制PSⅡ[66]等。KOSOUROV等[41]采用光暗交替(1 s光照/9 s黑暗)的光脉冲,保持低O2浓度,CBB循环未被激活,光合电子直接传递给氢化酶产氢,大幅提升了光合产氢效率。
2.2.2细胞聚集法
细胞聚集法利用藻细胞自身的呼吸作用消耗O2。XIONG等[42]构建了一种硅材料-绿藻复合体,利用阳离子聚电解质聚二甲基二烯丙基氯化铵(PDADMAC)的“桥联”作用,在诱导小球藻仿生硅矿化的同时,将小球藻细胞聚集成一种在光照下具有产氢功能的聚集体,能够以0.20 mmol·h-1·(mg chlorophyll)-1的速度至少产氢48 h。如图5所示,其产氢机制是构建一个空间功能化的聚集体,建立局部厌氧的环境,激活氢化酶产氢。暴露在外界环境的表层细胞获得足够的光进行正常的光合作用,而聚集体内部的藻类细胞由于缺乏光照,只能靠呼吸作用消耗聚集体内的O2,实现净耗氧。在此基础上,SHU等[67]通过添加一定浓度的二甲基亚砜(DMSO),增强了小球藻的呼吸作用,进一步降低了聚集体内的O2含量,提高了小球藻聚集体的产氢量,其光合产氢效率从0.42%提高至0.69%。
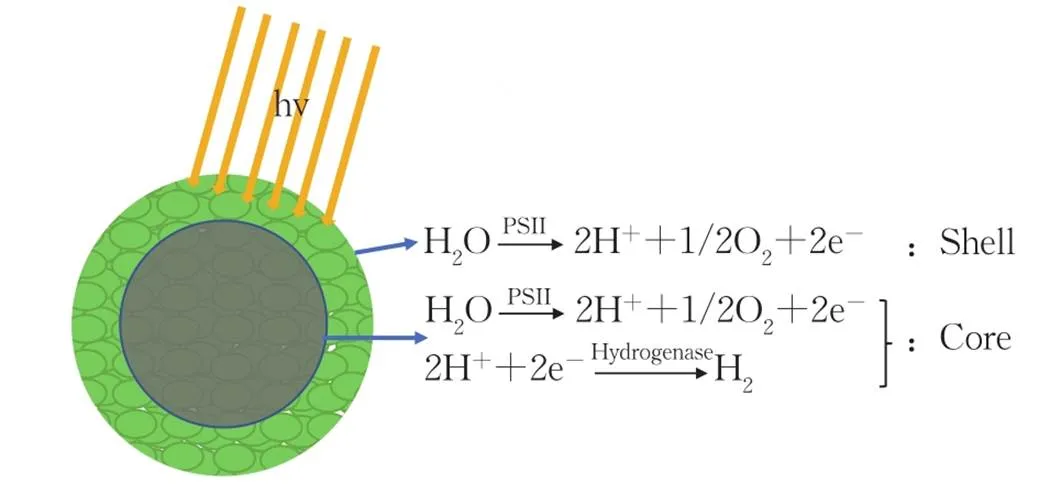
图5 小球藻聚集体空间功能分化产氢示意[42]
2.2.3代谢调控法
缺硫培养是应用最广泛的绿藻产氢代谢调控方法之一。WYKOFF等[68]和MELIS等[69]发现,去除莱茵衣藻培养基中的硫元素会阻碍D1蛋白生物合成,影响PSⅡ修复周期,进而抑制PSⅡ的活性,降低绿藻细胞的放氧水平,但不会影响线粒体呼吸速率,逐渐建立厌氧环境。然而,PSⅡ的活性被抑制会使传递给氢化酶的光合电子逐渐减少,最终导致产氢过程停止。为了进一步优化缺硫培养产氢的方法,MELIS等[70]设计了缺硫培养产氢的两阶段工艺:在阶段1进行有机物的积累,用正常含硫的TAP培养基培养藻类细胞。藻类细胞通过正常的放氧光合作用进行CBB循环,合成所需的有机物。当有机物积累到足够量时,使用缺硫(TAP-S)培养基进行缺硫培养,过渡至PSⅡ活性被抑制的阶段2,开始产氢(如图6所示)。阶段2产氢的电子来自阶段1合成的内源底物(淀粉等有机物)的氧化,能量转换效率相对较低。当内源底物耗尽时,产氢过程也将停止。此时需要使用正常的TAP培养基使莱茵衣藻重新进入阶段1。
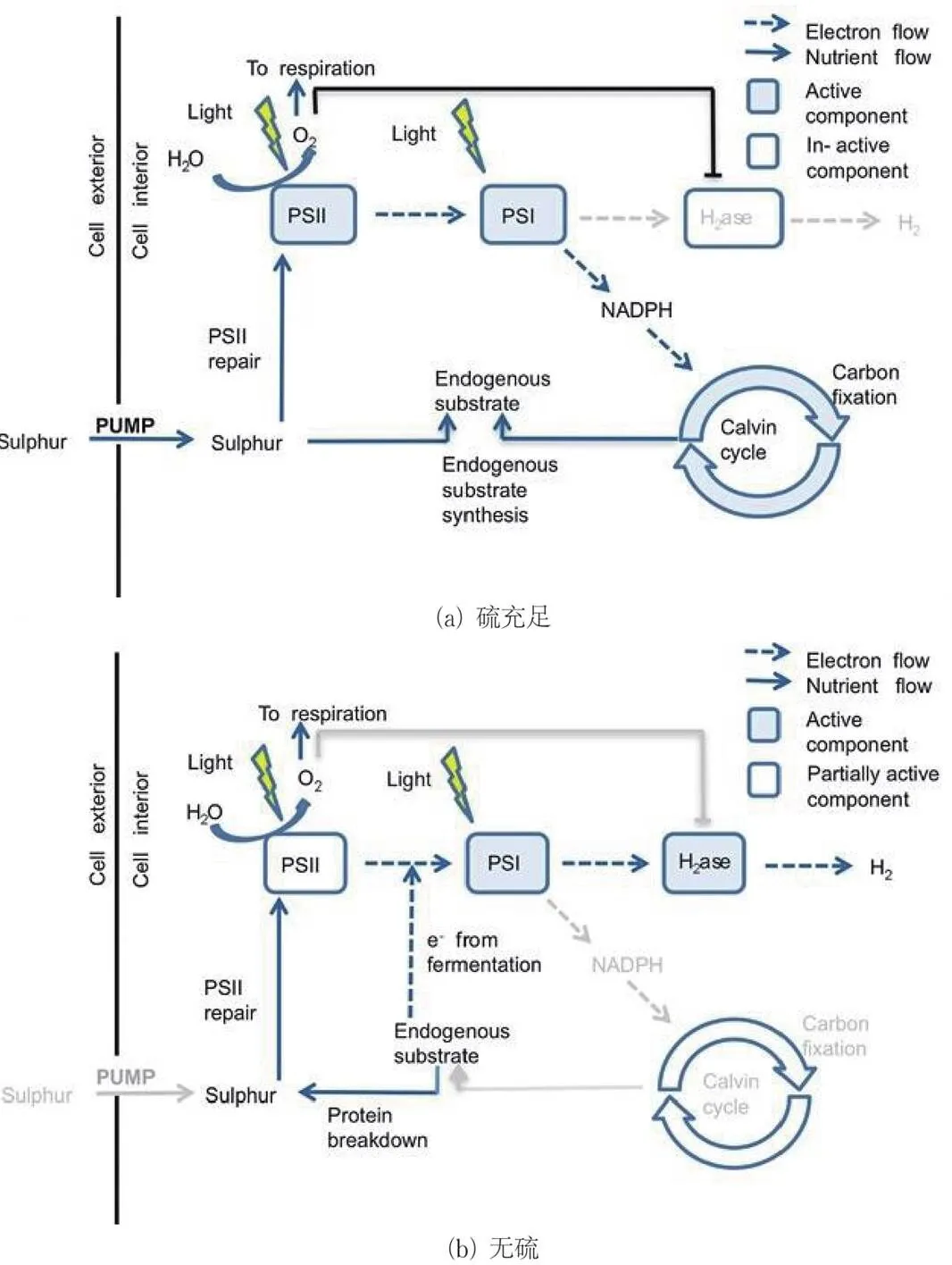
图6 硫充足条件下和无硫条件下细胞内过程和通路示意[71]
浅灰色箭头和文字表示不活跃的途径或过程。
在缺硫培养条件的基础上,固定化培养方法[72-73]进一步提升了绿藻光合产氢效率。固定化培养的细胞所占空间更小,所需生长介质体积更小,比悬浮液中的游离细胞更有优势[74]。此外,还有培养基中缺氮[75-76]、缺磷[77-78]、缺镁[79]和缺钾[80]等代谢调控法。代谢调控法常与基因工程方法结合,共同提高光合产氢效率,在产氢时间和总量上都有很大突破。由于代谢调控法在实验过程中需反复离心,操作较为烦琐且实验成本较高,故其大规模应用面临一定挑战。
2.3 基因工程方法
随着分子生物学的进展,已经有一系列利用基因工程方法提高绿藻光合产氢效率的研究。较为常见的方法是通过基因突变筛选出理想的光合产氢绿藻,或对绿藻进行定向基因改造。
2.3.1基因突变法
GHIRARDI等[81]和STAPLETON等[82]分别通过体内随机突变和体外随机突变方法尝试改造氢化酶,提升其耐氧性。遗憾的是,这些工作在提升耐氧性方面并没有带来较大的提升,只能寻找其他突变靶点筛选产氢的优势藻株。RÜHLE等[83]筛选了一种光合作用/呼吸作用比率较低的1突变体,在光照充足且硫足量的条件下建立了厌氧环境并诱导氢化酶的合成。在添加CBB循环抑制剂乙醇醛(GA)后,1突变体的产氢量是野生型缺硫条件下的2倍。KRUSE等[45]筛选了一种6莱茵衣藻突变体,证明其具有优化的呼吸代谢、大量的淀粉储备和较低的溶解氧浓度(野生型的40%)等特性,持续产氢14 d,产氢量约540 mL·L-1。D1蛋白是PSⅡ反应中心的一部分,D1中S155和D170之间的大多数氨基酸在介导电子转移中起关键作用,有望成为使PSⅡ部分失活的突变靶点[84]。TORZILLO等[47]筛选了双氨基酸取代的D1蛋白突变株L159I-N230Y,L159亮氨酸被异亮氨酸取代,N230天冬氨酸被酪氨酸取代。在缺硫培养条件下,该突变株与CC124相比,表现出更高的D1蛋白质含量、更高的呼吸作用效率、更高的碳水化合物储存能力以及较高的PSⅡ活性[85]。且该突变株的产氢量是野生型的20倍,持续时间更长,证实了PSⅡ部分失活可以促进产氢。同样,以PSⅡ活性为目标,BATYROVA等[86]构建的转基因突变体62.49能周期性地激活光合作用,只在厌氧状态下才开启光合放氧过程。因此,该突变株的光合放氧过程不连续,有效降低了O2浓度,而且产氢量随光照周期的增加逐渐增加,最终产氢量比野生型高4.5倍。
CBB循环是氢化酶产氢所需电子的主要竞争对手[27],而1,5-二磷酸核酮糖羧化酶/加氧酶(RuBisCO)在CBB循环过程中起关键作用。HEMSCHEMEIER等[87]发现,在缺硫培养条件下,碳同化过程受损的CC2803(RuBisCO大亚基缺失)产氢效率比野生型更高。同样地,PINTO等[88]筛选了RuBisCO小亚基酪氨酸突变体,CBB循环受到了抑制,产氢量比野生型高10~15倍。
除了光合作用的线性电子传递途径外,围绕PSⅠ的环式电子传递途径(CEF)可以将PSⅠ受体侧的电子传递给PQ池或Cyt6/复合体。CEF已被证明能产生类囊体跨膜质子梯度,诱导非光化学猝灭(NPQ)的产生。在高光条件下,PSⅠ周围的环式电子传递途径产生的质子梯度严重限制了绿藻产氢过程的电子供应[89]。CHEN等[90]筛选了一种环式电子传递途径受损的5突变体(也称91),能够持续产氢25 d,产氢量比野生型高30倍以上。在缺硫培养条件下,91突变体的活性氧(ROS)清除能力增强,能保护光合线性电子传递免受光氧化的损伤,使PSⅡ保持更高的活性,向氢化酶提供充足的电子。类似的结果也发生在环式电子传递途径被破坏的1突变体中,STEINBECK等[46]报道的质子梯度突变体5在缺硫培养条件下产氢量比野生型高10倍,产氢总量约850 mL·L-1。
2.3.2基因改造法
与基因突变技术不同,基因改造技术可以定向修饰绿藻,解决氢化酶的O2敏感性问题。HWANG等[91]通过在YSL01和YSL16中过表达氢化酶基因(),实现了有氧条件下的光自养产氢。XU等[92]将大肠杆菌丙酮酸氧化酶基因和长聚球藻()PCC7942的过氧化氢化酶基因导入莱因衣藻的叶绿体,用低强度光照射,转基因莱因衣藻细胞消耗的O2比野生型更多,营造了O2浓度较低的环境,显著提高了产氢量。WU等[48,93]将豆血红蛋白的基因导入莱因衣藻叶绿体并成功表达,由于豆血红蛋白可以结合O2,因此具有基因的莱茵衣藻消耗O2的速率比野生型更快,并持续产氢5 d。鉴于莱茵衣藻叶绿体基因组中强烈的密码子偏好性,WU等[94]将合成的密码子优化的-基因导入莱茵衣藻的叶绿体并表达。结果表明,-蛋白的表达水平比非优化组提高了6.8倍,产氢量提高了22%,呼吸速率提高了44%,1和2的转录水平比对照藻更稳定、更高,从而获得了产氢更理想的转基因莱茵衣藻。由于一些细菌中[FeFe]-氢化酶的耐氧性比绿藻更强,在绿藻中表达这些细菌的氢化酶基因也是一种有效提高产氢效率的方法,比如梭状芽孢杆菌[95]和丙酮丁醇梭菌的[FeFe]-氢化酶[96]。
除了氢化酶的氧敏感问题,光合电子利用效率低也是光合产氢效率不高的主要原因。为了解决此问题,YACOBY等[27]、EILENBERG等[97]、WEINER等[98]将电子供体Fd融合到氢化酶上,在莱茵衣藻中成功表达[27,97-98],研究发现,Fd-氢化酶融合酶能拦截光合电子,将其用于产氢过程,并证实了融合酶的O2敏感性比天然氢化酶低。因此,Fd-氢化酶融合酶对光合产氢具有双重积极作用。此外,BEN-ZVI[49]在莱茵衣藻中表达了氢化酶-超氧化物歧化酶(SOD)融合酶。表达氢化酶-SOD酶的藻类在产氢效率和时间上都超过了表达Fd-氢化酶的藻类,可以连续产氢长达14 d。
基因改造依赖于通过非法重组将随机插入基因组的转基因成功表达。基因改造的主要障碍是缺乏在绿藻中插入靶向基因的工具,需要开发可控的基因工程系统,通过同源重组替换目标基因。此外,通过核基因靶向和定点突变实现对绿藻产氢的精细控制是必要的。
3 总结与展望
光合产氢被认为是替代化石燃料能源最具前景的技术之一。在过去几十年间,研究者们对绿藻光合产氢代谢进行了大量探索,建立了很多重要的理论和实用技术方法,在绿藻光合产氢领域奠定了坚实的基础,如图7所示。[FeFe]-氢化酶氧敏感性和光合放氧过程的相互矛盾限制了绿藻光合产氢的发展。此外,光合产氢存在多种竞争电子代谢途径,在保持氢化酶活性的情况下使更多的电子流向氢化酶,是高效光合产氢的关键。
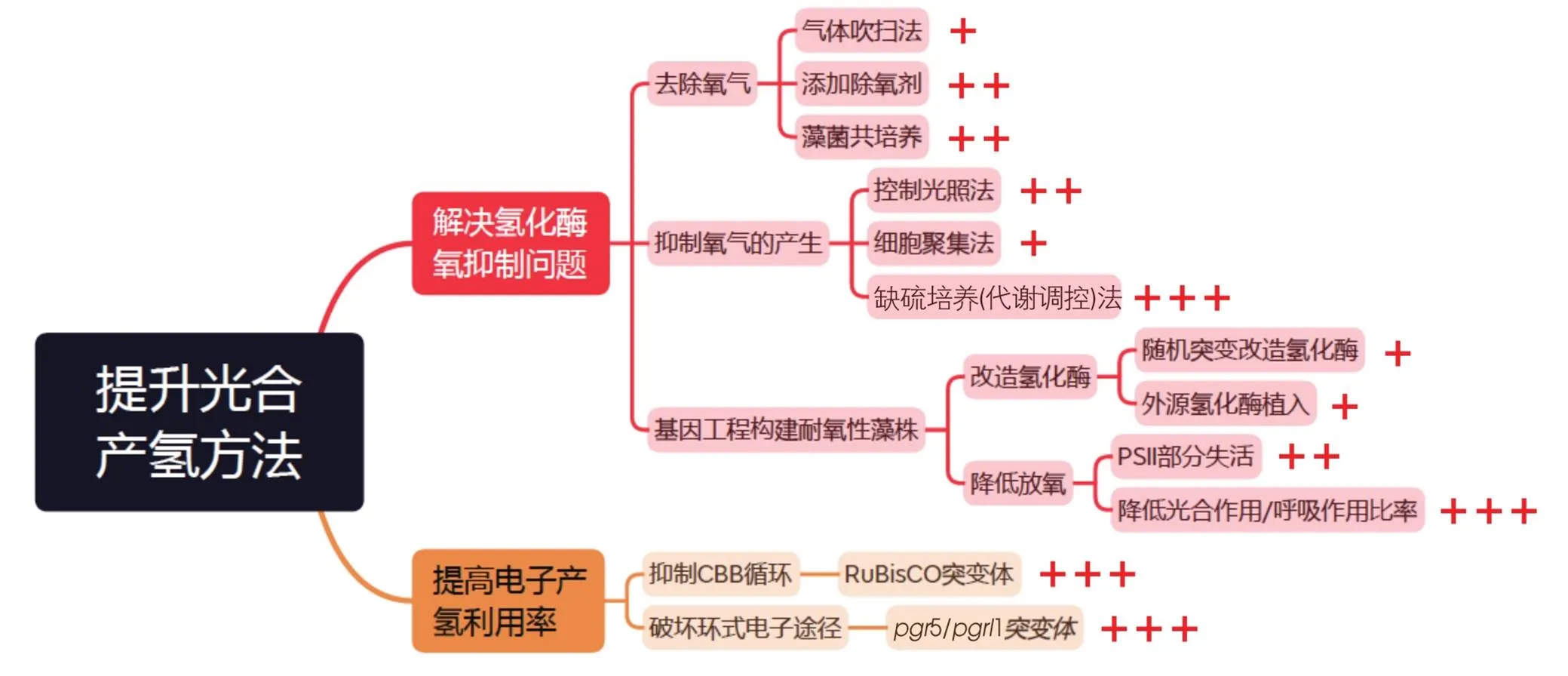
图7 提升光合产氢的方法总结
“+”数量越多,代表提升产氢效率的潜力值越高。
The more the number of " + ", the higher the potential of improving hydrogen production efficiency.
目前已经开发了多种方法针对性地规避这些限制因素,绿藻光合产氢的稳定性和效率均得到一定的提升。其中,缺硫培养被认为是光合产氢最成功的方法之一,在时间和空间上分离了光合放氧和光合产氢的过程,但是仍需继续优化,降低其操作复杂性并进一步控制产氢成本。与缺硫培养方法相比,添加除氧剂可以使绿藻更易进入光合产氢过程,需添加的化学试剂具有高O2清除能力和良好生物相容性。此外,藻菌共培养方法使用活细胞作为除氧剂,在产氢时间和成本上明显优于添加化学试剂,是一种具有潜力的产氢方法。与此同时,通过基因工程方法构建理想的高产氢藻株,有望彻底消除绿藻限制产氢的因素,是实现绿藻光合产氢商业化应用的有力手段。尽管绿藻光合产氢技术已经发展得比较成熟,但距离大规模应用仍有一定差距,许多科学和工程问题亟待解决。笔者认为,未来实现绿藻光合产氢的大规模应用可以从以下方面入手:
(1)筛选或者构建适合工业化的高效产氢的绿藻藻株。由于大自然的生物多样性可能存在大量的高产氢优异藻株,需研究者不断发现和筛选,利用现有的分子生物学技术快速、高效地筛选高产氢的野生型藻株。同时利用基因工程手段获得高效稳定的光合产氢藻株,进一步提升突变技术的筛选效率和稳定性是重要的研究方向。
(2)探究能消耗O2且能重复利用的试剂。目前已经探索出很多能直接与O2结合,且不会对绿藻的活性产生明显危害的还原试剂,但其大规模应用仍需关注试剂的消耗、成本以及对环境的影响等问题。如果能研究出可重复使用且可批量应用的试剂,则有望解决消耗O2的问题。
(3)进一步加深对绿藻内部的机理探究。不仅要考虑氢化酶的激活,还要重点关注CBB循环电子竞争途径和其他造成电子损失的微观生物学机理,探究控制竞争代谢途径之间电子的分配,在此基础上寻找理想的方法,在保证绿藻有良好光合活性的同时,让更多的电子能高效流向产氢的代谢途径。
(4)开发经济可行的光生物反应器系统。藻类生物质的商业生产已成功应用于室外,但对生物氢而言,露天场所不适合产生和收集扩散性的气体产物。因此,开发封闭的光生物反应器系统也是绿藻光合产氢大规模应用的硬性条件。通过光生物反应器精确地控制产氢过程中的光照、温度、pH等条件,达到有效回收和分离H2的应用目标。
笔者有理由相信,在提高产氢工艺效率、产量以及工艺操作的实用性和可持续性基础上,光合产氢将从基础研究转向应用研究,未来绿藻光合产氢有望达到商业化应用的要求,最终取代化石能源,建立一个安全可持续的能源系统。
[1] BOGDANOV D, FARFAN J, SADOVSKAIA K, et al. Radical transformation pathway towards sustainable electricity via evolutionary steps[J]. Nature Communications, 2019, 10(1): 1077-1093. DOI:10.1038/s41467-019-08855-1
[2] LEWIS N S. Developing a scalable artificial photosynthesis technology through nanomaterials by design[J]. Nature Nanotechnology, 2016, 11(12): 1010-1019. DOI:10.1038/nnano.2016.194
[3] WARNAN J, REISNER E. Synthetic organic design for solar fuel systems[J]. Angewandte Chemie International Edition, 2020, 59(40): 17344-17354. DOI:10.1002/anie.202006013
[4] GREGORY D P, PANGBORN J B. Hydrogen energy[J]. Annual Review of Energy, 1976, 1: 279-310. DOI:10.1146/annurev.eg.01. 110176.001431
[5] RAMACHANDRAN R, MENON R K. An overview of industrial uses of hydrogen[J]. International Journal of Hydrogen Energy, 1998, 23(7): 593-598. DOI:10.1016/S0360-3199(97)00112-2
[6] GUPTA R, JALIL M F. An Overview of Using Hydrogen in Transportation Sector as Fuel[M]. Singapore: Springer, 2021. DOI:10.1007/978-981-33-4080-0_49
[7] TURNER J A. A realizable renewable energy future[J]. Science, 1999, 285(5428): 687-689. DOI:10.1126/science.285.5428.687.
[8] KORNIENKO N, ZHANG J Z,SAKIMOTO K K, et al. Interfacing nature's catalytic machinery with synthetic materials for semi-artificial photosynthesis[J]. Nature Nanotechnology, 2018, 13(10): 890-899. DOI:10.1038/s41565-018-0251-7
[9] GAFFRON H, RUBIN J. Fermentative and photochemical production of hydrogen in algae[J]. The Journal of General Physiology, 1942, 26(2): 219-240. DOI:10.1085/jgp.26.2.219
[10]MELIS A. Solar energy conversion efficiencies in photosynthesis: Minimizing the chlorophyll antennae to maximize efficiency[J]. Plant Science, 2009, 177(4): 272-280. DOI:10.1016/j.plantsci.2009.06.005
[11]KUVYKIN I V, VERSHUBSKⅡ A V, TIKHONOV A N. Alternative pathways of photoinduced electron transport in chloroplasts[J]. Russian Journal of Physical Chemistry B, 2009, 3(2): 230-241. DOI:10.1134/S1990793109020092
[12]EROGLU E, MELIS A. Microalgal hydrogen production research[J]. International Journal of Hydrogen Energy, 2016, 41(30): 12772-12798. DOI:10.1016/j.ijhydene.2016.05.115
[13]HEMSCHEMEIER A, HAPPE T. Alternative photosynthetic electron transport pathways during anaerobiosis in the green alga[J]. Biochimica et Biophysica Acta-Bioenergetics, 2011, 1807(8): 919-926. DOI:10. 1016/j.bbabio.2011.02.010
[14]YANG W J, CATALANOTTI C, WITTKOPP T M, et al. Algae after dark: Mechanisms to cope with anoxic/hypoxic conditions[J]. The Plant Journal, 2015, 82(3): 481-503. DOI:10.1111/tpj.12823
[15]BATYROVA K, HALLENBECK P C. Recent Developments in Light‑Driven H2Production by the Green Alga,[M]. London: Future Science, 2015: 82-95. DOI:10. 4155/fseb2013.14.269
[16]MEUSER J E, ANANYEV G, WITTIG L E, et al. Phenotypic diversity of hydrogen production in chlorophycean algae reflects distinct anaerobic metabolisms[J]. Journal of Biotechnology, 2009, 142(1): 21-30. DOI:10.1016/j.jbiotec.2009.01.015
[17]FLORIN L, TSOKOGLOU A, HAPPE T. A novel type of iron hydrogenase in the green algais linked to the photosynthetic electron transport chain[J]. Journal of Biological Chemistry, 2001, 276(9): 6125-6132. DOI:10.1074/jbc.M008470200
[18]BRODERICK J B, BYER A S, DUSCHENE K S, et al. H-cluster assembly during maturation of the [FeFe]-hydrogenase[J]. JBIC Journal of Biological Inorganic Chemistry, 2014, 19(6): 747-757. DOI:10.1007/s00775-014-1168-8
[19]PETROVA E V, KUKARSKIKH G P, KRENDELEVA T E, et al. The mechanisms and role of photosynthetic hydrogen production by green microalgae[J]. Microbiology, 2020, 89(3): 251-265. DOI:10.1134/S0026261720030169
[20]GHIRARDI M L, KING P W, POSEWITZ M C, et al. Approaches to developing biological H2-photoproducing organisms and processes[J]. Biochemical Society Transactions, 2005, 33(1): 70-72. DOI:10.1042/BST0330070
[21]GHIRARDI M L, POSEWITZ M C, MANESS P C, et al. Hydrogenases and hydrogen photoproduction in oxygenic photosynthetic organisms[J]. Annual Review of Plant Biology, 2007, 58(1): 71-91. DOI:10.1146/annurev.arplant.58.032806.103848
[22]STRIPP S T, GOLDET G, BRANDMAYR C, et al. How oxygen attacks [FeFe] hydrogenase from photosynthetic organisms[J]. Proceedings of the National Academy of Sciences, 2009, 106(41): 17331-17336. DOI:10.1073/pnas.0905343106
[23]MEUSER J E, D’ADAMO S, JINKERSON R E, et al. Genetic disruption of both[FeFe]-hydrogenases: Insight into the role of HYDA2 in H2production[J]. Biochemical & Biophysical Research Communications, 2012, 417: 704-709. DOI:10.1016/j.bbrc.2011.12.002
[24]APPEL J, SCHULZ R. Hydrogen metabolism in organisms with oxygenic photosynthesis: Hydrogenases as important regulatory devices for a proper redox poising?[J]. Journal of Photochemistry & Photobiology B: Biology, 1998, 47(1): 1-11. DOI:10.1016/S1011-1344(98)00179-1
[25]ROCHAIX J D. REPRINT of: Regulation of photosynthetic electron transport[J]. Biochimica et Biophysica Acta(BBA)-Bioenergetics, 2011, 1807(8): 878-886. DOI:10.1016/j.bbabio.2011.05.009
[26]TOSHIHARU H, PETER S, DAVID B K. The Interaction of ferredoxin with ferredoxin-dependent enzymes[J]. Advances in Photosynthesis & Respiration, 2006, 24: 477-498. DOI:10.1007/978-1-4020-4256-0_28
[27]YACOBY I, POCHEKAILOV S, TOPORIK H, et al. Photosynthetic electron partitioning between [FeFe]- hydrogenase and ferredoxin: NADP+-oxidoreductase (FNR) enzymes in vitro[J]. Proceedings of the National Academy of Sciences, 2011, 108(23): 9396-9401. DOI:10.1073/pnas.1103659108
[28]GODAUX D, BAILLEUL B, BERNE N, et al. Induction of photosynthetic carbon fixation in anoxia relies on hydrogenase activity and proton-gradient regulation-like1-mediated cyclic electron flow in[J]. Plant Physiology, 2015, 168(2): 648-658. DOI:10.1104/pp.15.00105
[29]LEE J W, GREENBAUM E, et al. A new oxygen sensitivity and its potential application in photosynthetic H2production[J]. Applied Biochemistry and Biotechnology, 2003, 4(25): 303-313.
[30]KOSOUROV S N, BATYROVA K A, PETUSHKOVA E P, et al. Maximizing the hydrogen photoproduction yields incultures: The effect of the H2partial pressure[J]. International Journal of Hydrogen Energy, 2012, 37(10): 8850-8858. DOI:10.1016/j.ijhydene.2012.01.082
[31]GREENBAUM E, BLANKINSHIP S L, LEE J W, et al. Solar photobiochemistry: Simultaneous photoproduction of hydrogen and oxygen in a confined bioreactor[J]. The Journal of Physical Chemistry B, 2001, 105(17): 3605-3609.
[32]SUBRAMANIAN V, DUBINI A, ASTLING D P, et al. Profilingmetabolism under dark, anoxic H2-producing conditions using a combined proteomic, transcriptomic, and metabolomic approach[J]. Journal of Proteome Research, 2014, 13(12): 5431-5451. DOI:10.1021/pr500342j
[33]TSYGANKOV A A, KOSOUROV S N, TOLSTYGINA I V, et al. Hydrogen production by sulfur-deprivedunder photoautotrophic conditions[J]. International Journal of Hydrogen Energy, 2006, 31(11): 1574-1584. DOI:10.1016/j.ijhydene.2006.06.024
[34]HAHN J J, GHIRARDI M L, JACOBY W A. Effect of process variables on photosynthetic algal hydrogen production[J]. Biotechnology Progress, 2004, 20(3): 989-991.
[35]JO J H, LEE D S, PARK J M. Modeling and optimization of photosynthetic hydrogen gas production by green algain sulfur-deprived circumstance[J]. Biotechnol Progress, 2006, 22(2): 431-437. DOI:10.1021/bp050258z
[36]WEI L Z, YI J, WANG L J, et al. Light intensity is important for hydrogen production in NaHSO3-treated[J]. Plant & Cell Physiology, 2017, 58(3): 451-457. DOI:10.1093/pcp/pcw216
[37]KOSOUROV S, SEIBERT M, GHIRARDI M L. Effects of extracellular pH on the metabolic pathways in sulfur-deprived, H2-producingcultures[J]. Plant & Cell Physiology, 2003, 44(2): 146-155. DOI:10.1093/pcp/pcg020
[38]WEI L Z, LI X, FAN B Q, et al. A stepwise NaHSO3addition mode greatly improves H2photoproduction in[J]. Frontiers in Plant Science, 2018, 9: 1532-1539. DOI:10.3389/fpls.2018.01532.eCollection2018
[39]CHEN J, LI J, LI Q, et al. Engineering a chemoenzymatic cascade for sustainable photobiological hydrogen production with green algae[J]. Energy & Environmental Science, 2020, 13(7): 2064-2068. DOI:10.1039/d0ee00993h
[40]LAKATOS G, BALOGH D, FARKAS A, et al. Factors influencing algal photobiohydrogen production in algal-bacterial co-cultures[J]. Algal Research, 2017, 28: 161-171. DOI:10.1016/j.algal.2017.10.024
[41]KOSOUROV S, JOKEL M, ARO E M, et al. A new approach for sustained and efficient H2photoproduction by[J]. Energy & Environmental Science, 2018, 11(6): 1431-1436. DOI:10.1039/c8ee00054a
[42]XIONG W, ZHAO X H, ZHU G X, et al. Silicification-induced cell aggregation for the sustainable production of H2under aerobic conditions[J]. Angewandte Chemie International Edition, 2015, 54(41): 11961-11965. DOI:10.1002/anie.201504634
[43]HE M L, LI L, ZHANG L T, et al. The enhancement of hydrogen photoproduction inexposed to nitrogen limitation and sulfur deprivation[J]. International Journal of Hydrogen Energy, 2012, 37(22): 16903-16915. DOI:10.1016/j.ijhydene.2012.08.121
[44]CHADER S, HACENE H, AGATHOS S N. Study of hydrogen production by three strains ofisolated from the soil in the Algerian Sahara[J]. International Journal of Hydrogen Energy, 2009, 34(11): 4941-4946. DOI:10.1016/j.ijhydene.2008.10.058
[45]KRUSE O, RUPPRECHT J, BADER K P, et al. Improved photobiological H2production in engineered green algal cells[J]. Journal of Biological Chemistry, 2005, 280(40): 34170-34177. DOI:10. 1074/jbc.M503840200
[46]STEINBECK J, NIKOLOVA D, WEINGARTEN R, et al. Deletion of proton gradient regulation 5 (PGR5) and PGR5-Like 1 (PGRL1) proteins promote sustainable light-driven hydrogen production indue to increased PSⅡ activity under sulfur deprivation[J]. Frontiers in Plant Science, 2015, 6: 1-11. DOI:10.3389/fpls.2015.00892
[47]TORZILLO G, SCOMA A, FARALONI C, et al. Increased hydrogen photoproduction by means of a sulfur-deprivedD1 protein mutant[J]. International Journal of Hydrogen Energy, 2009, 34(10): 4529-4536. DOI:10.1016/j.ijhydene.2008.07.093
[48]WU S X, HUANG R, XU L L, et al. Improved hydrogen production with expression of hemH and lba genes in chloroplast of[J]. Journal of Biotechnology, 2010, 146(3): 120-125. DOI:10.1016/j.jbiotec.2010.01.023
[49]BEN-ZVI O, DAFNI E, FELDMAN Y, et al. Re-routing photosynthetic energy for continuous hydrogen production in vivo[J]. Biotechnology for Biofuels, 2019, 12(1): 1-13. DOI:10.1186/s13068-019-1608-3
[50]BENEMANN J R. Hydrogen production by microalgae[J]. Journal of Applied Phycology, 2000, 12(3/4/5): 291-300. DOI:10.1023/A:1008175 112704
[51]POW T, KRASNA A I. Photoproduction of hydrogen from water in hydrogenase-containing algae[J]. Archives of Biochemistry and Biophysics, 1979, 194(2): 413-421. DOI:10.1016/0003-9861(79)90635-0
[52]MARQUEZ-REYES L A, SÁNCHEZ-SAAVEDRA M P, VALDEZ-VAZQUEZ I. Improvement of hydrogen production by reduction of the photosynthetic oxygen in microalgae cultures ofand[J]. International Journal of Hydrogen Energy, 2015, 40(23): 7291-7300. DOI:10.1016/j.ijhydene.2015.04.060
[53]WYKOFF D D, DAVIES J P, MELIS A, et al. The regulation of photosynthetic electron transport during nutrient deprivation in[J]. Plant Physiology, 1998, 117(1): 129-139. DOI:10.1104/pp.117.1.129
[54]MELIS A, ZHANG L, FORESTIER M, et al. Sustained photobiological hydrogen gas production upon reversible inactivation of oxygen evolution in the green alga[J]. Plant Physiology, 2000, 122(1): 127-136. DOI:10.1104/pp.122.1.127
[55]NOONE S, RATCLIFF K, DAVIS R A, et al. Expression of a clostridial [FeFe]-hydrogenase inprolongs photo-production of hydrogen from water splitting[J]. Algal Research, 2017, 22: 116-121. DOI:10.1016/j.algal.2016.12.014
[56]GREENBAUM E. Photosynthetic hydrogen and oxygen production: Kinetic studies[J]. Science, 1982, 215(4530): 291-293. DOI:10.1126/science. 215.4530.291
[57]GIBBS M, GFELLER R P, CHEN C. Fermentative metabolism of: Ⅲ photoassimilation of acetate[J]. Plant Physiology, 1986, 82(1):160-166. DOI:10.1104/pp.82.1.160
[58]MA W M, CHEN M, WANG L J, et al. Treatment with NaHSO3greatly enhances photobiological H2production in the green alga[J]. Bioresource Technology, 2011, 102(18): 8635-8638. DOI:10.1016/j.biortech.2011. 03.052
[59]NAGY V, PODMANICZKI A, VIDAL-MEIRELES A, et al. Water-splitting-based, sustainable and efficient H2production in green algae as achieved by substrate limitation of the Calvin-Benson-Bassham cycle[J]. Biotechnology for Biofuels, 2018, 11(1): 69-85. DOI:10.1186/s13068-018-1069-0
[60]SU D Y, QI J R, LIU X M, et al. Enzyme-modulated anaerobic encapsulation ofcells allows switching from O2to H2production[J]. Angewandte Chemie International Edition, 2019, 58(12): 3992-3995. DOI:10.1002/anie.201900255
[61]FAKHIMI N, DUBINI A, TAVAKOLI O, et al. Acetic acid is key for synergetic hydrogen production in-bacteria co-cultures[J]. Bioresource Technology, 2019, 289: 121648-121657. DOI:10.1016/j.biortech.2019.121648
[62]LAKATOS G, DEÁK Z, VASS I, et al. Bacterial symbionts enhance photo-fermentative hydrogen evolution ofalgae[J]. Green Chemistry, 2014, 16(11): 4716-4727. DOI:10. 1039/C4GC00745J
[63]BAN S D, LIN W T, WU F Y, et al. Algal-bacterial cooperation improves algal photolysis-mediated hydrogen production[J]. Bioresource Technology, 2017, 251: 350-357. DOI:10.1016/j.biortech.2017.12.072
[64]PACHAPUR V L, SARMA S J, BRAR S K, et al. Co-culture strategies for increased biohydrogen production[J]. International Journal of Energy Research, 2015, 39(11): 1479-1504. DOI:10.1002/er.3364
[65]MARKOV S A, EIVAZOVA E R, GREENWOOD J. Photostimulation of H2production in the green algaupon photoinhibition of its O2-evolving system[J]. International Journal of Hydrogen Energy, 2006, 31(10): 1314-1317. DOI:10.1016/j.ijhydene.2005.11.017
[66]HOSHINO T, JOHNSON D J, CUELLO J L. Design of new strategy for green algal photo-hydrogen production: Spectral-selective photosystem Ⅰactivation and photosystem Ⅱ deactivation[J]. Bioresource Technology, 2012, 120: 233-240. DOI:10.1016/j.biortech.2012.06.011
[67]SHU L, XIONG W, SHAO C Y, et al. Improvement in the photobiological hydrogen production of aggregatedby dimethyl sulfoxide[J]. Chembiochem, 2018, 19(7): 669-673. DOI:10.1002/cbic.201700637
[68]WYKOFF D D, DAVIES J P, MELIS A, et al. The regulation of photosynthetic electron transport during nutrient deprivation in[J]. Plant Physiology, 1988, 117(1): 129-139. DOI:10.1104/pp.117.1.129
[69]MELIS A, ZHANG L, FORESTIER M, et al. Sustained photobiological hydrogen gas production upon reversible inactivation of oxygen evolution in the green alga[J]. Plant Physiology, 2000, 122(1): 127-136. DOI:10.1104/pp.122.1.127
[70]MELIS A, HAPPE T. Hydrogen production. green algae as a source of energy[J]. Plant Physiology, 2001, 127(3): 740-748.
[71]WILLIAMS C R, BEES M A. Mechanistic modeling of sulfur-deprived photosynthesis and hydrogen production in suspensions of[J]. Biotechnology and Bioengineering, 2014, 111(2): 320-335. DOI:10.1002/bit.25023
[72]MASWANNA T, PHUNPRUCH S, LINDBLAD P, et al. Enhanced hydrogen production by optimization of immobilized cells of the green algasp. CU2551 grown under anaerobic condition[J]. Biomass and Bioenergy, 2018, 111: 88-95. DOI:10.1016/j.biombioe.2018.01.005
[73]KOSOUROV S N, SEIBERT M. Hydrogen photoproduction by nutrient-deprivedcells immobilized within thin alginate films under aerobic and anaerobic conditions[J]. Biotechnology and Bioengineering, 2010, 102(1): 50-58. DOI:10.1002/bit.22050
[74]LAURINAVICHENE T V, FEDOROV A S, GHIRARDI M L, et al. Demonstration of sustained hydrogen photoproduction by immobilized, sulfur-deprivedcells[J]. International Journal of Hydrogen Energy, 2006, 31(5): 659-667. DOI:10.1016/j.ijhydene.2005. 05.002
[75]PHILIPPS G, HAPPE T, HEMSCHEMEIER A. Nitrogen deprivation results in photosynthetic hydrogen production in[J]. Planta, 2012, 235(4): 729-745. DOI:10.1007/s00425-011-1537-2
[76]APARICIO P J, AZUARA M P, BALLESTEROS A, et al. Effects of light intensity and oxidized nitrogen sources on hydrogen production by[J]. Plant Physiology, 1985, 78(4): 803-806. DOI:10.1104/pp.78.4.803
[77]BATYROVA K A, TSYGANKOV A A, KOSOUROV S N. Sustained hydrogen photoproduction by phosphorus-deprivedcultures[J]. International Journal of Hydrogen Energy, 2012, 37(10): 8834-8839. DOI:10.1016/j.ijhydene.2012. 01.068
[78]BATYROVA K, GAVRISHEVA A, IVANOVA E, et al. Sustainable hydrogen photoproduction by phosphorus-deprived marine green microalgaesp.[J]. International Journal of Molecular Sciences, 2015, 16(2): 2705-2716. DOI:10.3390/ijms16022705
[79]VOLGUSHEVA A, KUKARSKIKH G, KRENDELEVA T, et al. Hydrogen photoproduction in green algaeunder magnesium deprivation[J]. RSC Advances, 2015, 5(8): 5633-5637. DOI:10.1039/C4RA12710B
[80]PAPAZI A, GJINDALI A I, KASTANAKI E, et al. Potassium deficiency, a "smart" cellular switch for sustained high yield hydrogen production by the green alga[J]. International Journal of Hydrogen Energy, 2014, 39(34): 19452-19464. DOI:10.1016/j.ijhydene.2014.09.096
[81]GHIRARDI M L, TOGASAKI R K, SEIBERT M. Oxygen sensitivity of algal H2-production[J]. Applied Biochemistry and Biotechnology, 1997, 63-65(1): 141-151. DOI:10.1007/BF02920420
[82]STAPLETON J A, SWARTZ J R. Development of an in vitro compartmentalization screen for high-throughput directed evolution of [FeFe] hydrogenases[J]. PloS One, 2010, 5(12): e15275. DOI:10.1371/journal.pone.0015275
[83]RÜHLE T, HEMSCHEMEIER A, MELIS A, et al. A novel screening protocol for the isolation of hydrogen producingstrains[J]. BMC Plant Biology, 2008, 8: 107. DOI:10.1186/1471-2229-8-107
[84]XIONG J, SUBRAMANIAM S, GOVINDJEE. A knowledge-based three dimensional model of the Photosystem Ⅱ reaction center of[J]. Photosynthesis Research, 1998, 56(3): 229-254. DOI:10.1023/A:1006061918025
[85]SCOMA A, KRAWIETZ D, FARALONI C, et al. Sustained H2production in aD1 protein mutant[J]. Journal of Biotechnology, 2012, 157(4): 613-619. DOI:10. 1016/j.jbiotec.2011.06.019
[86]BATYROVA K, HALLENBECK P C. Hydrogen production by astrain with inducible expression of photosystem Ⅱ[J]. International Journal of Molecular Sciences, 2017, 18(3): 647-661. DOI:10.3390/ijms18030647
[87]HEMSCHEMEIER A, FOUCHARD S, COURNAC L, et al. Hydrogen production by: An elaborate interplay of electron sources and sinks[J]. Planta, 2008, 227(2): 397-407. DOI:10.1007/s00425-007-0626-8
[88]PINTO T S, MALCATA F X, ARRABACA J D, et al. Rubisco mutants ofenhance photosynthetic hydrogen production[J]. Applied Microbiology and Biotechnology, 2013, 97(12): 5635-5643. DOI:10.1007/s00253-013-4920-z
[89]TOLLETER D, GHYSELS B, ALRIC J, et al. Control of hydrogen photoproduction by the proton gradient generated by cyclic electron flow in[J]. The Plant Cell, 2011, 23(7): 2619-2630. DOI:10.1105/tpc.111. 086876
[90]CHEN M, ZHANG J, ZHAO L, et al. Loss of algal proton gradient regulation 5 increases reactive oxygen species scavenging and H2evolution[J]. Journal of Integrative Plant Biology, 2016, 58(12): 943-946. DOI:10.1111/jipb.12502
[91]HWANG J H, KIM H C, CHOI J A, et al. Photoautotrophic hydrogen production by eukaryotic microalgae under aerobic conditions[J]. Nature Communications, 2014, 5: 3234. DOI:10.1038/ncomms4234
[92]XU F Q, MA W M, ZHU X G. Introducing pyruvate oxidase into the chloroplast ofincreases oxygen consumption and promotes hydrogen production[J]. International Journal of Hydrogen Energy, 2011, 36(17): 10648-10654. DOI:10.1016/j.ijhydene.2011.05.130
[93]WU S X, YAN G Y, XU L L, et al. Improvement of hydrogen production with expression of lba gene in chloroplast of[J]. International Journal of Hydrogen Energy, 2010, 35(24): 13419-13426. DOI:10.1016/j.ijhydene. 2009.11.118
[94]WU S X, XU L L, HUANG R, et al. Improved biohydrogen production with an expression of codon-optimizedandgenes in the chloroplast of[J]. Bioresource Technology, 2011, 102(3): 2610-2616. DOI:10. 1016/j.biortech.2010.09.123
[95]NOONE S, RATCLIFF K, DAVIS R A, et al. Expression of a clostridial [FeFe]-hydrogenase inprolongs photo-production of hydrogen from water splitting[J]. Algal Research, 2016, 22: 116-121. DOI:10.1016/j.algal. 2016.12.014
[96]DUCAT D C, SACHDEVA G, SILVER P A. Rewiring hydrogenase-dependent redox circuits in cyanobacteria[J]. Proceedings of the National Academy of Sciences, 2011, 108(10): 3941-3946. DOI:10.1073/pnas.1016026108
[97]EILENBERG H, WEINER I, BEN-ZVI O, et al. The dual effect of a ferredoxin-hydrogenase fusion protein in vivo: Successful divergence of the photosynthetic electron flux towards hydrogen production and elevated oxygen tolerance[J]. Biotechnology for Biofuels, 2016, 9(1): 182-193. DOI:10.1186/s13068-016-0601-3
[98]WEINER I, SHAHAR N, FELDMAN Y, et al. Overcoming the expression barrier of the ferredoxin-hydrogenase chimera insupports a linear increment in photosynthetic hydrogen output[J]. Algal Research, 2018, 33: 310-315. DOI:10.1016/j.algal.2018.06.011
Progress of photobiological hydrogen production by green algae
ZHANG Yaqin1,2, TANG Ruikang1,2, MA Weimin3, XIONG Wei4, XU Xurong2
(1,,310027,;2,,310027,;3,,200234,;4,,330031,)
Photobiological hydrogen production by green algae exhibits a bright application prospect in solar energy utilization and hydrogen energy production due to the advantages of high energy conversion efficiency, environmental friendliness as well as abundant raw materials. This paper analyzes the potential factors limiting photobiological hydrogen production by green algae based on the mechanism, and summarizes various methods to improve the efficiency of photobiological hydrogen production by green algae. The main problems and development trends in the commercial application of photobiological hydrogen production by green algae are briefly reviewed, which are referable for the large-scale application of photobiological hydrogen production by green algae in the future.
green algae; photobiological hydrogen; hydrogenase; O2sensitivity; electronic sources
Q 949
A
1008⁃9497(2023)01⁃069⁃14
2022⁃03⁃30.
国家自然科学基金资助项目(21875215).
张亚琴(1994—),ORCID:https://orcid.org/0000-0003-2456-9704,硕士研究生,主要从事绿藻光合产氢研究,E-mail: 11837050@zju.edu.cn.
通信作者,ORCID:https://orcid.org/0000-0002-0626-0597,E-mail: xrxu@zju.edu.cn.

