耐高温厨余垃圾降解菌的分离、驯化与应用
2023-01-16陈海燕陆信曜诸葛斌
陈海燕,宗 红,陆信曜,诸葛斌
(1.江南大学 糖化学与生物技术教育部重点实验室,江苏 无锡 214122;2.江南大学 生物工程学院 工业微生物研究中心,江苏 无锡 214122)
厨余垃圾主要成分包括米和面粉类食物残余、蔬菜、肉骨等,据国家统计局数据显示,2018年,全国厨余垃圾产生量已达到10 800万t。由于人口增长和城市化的加速,近年来国内厨余垃圾的年增长率估计超过10%[1],实现厨余垃圾的减量化、资源化及无害化是亟待解决的环境问题。
目前,国内外厨余垃圾处理方法主要分为两大类,一类是非生物处理法,主要包括卫生填埋[2]、焚烧等;第二类是生物处理法,主要有堆肥[3]、厌氧发酵[4-5]、深度发酵产氢[6]、饲料化[7]以及厨余垃圾处理器[8]等。填埋和焚烧的资源化水平极低,且易造成环境的二次污染[9],所以就地化、快速化处理厨余垃圾的生物处理及利用微生物菌剂的研究越来越引起人们的重视。徐锐[10]研究了一种高效降解厨余垃圾的复合微生物菌剂,处理48 h后质量减少了40%。咸芳[11]自制微生物菌剂,当接种量为8%,处理厨余垃圾72 h后质量减少率最大可达78.5%。目前大部分的研究主要是针对微生物菌株的选择,而鲜少有利用厨余垃圾为培养基原料来制备微生物复合菌剂的研究。
本研究基于“以废治废”理念,从不同来源的垃圾样品中分离筛选耐高温的高效降解菌株,针对厨余垃圾成分复杂、营养物质不均衡等特点,以厨余垃圾浸出液为培养基,对菌株进行定向驯化,制成高活性复合微生物菌剂,并利用小型的厨余垃圾处理器进行实用性试验,以期为今后厨余垃圾降解菌株的制备和应用提供新思路。
1 材料与方法
1.1 实验材料
1.1.1 样品采集及处理
样品来自于江南大学学校食堂和周边饭店,挑去塑料袋、纸巾等杂物后用粉碎机粉碎搅匀后备用。
1.1.2 培养基
LB培养基(g/L):酵母浸粉5.0、NaCl 10.0、胰蛋白胨10.0。
固体油脂培养基[12](g/L):NaCl 5.0、蛋白胨10.0、CaCl27H2O 0.1、Tween-80 10.0;1.0%中性红水溶液1 mL,橄榄油乳化液(2%聚乙烯醇与橄榄油体积比为3∶ 1制成乳化液) 50 mL,pH调至7.4。
固体淀粉培养基[13](g/L):蛋白胨10.0、NaCl 5.0、牛肉膏5.0、可溶性淀粉2.0、琼脂15.0~20.0;pH 7.2~7.4。
固体纤维素培养基[12](g/L):KH2PO40.5、MgSO40.25、CMC-Na 1.88、刚果红0.2、琼脂16.0、明胶2.0;pH 7.0。
固体蛋白培养基[13](g/L):脱脂奶粉50.0、可溶性淀粉10.0、酵母膏5.0、KH2PO41.0、MgSO47H2O 0.2、琼脂20.0;pH 7.0~7.2 。
固体厨余垃圾浸出液培养基(g/L):厨余垃圾浸出液1 000,琼脂15.0~20.0。
以上培养基均于121 ℃条件下灭菌30 min。
1.2 实验方法
1.2.1 厨余垃圾浸出液的制备及测定方法
厨余垃圾浸出液制备:将预处理(挑去塑料袋、纸巾等杂物)的厨余垃圾用粉碎机粉碎搅匀,置于加热容器中,加入3倍质量的水,100 ℃加热2 h,冷却后过830 μm筛,将液体部分置于4 750 r/min离心机常温下离心1 h,去油后取液体部分。
化学需氧量(COD)检测用快速烘箱法[14];有机碳含量采用LY/T 1237—1999方法测定,总氮含量采用凯式定氮法[15]测定,C/N比为有机碳含量/总氮含量。
1.2.2 菌株的分离筛选
耐高温菌株的筛选:由于厨余垃圾处理温度一般为45~50 ℃,故采用45 ℃高温筛选不同来源的垃圾样品。称取3.0 g样品至装有50 mL无菌水的试管中,充分振荡混匀。将装有样品悬液的试管置于45 ℃水浴锅中水浴20 min并适当振荡。吸取1 mL样品悬液进行10X系列梯度稀释。分别取各梯度稀释液0.1 mL涂布于LB培养基,倒置于45 ℃培养箱培养8~12 h,观察菌落生长情况。分离纯化。筛选出的菌株用编号A1、A2、A3……表示。
蛋白质、淀粉、纤维素和油脂降解菌的筛选:将分离好的菌株点接于蛋白质、淀粉、纤维素和油脂筛选培养基中,置于45 ℃恒温培养箱培养24 h。采用透明圈法初步确定各菌种降解相应有机质的能力。
1.2.3 分子生物学鉴定
将筛选得到的菌株提取基因组[16],选用rDNA长度为1 501 bp的片段进行PCR扩增[16]。扩增产物送至天霖生物科技无锡有限公司检测。将16S rDNA序列测序所得序列输入GenBank数据库,用BLAST程序进行比对分析,并利用MEGA 5.1软件构建系统发育树。
1.2.4 筛选菌株的驯化
将筛选的菌株分别稀释涂布于厨余垃圾浸出液的固体培养基,45 ℃培养箱培养,每隔8 ~12 h将菌株生长最大的挑选出来,再接入下一个培养基,不断继代驯化,最终获得对厨余垃圾浸出液有更好耐受力以及生长快速稳定的菌株。
1.2.5 菌株活菌数及胞外酶活测定
活菌数测定:将驯化前后的菌株经活化后分别接种于厨余垃圾浸出液培养基及LB培养基中,摇床45 ℃、200 r/min培养24 h,测定其活菌数[17]。
粗酶液的制备:将驯化前后的各菌种以1%(体积分数)的接种量接种至厨余垃圾浸出液培养基,45 ℃、200 r/min摇床培养,取培养一定时间的发酵液,于10 000 r/min离心10 min,取上清液为粗酶液。
胞外酶活测定采用淀粉酶活的3,5-二硝基水杨酸(DNS)显色法[18],酶活力定义:每毫升粗酶液每分钟水解淀粉生成1 μg还原糖所用的酶量定义为一个酶活单位,以“U/mL”表示。蛋白酶(SB/T 10317-1999)酶活力定义:每毫升粗酶液每分钟水解酪蛋白产生1 μg酪氨酸所用的酶量定义为一个酶活单位,以“U/mL”表示。脂肪酶活(对硝基苯酚法)[19],每毫升粗酶液每分钟催化水解底物对硝基苯棕榈酸酯(p-NPP)产生1 μmol对硝基苯酸(p-NP)所需的酶量定义为一个酶活单位,以“U/mL”表示。纤维素酶活(DNS显色法)[20],每毫升粗酶液每分钟水解纤维素生成1 μg还原糖所用的酶量定义为一个酶活单位,以“U/mL”表示。
1.3 复合微生物菌剂的制备
复配比例:将厨余垃圾用粉碎机粉碎搅匀,每个锥形瓶中装40 g后灭菌,按照1%的比例投加筛选的单菌及复合菌剂,设定不同的菌剂复配比例,E1为A1、A2、A7与A8复配(体积比为1∶ 1∶ 1∶ 1)、E2为A1、A2、A7与A8复配(体积比为2∶ 1∶ 1∶ 1)、E3为A1、A2、A7和A8复配(体积比为1∶ 2∶ 1∶ 1)、E4为A1、A2、A7和A8复配(体积比为1∶ 1∶ 2∶ 1)、E5为A1、A2、A7和A8(体积比为1∶ 1∶ 1∶ 2),设置对照组CK为不添加任何微生物菌剂。将样品置于45 ℃摇床中,转速为150 r/min。
发酵条件:装液量3 L/5 L,通气量1.5 vvm,接种量为5%,温度为45 ℃,转速为400 r/min,pH电极在线监控,并用10 mol/L的KOH维持pH为7.0,发酵时间为30 h。
菌剂制备:按A1、A2、A7与A8菌液的体积比为2∶ 1∶ 1∶ 1混合后加入40 g/L海藻糖、10 g/L脱脂奶粉、10 g/L甘油做保护剂,按照质量比3∶ 1加入麸皮与沸石粉的混合载体,烘箱45 ℃制备复合菌剂。菌泥湿质量为发酵液经4 750 r/min离心30 min后所得固体的质量,干质量为在105 ℃烘箱烘至恒质量的质量。半衰期为菌剂活菌数降为一半时的时间。
1.4 厨余垃圾降解应用实验
实验分为3组。实验组:添加3%驯化后经厨余垃圾浸出液培养的复合微生物菌剂。对照组1:添加3%未驯化的LB培养基培养的复合微生物菌剂。对照组2:添加3%的去离子水。实验发酵仓初始温度控制在45 ℃,48 h后考察厨余垃圾的质量损失率。
2 结果与讨论
2.1 耐高温降解菌分离筛选与鉴定
共筛选出18株耐高温的菌株,分别编号为A1~A18。
将初筛得到的18株菌株分别点接到淀粉、蛋白质、脂肪和纤维素的4种鉴别培养基上,通过观察各菌株的菌落直径(D0)和透明圈直径(D)的大小来初步判断各菌株对各有机物的降解能力,用D/D0表示,结果如表1所示。
由表1可知:每株菌株对淀粉、蛋白质、脂肪和纤维素的降解能力不同,综合考虑各菌株对淀粉、蛋白质、脂肪和纤维素有机物的降解能力,选择A1、A2、A7和A8酶活较强的4株菌作为候选菌株,对菌株进行鉴定。
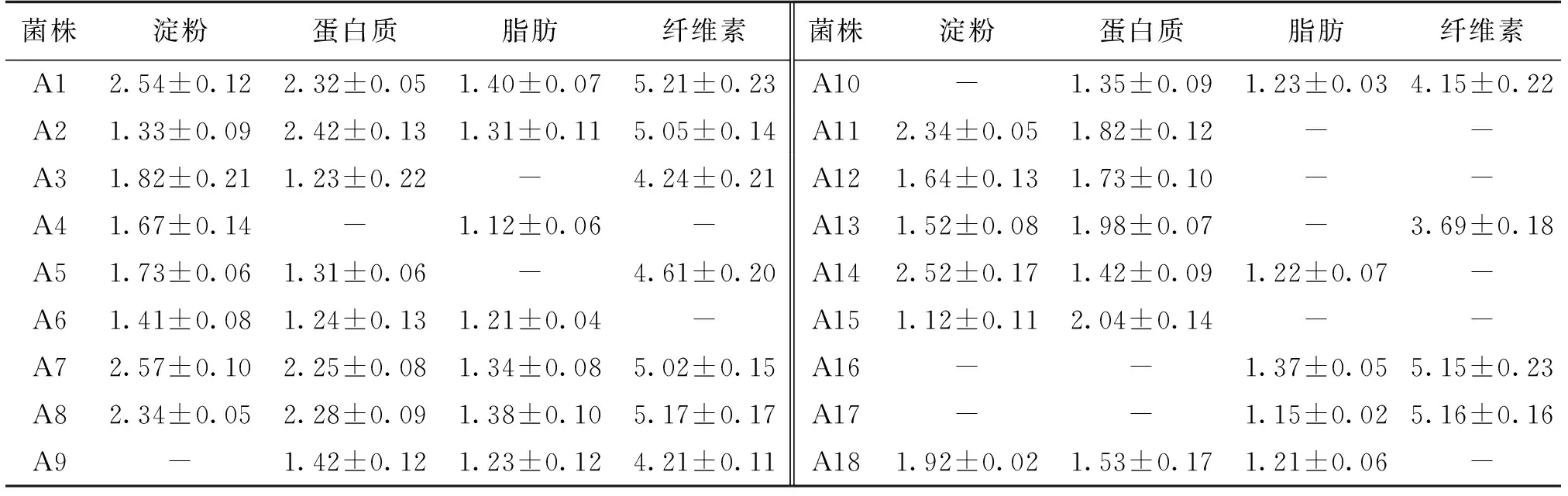
表1 各菌株对淀粉、蛋白质、脂肪、纤维素的降解能力
将筛选的4菌株在LB培养基上进行划线分离,于37 ℃培养箱中培养24 h,肉眼观察菌落形态、颜色、菌落边缘,再对菌株进行革兰氏染色,结果如图1所示。由图1可知:A1菌株为乳黄色不透明,微凸有褶皱,革兰氏染色为阳性;A2菌株为乳白色不透明,扁平无褶皱,革兰氏染色为阳性;A7菌株为乳黄色不透明,微凸有褶皱,革兰氏染色为阳性;A8菌株为乳黄色不透明,微凸有褶皱,革兰氏染色为阳性。
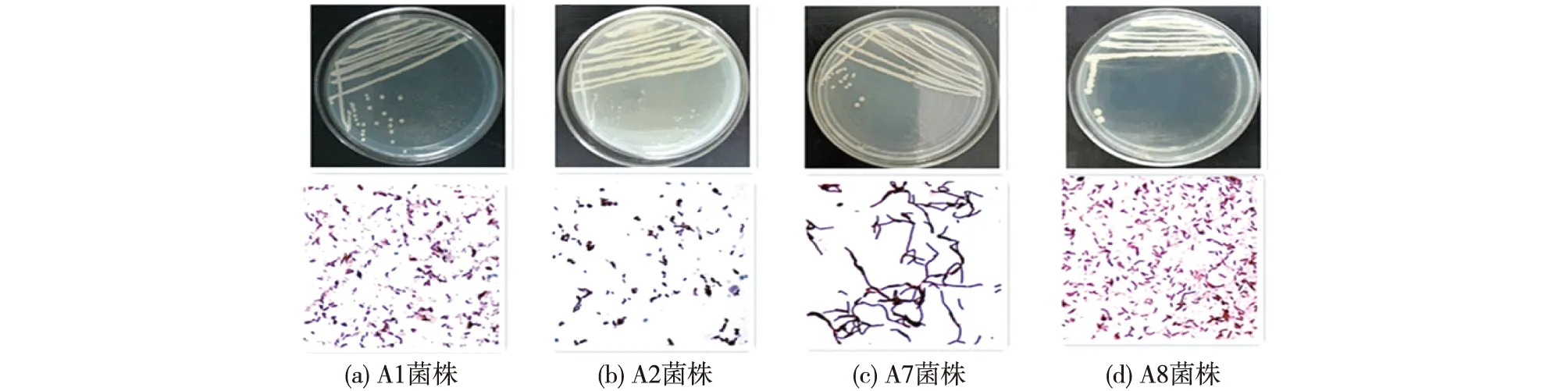
图1 菌株形态及革兰氏染色图Fig.1 Colony morphology and Gram staining of strains
测序比对后构建系统发育树如图2所示。由图2可确认:A1为枯草芽孢杆菌(Bacillussubtilis)、A2为短小芽孢杆菌(Bacilluspumilus)、A7为特基拉芽孢杆菌(Bacillustequilensis)、A8为嗜温鞘氨醇杆菌(Sphingobacteriumthalpophilum)。
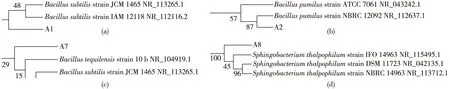
图2 筛选菌株系统发育进化树Fig.2 Phylogenetic tree of the strains
2.2 基于厨余垃圾培养基的菌株驯化及菌剂制备
2.2.1 驯化前后的活菌数对比
为考察驯化前后的菌株生长情况,将驯化前后的菌株分别接种于厨余垃圾浸出液培养基及LB培养基中,测定其活菌数,结果如图3所示。由图3可知:厨余垃圾浸出液中虽含有丰富的碳源和氮源,但成分多且复杂、营养物质不均衡,使得菌株生长情况不如细菌常用的LB培养基(图3(a))。通过厨余垃圾浸出液培养基的定向驯化,强化菌株对生长环境的适应性,在驯化过程中形成有利于自身生长繁殖的适应性机制。通过适应性驯化,培养24 h后的活菌数有了显著的提高,驯化后的菌株比LB培养基中的活菌数更高(图3(b)),A1、A2、A7和A8各菌株活菌数较驯化前分别提高了85.2%、94%、88.9%和44.9%。
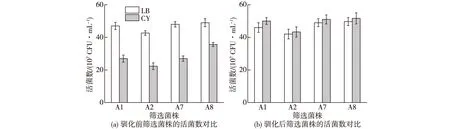
图3 筛选菌株驯化前后在LB培养基和厨余浸出液培养基(CY)中的活菌数对比Fig.3 Comparison of the number of viable bacteria in LB medium and CY medium before and after acclimation
2.2.2 驯化前后的菌株胞外酶活对比
蛋白质、淀粉、脂肪和纤维素等都属于大分子物质,微生物不能直接吸收利用,必须通过分泌到体外的胞外酶作用来水解这些大分子物质,进而转化为简单的氨基酸、葡萄糖等小分子物质,因此,菌株胞外酶活直接影响微生物的降解效能。考察驯化前后的菌株胞外酶活情况,结果如图4所示。
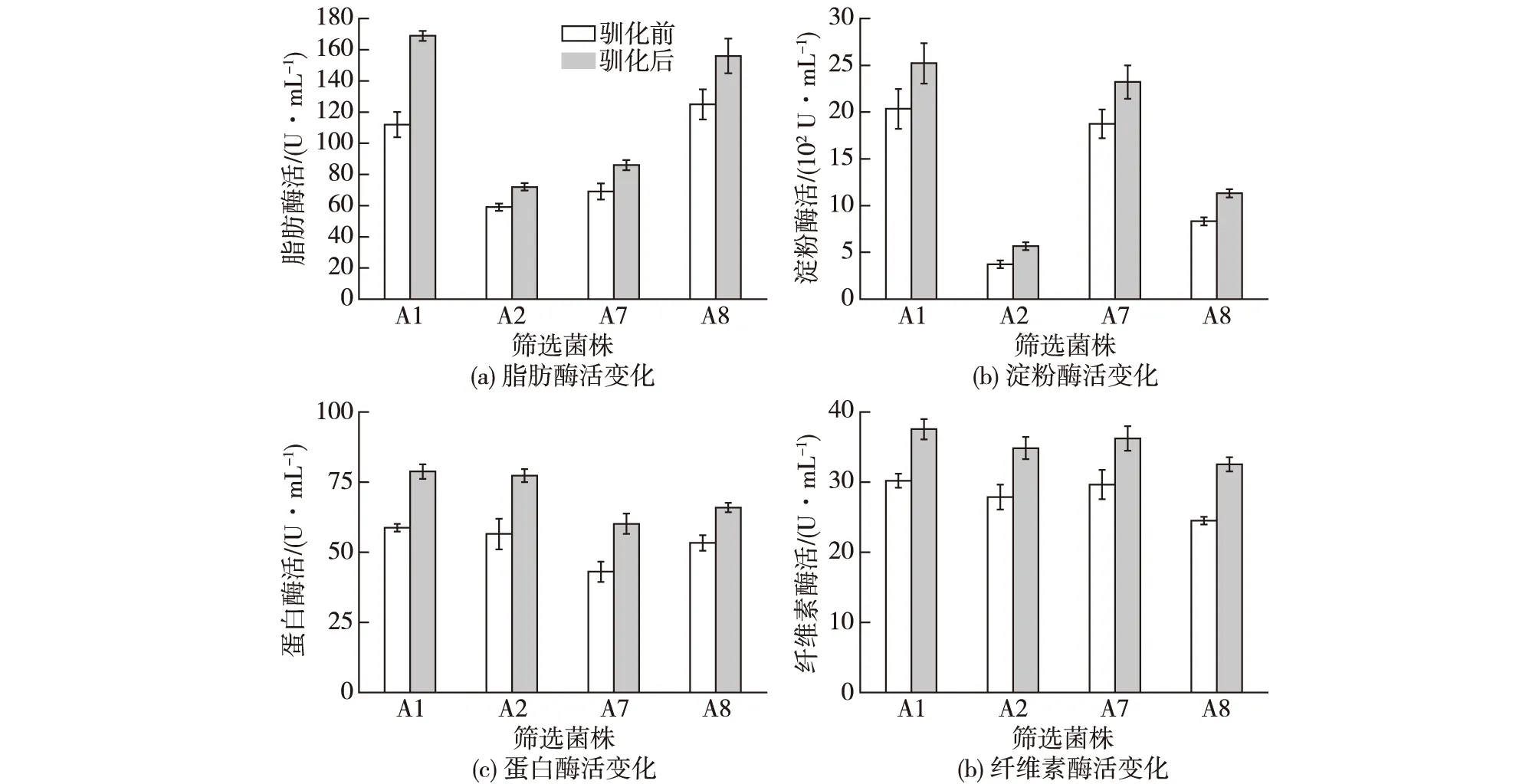
图4 筛选菌株驯化前后在厨余垃圾浸出液培养基中的酶活变化Fig.4 Changes of enzyme activity in food waste extract medium before and after acclimation
由图4可知:驯化前后的菌株在相同厨余垃圾浸出液培养基中培养后,驯化后菌株的酶活均高于驯化前,其中最显著的是A1菌株脂肪酶活提高了50.8%。洪骏等[21]发现油脂作为碳源对脂肪酶的产生具有一定的诱导作用。由此可见:厨余垃圾浸出液中所含有的淀粉、脂肪、蛋白和纤维素等物质,能够诱导相关酶基因的转录上调,提高酶的合成,加快厨余垃圾分解代谢。
2.2.3 复合微生物菌剂的制备
将筛选的4菌株按照不同比例投加到实验室小试的厨余垃圾样品中,48 h后的降解效果如图5所示。由图5可知:添加菌剂的处理效果明显高于不添加菌剂的CK组,表明添加微生物菌剂能明显提高厨余垃圾的降解效果;而复合菌剂的处理效果明显高于单菌的处理效果,表明筛选菌剂的复合在厨余垃圾处理有协同效果,且在E2时降解效果达到最佳为50.16%,即A1、A2、A7与A8菌的复合比例为2∶ 1∶ 1∶ 1,故后续的菌剂制备选用E2的复配比例。
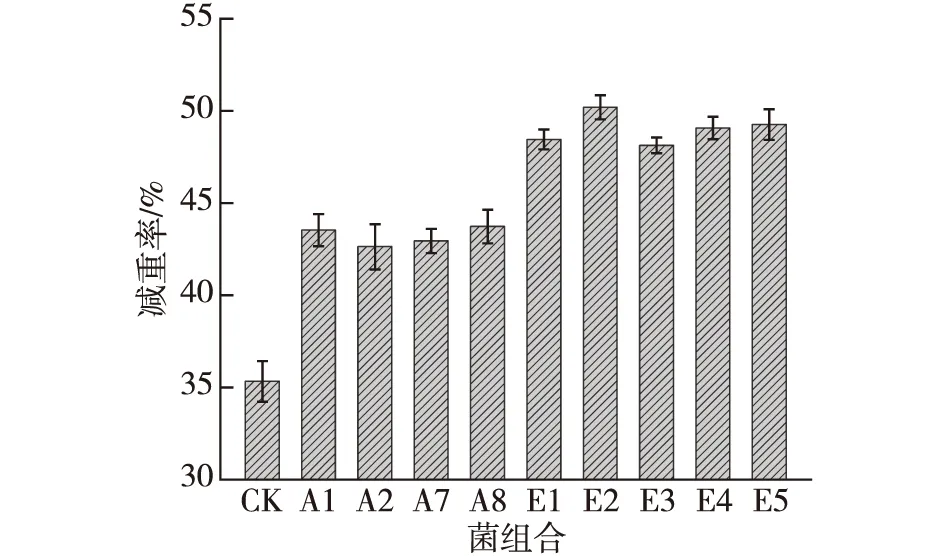
图5 微生物复配比例对厨余垃圾降解的影响Fig.5 Effects of microbial compound proportion on degradation capacity of food waste
利用厨余垃圾浸出液将驯化获得的菌株制备成复合微生物菌剂,菌剂制备结果如表2所示,并将所获得的菌剂进行应用。

表2 菌剂制备参数
2.3 厨余垃圾降解应用的应用
质量减少率是评价微生物降解过程的指标,表3列出了厨余垃圾降解前后的质量,由表3可知:加入微生物菌剂(实验组)能加快厨余垃圾中有机质的降解速率,在48 h后厨余垃圾的质量减少率达到最大值73.8%,与加入未驯化的微生物菌剂(对照组1)相比,质量减少率提高了近10%,与未加菌剂的对照组2相比,质量减少率提高了35.1%。本研究利用自制的高效微生物菌剂应用于厨余垃圾处理器,在48 h厨余垃圾的质量减少率达到最大值73.8%,高于徐锐[10]研究的微生物菌剂40%的降解效果,接近咸芳[11]的报道的72 h降解达到78.5%,但大大缩短了发酵周期,效果明显,非常适合应用于厨余垃圾的降解。

表3 厨余垃圾质量减少率
3 结论
从不同来源的垃圾样品中分离筛选出18株耐高温的菌株,通过45 ℃的温度筛选及平板透明圈法分析各菌株对淀粉、纤维素、蛋白和脂肪的降解能力,综合考虑各菌株的降解能力,选择A1、A2、A7、A8菌株;经过形态学及分子生物学鉴定,确认筛选的菌株A1、A2、A7、A8分别为枯草芽孢杆菌(Bacillussubtilis)、短小芽孢杆菌(Bacilluspumilus)、特基拉芽孢杆菌(Bacillustequilensis)、嗜温鞘氨醇杆菌(Sphingobacteriumthalpophilum),其中嗜温鞘氨醇杆菌对厨余垃圾有显著的降解效果未见报道。
经定向驯化,A1、A2、A7、A8在厨余垃圾浸出液培养基上生长及胞外酶活显著提高;制成菌剂后应用于厨余垃圾的降解质量减少,质量减少率达到73.8%,与对照组相比,质量减少率分别提高约10%和35.1%;利用厨余垃圾为原料制备的浸出液作为培养基驯化和菌剂制备的原料,不仅让废弃物资源得到了最大化利用,同时还提高了厨余垃圾处理效能,为厨余垃圾处理提供了一种思路。
