新鲜巨菌草对平菇胞外酶活性以及栽培料营养成分变化的影响
2020-04-17刘欣怡陈敏雷雅婷李晶王锦峰刘斌林占熺
刘欣怡 陈敏 雷雅婷 李晶 王锦峰 刘斌 林占熺

摘要:以新鲜巨菌草为栽培料,与巨菌草干草及木屑进行对比,制作平菇栽培种,测定平菇生长发育过程中几种胞外酶活性及栽培料营养成分含量的变化。结果显示:新鲜巨菌草与巨菌草干草为栽培料的平菇的羧甲基纤维素酶、半纤维素酶、滤纸酶、多酚氧化酶活力变化趋势基本相同,均随生育期延长逐渐降低,漆酶活性变化趋势为先升高后降低;木屑为栽培料的平菇,半纤维素酶、多酚氧化酶和漆酶活力随生育期延长先升高后下降,羧甲基纤维素酶活力逐渐降低,滤纸酶活力几乎无变化。新鲜巨菌草的多酚氧化酶活力较其他2种栽培料高。以巨菌草鲜草为栽培料时,平菇接种后的纤维素、半纤维素、木质素含量在不同生长时期均在下降;以巨菌草干草为栽培料时,平菇接种后干草的半纤维素含量在不同生长时期均在下降,纤维素、木质素的含量在菌糟时期有所上升;以木屑为栽培料时,平菇接种后到菌丝体满袋时期,纤维素、半纤维素、木质素含量上升,之后开始下降,木质素含量以较快速率下降。所有栽培料蛋白质含量的变化趋势均为先下降后上升,且菌糟时期的蛋白质含量都要比未接种时要高。研究表明,新鲜巨菌草对平菇的胞外酶活性及栽培料的营养成分有影响,且巨菌草栽培料在菌糟时期大大增加栽培料中的蛋白质含量,可以尝试将栽培后的菌糟当成饲料再次利用。
关键词:巨菌草;平菇;栽培料;胞外酶;营养成分
中图分类号: S646.1+40.4
文献标志码: A
文章编号:1002-1302(2020)02-0159-05
收稿日期:2018-12-12
作者简介:刘欣怡(1992—),女,安徽合肥人,硕士研究生,主要从事食(药)用菌方向相关研究。E-mail:523236125@qq.com。
通信作者:林占熺,研究员,主要从事菌草及食(药)用菌方向相关研究。Tel:(0591)83789223;E-mail:lzxjuncao@163.com。
平菇(Pleurotus ostreatus)在自然界中归属于侧耳属(Pleurotus),栽培广泛、产量巨大,在我国每个地方基本都有种植。作为人们最为喜爱的菌类之一,平菇肉质鲜美、营养丰富,是世界上种植面积最为广泛的食用菌之一。平菇在食用菌业中占比七成,是食用菌中最主要的组成成分。然而平菇栽培料的种类不多,其价格容易受到栽培料价格波动的影响,本研究采用一种新的培养料,为平菇的栽培配方提供了一个新的思路。
菌草栽培平菇已有一些相关研究[1],人们对平菇的产量及品质也越来越关注。近年来,有关平菇的胞外酶活性及栽培料营养成分影响也有报道,也有一些菌草栽培食用菌的报道[2],但关于新鲜巨菌草栽培平菇的报道则很少。常规菌草须要晒干后才能使用,新鲜巨菌草不须晾晒,即采即用,极大地节省了栽培料的准备时间,且减少了拌料时的加水量。本研究通过探究平菇生长过程中的胞外酶活性及栽培料营养成分的变化,探究新鲜巨菌草对平菇生长的影响,为新鲜巨菌草栽培食用菌提供了思路和研究方法。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株 本试验所用平菇菌株969,由国家菌草工程技术研究中心提供。
1.1.2 栽培料的原料 本试验所用的木屑、麦麸、石膏均由当地市场购买。巨菌草(Pennisetum giganteum Z.Z. Lin)鲜草由国家菌草工程技术研究中心提供,经研究所提供的鲜草粉碎机粉碎后使用。巨菌草干草由鲜草粉日晒至完全干燥而成,再经由研究所提供的干草粉碎机粉碎后使用。
1.1.3 培养基的配制 PDA固体培养基:去皮马铃薯200 g,沸水煮20 min,8层纱布过滤,加入葡萄糖20 g,琼脂20 g,定容至1 000 mL,pH值6.5~7.0。
PDA液体培养基:去皮马铃薯200 g,沸水煮 20 min,8层纱布过滤,加入葡萄糖20 g,琼脂20 g,酵母提取液2 g,KH2PO4 1 g,MgSO4·7H2O 0.5 g,溶解定容至1 000 mL,pH值6.5~7.0。
1.2 试验方法
1.2.1 栽培平菇 母种的培养:用“1.1.2”节中的方法配制好PDA固体培养基,分装到20 cm×20 cm的试管中,进行试管的斜面培养。待菌丝长满,放入4 ℃冰箱中待用。
液体菌种的培养:用“1.1.2”节中的方法配制好PDA液体培养基,分装到250 mL的锥形瓶中,每个锥形瓶装入 100 mL 液体培养基。放入高压灭菌锅中灭菌,用接种铲切下3块大小适中的布满浓白菌丝的琼脂块,放入锥形瓶中。在摇床中培养,温度设置为25 ℃,转速为150 r/min,培养7 d。
栽培料的配制:栽培料制作方法如表1所示。挑选生长适中的巨菌草鲜草以及干燥的、没有产生霉变的、健康的麸皮,按栽培料配方要求的量均匀堆洒,用2%石灰拌料,一边加水一边搅拌,使各种栽培料原料能够充分混匀,随即五指握紧搅拌料,可在指缝中看到水滴却不落下时即可停止继续加水。
栽培料装袋:将搅拌好的栽培料装入44 cm×22 cm×0.04 cm 的聚乙烯筒袋内,每袋装入360 g栽培料,相同栽培料设置12个重复。装袋完成后将聚乙烯袋擦拭干净,袋口扎紧,为下一步灭菌做准备。
灭菌:将准备好的菌袋和接种工具放置在高压灭菌锅中灭菌120 min,灭菌温度设置为121 ℃。灭菌结束后,待气压下降将菌袋取出。
接种:在超净工作台中接种,菌袋放入前先将超净工作台中的紫外灯打开20 min,之后将灭好菌的菌袋和接种工具放入,继续在紫外光灯下灭菌 20 min。接种前用85%乙醇消毒双手,在乙醇灯下进行接种工作。使用液体菌种接种,每袋接种量15 mL。
菌丝生长:将接种后的菌袋放在国家菌草工程技术研究中心的恒温培养室內培养,温度控制在 25 ℃ 左右,其间保持房间干净和通风。培养1个月左右后,菌丝基本可长满菌袋。
出菇:将长满菌丝的袋口割开,此时要保持室内的空气相对湿度为90%~95%,室内温度保持在15~20 ℃,注意通风。
采收:在平菇菌盖的边缘稍微有内卷时即可采摘,不要等菇伞完全张开。
1.2.2 对平菇生长过程中胞外酶活性的测定 使用苏州科铭生物技术有限公司提供的羧甲基纤维素酶试剂盒、滤纸酶试剂盒、纤维素酶试剂盒、半纤维素酶试剂盒、多酚氧化酶试剂盒、漆酶试剂盒测定。分别在平菇菌丝体满袋期、幼菇期、子实体成熟期提取不同胞外酶的粗酶液,在国家菌草工程技术研究中心测定酶活力。羧甲基纤维素酶活力单位定义:1 g组织1 min催化产生1 μg葡萄糖定义为1个酶活力单位。半纤维素酶活力单位定义:在50 ℃、pH值4.8条件下,1 g样品1 min分解木聚糖产生1 nmol还原糖所需要的酶量为1个酶活力单位。滤纸酶活力单位定义:在50 ℃、pH值4.6条件下,1 g组织1 min分解滤纸产生1 mg葡糖糖所需的酶量为1个酶活力单位。多酚氧化酶活力单位定义:1 g组织在1 mL反应体系中1 min使525 nm处吸光度变化0.005为1个酶活力单位。漆酶活力单位定义:1 g样品1 min氧化1 nmol底物2,2-联氮-二(3-乙基-苯并噻 唑-6-磺酸)二铵盐(ABTS)所需的酶量为1个酶活力单位。
1.2.3 对平菇生长过程中栽培料营养成分含量的测定 使用苏州科铭生物技术有限公司提供的纤维素含量测试盒、木质素含量测试盒、半纤维素含量测试盒、BCA蛋白含量测试盒测定。分别于平菇未接种、菌丝体满袋期、菌糟期在国家菌草工程技术研究中心实验室测定栽培料的营养成分。
2 结果与分析
2.1 平菇生长过程中不同栽培料对平菇胞外酶活性的影响
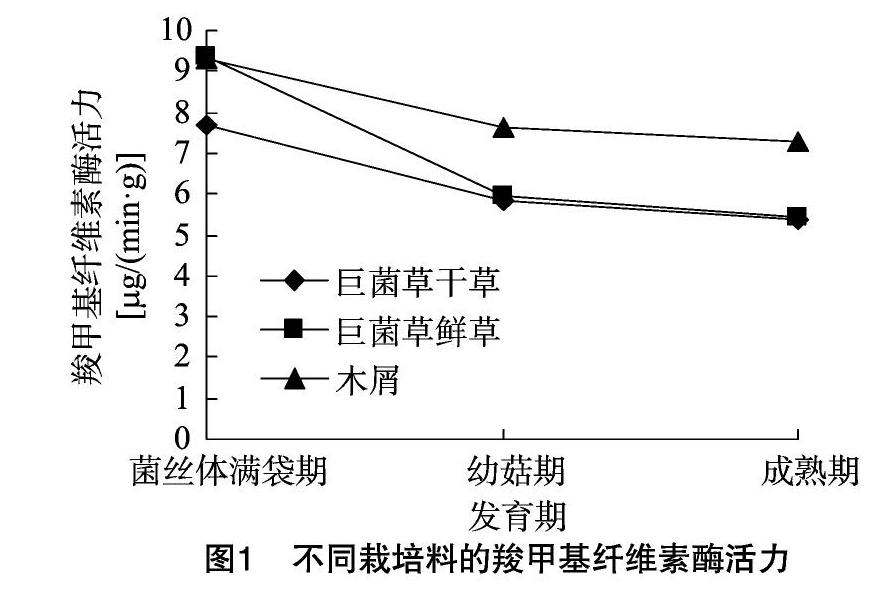
2.1.1 羧甲基纤维素酶活力的变化 如图1所示,菌丝体满袋期,巨菌草鲜草为栽培料的平菇羧甲基纤维素酶活力最高;幼菇期、子实体成熟期,均是木屑为栽培料的活力最高。在平菇生长过程中,不同栽培料的羧甲基纤维素酶活力的变化趋势基本相同,平菇菌丝体满袋期的酶活力最旺盛,之后开始下降;菌丝体满袋后到幼菇形成时期酶活力下降的比较快,其中巨菌草鲜草为栽培料的平菇酶活力下降最快;幼菇形成后到子实体成熟这段时期虽有所下降,但下降速度变慢。
2.1.2 半纤维素酶的活力变化 如图2所示,菌丝体满袋期,巨菌草干草为栽培料的平菇半纤维素酶活力最高;幼菇期、子实体成熟期,均是木屑为栽培料的活力最高。以巨菌草为栽培料的平菇半纤维素酶活力趋势基本一致;以木屑为栽培料的活力先升高后下降;幼菇形成后到子实体成熟阶段,不同栽培料的酶活力皆有所下降,趋势相似。
2.1.3 滤纸酶的变化 如图3所示,菌丝体满袋期,以巨菌草干草为栽培料的平菇滤纸酶活力最高;幼菇期、子实体成熟期均以巨菌草鲜草为栽培料的酶活力最高。幼菇期,以巨菌草为栽培料的平菇滤纸酶活力的趋势基本一致,在菌丝体满袋后开始下降,其中巨菌草干草的滤纸酶活力迅速下降;幼菇形成后到子实体成熟期,不同栽培料的平菇半
纤维素酶活力几乎无变化。
2.1.4 多酚氧化酶的变化 如图4所示,在菌丝体满袋期、幼菇期、子实体成熟期均以巨菌草鲜草为栽培料的平菇多酚氧化酶活力最高。以巨菌草为栽培料的平菇多酚氧化酶活力的变化趋势基本一致;以木屑为栽培料的平菇在菌丝体满袋到幼菇形成时期,多酚氧化酶的活力有所上升,在幼菇形成后到成熟期,多酚氧化酶的活力稍有下降。
2.1.5 漆酶的变化 如图5所示,菌丝体满袋期,以巨菌草干草为栽培料的平菇漆酶活力最高;在幼菇期、子实体成熟期均以巨菌草鲜草为栽培料的活力最高。不同栽培料的平菇漆酶活力变化趋势基本一致,均为先升高后降低。
2.2 平菇生长过程中不同栽培料营养成分含量的变化
2.2.1 纤维素含量的变化 如图6所示,在未接种时,巨菌草鲜草为栽培料配方的纤维素含量最高;在菌丝体满袋期、菌糟期均以木屑为栽培料的含量最高。以巨菌草为栽培料配方的纤维素含量变化趋势基本一致,纤维素含量都是先以较快速率下降后变化缓慢,以巨菌草鲜草纤维素含量微微下降,巨菌草干草纤维素含量微微上升;以木屑为栽培料配方的纤维素含量先上升后下降,但最后纤维素含量还是比未接种时有所升高。
2.2.2 半纤维素含量的变化 如图7所示,在未接种时,巨菌草干草为栽培料配方的半纤维素含量最高;在菌絲体满袋期,以木屑为栽培料的含量最高;菌糟期,以巨菌草鲜草为栽培料的含量最高。未接种到菌丝体满袋时,不同栽培料的半纤维素含量变化趋势基本一致(巨菌草的半纤维素含量变化趋势基本一致,木屑的半纤维含量先微微上升再下降),菌丝体满袋后半纤维素含量一直下降,巨菌草鲜草的半纤维素含量下降速率较缓。
2.2.3 木质素含量的变化 如图8所示,未接种时和菌糟时期,均以巨菌草干草为栽培料配方的木质素含量最高;菌丝体满袋时,以木屑为栽培料的含量最高。不同栽培料的木质素含量变化趋势不一致,巨菌草鲜草的木质素含量在未接种时最低,且一直呈下降趋势;巨菌草干草的木质素含量在未接种到菌丝体满袋期呈下降趋势,菌丝体满袋后到菌糟期,木质素含量有所上升;木屑的木质素含量在未接种到菌丝体满袋期有所上升,菌丝体满袋后到菌糟期以较快速率下降。
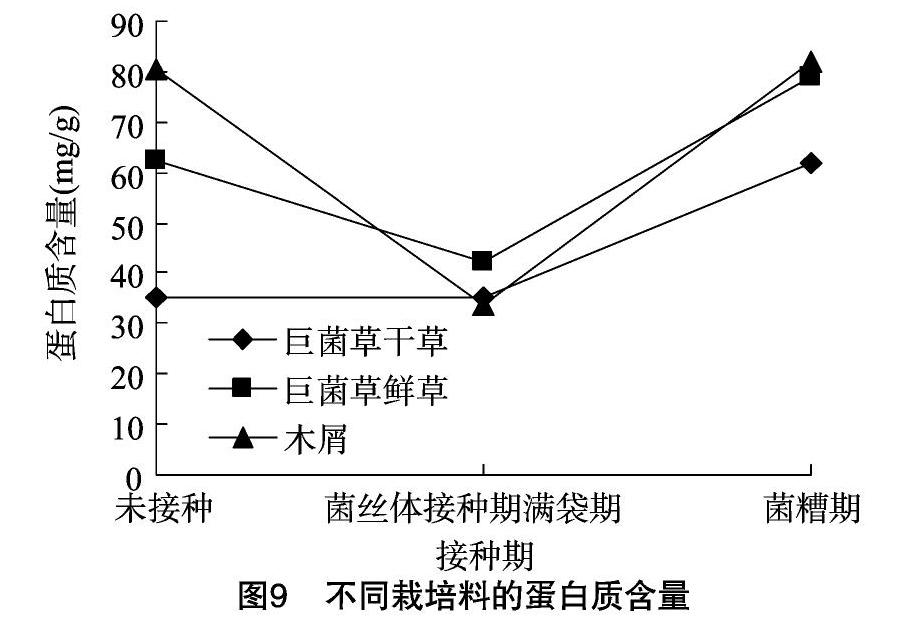
2.2.4 蛋白质含量的变化 如图9所示,未接种时,以木屑为栽培料配方的蛋白质含量最高;菌丝体满袋期,以巨菌草鲜草为栽培料的含量最高;在菌糟期,以木屑为栽培料的含量最高。不同栽培料的蛋白质含量变化基本一致,均在未接种到菌丝体满袋期时下降,以木屑为栽培料下降速度最快;在菌丝体满袋到菌糟期含量上升,上升速率均较快。
3 讨论与结论
3.1 平菇生长过程中胞外酶活性的变化
木质素酶系和纤维素酶系是研究食用菌胞外酶活力的主要两大酶系。本试验所研究的羧甲基纤维素酶、滤纸酶皆属于纤维素酶系,多酚氧化酶和漆酶属于木质素酶系。结果表明,新鲜巨菌草会对平菇子实体生长过程中的胞外酶活力产生影响。不同栽培料平菇的生长过程中,羧甲基纤维素酶活力变化趋势基本相同,但酶活力大小有所不同;以巨菌草为栽培料的平菇半纤维素酶活力的变化趋势基本一致,以木屑为栽培料的平菇半纤维素酶活力在菌丝体满袋期时最低,再升高,之后下降,这可能是因为木屑中的半纤维素含量较少,所以木屑不会优先分解半纤维素;在菌丝体满袋期,以巨菌草干草为栽培料的平菇滤纸酶有较高活力,以巨菌草鲜草和木屑为栽培料的平菇滤纸酶活力都很低,而且几乎没有什么变化;以巨菌草为栽培料的平菇多酚氧化酶活力的变化趋势基本一致,以木屑为栽培料的平菇在菌丝体满袋到幼菇形成时期,多酚氧化酶的活力有所上升,幼菇形成后到成熟期,多酚氧化酶的活力稍有下降,由此可推断,幼菇生长阶段巨菌草和木屑所利用的营养成分可能不同,导致多酚氧化酶变化趋势不同;不同栽培料的平菇漆酶活力变化趋势基本一致,菌丝满袋到幼菇形成时期不同栽培料的漆酶活力都以较快的速度上升,到幼菇期达到顶峰,从幼菇形成到子实体成熟时期,不同栽培料的漆酶活力均有所下降,由此可推断,漆酶在平菇幼菇生长到子实体成熟阶段起促进作用[3-12]。
3.2 平菇生长过程中栽培料营养成分含量的变化
本试验测定了平菇生长过程中不同栽培料的木质素、纤维素、半纤维素、蛋白质含量的变化。可能由于巨菌草干草与鲜草栽培料皆为粉末,故取样时粉末对应的位置也许不同,故鲜草纤维素含量比干草稍高。结果表明,未接种时,巨菌草鲜草的纤维素含量最高,巨菌草干草的木质素含量较鲜草高,巨菌草鲜草与干草的半纤维素含量差别不大,由此推断,巨菌草在经过暴晒后,可能经过了一些物理和化学变化,使木质素含量上升,纤维素含量降低。菌丝体满袋期时,巨菌草的纤维素、半纤维素、木质素、蛋白质含量皆有所下降。由酶活力数据可知,此时巨菌草纤维素酶(羧甲基纤维素酶、半纤维素酶、滤纸酶)和木质素酶(多酚氧化酶、漆酶)的活力都较高,推测平菇在菌丝体生长阶段有利用巨菌草中的木质素、纤维素和半纤维素。木屑的纤维素、半纤维素、木质素的含量在此时期均有所上升,由酶活力结果可知,此时期几乎所有酶的活力均较低,推断可能是因为以木屑为栽培料的配方先分解了别的物质[13]。
蛋白质富含能量。由本研究结果可知,在未接种到菌丝体满袋期时所有栽培料的蛋白质含量均呈下降趋势,且木屑配方的蛋白质含量下降速率最快,推断可能以木屑为栽培料的平菇菌丝体先分解蛋白质,在之后的阶段再开始利用其他营养成分。巨菌草在变为菌糟时蛋白质含量较未接种时有所上升,此时的巨菌草菌糟可以尝试作为饲料使用,具有很好的循环利用性。这一点也与宋瑞清等的报道[14]相符合。
3.3 结论
本研究通过试验探究新鲜巨菌草对栽培平菇的影响,初步探索了新鲜巨菌草对平菇生长过程中胞外酶活力及栽培料营养成分含量的变化,确定新鲜巨菌草作为平菇栽培料的可行性,并为巨菌草菌糟作为饲料的可行性作出了初步探索,为之后的基础研究提供了理论依据。
参考文献:
[1]马晓龙,汪志红,杨绍丽,等. 巨菌草栽培平菇配方筛选试验[J]. 食用菌,2016,38(2):42-43.
[2]薛志香,曾 峰,曹秀明,等. 鲜菌草与干菌草栽培的香菇品质比较[J]. 福建农林大学学报(自然科学版),2017,46(6):697-701.
[3]刘尚旭,赖 寒. 木质素降解酶的分子生物学研究进展[J]. 重庆教育学院学报,2001,14(3):64-67.
[4]赵 曦,黄 艺,杨 青,等. 木质素降解酶研究进展与外生菌根真菌[J]. 环境科学与技术,2008,31(1):45-50.
[5]胡雪竹. 木质素降解酶的研究进展[J]. 安徽农业科学,2011,39(11):6326-6328,6363.
[6]戴四发,金光明,王立克,等. 纖维素酶研究现状及其在畜牧业中的应用[J]. 安徽技术师范学院学报,2001,15(3):32-38.
[7]郭 昌,林金秀,林小锹,等. 无机盐对纤维素降解真菌产内切 β-D-1,4-葡聚糖酶的影响[J]. 中国农学通报,2009,25(8):27-33.
[8]林祥木. 产纤维素酶菌株的诱变选育及其产酶条件的研究[D]. 福州:福建农林大学,2004.
[9]张晓勇,高向阳,陈秀霞,等. 纤维素酶半纤维素酶的应用及分子相关性[J]. 纤维素科学与技术,2006,14(1):47-51.
[10]王孟兰,赵 妍,陈明杰,等. 食用菌半纤维素酶系研究进展[J]. 生物学杂志,2014,31(1):64-67.
[11]魏川子,王兆斌,李燕蒙,等. 半纤维素酶在畜禽饲料中的应用及研究进展[J]. 畜牧与饲料科学,2015,36(12):44-46.
[12]高雅君,丁长河. 木聚糖酶在食品工业中的应用研究进展[J]. 粮食与食品工业,2017,24(2):32-36.
[13]郭新红,喻达时,王 婕,等. 6种植物中木质纤维素含量的比较研究[J]. 湖南大学学报(自然科学版),2008,35(9):76-78.
[14]宋瑞清,杨 谦,邓 勋. 平菇菌株对稻草生物降解的能力[J]. 东北林业大学学报,2004,32(1):81-83.刘 梅,原居林,倪 蒙,等. 基于系统动力学模型的淡水渔业捕捞时间和喂养策略的优化分析[J]. 江苏农业科学,2020,48(2):164-170.
