碳青霉烯酶抑制剂增强试验检测肠杆菌目细菌碳青霉烯酶表型的临床应用
2023-01-14黄新明
王 璐,黄新明,章 杰,彭 成
碳青霉烯类抗菌药物通常用来治疗多重耐药肠杆菌目细菌(如产超广谱β内酰胺酶、AmpC酶等)造成的感染。但随着该类药物的广泛应用,耐碳青霉烯肠杆菌目细菌逐渐增多。肠杆菌目细菌对碳青霉烯类药物耐药的主要原因是产生水解碳青霉烯类药物的酶[1],从而导致药物失活。这些酶中最常见是Ambler分类中的A类酶(以KPC为主)和B类酶(又称金属酶,如NDM、IMP等)[2]。 这两类酶不仅能够水解碳青霉烯类药物,引起治疗失败,同时还能够编码在转座子和/或整合子上传播给其他肠杆目细菌,引起流行爆发。因此,临床实验室迫切需要采取便捷、准确的试验方法以了解肠杆菌目细菌对碳青霉烯类药物耐药机制,从而及时采取相应防治措施。本研究以 PCR 方法检测耐药基因结果为金标准,评估A类酶抑制剂及B类酶抑制剂用于碳青霉烯酶型别检测的应用价值。现作报道。
1 资料与方法
1.1 菌株来源 收集六安市人民医院2020-2021年临床送检标本中,经VITEK 2 Copmact仪鉴定为肠杆菌目并且初步判断为耐碳青霉烯类肠杆菌目细菌(carbapenem-resistantEnterobacteriaceae,CRE)的共227株菌株。剔除同一病人重复分离菌株。其中肺炎克雷伯菌179株,大肠埃希菌20株,阴沟肠杆菌14株,弗氏枸橼酸杆菌4株,黏质沙雷菌3株,植生拉乌尔菌2株,产气肠杆菌2株,布氏枸橼酸杆菌、产酸克雷伯菌及潘氏变形杆菌各1株。仪器鉴定质控菌株为霍氏肠杆菌ACTT 700323,药敏质控菌株为大肠埃希菌ATCC 25922,KPC阳性菌株为经DNA测序验证菌株[3],NDM、IMP、OXA-48阳性对照及非产碳青霉烯酶阴性对照肺炎克雷伯菌ATCC BAA-1706系浙江大学医学院附属第一医院传染病诊治国家重点实验室惠赠。
1.2 仪器与试剂 VITEK 2 Compact全自动细菌鉴定药敏仪和革兰阴性菌鉴定药敏卡(GN和GN334)均购自法国梅里埃公司,PCR仪、电泳仪及凝胶成像系统购自美国BIO-RAD公司,PCR试剂购自日本Takara公司,引物交由生工生物工程有限公司合成。厄他培南、亚胺培南及美罗培南药物纸片(10 μg)均购自英国OXOID公司。BP平板、MAC平板及MH平板购自上海科玛嘉公司。乙二胺四乙酸盐(EDTA)溶液购自上海生工公司,硼酸(PBA)购自美国Sigma公司。
1.3 方法
1.3.1 菌株鉴定与药敏复核试验 采用VITEK 2 Copmact全自动细菌鉴定药敏仪与配套鉴定药敏卡(GN和GN334)进行鉴定,采用纸片扩散法对厄他培南、亚胺培南及美罗培南药敏结果进行复核。根据美国临床实验室标准化研究所标准操作规程(CLSI-M100-30)进行试验操作及折点判断。
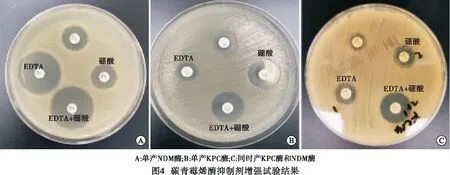
1.3.2 碳青霉烯酶抑制剂增强试验A类和B类碳青霉烯酶 依据CLSI文件中纸片扩散法进行试验。将血平板上过夜培养的菌落制备成0.5麦氏浊度菌悬液,均匀涂布于MH平板上,之后贴4片亚胺培南纸片。一片滴加EDTA溶液10 μL,一片纸片滴加PBA溶液10 μL,第3片同时滴加EDTA溶液和PBA溶液各10 μL,第4片不加任何溶液。35 ℃过夜孵育后量取纸片的抑菌圈直径。结果判读:(1)滴加EDTA溶液的亚胺培南纸片与单药纸片相比抑菌圈直径之差≥5 mm,即该菌株产B类酶;(2)滴加PBA溶液的亚胺培南纸片与单药纸片相比抑菌圈直径之差≥5 mm ,即判断为该菌株产A类酶;(3)如滴加EDTA或PBA的亚胺培南纸片与单药纸片相比抑菌圈直径相差均<5 mm,则判断该菌株不产A类或B类酶;(4)如同时滴加EDTA和PBA的亚胺培南纸片与单药纸片相比抑菌圈直径相差≥5 mm,则判断同时产A类和B类酶。
1.3.3 PCR试验检测碳青霉烯酶基因 采用煮沸法提取待测菌株的基因组DNA作为模板。扩增基因包括:KPC、NDM、IMP、VIM及OXA-48。引物合成及扩增条件参照文献[4]进行(见表1)。部分阳性扩增产物交由上海生工生物工程股份有限公司进行DNA双向测序,测序结果采用NCBI 数据库进行BLAST比对。
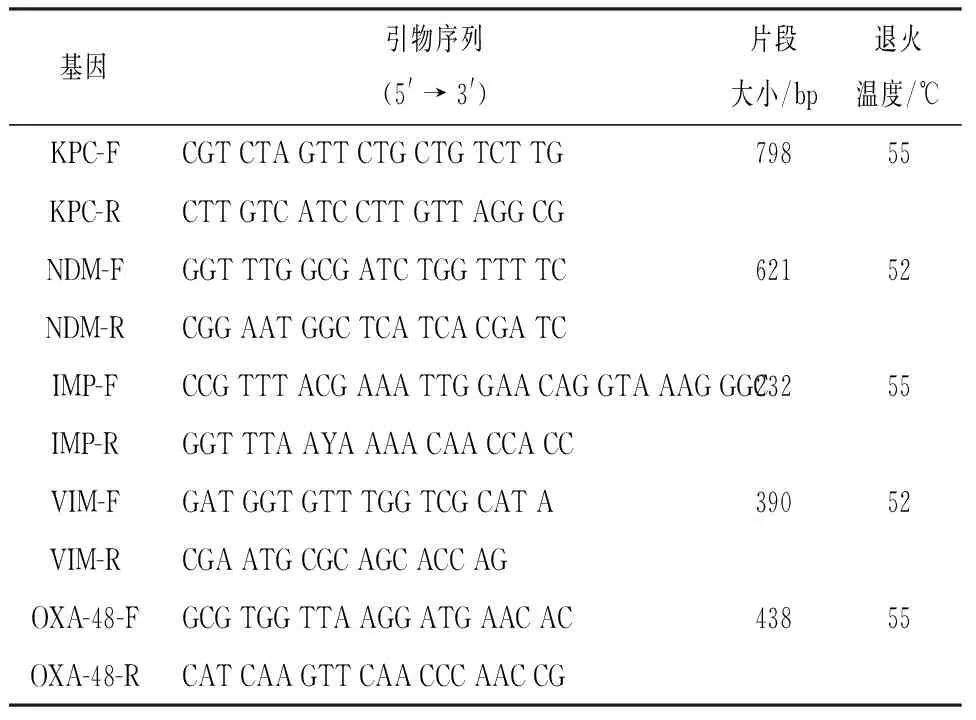
表1 碳青酶烯酶基因引物序列
1.4 统计学方法 以 PCR结果为金标准,计算碳青霉烯酶抑制剂增强试验检测A类酶和B类酶的灵敏度、特异度、阳性预测值和阴性预测值,分别与基因检测结果进行一致性检验,计算Kappa值:Kappa 值>0.75,说明两种方法诊断结果一致性较好;Kappa 值在0.40~0.75,说明一致性一般;Kappa值<0.40,说明一致性较差。检验水准α=0.05。
2 结果
2.1 CRE菌株标本及科室 分布 227株CRE菌株中,标本来源分别为:痰液157株(69.2%),尿液34株(15.0%),血液13株(5.7%),脓液9株(4.0%),腹水、导管及穿刺液各3株(1.3%),支气管肺泡灌洗液、直肠拭子各2株(0.9%),胸水1株(0.4%)。菌株来源科室分布:重症监护室88株(38.8%),神经外科28株(12.3%),呼吸内科18株(7.9%),急诊科15株(6.6%),普外科11株(4.8%),肾脏内科10株(4.4%),其余科室57株(25.2%)。
2.2 菌株药敏试验结果 CRE对替加环素耐药率低,为5.3%,对阿米卡星、复方新诺明耐药率分别为31.7%、52.4%。对其他抗菌药物耐药率均>80%(见表2)。
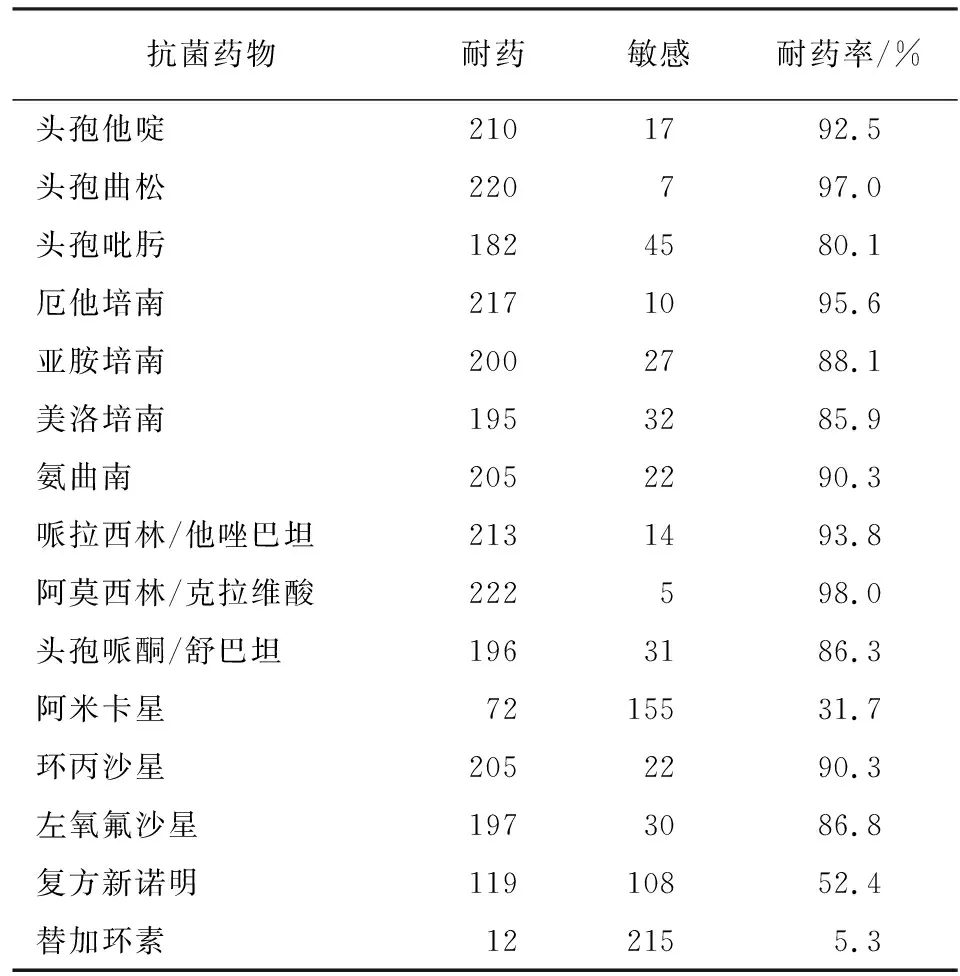
表2 CRE对常用抗菌药物的耐药率(n=227)
2.3 227株CRE碳青霉烯酶基因检测 经 PCR 扩增、测序后比对,产KPC 164株,产NDM 51株,产IMP 2株,产OXA-48 1株,同时产KPC和NDM 1株。8 株未检出常见碳青霉烯酶基因。部分电泳结果见图1~3。
2.4 碳青霉烯酶抑制剂增强试验 单产A类酶菌株有167株,单产B类酶菌株有53株,1株同时产A类酶和B类酶。5株肺炎克雷伯菌和1株产气肠杆菌未检出,5株阴性肺炎克雷伯菌中,PCR结果显示有4株未检测到常见耐药基因,1株产OXA-48酶;1株产气肠杆菌未检测出常见耐药基因(见图4)。碳青霉烯酶抑制剂增强试验对于单独产 KPC 碳青霉烯酶的检测,灵敏度为100.0%(164/164),特异度为 95.2%(60/63),阳性预测值为 98.2%(164/167),阴性预测值为100.0%(60/60),Kappa 值为 0.967(P<0.01),两种检测方法之间一致性高。对于单独产 B 类碳青霉烯酶的检测,灵敏度和特异度均为 100.0%,阳性预测值、阴性预测值均为 100.0%,Kappa 值为 1.000(P<0.01),两种检测方法之间一致性高(见表3~5)。
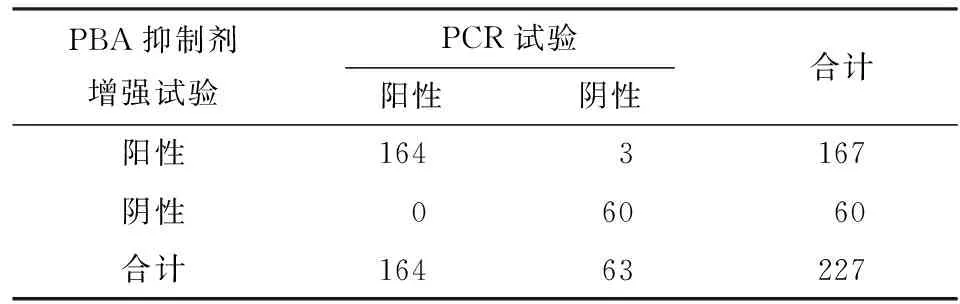
表3 两种方法检测单产A类碳青霉烯酶菌株结果比较(株)
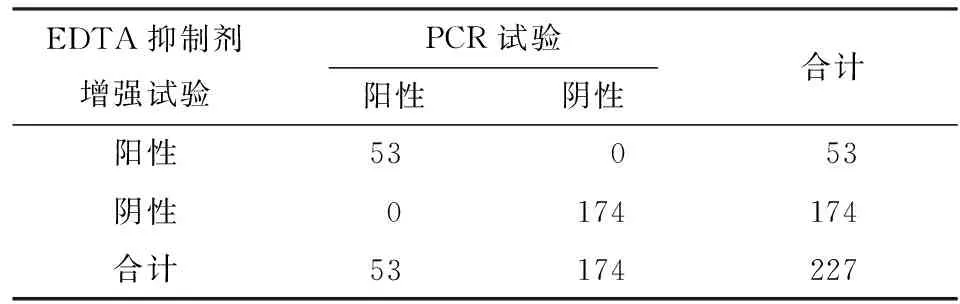
表4 两种方法检测单产B类碳青霉烯酶菌株结果比较(株)
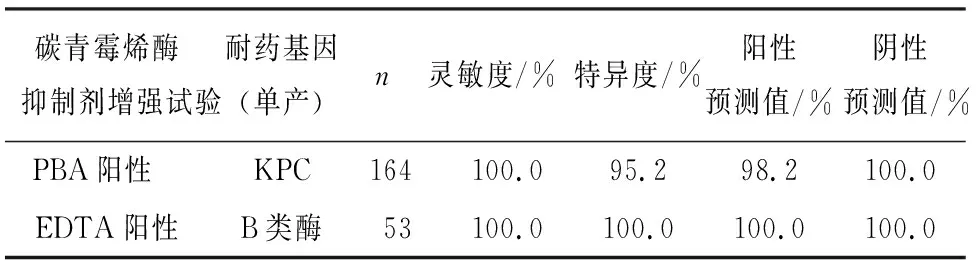
表5 碳青霉烯酶抑制剂增强试验检测碳青霉烯酶性能评价
3 讨论
我国临床分离的肠杆菌目细菌以产KPC和NDM为主[5-6],肠杆菌目细菌产KPC和NDM是导致临床采用β-内酰胺类药物治疗失败的主要原因之一。一直以来,KPC酶和B类酶在全球各国独立传播流行,但有报道[2]称发现同时携带KPC酶和B类酶的肺炎克雷伯菌株[2],二者同时存在可增强菌株对碳青霉烯类抗菌药物的水解活性,扩大菌株耐药谱范围,还可能共同在医院或社区中传播。同时,治疗CRE感染的新型抗菌药物对不同碳青霉烯酶型菌株的抗菌活性不同,治疗效果不同,例如头孢他啶/阿维巴坦对产KPC酶和D类酶(OXA-48)菌株具有较好的抗菌活性[7],但对产B类酶菌株无效,体外研究认为对于后者,往往需要联合应用氨曲南[8]。因此快速准确获得菌株碳青霉烯酶型别对临床治疗、感染控制都是至关重要的。过去实验室通常采用PCR技术进行检测,但成本高、操作复杂,需要专业技术人员和设备。本研究采用新型碳青霉烯酶检测技术,操作便捷,成本较低,对技术含量要求不高,结果易判读,对于临床治疗和流行病学调查具有重要意义。
本研究结果显示,亚胺培南联合PBA检测肠杆菌目细菌单独产KPC酶,与PCR方法相比,灵敏度可达到100.0%。有3株菌,PBA抑制剂增强试验结果为阳性,但未检测到KPC酶,考虑菌株可能产生其他少见类型的A类酶,如GES、SIM等,此外有研究[9]发现,产AmpC酶合并膜孔蛋白缺失时,PBA抑制剂增强试验结果同样可出现阳性。后续我们可以采取扩增相应基因或全基因组测序的方法加以验证。
对于单独产B类酶的检测,EDTA抑制剂增强试验灵敏度和特异度均为100%,PCR试验结果显示,53株B类酶中,51株产NDM,2株产IMP,亚胺培南联合EDTA均可以检测出,与其他研究[10-11]结果相同。但采用EDTA检测肺炎克雷伯菌产B类酶的特异性与吡啶二羧酸相比较低,考虑可能与本研究纳入产B类酶菌株数量、种类有限相关,因此该结果有待进步一验证。
同时本研究发现,对于同时产KPC和NDM的菌株,使用亚胺培南单独联合PBA或EDTA检测结果均为阴性。而在纸片上同时滴加PBA及EDTA时,相较于亚胺培南纸片,抑菌圈有明显扩大,与其他研究者研究结果相同[12]。可能任何一种抑制剂单独作用均不足以全部抑制KPC和NDM对亚胺培南的水解活性,只有两种抑制剂同时存在情况下,才能够完全抑制。但该方法无法检出产OXA-48的菌株,有报道[12]称可利用大肠埃希菌ACTT 25922、亚胺培南纸片、PBA及EDTA,采用的纸片扩散法进行简单的操作区分产OXA-48菌株。后续我们将继续收集产OXA-48菌株并加以验证。
综上所述,采用PBA和EDTA进行碳青霉烯酶抑制剂增强试验具有操作简便、结果易判读、准确性较高及成本低廉等优点,适合临床微生物实验室常规开展。
