特殊状态人群中亚胺培南-西司他丁的群体药动学研究进展
2022-05-17左建丽何瑶李福书陈兴郑晓媛
左建丽 何瑶 李福书 陈兴 郑晓媛

中图分类号 R969;R978.1 文献标志码 A 文章编号 1001-0408(2022)09-1141-06
DOI 10.6039/j.issn.1001-0408.2022.09.20
摘 要 亚胺培南-西司他丁为广谱碳青霉烯类抗菌药物,已在临床广泛应用,但其在特殊状态人群[本文特指连续性肾脏替代治疗(CRRT)患者、体外膜肺氧合(ECMO)患者、病情危重的烧伤患者以及新生儿和儿童]的个体化给药方案制订中缺乏相应指南和专家共识。本文总结亚胺培南-西司他丁在特殊状态人群中的群体药动学研究,推荐亚胺培南-西司他丁剂量为:CRRT患者给予1~3 g/d;烧伤患者给予500 mg~1 g,q6 h;ECMO患者给予750 mg~1 g,q6 h;新生儿给予20 mg/kg,q8 h或25 mg/kg,q8 h;儿童给予25 mg/kg,q6 h。
关键词 亚胺培南-西司他丁;群体药动学;连续性肾脏替代治疗;体外膜肺氧合;危重症;特殊人群;剂量优化
Research advance of population pharmacokinetics of imipenem-cilastatin in special status populations
ZUO Jianli,HE Yao,LI Fushu,CHEN Xing,ZHENG Xiaoyuan(Dept. of Pharmacy, Chongqing Emergency Medical Center/Chongqing University Central Hospital,Chongqing 400014,China)
ABSTRACT Imipenem-cilastatin is a broad-spectrum carbapenem antibiotic drug that has been widely used in clinical practice, but there is a lack of guidelines and expert consensus on the development of individualized regimens for special status populations [e.g. continuous renal replacement therapy(CRRT)patients,extracorporeal membrane oxygenation(ECMO)patients,critically ill burn patients, neonates and children]. In this paper, by searching population pharmacokinetics research of imipenem- cilastatin in special status populations, it is recommended that imipenem-cilastatin is given 1 to 3 g/d for CRRT patients; 500 mg to 1 g,q6 h for burn patients; 750 mg to 1 g,q6 h for ECMO patients; 20 mg/kg or 25 mg/kg,q8 h for neonates; and 25 mg/kg,q6 h for children.
KEYWORDS Imipenem-cilastatin; population pharmacokinetics; continuous renal replacement therapy; extracorporeal membrane oxygenation; critically ill; special status population; dose optimization
亞胺培南-西司他丁是一种临床常用的广谱碳青霉烯类抗菌药物,在特殊状态人群[本文特指连续性肾脏替代治疗(continuous renal replacement therapy,CRRT)患者、体外膜肺氧合(extracorporeal membrane oxyge- nation,ECMO)患者、病情危重的烧伤患者以及新生儿和儿童]的个体化给药方案制订中缺乏相应指南和专家共识。特殊状态人群由于病情危重程度不同、个体差异较大,其药动学特点往往与正常人存在显著差异。如果按照常规经验性方案进行治疗,可能导致患者体内血药浓度过高或不足,继而导致亚胺培南-西司他丁药动学参数的达标率较低,治疗效果欠佳。因此,给特殊状态人群制订安全且有效的个体化给药方案是临床亟待解决的问题。
群体药动学(population pharmacokinetics,PPK)是个体化给药的有力工具,旨在描述接受了临床剂量的个体之间存在的差异,已被广泛应用于各种药物的剂量优化。截至目前,亚胺培南-西司他丁在特殊状态人群中的PPK研究鲜有报道。因此,本文总结亚胺培南-西司他丁在特殊状态人群中的PPK研究,以期为其个体化给药方案提供合理建议。
1 亚胺培南-西司他丁和PPK的概述
亚胺培南是甲砜霉素(由卡特利链霉菌产生)的半合成衍生物,也是1980年发现的第一个碳青霉烯类抗菌药物,主要通过肾脱氢肽酶1或肾二肽酶迅速降解,其结构如图1所示[1-2]。西司他丁是一种肾脱氢肽酶抑制剂,可抑制肾脱氢肽酶对亚胺培南的代谢(可使亚胺培南的代谢时间达8 h),通过增加半衰期(t1/2)来延长亚胺培南的抗菌作用,其结构如图2所示[3-4]。
亚胺培南-西司他丁由亚胺培南和西司他丁按1 ∶ 1比例混合而成,其抗菌谱覆盖了革兰氏阴性菌、革兰氏阳性菌、需氧菌和厌氧菌等,包括金黄色葡萄球菌、铜绿假单胞菌、草绿色链球菌、无乳链球菌、化脓性链球菌、粪肠球菌和大肠杆菌等,已广泛用于腹腔感染、下呼吸道感染、败血症、心内膜炎以及皮肤软组织的复杂性感染的治疗[5]。亚胺培南-西司他丁是亲水性药物(LogP约为0.19),t1/2约为1 h、生物利用度约为89%、肾清除率为0.05 L/h[6] ),但在特殊状态人群中,由于各种原因导致的肾功能不全会使亚胺培南-西司他丁蓄积,进而使患者的t1/2延长至肾功能正常者的2~3倍,消除半衰期可延长至5 h左右[7]。综上,亚胺培南-西司他丁的药动学参数在特殊状态人群中会有所不同,其经验性给药不一定能达到最好的疗效。因此,寻找亚胺培南-西司他丁在特殊状态人群中的给药剂量范围具有重要的临床意义。
PPK是由Sheineret于1972年发现的一种使用药动学模型(如NONMEM、WinNonLin、Pmetrics 和MatLab等)分析药物代谢特点的方法,也是药物剂量调整的一种重要模型[8]。PPK是一种利用药动学与统计学对体内药物浓度数据进行分析,并调查特定患者群体中的药物浓度或暴露情况的一种方法。PPK模型由结构模型(描述药动学固定参数如群体典型值、固定效应参数、个体间变异等)和协变量模型(年龄、体质量、疾病状况和相互作用等)构成[9]。研究报道,PPK模型可结合贝叶斯法和蒙特卡洛模拟法,利用临床数据更准确地描述药动学/药效学(PK/PD)关系,为最佳治疗方案提供信息,从而优化抗菌药物的剂量并制订个体化给药方案[10]。
2 亚胺培南-西司他丁的PK/PD指数及影响剂量调整的因素
亚胺培南-西司他丁是时间依赖性药物,其效能取决于游离药物浓度大于细菌最低抑菌浓度(minimum inhibitory concentration,MIC)的时间占给药周期的百分比(%fT>MIC)[11-12]。%fT>MIC是评估时间依赖性抗菌药物的PK/PD指数,碳青霉烯类药物为40%~50%。其次,碳青霉烯类药物在抗感染方面也会因感染的严重程度要求不同的PK/PD指数:轻中度感染时,%fT>MIC超过40%就能获得良好的治疗效果;而重度感染时为了获得最佳疗效,%fT>MIC可能需要达100%[13-16]。
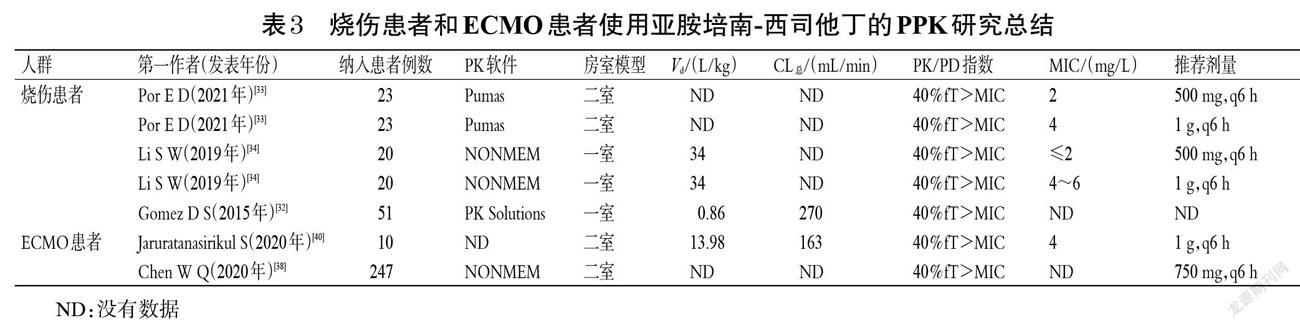
研究显示,在危重患者和特殊状态人群中,分布容积(Vd)和清除率(CL)是影响抗菌药物浓度变化的主要因素[17-18]。亚胺培南-西司他丁是亲水性药物,不易透过细胞膜,故Vd较小;但在特殊状态人群中Vd趋于增加,从而导致其血药浓度降低[17],因此,在治疗过程中需给予负荷剂量以快速取得治疗效果[18]。例如:对于行CRRT的危重患者来说,CRRT会清除亚胺培南-西司他丁致使CL升高,故需增加亚胺培南-西司他丁的剂量;对于孕妇和儿童等特殊状态人群来说,其特殊的生理状态使CL降低,故需减少亚胺培南-西司他丁的剂量。笔者参考文献[13],对危重患者使用亚胺培南-西司他丁的个体化给药方案进行总结,结果见表1。
3 亚胺培南-西司他丁在特殊状态人群中的PPK研究及剂量调整
3.1 成年危重患者
3.1.1 CRRT患者 CRRT是指能模拟肾脏完成代谢并维持水电解质平衡,主要是以缓慢的流速/透析速通过弥散和对流等方式进行溶质交换和杂质清除的一种体外血液净化方式[19]。CRRT现已成为一种成熟的治疗技术,主要应用于临床危重疾病的抢救(如急性肾衰竭、多脏器功能障碍、急性坏死性胰腺炎、重症感染、氮质血症、容量负荷、代谢性酸中毒以及电解质紊乱等)[20]。临床上,对于使用亚胺培南-西司他丁治疗的重症感染肾功能不全患者,需要行CRRT来清除体内杂质和提高感染灶的抗菌疗效。由于亚胺培南-西司他丁的血浆蛋白结合率低、Vd小,故容易被CRRT仪清除,所以对于接受CRRT的患者需要调整亚胺培南-西司他丁的剂量。其中,影响其剂量调整的因素主要包括患者本身(基础疾病、残余肾功能、容量超负荷和PK特征)、CRRT模式
[包括连续性静-静脉血液滤过(CVVH)、连续性静-静脉血液透析(CVVHD)、连续性静-静脉血液透析滤过 (CVVHDF)]、CRRT相关参数(透析率、饱和系数和筛分系数)、病原体的感染部位、CL、t1/2、Vd、MIC以及PK/PD靶标等,其中CL、t1/2、Vd和MIC是最主要的影响因素[21]。因此,笔者主要以CL、Vd和MIC为讨论重点,总结了目前亚胺培南-西司他丁剂量调整的PPK研究。
2021年,Rungkitwattanakul等[22]通过检索PubMed、Embase和ScienceDirect等数据库(截至2020年5月)纳入了11篇文章,然后使用蒙特卡洛模拟方法设定模拟5 000例患者,并对模拟数据用一室模型评估亚胺培南-西司他丁的疗效。结果显示,对于透析液流出率为25 mL/(kg·h)和35 mL/(kg·h)的CRRT患者,给予亚胺培南-西司他丁750 mg,q6 h后约有90%的患者能达到药效学靶标,从而取得最佳的临床治疗效果。2020年,Li等[23]根据肌酐透析率和透析液流量纳入了30例患者,对收集的209份血样和174份透析废液,使用NONMEM软件和蒙特卡洛模拟法设定模拟1 000例患者,验证并确定其MIC值。在该研究中CVVH和CVVHDF模式下均采用三室模型进行评价,得到的结果虽然与前期文献中二室模型分析的结果不一致,但均说明肌酐清除率是影响中枢清除率的显著协变量、透析液流量是影响透析室清除率的显著协变量。2005年,Fish等[24]研究了12例接受2种CRRT模式(6例CVVH和6例CVVHDF)的重症监护室患者,结果显示,亚胺培南-西司他丁的消除半衰期为2.6~2.7 h,CL总分别为(145±18)、(178±18) mL/min,因此建议在肠杆菌科革兰氏阴性菌感染(MIC≤2 mg/L)时给予该药1~1.5 g/d,在铜绿假单胞菌感染和院内感染(4≤MIC≤8 mg/L)时给予该药2 g/d。Trotman等[25]报道了接受CRRT的患者,提出若要达到2 mg/L的血药浓度建议给予亚胺培南-西司他丁250 mg,q6 h或500 mg,q8 h;若要达到4 mg/L的血药浓度则建议给予亚胺培南-西司他丁500 mg,q6 h。基于上述文献,对于使用亚胺培南-西司他丁并接受CRRT的危重患者,建議综合CRRT模式和PK/PD指数推荐剂量。笔者对使用亚胺培南-西司他丁且行CRRT的危重患者的PPK研究进行总结,结果见表2。
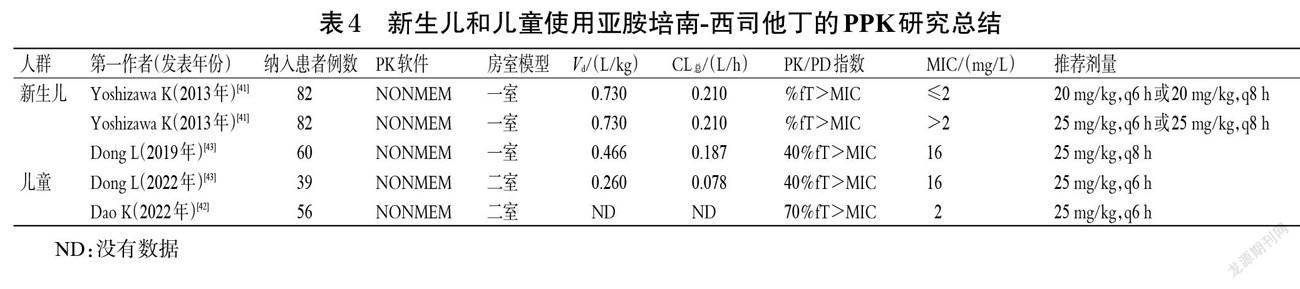
3.1.2 烧伤患者 烧伤一般分为休克期(≤12 h)和感染期(48~72 h)2个阶段,约75%的烧伤患者最终会发生感染[31]。烧伤后,患者血浆流失、免疫力降低,且在烧伤后48~72 h会出现感染(常见的致病菌主要为鲍曼不动杆菌、铜绿假单胞菌和金黄色葡萄球菌)。研究显示,患者烧伤48 h后会出现心输出量增加、血清白蛋白减少、肾血流量和肾小球滤过率增加,使药物血浆CL增加,最终改变药物的PK[32]。
截至目前,国内关于亚胺培南-西司他丁在烧伤患者中的PPK研究很少,大多数仍集中在国外。例如,Por等[33]研究了烧伤患者接受/不接受CVVH治疗的PPK,共纳入23例烧伤面积为40%的患者(nCVVH=12,n非ECMO=11),使用二室模型和蒙特卡洛模拟法(n=1 000)进行分析,结果显示,决定亚胺培南-西司他丁剂量调整的主要影响因素仍是CL(CLCVVH为88.08~253.95 mL/min)。该团队建议对未接受CVVH治疗的烧伤患者给予500 mg,q6 h,对于接受CVVH治疗的烧伤患者给予1 000 mg,q6 h。Li等[34]基于PubMed和Google Scholar数据库,筛选出使用亚胺培南-西司他丁并接受CRRT的烧伤和非烧伤患者各10例(感染的病原菌包括产气肠杆菌、肺炎克雷伯菌、鲍曼不动杆菌、大肠杆菌、铜绿假单胞菌等),然后使用NONMEM软件和一室模型进行分析。结果显示,当MIC≤2 mg/L时,建议给予亚胺培南-西司他丁0.5 g,q6 h;当4≤MIC≤6 mg/L时,建议给予亚胺培南-西司他丁1 g,q6 h。Cota等[35]用蒙特卡洛模拟法设定模拟10 000例烧伤患者,结果显示,对于感染铜绿假单胞菌且烧伤面积>20%的患者,建议给予亚胺培南-西司他丁1 g,q6 h。基于此,笔者对烧伤患者使用亚胺培南-西司他丁的PPK研究进行总结,结果见表3。
3.1.3 ECMO患者 ECMO是一种为呼吸衰竭或心力衰竭患者提供临时心脏呼吸支持的体外装置[36]。ECMO的常见适应证是急性呼吸窘迫综合征,主要由感染性病因引起,故ECMO患者需要进行抗菌治疗[37]。例如:对于严重感染的ECMO患者可选择亚胺培南-西司他丁治疗,但由于ECMO的置入会吸附抗菌药物,从而降低了药物的CL。Chen等[38]使用二室模型分析了247例患者(nECMO=48,n非ECMO=199),结果显示,ECMO患者的CL值远超非ECMO患者(CLECMO=28.3 L/h,CL非ECMO=8.88 L/h),前者亚胺培南-西司他丁血药浓度低,建议给予750 mg,q6 h以获得更高的治疗成功率;对于肌酐清除率(CLCR)≤70 mL/min的患者应该减少亚胺培南-西司他丁的剂量;对于体质量为50~80 kg的患者则不需要调整剂量。Welsch等[39]研究发现,2例接受ECMO治疗的肺移植患者分别感染了阴沟肠杆菌和肺炎克雷伯菌,给予亚胺培南-西司他丁1 g,q6 h后,移植效果均较好。Jaruratanasirikul等[40]给10例ECMO患者输注0.5 g,q6 h亚胺培南-西司他丁后,其Vd为13.98 L、CL总为9.78 L/h、CL为60~120 mL/min;经PPK模型分析后,建议针对该类患者给予1 g,q6 h亚胺培南-西司他丁以获得更好的临床治疗效果。基于此,笔者对ECMO患者使用亚胺培南-西司他丁的PPK研究进行总结,结果见表3。
3.2 新生儿和儿童
亚胺培南-西司他丁在儿童中的用量不同于成年人,其治疗剂量是根据年龄以mg/kg计算的。此外,亚胺培南-西司他丁是否能用于新生儿和儿童,各国均有不同的规定,如欧洲各国和日本均不推荐将亚胺培南-西司他丁用于新生儿。但在美国,则将亚胺培南-西司他丁推荐用于体质量大于1.5 kg的新生儿(禁用于患脑膜炎的新生儿);对于周龄小于1周的新生儿推荐剂量为25 mg/kg,q12 h;对于周龄1~4周的新生儿推荐剂量为25 mg/kg,q8 h[41]。我国目前也尚无针对儿童和新生儿的亚胺培南-西司他丁给药指南,但有部分国外研究通过运用PPK分析了此类人群的给药剂量范围。
Dao等[42]将 82例新生儿的173份血样进行PK研究,结果显示,给予新生儿20~25 mg/kg,q6 h~q12 h的剂量可获得最佳疗效(%fT>MIC达100%)。Dong等[43]纳入了56例儿童血液肿瘤患者,所有患儿均按15~25 mg/kg,q6 h注射亚胺培南-西司他丁。结果显示,体质量、年龄和CL是影响亚胺培南-西司他丁剂量调整的3个协变量;对于感染铜绿假单胞菌的儿童来说,给予亚胺培南-西司他丁25 mg/kg,q6 h即可达到良好的效果。Yoshizawa等[41]对比了使用亚胺培南-西司他丁的60例新生儿和39例儿童的血液和尿液样本,发现新生儿的CL是儿童的1/2、Vd是儿童的1.8倍;当给予新生儿25 mg/kg,q8 h,给予儿童25 mg/kg,q6 h的亚胺培南-西司他丁时,约有90%的患儿达到MIC(16 mg/L)。笔者对新生儿和儿童使用亚胺培南-西司他丁的PPK研究进行总结,结果见表4。
4 结语
本文通过回顾亚胺培南-西司他丁在特殊状态人群中的PPK研究发现,Vd和CL是影响其剂量调整最重要的协变量。在特殊生理病理状态下,患者的Vd和CL较正常患者变化明显,如CRRT患者和烧伤患者的Vd、CL均升高,ECMO患者、新生儿和儿童的Vd升高、CL降低。基于此,笔者建议亚胺培南-西司他丁给药剂量为:CRRT患者给予亚胺培南-西司他丁1~3 g/d;烧伤患者给予500 mg~1 g,q6 h;ECMO患者给予750 mg~1 g,q6 h;新生儿给予20 mg/kg,q8 h或25 mg/kg,q8 h;儿童给予25 mg/kg,q6 h。本研究虽然推荐了亞胺培南-西司他丁具体的剂量范围,但由于这些文献尚存在样本量少、研究因素单一和纳入协变量较少等不足,仅能为临床医师和药师制订用药方案提供思路。未来也期望纳入更多的临床数据进行亚胺培南-西司他丁的PPK研究,以期为制订特殊状态人群的个体化给药方案提供合理建议。
参考文献
[ 1 ] KAHAN F M,KROPP H,SUNDELOF J G,et al. Thienamycin:development of imipenem-cilastatin[J]. J Antimicrob Chemother,1983,12(Suppl D):1-35.
[ 2 ] BARRY A L,JONES R N,THORNSBERRY C,et al. Imipenem(N-formimidoyl thienamycin):in vitro antimicro- bial activity and beta-lactamase stability[J]. Diagn Microbiol Infect Dis,1985,3(2):93-104.
[ 3 ] BALFOUR J A,BRYSON H M,BROGDEN R N. Imipenem/ cilastatin:an update of its antibacterial activity,pharmacokinetics and therapeutic efficacy in the treatment of serious infections[J]. Drugs,1996,51(1):99-136.
[ 4 ] DRUSANO G L. An overview of the pharmacology of imipenem/cilastatin[J]. J Antimicrob Chemother,1986,18(Suppl E):79-92.
[ 5 ] NAKANE T,TAMURA K,HINO M,et al. Cefozopran,meropenem,or imipenem-cilastatin compared with cefepime as empirical therapy in febrile neutropenic adult patients:a multicenter prospective randomized trial[J]. J Infect Chemother,2015,21(1):16-22.
[ 6 ] ROGERS J D,MEISINGER M A,FERBER F,et al. Pharmacokinetics of imipenem and cilastatin in volunteers[J]. Rev Infect Dis,1985,7(Suppl 3):S435-S446.
[ 7 ] DREETZ M,HAMACHER J,ELLER J,et al. Serum bactericidal activities and comparative pharmacokinetics of meropenem and imipenem-cilastatin[J]. Antimicrob Agents Chemother,1996,40(1):105-109.
[ 8 ] ABDULLA A,EDWINA A E,FLINT R B,et al. Model- informed precision dosing of antibiotics in pediatric patients:a narrative review[J]. Front Pediatr,2021,9:624639.
[ 9 ] GOUTELLE S,WOILLARD J B,NEELY M,et al. Nonparametric methods in population pharmacokinetics[J]. J Clin Pharmacol,2022,62(2):142-157.
[10] CHENG Y,WANG C Y,LI Z R,et al. Can population pharmacokinetics of antibiotics be extrapolated? implications of external evaluations[J]. Clin Pharmacokinet,2021,60(1):53-68.
[11] CRAIG W A. Pharmacokinetic/pharmacodynamic parameters:rationale for antibacterial dosing of mice and men[J]. Clin Infect Dis,1998,26(1):1-10.
[12] ASÍN-PRIETO E,RODRÍGUEZ-GASCÓN A,ISLA A. Applications of the pharmacokinetic/pharmacodynamic(PK/PD) analysis of antimicrobial agents[J]. J Infect Chemother,2015,21(5):319-329.
[13] GATTI M,PEA F. Pharmacokinetic/pharmacodynamic target attainment in critically ill renal patients on antimicro- bial usage:focus on novel beta-lactams and beta lactams/beta-lactamase inhibitors[J]. Expert Rev Clin Pharmacol,2021,14(5):583-599.
[14] DELATTRE I K,TACCONE F S,JACOBS F,et al. Optimizing β-lactams treatment in critically-ill patients using pharmacokinetics/pharmacodynamics targets:are first conventional doses effective?[J]. Expert Rev Anti Infect Ther,2017,15(7):677-688.
[15] GUILHAUMOU R,BENABOUD S,BENNIS Y,et al. Optimization of the treatment with beta-lactam antibiotics in critically ill patients-guidelines from the French Society of Pharmacology and Therapeutics(Société Française de Pharmacologie et Thérapeutique-SFPT) and the French Society of Anaesthesia and Intensive Care Medicine (Société Française d’Anesthésie et Réanimation-SFAR)
[J]. Crit Care,2019,23(1):104.
[16] ROBERTS J A,PAUL S K,AKOVA M,et al. DALI: defining antibiotic levels in intensive care unit patients:are current β-lactam antibiotic doses sufficient for critically ill patients?[J]. Clin Infect Dis,2014,58(8):1072-1083.
[17] TRIGINER C,IZQUIERDO I,FERNÁNDEZ R,et al. Gentamicin volume of distribution in critically ill septic patients[J]. Intensive Care Med,1990,16(5):303-306.
[18] KEES M G,VÖGELER S,HILPERT J W. Initial dosing of vancomycin in critically ill patients[J]. Int J Antimicrob Agents,2011,38(1):91-92.
[19] PROWLE J R,BELLOMO R. Continuous renal replacement therapy:recent advances and future research[J]. Nat Rev Nephrol,2010,6(9):521-529.
[20] TANDUKAR S,PALEVSKY P M. Continuous renal replacement therapy:who,when,why,and how[J]. Chest,2019,155(3):626-638.
[21] VERMA S,PALEVSKY P M. Prescribing continuous kidney replacement therapy in acute kidney injury:a narrative review[J]. Kidney Med,2021,3(5):827-836.
[22] RUNGKITWATTANAKUL D,CHAROENSAREERAT T,KERDNIMITH P,et al. Imipenem dosing recommendations for patients undergoing continuous renal replacement therapy:systematic review and Monte Carlo simulations[J]. Ren Replace Ther,2021,7:61.
[23] LI Z,BAI J,WEN A P,et al. Pharmacokinetic and pharmacodynamic analysis of critically ill patients undergoing continuous renal replacement therapy with imipenem[J]. Clin Ther,2020,42(8):1564-1577.e8.
[24] FISH D N,TEITELBAUM I,ABRAHAM E. Pharmacokinetics and pharmacodynamics of imipenem during conti- nuous renal replacement therapy in critically ill patients
[J]. Antimicrob Agents Chemother,2005,49(6):2421-2428.
[25] TROTMAN R L,WILLIAMSON J C,SHOEMAKER D M,et al. Antibiotic dosing in critically ill adult patients receiving continuous renal replacement therapy[J]. Clin Infect Dis,2005,41(8):1159-1166.
[26] LEWIS S J,KAYS M B,MUELLER B A. Use of Monte Carlo simulations to determine optimal carbapenem do- sing in critically ill patients receiving prolonged intermittent renal replacement therapy[J]. J Clin Pharmacol,2016,56(10):1277-1287.
[27] WEN A P,LI Z,YU J X,et al. Clinical validation of therapeutic drug monitoring of imipenem in spent effluent in critically ill patients receiving continuous renal replacement therapy:a pilot study[J]. PLoS One,2016,11(4):e0153927.
[28] TEGEDER I,BREMER F,OELKERS R,et al. Pharmacokinetics of imipenem-cilastatin in critically ill patients undergoing continuous venovenous hemofiltration[J]. Antimicrob Agents Chemother,1997,41(12):2640-2645.
[29] MUELLER B A,SCARIM S K,MACIAS W L. Comparison of imipenem pharmacokinetics in patients with acute or chronic renal failure treated with continuous hemofiltration[J]. Am J Kidney Dis,1993,21(2):172-179.
[30] KELLER E,FECHT H,BÖHLER J,et al. Single-dose kinetics of imipenem/cilastatin during continuous arteriovenous haemofiltration in intensive care patients[J]. Nephrol Dial Transplant,1989,4(7):640-645.
[31] JESCHKE M G,VAN BAAR M E,CHOUDHRY M A, et al. Burn injury[J/OL]. Nat Rev Dis Primers,2020[2022- 02-23]. https://www.researchgate.net/publication/339236767 Burn_injury. DOI:10.1038/s41572-020-0145-5.
[32] GOMEZ D S,SANCHES-GIRAUD C,SILVA C V Jr, et al. Imipenem in burn patients:pharmacokinetic profile and PK/PD target attainment[J]. J Antibiot(Tokyo),2015,68(3):143-147.
[33] POR E D,AKERS K S,CHUNG K K,et al. Population pharmacokinetic modeling and simulations of imipenem in burn patients with and without continuous venovenous hemofiltration in the military health system[J]. J Clin Pharmacol,2021,61(9):1182-1194.
[34] LI S W,XIE F F. Population pharmacokinetics and simulations of imipenem in critically ill patients undergoing continuous renal replacement therapy[J]. Int J Antimicrob Agents,2019,53(1):98-105.
[35] COTA J M,FAKHRIRAVARI A,ROWAN M P,et al. Intravenous antibiotic and antifungal agent pharmacokine- tic-pharmacodynamic dosing in adults with severe burn injury[J]. Clin Ther,2016,38(9):2016-2031.
[36] NAPP L C,ZIEGELER S,KINDGEN-MILLES D. Rationale of hemoadsorption during extracorporeal membrane oxygenation support[J]. Blood Purif,2019,48(3):203- 214.
[37] GOMEZ F,VEITA J,LAUDANSKI K. Antibiotics and ECMO in the adult population-persistent challenges and practical guides[J]. Antibiotics(Basel),2022,11(3):338.
[38] CHEN W Q,ZHANG D,LIAN W W,et al. Imipenem population pharmacokinetics:therapeutic drug monitoring data collected in critically ill patients with or without extracorporeal membrane oxygenation[J]. Antimicrob Agents Chemother,2020,64(6):e00385-e00320.
[39] WELSCH C,AUGUSTIN P,ALLYN J,et al. Alveolar and serum concentrations of imipenem in two lung transplant recipients supported with extracorporeal membrane oxygenation[J]. Transpl Infect Dis,2015,17(1):103-105.
[40] JARURATANASIRIKUL S,VATTANAVANIT V,WONGPOOWARAK W,et al. Pharmacokinetics and Monte Carlo dosing simulations of imipenem in critically ill patients with life-threatening severe infections during support with extracorporeal membrane oxygenation[J]. Eur J Drug Metab Pharmacokinet,2020,45(6):735-747.
[41] YOSHIZAWA K,IKAWA K,IKEDA K,et al. Population pharmacokinetic-pharmacodynamic target attainment analy- sis of imipenem plasma and urine data in neonates and children[J]. Pediatr Infect Dis J,2013,32(11):1208- 1216.
[42] DAO K,FUCHS A,ANDRÉ P,et al. Dosing strategies of imipenem in neonates based on pharmacometric modelling and simulation[J]. J Antimicrob Chemother,2022,77(2):457-465.
[43] DONG L,ZHAI X Y,YANG Y L,et al. Population pharmacokinetics and dosing optimization of imipenem in children with hematological malignancies[J]. Antimicrob Agents Chemother,2019,63(6):e00006-e00019.
(收稿日期:2022-01-29 修回日期:2022-04-08)
(編辑:唐晓莲)
