肠杆菌目细菌碳青霉烯酶的实验室检测和临床报告规范专家共识
2020-11-20徐雪松杨启文褚云卓郭大文胡志东0刘根焰倪语星苏丹虹辉0魏莲花俞云松张利侠周铁丽王明贵朱德妹胡付品
喻 华,徐雪松,李 敏,杨启文,杨 青,张 嵘,褚云卓,单 斌,郭大文,胡志东0,简 翠,李 轶,廖 康,刘根焰,季 萍,金 炎,倪语星,沈 瀚,苏丹虹,卓 超,王 辉0,魏莲花,俞云松,张 泓,张利侠,周铁丽,朱 镭,王明贵,朱德妹,胡付品
当前,细菌耐药已成为全球公共健康领域的重大挑战,其中尤以碳青霉烯类耐药肠杆菌目细菌(carbapenem-resistantEnterobacterales, CRE)引起的感染形势最为严峻。碳青霉烯类抗菌药物包括亚胺培南、美罗培南和厄他培南等,是治疗多重耐药革兰阴性杆菌所致感染最有效的抗菌药物之一。随着该类药物在临床的广泛应用,肠杆菌目细菌对碳青霉烯类抗菌药物的耐药率呈逐年快速上升趋势。CHINET中国细菌耐药监测网历年监测结果显示[1-2],我国临床分离肺炎克雷伯菌对碳青霉烯类抗菌药物的耐药率从2005年的3%快速攀升至2019年的25%以上,上升幅度高达8倍。2018年全国细菌耐药监测网(CARSS)数据显示,全国1 429所医院临床分离的肺炎克雷伯菌对碳青霉烯类抗菌药物的平均耐药率为10.1%,部分省市甚至超过20%[3]。由于CRE菌株通常还携带有对其他抗菌药物耐药的基因,对抗菌药物呈广泛耐药甚至全耐药的特征,使临床的抗感染治疗面临无药可用的困境[4]。
1 CRE的定义
美国疾病预防控制中心关于CRE的定义[5]为满足以下任意一个条件:①对亚胺培南、美罗培南、厄他培南或多利培南任何一种碳青霉烯类耐药者;对于天然对亚胺培南敏感性降低的细菌(如摩根菌属、变形杆菌属和普罗威登菌属等),需参考除亚胺培南外的其他碳青霉烯类抗菌药物的药敏结果。②产生碳青霉烯酶。
2 CRE的耐药机制
产生碳青霉烯酶是肠杆菌目细菌对碳青霉烯类药物耐药最主要的机制[6]。按照Ambler分子分类方法,碳青霉烯酶可分为A、B和D三类。A类为丝氨酸碳青霉烯酶,以blaKPC(blaKPC-2-blaKPC-55)、blaSME(blaSME-1-blaSME-5)、blaIMI(blaIMI-1-blaIMI-18)、blaNMC和blaGES(blaGES-1-blaGES-43)型为主;B类为金属β内酰胺酶,以b l aNDM(blaNDM-1-blaNDM-29)、blaIMP(blaIMP-1-blaIMP-85)、blaVIM(blaVIM-1-blaVIM-69)、blaGIM(blaGIM-1-blaGIM-2)和blaSPM型为主;D类为OXA-48型丝氨酸碳青霉烯酶,以blaOXA-181和blaOXA-232为主。除产生碳青霉烯酶外,少数菌株对碳青霉烯类药物耐药的机制是产生超广谱β内酰胺酶和/或AmpC酶合并外膜孔蛋白表达下调或缺失。
3 碳青霉烯酶分布特征
不同国家、不同地区、不同医院、不同人群以及不同细菌所产的碳青霉烯酶种类均有差异[7-9]。我国临床分离的CRE菌株产生的碳青霉烯酶以KPC和NDM型为主,少数菌株产生OXA-48、IMP和VIM型碳青霉烯酶[10-12]。KPC-2型酶为KPC型碳青霉烯酶最主要的亚型,NDM-1和NDM-5是NDM型金属酶中最主要的亚型,而OXA-181和OXA-232型酶是OXA-48型碳青霉烯酶中最主要的亚型。CHINET中国细菌耐药监测网对2018年收集自全国39所医院935株CRE菌株的研究结果显示,产KPC、NDM和OXA-48型碳青霉烯酶菌株所占比例分别为51.6%(482/935)、35.7%(334/935)和7.3%(68/935),其中少数菌株产碳青霉烯酶复合酶。儿童和成人患者中分离的碳青霉烯类耐药菌株产生的碳青霉烯酶型别有所差异,儿童患者分离的碳青霉烯类耐药肺炎克雷伯菌主要产生KPC、NDM和OXA-48型碳青霉烯酶,而成人患者分离株主要产KPC型碳青霉烯酶;但儿童和成人患者分离的碳青霉烯类耐药大肠埃希菌主要产生NDM型金属β内酰胺酶。
4 碳青霉烯酶检测的临床意义
由于不同种类的抗菌药物对产生不同碳青霉烯酶菌株的体外抗菌活性不同,准确、快速地对CRE产生的碳青霉烯酶进行检测并分型,对于临床抗感染治疗的精准用药和医院感染预防控制具有重要的价值[13-15]。如目前刚上市的抗菌新药头孢他啶-阿维巴坦[16-17],对产KPC和OXA-48型丝氨酸碳青霉烯酶菌株具有高度抗菌活性,但对产金属β内酰胺酶菌株无抗菌活性。目前处于临床研究阶段的美罗培南-韦博巴坦(meropenem-vaborbactam)[18-19]和亚胺培南-雷利巴坦(imipenem-relebactam)[20],对产KPC型碳青霉烯酶菌株具有高度抗菌活性,但对产金属β内酰胺酶和D类OXA-48型碳青霉烯酶菌株无抗菌活性。同时,尚有多种新型碳青霉烯酶抑制剂正处于临床研究阶段,包括enmetazobactam[21]、taniborbactam[22-24]和齐达巴坦(zidebactam)[25-27]等。同时,实验室亦可根据不同碳青霉烯酶的特征,如金属β内酰胺酶不能水解氨曲南,KPC型碳青霉烯酶的活性可被阿维巴坦、韦博巴坦或雷利巴坦抑制,被克拉维酸弱抑制,通过开展联合药敏试验制定精准的抗感染治疗方案[28-29]。目前已上市及处于临床研究阶段的不同碳青霉烯酶抑制剂的抑酶活性见表1(表1内容参考文献[30- 31])。
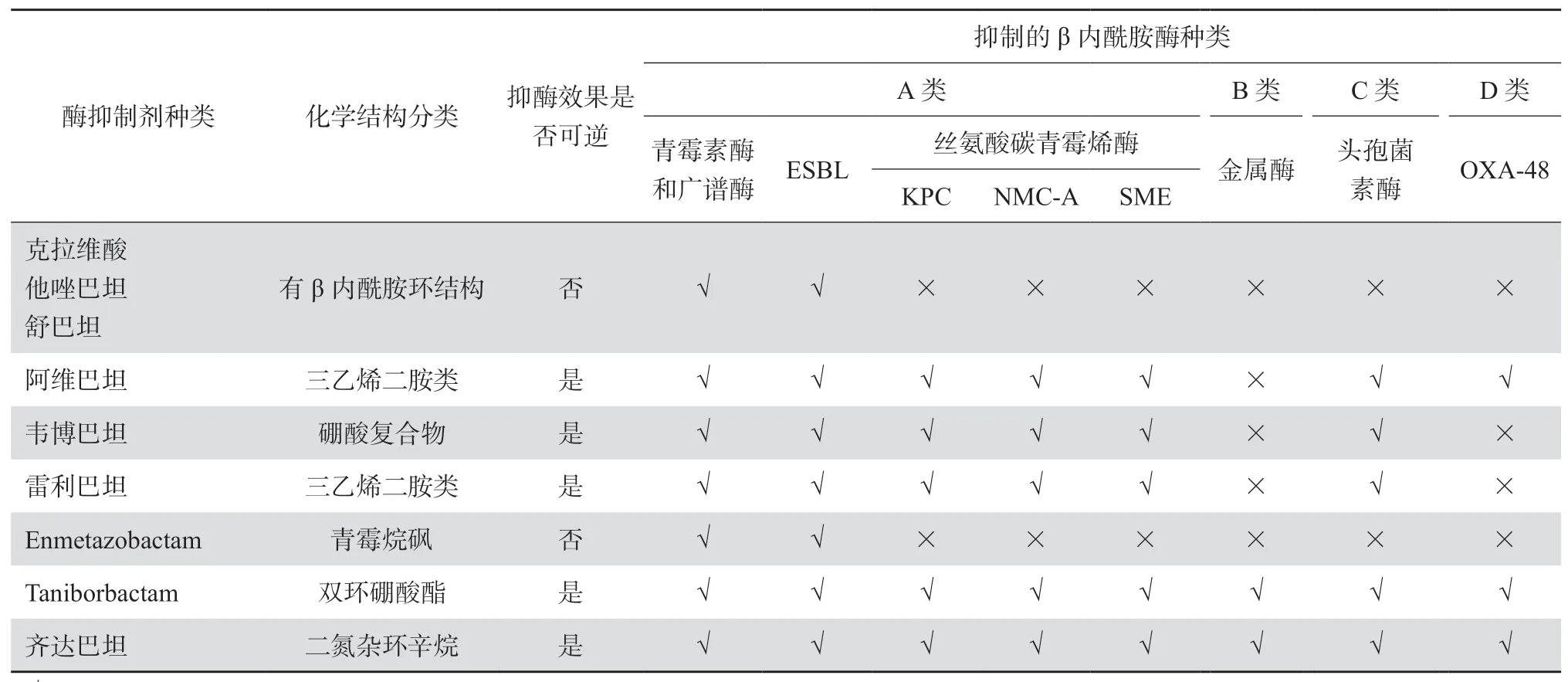
表1 不同酶抑制剂抑酶活性
5 碳青霉烯酶实验室检测
目前实验室检测碳青霉烯酶的方法分为表型检测和基因型检测。表型检测方法包括Carba NP试验、改良碳青霉烯灭活试验(包括mCIM和eCIM)、碳青霉烯酶抑制剂增强试验和时间飞行质谱技术等;基因型检测方法包括酶免疫层析技术和基因检测技术。执行上述碳青霉烯酶检测方法时,均需按要求选择相应的阳性质控菌株和阴性质控菌株进行质控,以确保检测方法的可靠性。下文简单介绍目前临床微生物实验室较为常用的碳青霉烯酶检测方法的原理、结果判读、检测性能以及优缺点等,以供不同层次的实验室根据实际情况选择合适的检测方法。不同碳青霉烯酶实验室检测方法比较见表2。
5.1 Carba NP试验
美国临床和实验室标准化协会(CLSI)于2015年推荐Carba NP试验检测肠杆菌目细菌和铜绿假单胞菌产生的碳青霉烯酶[32]。Carba NP试验具体操作步骤可参考最新版CLSI M100文件要求。该试验原理为细菌产生的碳青霉烯酶可以水解亚胺培南,导致溶液pH值改变而发生颜色变化。研究显示,Carba NP试验检测碳青霉烯酶(包括产KPC、NDM、VIM、IMP、SPM或和SME型碳青霉烯酶菌株)的灵敏度和特异度均超过90%[33]。Carba NP试验具有操作简单和快速的特点(4~6 h),适合所有临床微生物实验室开展。缺点是需特殊试剂,其中一些需自制(有效期短);一些分离株会出现无效结果;可能无法检测某些类型碳青霉烯酶(如染色体介导OXA型碳青霉烯酶)。
5.2 改良碳青霉烯灭活试验
CLSI推荐改良碳青霉烯灭活试验(mCIM)和EDTA改良碳青霉烯灭活试验(eCIM)用于肠杆菌目细菌和铜绿假单胞菌中碳青霉烯酶的检测[32]。mCIM和eCIM试验具体操作步骤可参考最新版CLSI M100文件要求。其原理是将美罗培南与受试菌悬液混合,若受试菌产生碳青霉烯酶,可破坏美罗培南的抗菌活性;若受试菌不产碳青霉烯酶,美罗培南仍可保持其对大肠埃希菌ATCC 25922的抗菌活性。根据金属β内酰胺酶的活性可被EDTA抑制的特点,mCIM和eCIM联合可区分细菌产生的丝氨酸碳青霉烯酶或金属β内酰胺酶。mCIM试验可用于检测肠杆菌目细菌和铜绿假单胞菌中的碳青霉烯酶,而mCIM联合eCIM仅适用于肠杆菌目细菌以区分其产生的碳青霉烯酶类型(丝氨酸碳青霉烯酶或金属β内酰胺酶)。研究显示,mCIM试验检测肠杆菌目细菌和铜绿假单胞菌中碳青霉烯酶的灵敏度和特异度均超过97%,特异度为100%[34-36]。mCIM试验检测不动杆菌属实验室间的特异度和重复性均较差,方法未获得CLSI认可。eCIM试验区分肠杆菌目细菌中金属β内酰胺酶和丝氨酸碳青霉烯酶的灵敏度> 95%、特异度>92%。mCIM和eCIM试验具有操作简单、无需特殊试剂和成本低的特点,适合所有临床微生物实验室开展。缺点是需过夜孵育,耗时长。
5.3 碳青霉烯酶抑制剂增强试验
5.3.1 A类丝氨酸碳青霉烯酶和B类金属β内酰胺酶的检测 根据A类丝氨酸碳青霉烯酶的活性可被
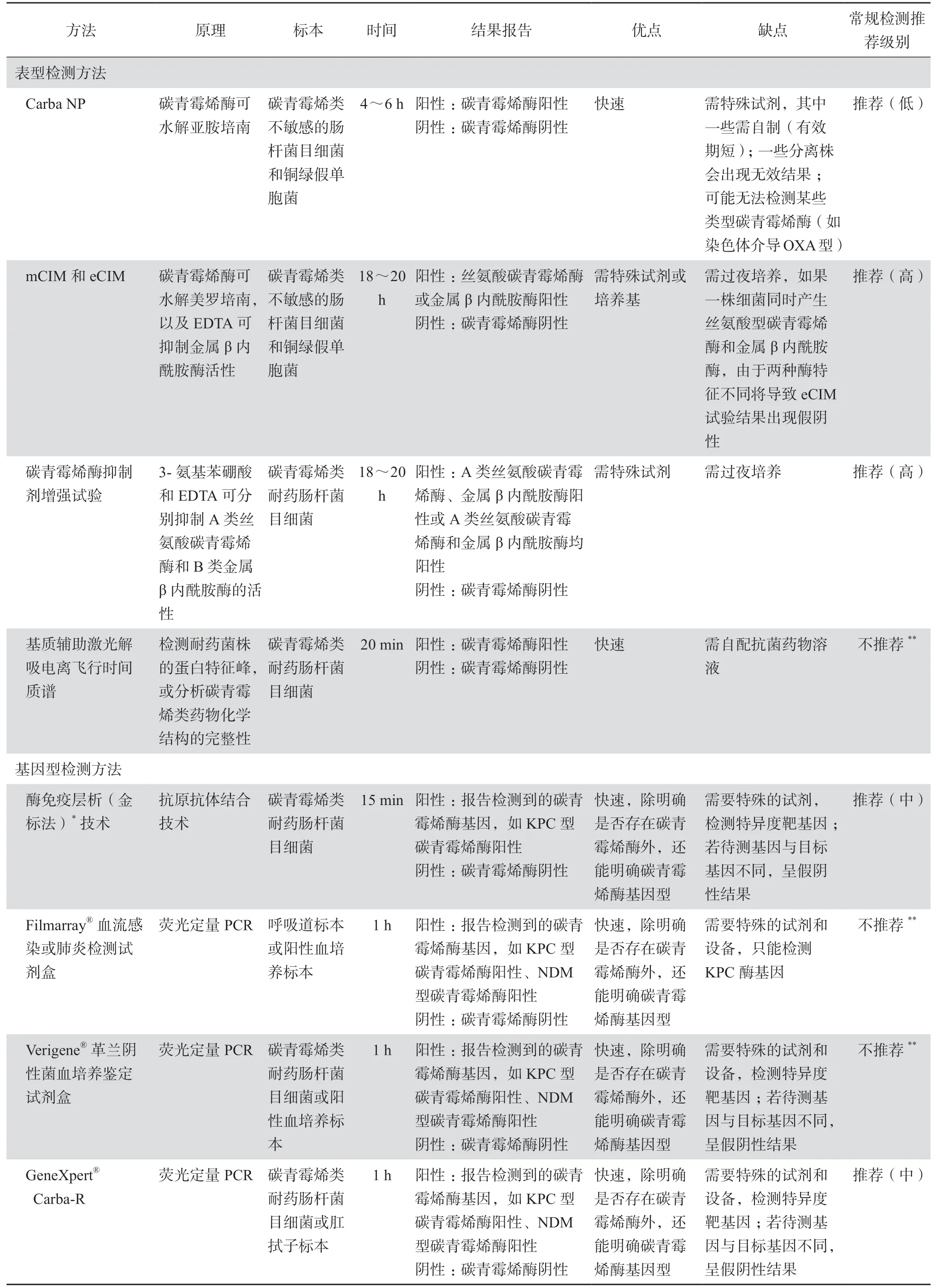
表2 不同碳青霉烯酶检测方法原理、适用标本、检测时间、结果报告及其优缺点
3-氨基苯硼酸(APB)抑制[37],而金属β内酰胺酶的活性可被EDTA抑制的特点[38-41],APB联合EDTA可对单产A类丝氨酸碳青霉烯酶、单产B类金属β内酰胺酶以及同时产生A类丝氨酸碳青霉烯酶和B类金属β内酰胺酶的肠杆菌目细菌进行检测并区分[42],具体实验操作步骤见附件1。研究显示,碳青霉烯酶抑制剂增强试验检测单产KPC或金属酶菌株的灵敏度均为100%,检测同时产KPC和金属酶菌株的灵敏度为96.8%,特异度为98.8%[42]。本方法具有操作简单、结果容易阅读以及可检测单产或同时产不同类型碳青霉烯酶的特点,适合所有临床微生物实验室开展,但缺点是需特殊试剂、耗时长以及不能检测OXA-48型碳青霉烯酶。
5.3.2 D类OXA-48型碳青霉烯酶的检测 相比于A类丝氨酸碳青霉烯酶和B类金属β内酰胺酶,目前可用于检测并区分OXA-48型碳青霉烯酶的表型检测方法极少。Tsakris等[43]利用APB和EDTA对不同种类碳青霉烯酶的抑制特点,报道了一种可简单检测并区分OXA-48型碳青霉烯酶的检测方法,具体实验操作步骤见附件2。该方法检测并区分OXA-48型碳青霉烯酶的灵敏度和特异度分别为96.3%和97.7%,具有操作简单且结果容易阅读的特点,适合所有临床微生物实验室开展,但缺点是需特殊试剂、耗时长。
5.4 质谱技术
基质辅助激光解吸电离飞行时间质谱(MALDI-TOF MS) 是近年来发展的简便、快速、准确的病原微生物鉴定方法。质谱技术通过比较不同细菌间质谱峰强度差异,可快速对碳青霉烯类耐药细菌进行检测;或者基于碳青霉烯酶水解碳青霉烯类而使药物的特异峰发生改变的特点进行检测[44-48]。质谱技术虽然可快速检测碳青霉烯酶的种类,但缺点是目前仅对某种碳青霉烯酶有为数不多的研究且无统一可行的方法,而酶水解法需要配制抗菌药物溶液作为底物与待测菌进行共孵育(孵育时间约1~2.5 h),操作较繁琐,不适于在临床微生物实验室常规开展。
5.5 酶免疫层析技术
利用抗原抗体免疫层析技术快速检测肠杆菌目细菌中的碳青霉烯酶,是近年发展起来的目前为止以细菌菌落为基础的检测方法中最快速的检测技术[49-50]。该方法操作简单(不同产品实验操作步骤需参考产品说明书),加样后测试条上相应区域标记线条出现红色(除对照线条外),提示该菌产生所对应的碳青霉烯酶。目前该测试条最多可同时快速检测KPC、NDM、OXA-48、VIM和IMP五种碳青霉烯酶。与测序方法相比,酶免疫层析技术检测碳青霉烯酶基因的灵敏度和特异度均在90%以上。酶免疫层析技术具有操作简单,结果容易判读的优点,但缺点是价格较高,各实验室可根据自身条件选择性地开展碳青霉烯酶的检测,譬如对于高危患者(免疫抑制患者或骨髓移植患者等)分离CRE菌株碳青霉烯酶基因的快速检测,以协助临床尽早启动有针对性的抗感染治疗方案。
5.6 碳青霉烯酶分子检测技术
分子检测技术可直接快速检测临床标本如直肠拭子中CRE菌株中的碳青霉烯酶基因。如GeneXpert[51-52]、Verigene[53]和Filmarray[54]等系统采用荧光定量PCR技术对主要的碳青霉烯酶基因包括KPC、NDM、IMP、VIM和OXA-48等进行检测,检测时间一般在1 h左右,检测灵敏度和特异度可达96%以上。分子检测技术具有快速(可直接从标本中检测)和结果容易判读的优点,但缺点是价格昂贵,各实验室可根据自身条件有选择性地开展碳青霉烯酶的检测。比如对于高危患者(免疫抑制患者或骨髓移植患者等)分离CRE菌株碳青霉烯酶基因的快速检测,可协助临床尽早启动有针对性的抗感染治疗方案。
6 碳青霉烯酶的实验室检测流程、结果报告及结果解释
6.1 实验室碳青霉烯酶检测流程图
实验室碳青霉烯酶检测流程见图1。
6.2 报告模式
如以细菌为样本进行检测,建议与细菌鉴定及药敏试验结果同时报告。除按要求提供一般细菌鉴定和药敏试验报告规定的信息外,碳青霉烯酶检测报告信息包括①检测方法:表型或基因型检测方法。②检测结果报告及解释:采用mCIM和eCIM方法需同时报告“阳性”或“阴性”检测结果并判断该菌所产碳青霉烯酶种类或基因型;采用碳青霉烯酶抑制剂增强试验可直接报告最终检测结果,或同时报告纸片抑菌圈直径并判断该菌所产碳青霉烯酶种类;采用免疫层析或分子检测技术,直接报告检测到的碳青霉烯酶基因型。③碳青霉烯酶表型或基因型检测结果解释等。参考表3。
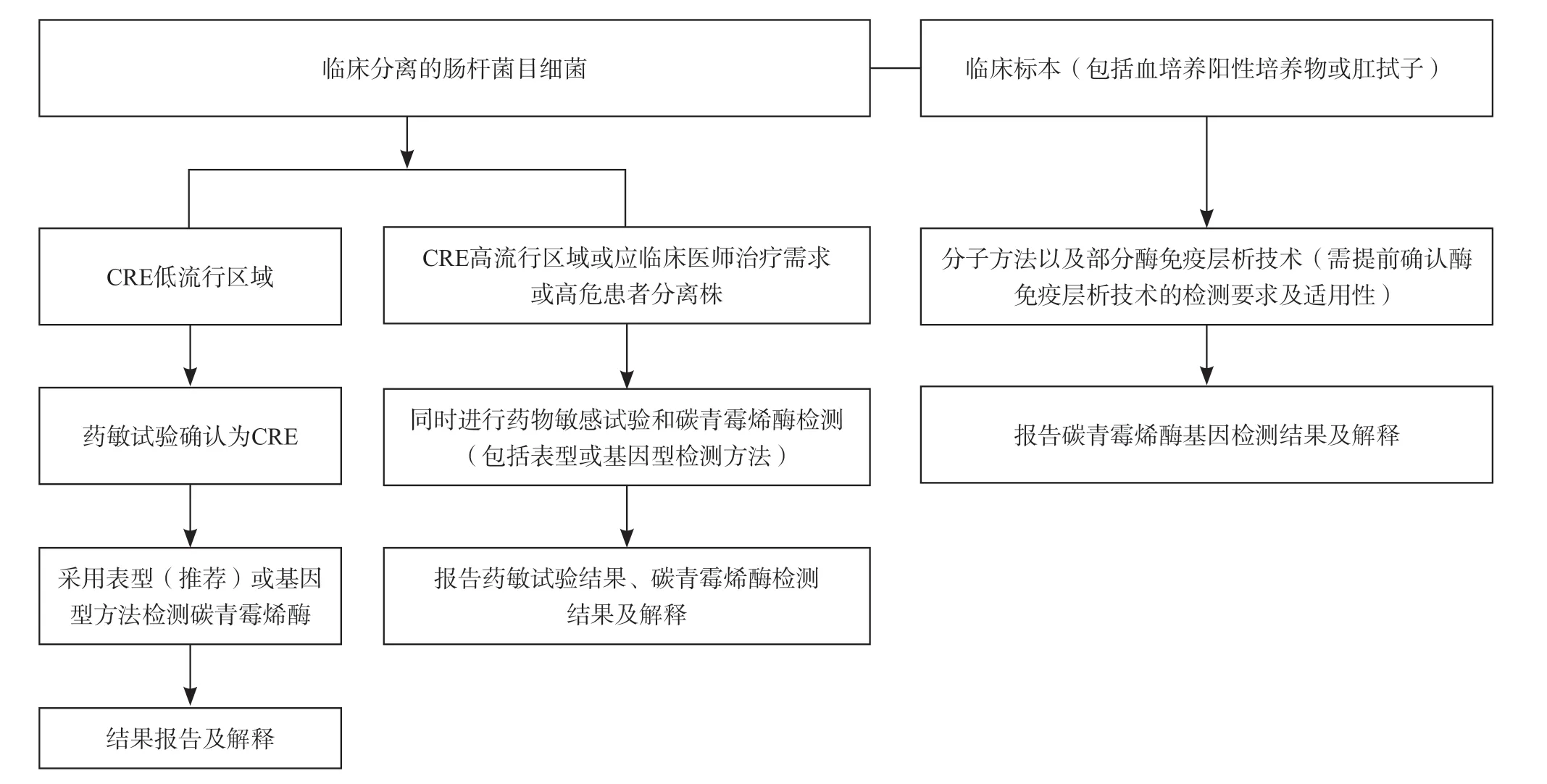
图1 实验室碳青霉烯酶检测流程图

表3 碳青霉烯酶检测结果报告
如以临床标本或细菌(少数情况可能在药敏试验前即以菌株直接检测以早期指导临床抗感染治疗)直接检测碳青霉烯酶基因,可以单独报告检测结果,报告信息包括①患者姓名、年龄、性别、科室、标本类型;②临床诊断;③检测目的,评估治疗效果、去定植或基于感染控制目的;④基因型检测方法、结果解释。参考表 3。
7 质控要求
7.1 质控频率要求
每天或每次试验时应测试阳性或阴性质控菌 株。
7.2 质控菌株选择
按照不同检测方法可检测的碳青霉烯酶型别或靶基因种类,选择相应的阳性和阴性质控菌株。阳性质控菌株首选肺炎克雷伯菌ATCC BAA-1705(KPC型碳青霉烯酶阳性株)、肺炎克雷伯菌ATCC BAA-2146(NDM型金属β内酰胺酶阳性株)、肺炎克雷伯菌ATCC BAA 2524(OXA-48型碳青霉烯酶阳性株);阴性质控菌株首选肺炎克雷伯菌ATCC BAA-1706(非产碳青霉烯酶株)。如实验室无法获得上述首选ATCC阳性或阴性质控菌株,亦可选择经DNA测序明确产相应型别碳青霉烯酶基因的菌株作为阳性质控菌,以及选择大肠埃希菌ATCC 25922作为阴性质控菌株。
附件1
A类丝氨酸碳青霉烯酶和B类金属β内酰胺酶的检 测
实验步骤按CLSI推荐的纸片扩散法进行:将待测菌调制成0.5麦氏浊度菌悬液,均匀涂布于MH琼脂平板上,随后贴4张碳青霉烯类抗菌药物纸片(一般为亚胺培南或美罗培南)于琼脂表面。一张纸片不加任何液体,一张纸片滴加APB溶液(终浓度300 μg/片,初始浓度为30 mg/L的溶液可滴加10 μL)、一张纸片EDTA溶液(终浓度292 μg/ 片,初始浓度0.1 mol/L的溶液可滴加10 μL)、最后一张同时滴加APB溶液(终浓度300 μg/片)和EDTA溶液(终浓度292 μg/片)。过夜孵育后量取纸片抑菌圈直径。结果判读如下:①添加APB溶液的亚胺培南纸片抑菌圈直径与单药纸片相差≥5 mm,即可判断该受试菌株产A类碳青霉烯酶(图1A);②添加EDTA溶液的亚胺培南纸片抑菌圈直径与单药纸片相差≥5 mm,即可判断该受试菌株产生B类碳青霉烯酶(图1B);③如仅同时添加APB和EDTA的亚胺培南纸片抑菌圈直径与单药纸片相差 ≥5 mm,可判断该受试菌株同时产A类碳青霉烯酶和B类金属β内酰胺酶(图1C);④如含酶抑制剂的亚胺培南纸片抑菌圈直径与单药相差均<5 mm,可判断该菌不产A类或B类碳青霉烯酶,其耐药机制可能为产生OXA-48型碳青霉烯酶,或产生ESBL和/或AmpC酶合并膜孔蛋白的下调或缺失。
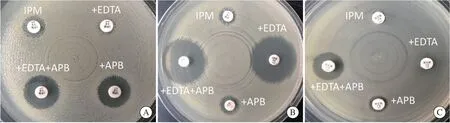
图1 碳青霉烯酶抑制剂增强试验检测A类和B类碳青霉烯酶
附件2
D类OXA-48型碳青霉烯酶的检测
实验步骤按CLSI推荐的纸片扩散法进行:将大肠埃希菌ATCC 25922调制成0.5麦氏浊度菌悬液,均匀涂布于MH琼脂平板上,将一张亚胺培南纸片于琼脂表面。取两张无菌空白纸片,每张纸片取待测菌纯分菌落3~4个,在亚胺培南纸片左右各贴上一张已取待测菌菌落的空白药敏纸片。然后在亚胺培南纸片左侧的空白纸片加上EDTA溶液(终浓度292 μg/片,初始浓度0.1 mol/ L的溶液可滴加10 μL),在亚胺培南纸片右侧的空白纸片同时加上EDTA(终浓度292 μg/片,初始浓度0.1 mol/L的溶液可滴加10 μL)和APB溶液(终浓度600 μg/片,初始浓度为50 mg/L的溶液可滴加12 μL)。过夜孵育后判读结果:①含EDTA或3-氨基苯硼酸空白纸片均出现细菌矢状生长者,提示该菌产OXA-48型碳青霉烯酶(图2A);②含EDTA或APB空白纸片均未出现细菌矢状生长者,提示该菌产金属β内酰胺酶(图2B);③仅含EDTA空白纸片出现细菌矢状生长者,提示该菌产A类丝氨酸碳青霉烯酶(图2C)。

图2 碳青霉烯酶抑制剂增强试验检测OXA-48型碳青霉烯酶
