miR-18b-5p调控WWOX对胶质瘤细胞增殖、凋亡的影响
2023-01-14苏保寿薛治乾余鹏飞吴益敏喻闻庆
苏保寿,薛治乾,余鹏飞,吴益敏,喻闻庆
胶质瘤是原发性脑肿瘤,起源于神经胶质干细胞或祖细胞,其基因多态性与病人预后及生存时间有关,虽然手术、放疗和烷基化剂化疗是治疗的主要手段,但个体化治疗策略可改善预后和延长生存时间[1-2]。研究胶质瘤细胞增殖和凋亡的分子机制,可为胶质瘤病人提供个体化策略并改善预后。
有研究[3]用芯片筛选胶质瘤组织中差异表达的miRNA,并将胶质瘤组织和非肿瘤脑组织进行聚类分析发现miR-18b在胶质瘤中上调表达;另一研究[4]通过实时荧光定量PCR进一步验证了miR-18b在胶质瘤中高表达;但miR-18b-5p对胶质瘤细胞增殖、凋亡、迁移、侵袭的影响目前还不清楚。包含WW域的氧化还原酶基因(WWOX)在胶质瘤组中的表达明显低于正常对照组,WWOX基因缺失或低表达在胶质瘤发生过程中起重要作用[5],且上调WWOX的表达可促进胶质瘤的免疫反应[6]。WWOX和miR-18b-5p在胶质瘤发生发展中都具有重要作用,而两者是否存在某种调控关系尚不明确。本研究探讨了miR-18b-5p对胶质瘤U251细胞增殖、凋亡的影响,并探讨WWOX在此机制中的作用。现作报道。
1 材料与方法
1.1 材料 选取2014年6月至2017年6月于本院病理检查确诊为胶质瘤的病人手术切除的胶质瘤组织及癌旁组织(距离胶质瘤组织边缘>2 cm)各56例,男30例,女26例,年龄18~66(41.02±14.6)岁,胶质瘤分级:Ⅰ级5例、Ⅱ级12例、Ⅲ级19例、Ⅳ级20例。所有病人术前未接受放疗和化疗。本研究通过医院医学伦理委员会批准,并与所有病人签订知情同意书。
1.2 试剂与仪器 人胶质瘤细胞株U251购自美国ATCC;DMEM高糖培养基和胎牛血清(FBS)购自美国Gibco公司,牛血清白蛋白(BSA)、胰蛋白酶Trypsin、四氮唑蓝(MTT)和二甲基亚砜(DMSO)购自美国Sigma-Aldrich公司;Trizol试剂、real-time PCR 试剂盒、反转录试剂盒(RT-PCR)、Lipofectamine 2000转染试剂购自美国Invitrogen公司;双荧光素酶报告系统购自美国Promega公司;引物、WWOX干扰物(si-WWOX)、miR-18b-5p mimics(miR-18b-5p)、miR-18b-5p抑制剂(anti-miR-18b-5p)、阴性对照(miR-NC、anti-miR-NC和si-NC)、双荧光素酶报告系统WWOX突变型和野生型载体购自上海吉玛制药有限公司;WWOX抗体、Cyclin D1抗体、p21抗体、Bax抗体、Bcl-2抗体和GAPDH抗体购自英国Abcam公司;流式细胞仪和流式试剂盒(购自美国BD公司);显微镜、全自动酶标仪及Real-time PCR仪(购自美国Bio-Rad公司)。
1.3 方法
1.3.1 细胞培养 将胶质瘤U251细胞培养于含10% FBS、1%青-链霉素、谷氨酰胺和丙酮酸钠的DMEM高糖培养液中,置于湿度95%、37 ℃ 5% CO2培养箱中培养。待细胞铺满瓶底时,消化传代,进行后续实验。
1.3.2 细胞转染 将对数生长期的U251细胞以2×105个细胞/孔接种于6孔板中,培养细胞至融合度达到80%~90%时进行转染。无血清OptiMEM培养液稀释脂质体和各载体或片段,包括anti-miR-NC、anti-miR-18b-5p、miR-NC、miR-18b-5p、si-NC、si-WWOX、pcDNA3.1、pcDNA3.1-WWOX、anti-miR-18b-5p+si-NC、anti-miR-18b-5p+si-WWOX、WT-WWOX+miR-NC、WT-WWOX+miR-18b-5p、MUT-WWOX+miR-NC和MUT-WWOX+miR-18b-5p的载体,将等体积脂质体与各组载体轻柔混匀,室温孵育20 min,加入培养好的细胞中,混匀后常规培养6 h,弃上清液,换成DMEM完全培养基,转染48 h,收集细胞,通过Real-timePCR验证转染效果。
1.3.3 Real-timePCR检测RNA的表达 收集各组转染后培养48 h的U251细胞、胶质瘤组织和癌旁组织,用Trizol试剂提取细胞总RNA,保存于-80 ℃。然后取总RNA按照反转录PCR试剂盒说明书合成cDNA,同样-80 ℃保存。按照 real-timePCR的说明书取cDNA进行反应合成miR-18b-5p,反应程序为:94 ℃ 1 min;94 ℃ 40 s、59 ℃ 30 s、72 ℃ 40 s,35个循环;72 ℃ 10 min。根据2-ΔΔCt方法进行数据分析。
1.3.4 MTT实验测定细胞增殖 收集转染后48 h的U251细胞,消化细胞并用培养液稀释细胞,以2×103个细胞/孔接种于96微孔板中,分别在培养至24、48、72 h时进行 MTT 实验,每孔加入 20 μL MTT(5 mg/mL),继续培养4 h,弃上清液,每孔加入150 μL DMSO,室温振荡5 min溶解结晶,酶标仪测定490 nm吸光度值。
1.3.5 流式细胞术检测细胞凋亡率 将转染后培养至对数生长期的各组U251细胞,接种于96孔板中,继续培养48 h,收集细胞,洗涤2次,根据流式试剂盒说明书操作,加入100 μL Binding buffer重悬细胞,加入5 μL Annexin V-FITC和 10 μL碘化丙啶,室温避光15 min,再加入400 μL Binding buffer,上流式细胞仪检测细胞凋亡率。
1.3.6 Western blotting检测蛋白表达 收集转染后培养至对数生长期的U251细胞,加入细胞裂解液,室温裂解细胞20 min,超声破碎细胞,收集蛋白并检测蛋白浓度,将蛋白样本进行SDS-PAGE分离,转PVDF膜,室温封闭1 h,然后将膜加入稀释的一抗中(WWOX抗体1∶2 000、Cyclin D1抗体1∶5 000、p21抗体1∶4 000、Bax抗体1∶3 000、Bcl-2抗体1∶1 000和GAPDH抗体1∶3 000),4 ℃过夜,用缓冲液洗膜2次,加入稀释后的酶标二抗,室温孵育2 h,洗膜,显影。分析蛋白表达量。
1.3.7 双荧光素酶报告系统实验 U251细胞培养,当细胞融合度达到80%时,进行转染,将构建的WWOX的野生型(WT-WWOX)和突变型(MUT-WWOX)双荧光素酶报告载体分别共转染miR-NC或miR-18b-5p,培养72 h,收集细胞,裂解细胞,离心收集裂解后的上清液,加入荧光素酶底物,发光仪检测荧光素酶活性。以海肾荧光素酶活性为内参照,计算WT-WWOX和MUT-WWOX的相对萤火虫荧光素酶活性。
1.4 统计学方法 采用两独立样本t(或t′)检验和配对t检验、方差分析和q检验。
2 结果
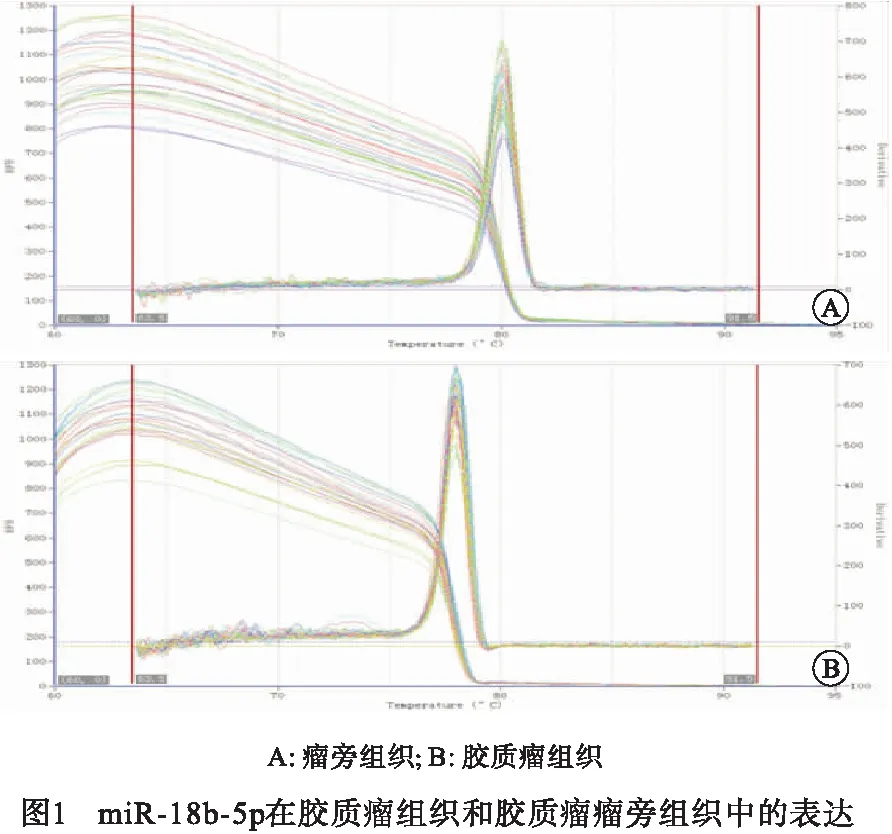
2.1 miR-18b-5p在胶质瘤组织和胶质瘤瘤旁组织中的表达 与瘤旁组织(0.52±0.05)相比,在胶质瘤组织中miR-18b-5p的表达量(1.31±0.13)升高(t=42.44,P<0.01)(见图1)。
2.2 抑制miR-18b-5p表达可抑制胶质瘤U251细胞增殖并促进细胞凋亡 与anti-miR-NC组相比,anti-miR-18b-5p组的miR-18b-5p表达量下降,细胞活性在24、48和72 h均下降,增殖相关蛋白Cyclin D1表达量下降,p21表达升高,细胞凋亡率上升,凋亡蛋白Bax表达上升,抗凋亡蛋白Bcl-2表达降低(P<0.01)(见图2和表1~2)。
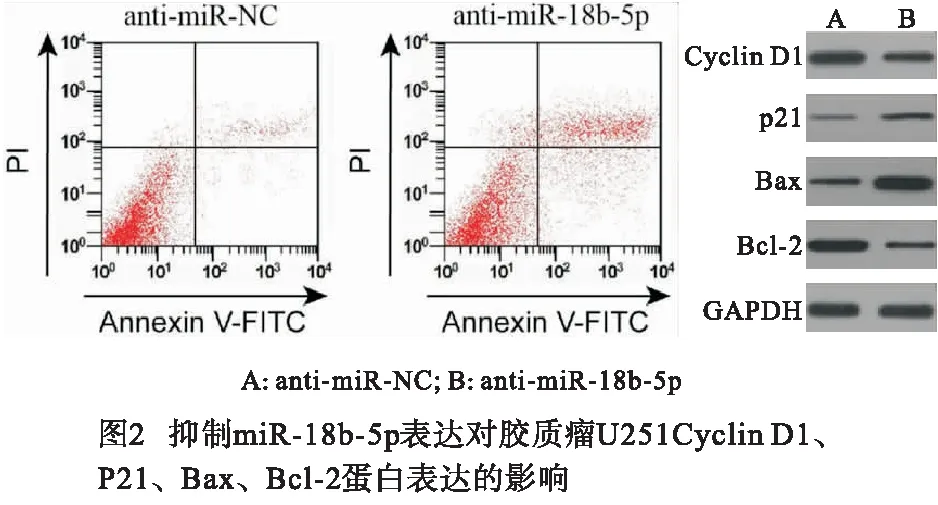
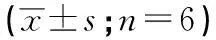
表1 抑制miR-18b-5p表达对细胞U251凋亡率及细胞活性的影响
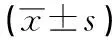
表2 抑制miR-18b-5p表达对细胞U251中Cyclin D1、p21、Bax、Bcl-2蛋白表达的影响
2.3 miR-18b-5p靶向调控WWOX miR-18b-5p的序列中含有与WWOX3′UTR互补的核苷酸序列(见图3)。双荧光素酶报告系统结果显示,与对照miR-NC组相比,miR-18b-5p组野生型WT-WWOX的萤火虫荧光素酶相对活性下降(P<0.01),而突变型MUT-WWOX的萤火虫荧光素酶相对活性无明显变化(P>0.05)(见表3)。与miR-NC组相比,miR-18b-5p组的WWOX蛋白表达量降低;与anti-miR-NC组相比,anti-miR-18b-5p组的WWOX表达量升高,差异有统计学意义(P<0.01)(见表4)。
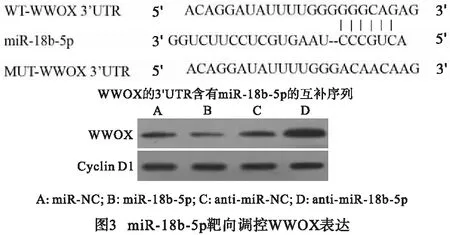
表3 双荧光素酶报告实验
表4 WWOX蛋白蛋白的表达
2.4 过表达WWOX可抑制U251细胞增殖和诱导细胞凋亡 与pCDNA3.1组相比,pCDNA3.1- WWOX组的WWOX蛋白表达量升高,增殖蛋白Cyclin D1表达降低,p21表达上升,细胞活性在24、48和72 h均下降,凋亡蛋白Bax表达升高,抗凋亡蛋白Bcl-2表达下降,细胞凋亡率升高,差异均有统计学意义(P<0.01)(见图4和表5~6)。
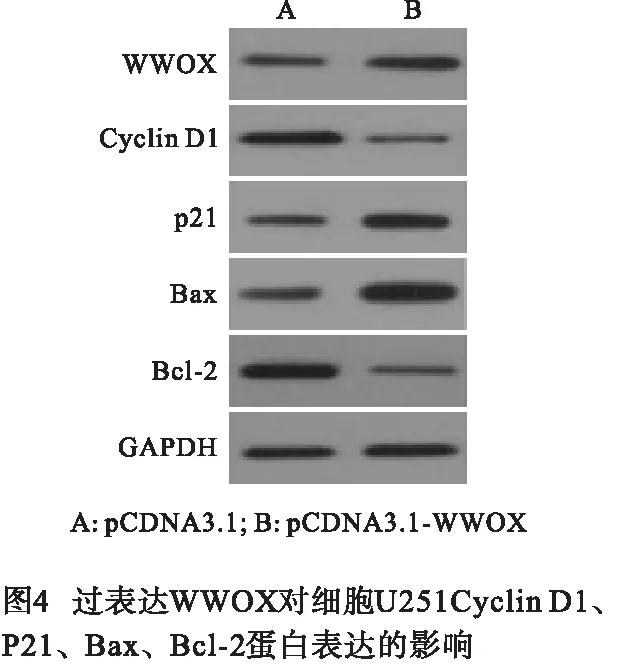
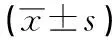
表5 过表达WWOX对细胞U251的细胞活性及凋亡率的影响
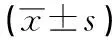
表6 过表达WWOX对细胞U251中Cyclin D1、p21、Bax、Bcl-2蛋白表达的影响
2.5 抑制WWOX表达能逆转抑制miR-18b-5p对U251细胞增殖、凋亡的影响 与anti-miR-NC组相比,anti-miR-18b-5p组的WWOX蛋白表达量升高,miR-18b-5p表达量下降,细胞活性在24、48和72 h均下降,Cyclin D1表达量下降,p21表达升高,细胞凋亡率上升,Bax表达上升,Bcl-2表达降低(P<0.01),anti-miR-18b-5p+si-NC组与anti-miR-18b-5p组结果差异无统计学意义(P>0.05),与anti-miR-NC组相比,anti-miR-18b-5p+si-WWOX组与anti-miR-18b-5p组结果相反(P<0.05~P<0.01)(见图5和表7~8)。

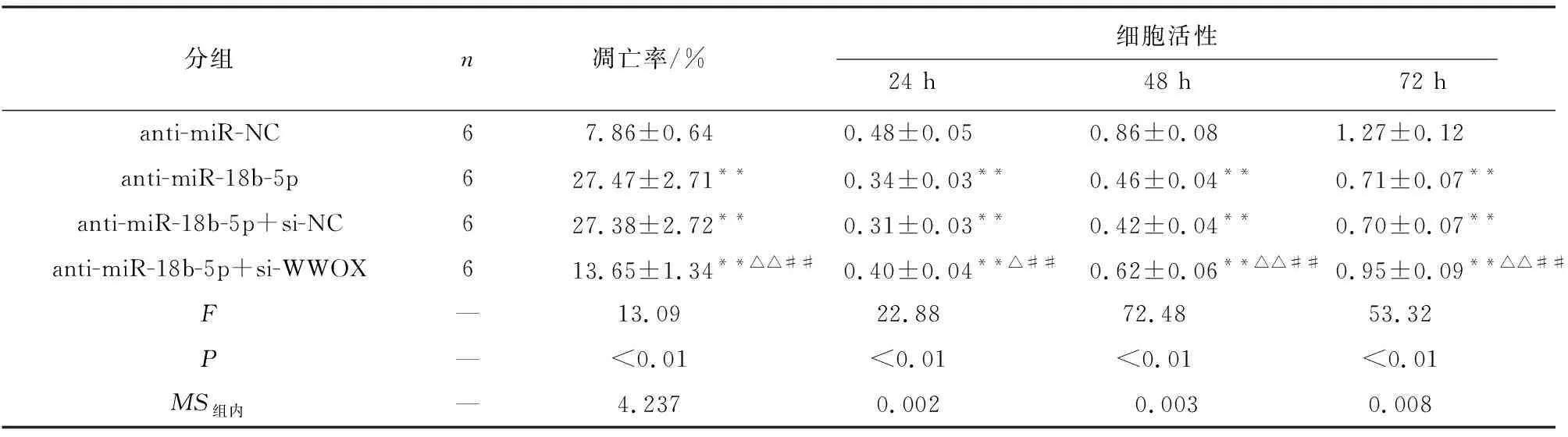
表7 抑制WWOX表达能逆转抑制miR-18b-5p对细胞U251的细胞活性就凋亡率的影响(x±s)
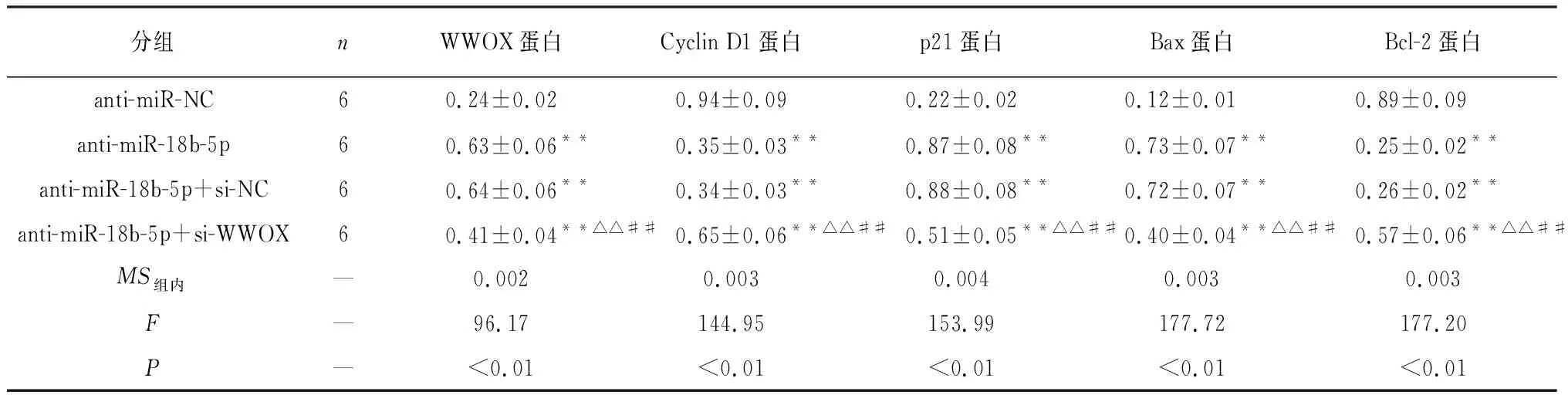
表8 抑制WWOX表达能逆转抑制miR-18b-5p对细胞U251中Cyclin D1、p21、Bax、Bcl-2蛋白表达的影响(x±s)
3 讨论
miRNA在胶质瘤中差异表达,可能是胶质瘤的诊断和预后生物标志物[7]。miRNA富含于大脑,其差异表达对胶质瘤的发生起重要作用,其参与受体酪氨酸激酶信号传导、血管生成、侵袭、分化抑制、细胞周期增强和凋亡抑制[8]。识别关键的miRNA也可为开发胶质瘤有效的生物标志物和抑制性RNA策略提供依据。
miR-18b-5p在多种肿瘤组织中表达异常。WANG等[9]最新研究发现,在紫杉醇抵抗的乳腺癌细胞株MCF-7/PR中,miR-18b-5p是lncRNA AC073284.4的直接靶点,AC073284.4可通过上调DOCK4靶向结合miR-18b-5p,从而减轻乳腺癌细胞的侵袭、转移和上皮间充质转化。miR-18b-5p在结直肠癌病人血浆[10]和大肠癌组织[11]中表达上调,通过下调PTEN表达诱导PI3K/Akt2信号通路持续活化,促进大肠癌发生发展。miR-18b-5p在前列腺癌中表达降低,与肿瘤恶性程度有关,对预测前列腺癌具有较高的敏感性和特异性[12]。研究[3-4]发现,miR-18b在胶质瘤组织中表达上调,其作用尚不清楚。本研究结果发现,与癌旁组织相比,在胶质瘤癌组织中miR-18b-5p的表达量显著升高,抑制miR-18b-5p表达可以抑制胶质瘤U251细胞增殖并促进细胞凋亡,说明miR-18b-5p在胶质瘤中具有重要作用。
本研究通过生物信息学预测发现,WWOX的3′UTR中含有与miR-18b-5p互补的核苷酸序列,提示两者可能存在结合位点或调控关系,WWOX可能参与miR-18b-5p对胶质瘤的调控过程。WWOX包含两个WW域和一个短链脱氢酶/还原酶域的相对分子质量为46 000的蛋白质,是一种肿瘤抑制因子,在乳腺癌、前列腺癌、食管癌、肺癌、胃癌和胰腺癌中表达缺失或减少,位于染色体16q23,跨越人类基因组第二常见的脆弱位点FRA16D[13]。WWOX在多形性胶质母细胞瘤(GBM)中表达下调,其可诱导p53突变的GBM细胞发生凋亡,抑制GBM[14]。在胶质母细胞瘤细胞T98G中高表达WWOX可抑制细胞增殖和对细胞外基质的黏附力,促进细胞凋亡[15]。对3 622名中国成年人的研究发现,WWOX基因缺失可能易患胶质瘤[16]。本研究结果表明,过表达WWOX可抑制U251细胞增殖和促进细胞凋亡,与这些研究结果一致,说明WWOX可抑制胶质瘤。
双荧光素酶报告系统结果表明,miR-18b-5p靶向负调控WWOX的表达,进一步的实验发现,抑制WWOX表达逆转了下调miR-18b-5p表达对U251细胞增殖、凋亡的影响,说明两者在胶质瘤细胞中具有调控关系。miRNA的主要功能是在转录后水平对其靶基因进行负调控,每个miRNA调节多个靶标基因的表达[17]。因此,miR-18b-5p/WWOX的调控网络仍需进一步验证。
综上,本研究证实miR-18b-5p和WWOX在胶质瘤中具有重要的作用,miR-18b-5p和WWOX有望做为胶质瘤分子诊治靶点。
