基于倾向性得分匹配分析举宫器在腹腔镜宫颈癌根治术中对脉管癌栓阳性率的影响
2023-01-14李桂林
金 欣,李桂林
子宫颈癌是全球范围内女性第二大恶性肿瘤[1],其严重威胁女性生命健康。目前临床治疗手段主要为手术和放疗。其中腹腔镜手术因其微创、术中出血少、术后恢复快、切口小等优势在妇科肿瘤手术中迅速发展[2]。然而,2018年新英格兰杂志的2篇研究报道称相比腹腔镜及机器人手术,开腹宫颈癌根治术具有更好的肿瘤学结局[3-4],多数学者认为这可能与术中举宫器的使用有关[5]。近年来研究发现,D2-40能特异性识别淋巴管内皮细胞的M2A癌胚膜抗原[6],用于肿瘤组织中淋巴管的计数。CD34是常特异性微血管标记分子。在本研究中,我们通过免疫组织化学染色检测CD34标记MVD、D2-40标记MLVD及脉管癌栓阳性率,探讨腹腔镜宫颈癌根治术中举宫器的应用与脉管癌栓阳性率的相关性。为了得出更准确的结论,我们运用倾向性得分匹配(propensity score matching,PSM)分析,以缩小组间差距。
1 资料与方法
1.1 标本来源 选取2018年11月至2021年3月我院行腹腔镜宫颈癌根治术的病人共269例。纳入标准:(1)临床资料完整;(2)腹腔镜子宫根治性切除术为首次唯一治疗方式;(3)组织病理学确诊的宫颈癌。排除标准:(1)合并其他部位肿瘤或难以控制的感染性疾病;(2)宫颈癌ⅡB期及以上;(3)术前放化疗及其他治疗史;(4)缺HPV16/18感染指标及血液学指标。依据入组及排除标准,共纳入109例病人,其中举宫法73例,免举宫法36例。本研究通过徐州市妇幼保健院医学伦理委员会审批(批件号:[2021]伦审第(01)号),病人均签署知情同意书。
1.2 资料收集 收集所有病人的临床资料包括年龄、体质量指数(BMI)、临床分期、术前鳞状细胞癌相关抗原(SCC)及CA125、HPV16/18感染、病理类型、手术方式、手术时间、术中失血量、阴道切除长度、肿瘤直径等。免举宫法选择术中应用经腹外置举宫器(腹腔镜根治性子宫切除术中经阴道子宫运动控制及阴道闭合器,国际专利号:PCT/CN2019/077777)牵拉子宫(见图1),行腹腔镜下宫颈癌根治术±盆腔淋巴结清扫术腹主动脉旁淋巴结切除术。
1.3 免疫组织化学染色 全部标本经10%甲醛溶液固定,石蜡包埋,对全部标本的癌组织及癌旁组织病理蜡块进行5 μm连续切片,癌旁组织取自距病人肉眼可见原发肿瘤外1 cm组织。免疫组织化学染色采用SP法,实验操作按照试剂盒说明进行,DAB显色。鼠抗CD34单克隆抗体、抗D2-40单克隆抗体购于美国Abcam公司。
1.4 结果判读 双盲法判读染色结果。淋巴管内皮细胞质呈棕黄色或棕褐色为D2-40表达阳性,血管内皮细胞膜为棕黄色或棕褐色为CD34表达阳性,光学显微镜下见淋巴管/血管呈闭塞或扩张的条索状,管壁覆盖单层上皮细胞,周围无清晰的平滑肌细胞及基底膜,腔内未见红细胞,可见癌巢为脉管癌栓阳性[7]。每例标本随机低倍视野(100×)选取5个脉管密集区,高倍视野下(400×)观察并计数微血管密度(MVD)与微淋巴管密度(MLVD)及脉管内癌栓情况,取5个高倍视野中脉管癌栓阳性率的平均数。
1.5 PSM分析 PSM分析是减少非随机对照研究或者观察性研究中数据偏差和混杂因素的一种统计学方法[8-9]。考虑到本研究为回顾性研究,不能严格随机化分组,为了消除混杂因素的影响,故选用此方法。采用1∶1比例来匹配2组的基本资料(年龄、BMI、术前SCC及CA125、HPV16/18感染、手术时间、术中失血量、临床分期、组织学类型、阴道切除长度),匹配容差为0.05。
1.6 统计学方法 采用t检验和χ2检验。
2 结果
2.1 2组病人匹配前基本资料情况 依据纳排标准共纳入109例符合标准的早期宫颈癌病人,其中举宫法组73例,免举宫法36例。在未进行PSM前,2组病人在BMI、术前SCC、临床分期方面差异均有统计学意义(P<0.05)(见表1)。
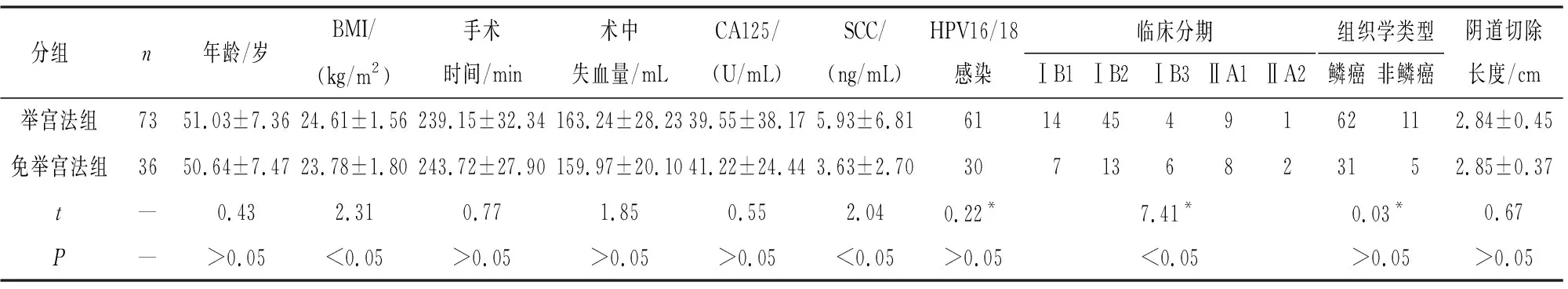
表1 2组病人匹配前的临床病理资料基线表
2.2 2组病人匹配后基本资料情况 经过1∶1匹配后,共46例病人匹配成功,举宫法组23例,免举宫法组23例。PSM分析后2组间的10个混杂因素差异均无统计学意义(P>0.05)(见表2)。

表2 2组病人匹配后的临床病理资料基线表
2.3 匹配后2组病人脉管计数与癌栓阳性情况 腹腔镜宫颈癌根治术举宫法与免举宫法病人的癌组织和癌旁组织免疫组化结果显示,脉管计数与脉管癌栓阳性率差异均无统计学意义(P>0.05)(见表3、4)。

表3 2组宫颈癌病人癌组织和癌旁组织脉管计数比较
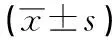
表4 2组宫颈癌病人癌组织和癌旁组织脉管癌栓阳性率比较
3 讨论
近年来由于宫颈癌发病率在我国逐年升高,且呈年轻化趋势。手术治疗仍为早期宫颈癌首选方法。2018年新英格兰杂志质疑了宫颈癌微创手术的安全性。有学者术中使用举宫器不断改变方向和位置,可能将癌细胞带入宫腔内,同时挤压癌组织,使癌细胞脱落于阴道内,并将其挤压入微脉管;在退出举宫器时,可能造成阴道残端、盆腹腔的污染,导致医源性转移[10-11],认为术中举宫器的使用可能是造成宫颈癌病人不良预后的原因之一。目前关于早期宫颈癌术中举宫器使用的挤压作用对脉管癌栓阳性率的影响因素研究较为少见。本研究通过对46例早期宫颈癌病人回顾性分析发现腹腔镜宫颈癌根治术中使用举宫器安全可行,可能不是ⅠB~ⅡA期宫颈癌病人发生脉管癌栓的危险因素。
本研究纳入的2组病人在BMI、术前SCC、临床分期等基本资料上存在显著差异,这可能与手术医师在综合评估病人病情及肿瘤大小,个体化选择手术方式有关。临床分期是影响手术操作及病人预后的重要因素。我们采用PSM减少病例选择偏倚,在将年龄、术前SCC、临床分期等不均衡的协变量纳入PSM模型的基础上,同时考虑了年龄、BMI、术前SCC及CA125、HPV16/18感染、手术时间、术中失血量、临床分期、组织学类型、阴道切除长度等变量,进一步匹配后减少2组混杂因素的干扰,提高结果的准确性。
宫颈癌的主要转移途径是淋巴转移,淋巴结内的淋巴管-静脉吻合支又造成其血源性转移[12]。脉管癌栓浸润是指在显微镜下见至少一簇肿瘤细胞浸润在淋巴管或血管腔内,因小血管及小淋巴管不易区分,统称“脉管”[13]。脉管癌栓浸润可能与肿瘤微环境中的机械力学因素有关。当肿瘤发生时,肿瘤间质可通过趋化因子(白细胞介素-8)等招募中性粒细胞等炎性细胞构成肿瘤微环境[14]。此时,细胞质膜上的黏着斑及黏着复合物如纽蛋白等通过整合素受体可将机械力通过胞膜传导,将机械力转化为生化信息,从而引起肿瘤的迁移与侵袭[15]。此外,当血管和淋巴管内皮细胞破损时,肿瘤细胞附着于破损处或者相邻内皮细胞间,细胞外基质中多种生长因子如转化生长因子β等被激活,E-钙黏素等上皮细胞表型分子表达下调,波形蛋白等间质细胞表型分子表达上调,导致上皮间质转化,诱导肿瘤干细胞的形成,最终导致脉管癌栓浸润[16-17]。
脉管癌栓浸润与多种恶性肿瘤的不良预后相关。黄清等[18]回顾性分析了201例行根治切除的大肠癌病人组织标本中的脉管癌栓与病人预后的关系,发现脉管癌栓阳性是影响预后的独立因素(P<0.01),提出脉管癌栓浸润可能为淋巴转移及远处转移的亚临床前期。脉管癌栓与宫颈癌病人盆腔淋巴结转移密切相关[19]。潘秀玉等[20]回顾性分析了286例ⅠA~ⅡB期宫颈癌手术病人,发现脉管癌栓浸润是淋巴结转移的显著危险因素(P<0.05)。SILVA-FILHO等的前瞻性研究中纳入ⅠB期宫颈癌行根治性子宫切除术病人30例,发现淋巴脉管间隙浸润是淋巴结转移的独立危险因素(P<0.01)[21],YEASMIN等[22]指出ⅠA期宫颈癌保守性治疗时需要考虑脉管浸润情况。
本研究也有一定的局限性。本研究是一个单中心、回顾性的非随机对照研究,目前纳入的样本量较少,虽然经过PSM分析,但是仍然存在不可避免的选择偏倚,论证力度仍有欠缺,结论仍需多中心大样本量的前瞻性研究得以证实。
综上,腹腔镜宫颈癌根治术中举宫器的使用对癌旁脉管的侵犯并未造成影响,其可能并非宫颈癌病人术后不良预后的原因。因此,笔者推荐符合指征的早期宫颈癌病人可积极行微创手术。但在使用举宫器的同时,仍应保证无瘤原则的执行,避免癌细胞的扩散。
