基于mp-MRI影像组学预测前列腺癌Gleason分级的价值探讨
2023-01-14谢宗玉陈艾琪马宜传
于 娟,谢宗玉,陈艾琪,陈 路,刘 浩,马宜传
前列腺癌是威胁男性生命健康的恶性肿瘤之一,发病率全世界范围内排第二[1],前列腺癌的早期诊断与治疗至关重要,其中多参数磁共振成像(mp-MRI)检查的重要性,已得到国内外广泛学者的验证,对于诊断前列腺临床显著性癌有很好的价值[2-3]。2019年更新的PI-RADS V2.1版本[4]对于MRI的技术要求是多方位的T2WI成像(T2WI横轴位、冠状位和/或矢状位);扩散加权成像,ADC图建议b值范围0~100 s/mm2、1 000 s/mm2,高b值的1 400 s/mm2也很有必要[5];以及动态对比增强MRI。前列腺癌病理应用最广泛的Gleason分级系统,Gleason评分分数直接影响着前列腺癌的预后,分数越高,恶性程度越高,病人预后越差[6]。影像组学是近些年的研究热点,已有不少研究证明,人工智能通过大量的数据分析影像组学特征,能够准确地进行影像诊断、治疗效果评估以及预后判断[7-8]。本文旨在研究mp-MRI基础上应用影像组学能否准确预测前列腺癌Gleason分级,预测病人预后。现作报道。
1 资料与方法
1.1 一般资料 回顾性分析2017年6月至2020年7月蚌埠医学院第一附属医院经手术或穿刺病理证实的前列腺癌病人资料。纳入标准:所有病人术前1个月内行3.0T MR检查;MR图像清晰有效,且参数设置符合PI-RADS V2.1版本技术要求。排除标准:病人行MR检查前已进行过前列腺疾病相关治疗;MR图像质量差,无法有效勾画出病灶进行智能分析;病人实验室检查前列腺特异性抗原(PSA)值缺失。最终266例前列腺癌病人纳入本研究,年龄47~84岁,PSA范围为0.022~189.630 ng/mL;低危组Gleason评分为1~2级的148例(3+3、3+4分);高危组Gleason评分为3~5级的118例(4+3、4+5、5+4、5+5分)。采用随机分组法将所有病例分为训练组186例和测试组80例,测试集比例为0.3。
1.2 MR扫描方法及技术参数 采用PHILIPS ACHIEVA 3.0T TX磁共振成像仪,16通道腹部线圈,Extended MR Work Space后处理站。病人取仰卧位,检查前适度充盈膀胱。检查序列符合前列腺PI-RADS v2技术规范要求,包括常规平扫T1WI、高分辨T2WI(TSE序列,TR 4 682 ms,TE 100 ms,层厚4 mm,层间距0,FOV 260 mm×260 mm)、扩散加权成像DWI(b值选择为0、1 500 s/mm2,选择EPI序列,TR 3 000 ms,TE 56 ms,层厚4 mm,层间距0,FOV 260 mm×260 mm),高分辨T2WI、DWI扫描范围包括整个精囊腺及前列腺,T2WI序列与DWI序列扫描层面一一对应,应用后处理软件得到ADC图像。
1.3 影像组学数据处理与模型建立 两名在前列腺疾病MR诊断方面有丰富经验的医生利用达尔文科研平台在高分辨T2WI横轴位以及ADC图上分别手动勾画病灶最大层面的ROI,并对2组间ROI的勾画差异作一致性检验。在达尔文平台上创建实验,平台自动对病灶ROI的特征进行提取,对提取的特征数据进行预处理,测试集比例选择0.3,将特征数据降维,每一维度特征线性拉伸到[1]区间内。最优特征筛选个数K值选择100,构建支持向量机模型,在训练组及测试组中绘制ROC曲线,应用方差值评估影像组学特征与Gleason高危组、低危组是否有相关性,并对模型进行5折交叉验证。
国际泌尿病理协会(ISUP)将前列腺癌Gleason分级划分为5个等级。ISUP 1级:Gleason 2~6分;ISUP 2级:Gleason 3+4分、Gleason 4+3分、Gleason 8分、Gleason 9~10分。其中ISUP将Gleason 3+4分、Gleason 4+3分区分开,前者为低危组,后者为高危组。
1.4 统计学方法 采用受试者工作曲线(ROC)和Delong实验验证。
2 结果
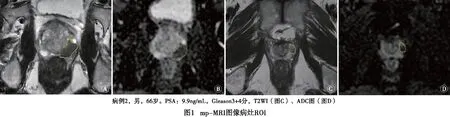
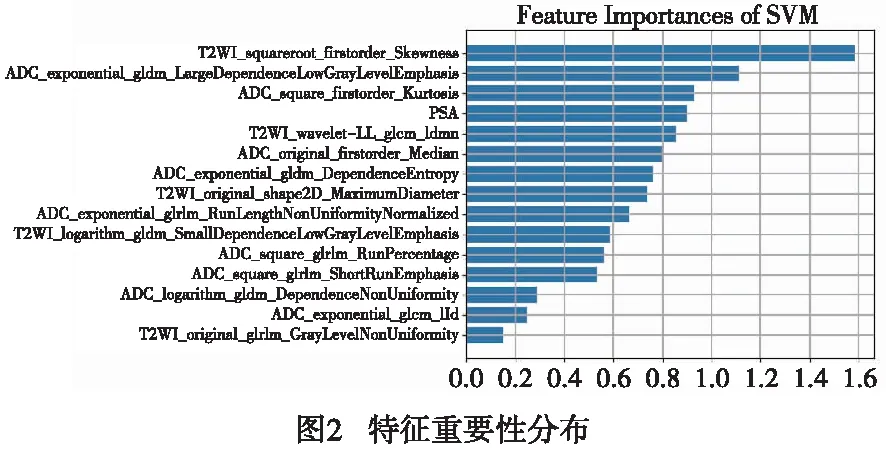
2.1 影像组学特征 对266例病人的前列腺癌病灶ROI提取了1 879个特征(见图1);通过模型筛选,保留15个最重要的影像特征纳入实验,包括T2WI相关特征5个、ADC图相关特征9个以及PSA值(见图2)。
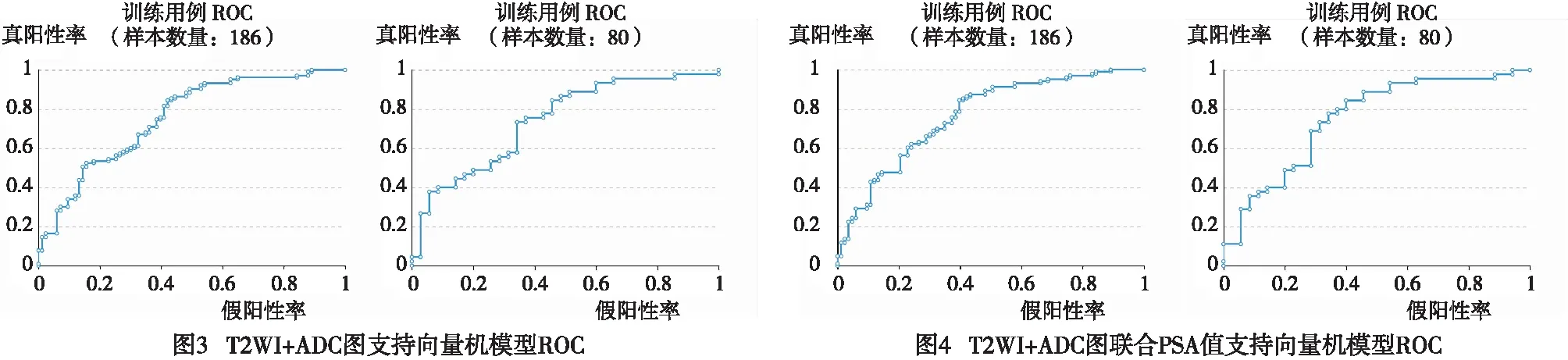
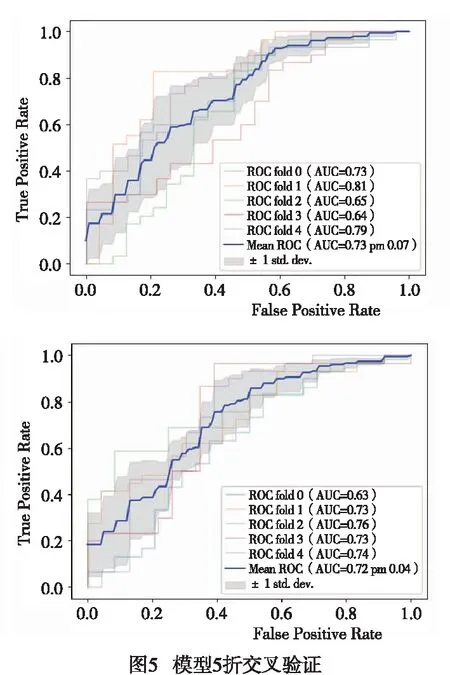
2.2 模型效能 T2WI、ADC图影像组学模型在Gleason评分高危组、Gleason评分低危组之间差异有统计学意义(P<0.01),训练组ROC曲线下面积(AUC)为0.753(0.671~0.838),测试组AUC为0.741(0.572~0.893),准确率62.5%(见图3)。T2WI、ADC图影像组学联合PSA值在Gleason评分高危组、低危组之间差异有统计学意义(P<0.01),训练组AUC为0.768(0.688~0.870),测试组AUC为0.752(0.613~0.917),准确率72.5%(见图4)。2组测试组模型进行5折交叉验证(见图5),2组实验AUC经Delong实验验证差异无统计学意义(P>0.05)。
3 讨论
Gleason分级评分系统是目前临床应用最广泛的前列腺癌组织学评价系统,决定病人的治疗方式及预后评估[9],Gleason 3+4分与Gleason 4+3分评分总分虽一致,但Gleason 4+3分主要结构恶性程度更高,2020年欧洲泌尿外科学会指南提出对于穿刺结果为Gleason 4+3分的病人应采取积极治疗[10-11];Gleason 4+3分病人总体生存率低于Gleason 3+4分[12],因此本组实验中将Gleason 3+4分及以下的病例分为低危组,Gleason 4+3分及以上的病例分为高危组,具有重要的临床应用价值。2020年欧洲泌尿外科学会指南中关于前列腺癌早期诊断中,推荐PSA筛查、前列腺mp-MRI检查及前列腺穿刺[13],且强烈推荐在前列腺mp-MRI有阳性发现时行前列腺穿刺,因此无创性的PSA筛查、前列腺mp-MRI检查在前列腺癌的诊断中具有非常可信的价值。前列腺mp-MRI检查中高分辨T2WI、ADC图更为重要,逐渐成为研究热点,拥有缩短病人检查时间、避免对比剂不良反应事件发生等优点[14]。
影像组学是近年来影像医学方向的研究热点,为精准评估肿瘤的生物学行为提供了全新的方式,本研究基于mp-MRI高分辨T2WI、ADC图,通过勾画病灶ROI的方式提取病灶大量的影像特征数据进行分析,样本量达266例,提取了1 878个特征,将特征数据降维处理,通过最优特征筛选,利用样本方差F值,评估特征与分类标签的线性相关性,最终选择了15个最具重要性的特征进行前列腺癌恶性程度的预测,特征重要性排名中,T2WI平方根一阶偏度和ADC灰度矩阵相关特征以及ADC平方根一阶峰度排在了前三位,说明一阶直方图和灰度相关矩阵对于影像组学评估价值较高,其特征与前列腺癌的恶性程度相关,其余较重要的有T2WI基于2D形状特征及T2WI、ADC图的高阶纹理特征等,说明以上影像组学特征均与肿瘤的恶性程度有关,对于影像组学的评估有一定的作用价值。本研究构建的支持向量机分类模型能够较好地通过影像组学特征预测Gleason评分的高危、低危,测试组的ROC曲线较好的验证了训练组的预测效能,训练组ROC曲线下面积AUC为0.753,测试组ROC曲线下面积AUC为0.741,并且使用了5折交叉验证模型,使训练组的预测效能更有说服力,本研究结果与国内部分研究结果相一致[15]。血清学PSA是前列腺癌最具特征性的肿瘤标志物,在前列腺癌的早期检测中无法被其他检测替代,本试验将PSA值作为临床特征,与T2WI、ADC图影像组学特征联合构建支持向量机模型,其对前列腺癌Gleason分级的预测价值高于单纯应用T2WI/ADC图影像组学,训练组AUC为0.768,测试组AUC为0.752,Delong验证得出两者ROC曲线下面积的差异无统计学意义,结果说明,联合PSA值对于mp-MRI影像组学预测前列腺癌恶性程度贡献价值不高,联合PSA值的预测效能只在一定程度上稍高于单纯应用T2WI/ADC图影像组学的预测效能,可能原因在于前列腺特异性抗原对于前列腺癌的检出具有较高的价值,但不能够很好地提示其恶性程度。
本研究的局限性:(1)病灶ROI的手动勾画,本研究结合T2WI、DWI及ADC图手动勾画病灶,每个序列的病灶影像可互相匹配,与临床病理病灶部位吻合度较高,但仍具有主观性及不确定性,病灶勾画花费时间较长,不利于进行大样本大数据研究;且ROI取病灶最大层面进行二维勾画,病灶体积等三维数据丢失,不利于提取病灶的所有影像特征。(2)构建支持向量机模型参数设定缺乏规范化设计及标准参考,不同设计者之间可能存在差异造成模型预测效能的不同。(3)本研究未对PSA值进行分层探讨,原因一是PSA值分层后每组病例量不足以研究影像组学,二是目前应用前列腺影像组学对于Gleason分级预测的价值分析中对于联合PSA值且对PSA值分层探讨的文献数据较少,预测效能有待研究,期望在未来病例数足够时对PSA值进行分层探讨。
综上,本研究利用mp-MRI影像组学构建模型预测Gleason分级有较高的应用价值,Gleason评分高危组与低危组间影像特征差异有统计学意义,有较高的临床应用价值,可为临床诊疗及预后评估提供重要参考。
