具核梭杆菌诱导自噬调控蛋白LC3高表达在食管鳞癌中的临床意义
2023-01-10何珂瑶刘怡文张哲源张家豪代宁涛杨海军孔金玉周福有
何珂瑶 刘怡文 张哲源 张家豪 代宁涛 杨海军 孔金玉 周福有,4
1新乡医学院第三附属医院胸外科(河南新乡 453003);2河南科技大学临床医学院,河南科技大学第一附属医院,河南科技大学肿瘤研究所,河南省肿瘤表观遗传重点实验室(河南洛阳 471003);3安阳市肿瘤医院病理科(河南安阳 455000);4安阳市肿瘤医院胸外科,河南省食管癌精准防治医学重点实验室(河南安阳 455000)
食管鳞癌(esophageal squamous cell carcinoma,ESCC)发病率与病死率极高,病因至今尚未完全明确[1-2]。笔者既往研究证实,具核梭杆菌(Fusobacterium nucleatum,Fn)为ESCC的关键致病因素[3-4]。资料显示,病原微生物入侵可引发宿主细胞自噬反应,并通过多种生物学机制发生自噬逃逸,从而长期定植并促进多种肿瘤的发生发展及化疗耐受[5-7]。微管相关蛋白1轻链3(microtubule associated protein 1 light chain 3,LC3)是最早发现的自噬调节因子,多种病原微生物可通过调控LC3活性,引起自噬小体堆积,为自身定植提供条件[8-10]。因此推测Fn可能通过激活LC3,诱发自噬反应,促进ESCC恶性演进。
本研究首先建立LC3敲降的ESCC细胞系,分别用Fn感染亲本与敲降细胞系,探索LC3在Fn促癌机制中发挥的作用。并检测ESCC组织中Fn感染及LC3表达情况,进一步分析二者对ESCC患者生存期的影响,为ESCC防治提供新思路。
1 材料与方法
1.1 主要试剂与仪器 ESCC细胞系KYSE150及Fn菌株(本实验室冻存);四氧化锇、丙酮、环氧树脂(德国Merck生命科学公司);醋酸铀、柠檬酸铅(中国ChemicalBook公司);LC3抗体(英国Abcam公司);GAPDH抗体、山羊抗兔IgG、ECL发光显影液(中国CWBIO公司);免疫组化试剂盒(中国ZSGB-BIO公司);RNAscope试剂盒及Fn特异性探针(美国ACD公司);凝胶成像仪(美国Thermo公司);透射电镜(日本Hitachi公司);酶标仪(美国PerkinElmer公司)。
1.2 Fn感染ESCC细胞 厌氧工作站中常规培养Fn。培养箱中常规培养KYSE150。将Fn(菌液OD600nm=1~2)加入KYSE150培养基(MOI=10),感染12 h及24 h,进行后续实验。具体细菌及细胞培养方法参照本课题组前期研究[11]。
1.3 Western blot 各组细胞蛋白(30 μg总蛋白/泳道)经电泳、转膜、封闭后,LC3(1∶1 000)和GAPDH(1∶2 000)抗体孵育4 h,山羊抗兔IgG(1∶2 000)孵育2 h。ECL发光显影液于凝胶成像仪中检测蛋白条带,Image Lab软件测定灰度值。以LC3-Ⅱ与GAPDH比值为最终LC3-Ⅱ相对表达量[12]。实验重复3次。
1.4 透射电镜 各组细胞经戊二醛及四氧化锇固定、梯度丙酮脱水、渗透液渗透、环氧树脂包埋后,常规切片(片厚100 nm)。经醋酸铀及柠檬酸铅染色后,用透射电镜观察各组细胞中自噬小体。
1.5 慢病毒载体包装 培养箱中常规培养293T细胞,采用慢病毒包装试剂盒,将LC3敲降质粒(LC3-DNA)配制为LC3-DNA-EndoFectin混合物,加入293T培养基中,48 h后收取病毒上清,加入KYSE150培养基中。嘌呤霉素筛选后,Western blot检测敲降效率。将LC3敲降后的细胞命名为KYSE150-LC3。
1.6 平板克隆 各组细胞均于6孔板中铺入每孔2 mL细胞悬液(含1×103个细胞),常规培养1周。经甲醛固定、结晶紫染色后,拍照并计数克隆数[13]。实验重复3次。
1.7 划痕实验 各组细胞均于6孔板中常规培养。待细胞融合至70%,用无菌枪头划痕。至培养箱常规培养,每隔6 h对同一位置细胞拍照。用Image J软件测量并计算各组细胞的迁移面积[14]。实验重复3次。
1.8 Transwell Matrigel胶包被Transwell小室基底膜。各组细胞饥饿培养24 h后,取100 μL细胞悬液(含1×105个细胞),加入Transwell小室,并向下室加入600 μL含血清培养基,常规培养24 h。擦去小室上层细胞,经甲醛固定、结晶紫染色后,拍照并计数穿过基底膜的细胞数[15]。实验重复3次。
1.9 病例资料 选取2015年1月至2017年1月安阳市肿瘤医院216例ESCC患者癌组织及相应癌旁组织石蜡包埋标本为研究对象,于术前获得患者知情同意,且经伦理委员会审核批准(批件号:2022WZ17K01)。纳入标准及排除标准见图1,最终纳入211例ESCC患者。
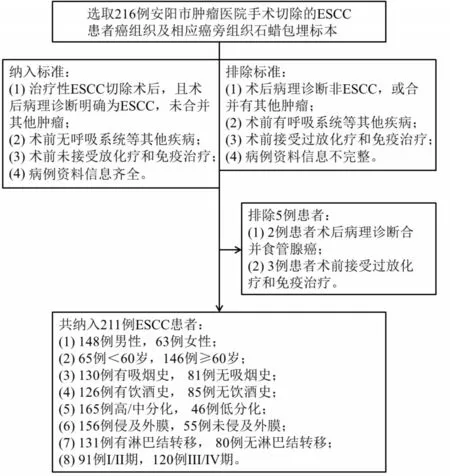
图1 本研究ESCC患者的入组标准及临床病理特征Fig.1 Enrollment criteria and clinicopathological characteristics of ESCC patients in this study
1.10 RNAscope ESCC组织及相应癌旁组织病理切片(片厚2 μm),经脱蜡、水化、靶标修复液修复、双氧水及蛋白酶孵育、Fn探针杂交后,显色试剂显色。结果判定:细胞浆可见红色颗粒为Fn 16S rRNA表达阳性。本研究中:(1)Fn感染阳性细胞判定标准为细胞中红色颗粒≥8个;(2)Fn感染阳性样本判定标准为每张切片中阳性细胞比例≥30%。具体操作步骤及评分细则参照本课题组前期研究[16]。
1.11 免疫组化 同批ESCC组织及相应癌旁组织连续切片(片厚2 μm),经脱蜡、水化、抗原修复后,试剂盒中试剂1及试剂2封闭。LC3抗体(1∶200)、试剂3及试剂4孵育后DAB显色。复染、脱水、透明后封片。结果判定:细胞浆出现棕黄色颗粒为LC3表达阳性。本研究中LC3阳性判定标准为评分>4分。具体操作步骤、阳性对照、阴性对照及评分细则参照文献[17]。
1.12 统计学方法 (1)采用SPSS 26.0软件及GraphPad 5.0软件进行统计学分析及绘图。(2)计量资料以(±s)表示,t检验比较两组间差异;单因素方差分析比较两组以上组间差异。(3)计数资料采用χ2检验分析相关性,Cohen's kappa系数分析一致性(Kappa>0.7,一致性显著)。(4)生存分析:①Kaplan-Meier生存分析比较各组间生存时间差异;②生存时间为患者入院时间至最后1次随访日期或死亡;③随访时间为60个月;④删失数据为随访至60个月仍存活的患者(59例),未删失数据为由ESCC导致的死亡患者(152例)。(5)P <0.05为差异有统计学意义。
2 结果
2.1 Fn感染对KYSE150中LC3及自噬小体的影响 采用Fn感染KYSE15012h及24h。通过Western blot检测各组细胞中LC3-Ⅱ表达情况(图2A、B)结果显示:与KYSE150相比,KYSE150+Fn(12 h)及KYSE150+Fn(24 h)中 LC3-Ⅱ表达量逐渐增高(P<0.05)。采用透射电镜观察KYSE150及KYSE 150+Fn(24 h)中自噬小体形成情况(图2C、D)结果显示:与KYSE150相比,KYSE150+Fn(24 h)中自噬小体数量增加(P<0.05)。
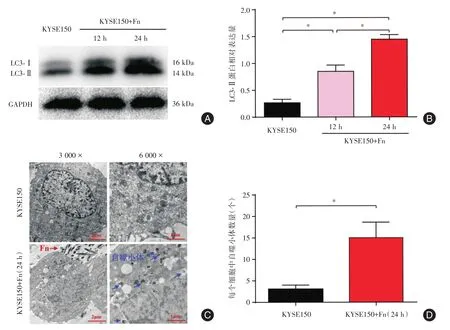
图2 Fn感染可诱导KYSE150中LC3-Ⅱ高表达及自噬小体富集Fig.2 Fn infection induced high expression of LC3-Ⅱand enrichment of autophagosomes in KYSE150
2.2 Fn感染及LC3高表达对KYSE150增殖能力的影响 采用Western blot检测LC3敲降效率(图3A、B)结果显示:与KYSE150相比,KYSE150-LC3中LC3表达量降低(P<0.05),成功建立LC3敲降的稳定细胞系。用Fn感染KYSE150及KYSE150-LC3,实验分为 KYSE150组、KYSE150-LC3组、KYSE150+Fn组及KYSE150-LC3+Fn组。采用平板克隆检测各组细胞的增殖能力(图3C、D)结果显示:与KYSE150组相比,KYSE150-LC3组增殖能力降低(P<0.05);而KYSE150+Fn组增殖能力增强(P<0.05)。与KYSE150+Fn组相比,KYSE150-LC3+Fn组增殖能力降低(P<0.05)。

图3 Fn感染及LC3高表达对KYSE150增殖能力的影响Fig.3 Effect of Fn infection and LC3 high expression on the proliferation of KYSE150
2.3 Fn感染及LC3高表达对KYSE150迁移及侵袭能力的影响 采用划痕实验(图4A-C)及Transwell(图4D、E)检测各组细胞的迁移及侵袭能力,结果显示:与KYSE150组相比,KYSE150-LC3组上述能力降低(P<0.05);而KYSE150+Fn组上述能力增强(P<0.05)。与KYSE150+Fn组相比,KYSE150-LC3+Fn组上述能力降低(P<0.05)。
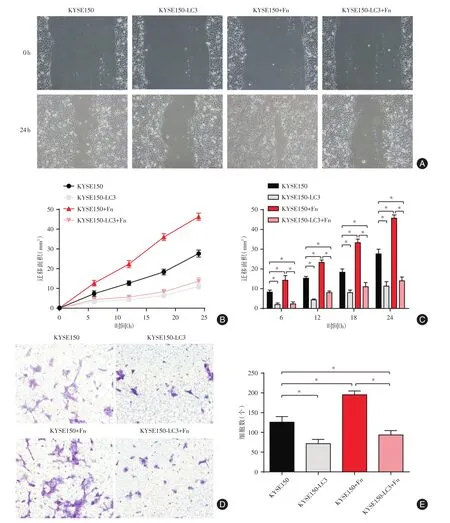
图4 Fn感染及LC3高表达对KYSE150迁移及侵袭能力的影响Fig.4 Effect of Fn infection and LC3 high expression on the migration and invasion of KYSE150
2.4 ESCC组织中Fn感染及LC3表达检测 采用RNAscope检测Fn感染情况,结果显示:癌细胞及间质细胞胞浆出现红色颗粒,为Fn感染阳性(图5A),而相应癌旁组织中Fn多为阴性(P<0.05,图5E及表1)。采用免疫组化检测LC3表达情况,结果显示:癌细胞胞浆出现棕黄色颗粒,为LC3表达阳性(图5B),而相应癌旁组织中LC3多为阴性(P<0.05,图5F与表1)。癌组织中Fn感染率及LC3阳性率分别为39.81%及41.71%,二者具有显著一致性(P<0.05,表2)。

图5 Fn感染与LC3表达检测结果(DAB染色,×400)Fig.5 Detection results of Fn infection and LC3 expression(DAB staining,× 400)

表1 ESCC组织及相应癌旁组织中Fn及LC3阳性率的比较Tab.1 Comparison of positive rates of Fn and LC3 in ESCC tissues and corresponding adjacent tissues 例(%)

表2 ESCC组织中Fn感染与LC3高表达的一致性分析Tab.2 Consistency analysis of Fn infection and LC3 high expression in ESCC tissues 例(%)
2.5 Fn感染及LC3高表达与ESCC患者临床病理特征的相关性 将2张连续切片中Fn及LC3同时判定为阳性的样本定义为Fn诱导LC3高表达阳性组,以Fn+LC3(+)表示(75例);不满足2张连续切片同时阳性的归为阴性组,以Fn+LC3(-)表示(136例)。分析各因素与患者临床病理特征的相关性(表3)结果显示:Fn感染、LC3高表达及Fn+LC3(+)的ESCC患者中,男性多于女性,有吸烟、饮酒史的患者多于无吸烟、饮酒史的患者,低分化患者多于中-高分化患者,肿瘤浸润深度侵及外膜的患者多于未侵及外膜的患者,有淋巴结转移的患者多于无淋巴结转移的患者,临床分期为Ⅲ/Ⅳ期的患者多于Ⅰ/Ⅱ期的患者(均P<0.05)。

表3 Fn感染及LC3表达与ESCC患者临床病理特征的相关性Tab.3 Correlation analysis of Fn infection and LC3 expression with clinicopathological features of ESCC patients 例(%)
2.6 Fn感染及LC3高表达对ESCC患者生存期的影响 分析各因素与ESCC患者生存期之间相关性。结果显示:211例ESCC患者术后5年总生存率为27.96%(图6A),其中Fn感染阳性、LC3表达阳性及Fn+LC3(+)组患者的5年总生存率及中位生存时间均显著低于阴性组患者(P<0.05,图6B-D)。且与Fn感染及LC3表达阳性的患者相比,Fn+LC3(+)患者5年生存期缩短更显著。

图6 ESCC患者术后生存曲线Fig.6 Survival curve of ESCC patients after surgery
3 讨论
ESCC是常见的恶性肿瘤。笔者发现,Fn感染阳性的ESCC患者预后不良[4]。阐明Fn致病的分子机制对降低ESCC发病率及改善患者预后至关重要。
病原微生物对宿主微环境的重塑机制至今尚未完全明确,但多数可引发宿主细胞自噬反应,并演进出多种机制发生自噬逃逸[18-20]。LC3为自噬标志蛋白。当自噬被诱导时,胞浆中的LC3-Ⅰ被修饰成膜结合型LC3-Ⅱ,转定位于自噬小体双层膜表面,一般以LC3-Ⅱ表达量评估自噬水平[21-22]。多种病原微生物均可通过调控LC3表达及转定位,诱发癌细胞自噬。幽门螺旋杆菌、乙肝病毒及人乳头瘤病毒均可通过激活LC3,诱发癌细胞自噬,协助自身大量复制,并促进胃癌、肝癌及宫颈癌的恶性增殖[8-10]。本研究发现,Fn感染后,ESCC细胞中LC3表达量及自噬小体数量增加,表明Fn感染可诱导LC3高表达,引发ESCC细胞自噬反应。为探明LC3在Fn促癌机制中发挥的作用,建立LC3敲降的ESCC细胞系,分别用Fn感染亲本与敲降细胞系,发现Fn感染时,ESCC细胞的LC3蛋白增加、恶性生物学行为增强,提示Fn可通过诱导LC3高表达,引发自噬潮,促进ESCC细胞快速增殖及恶性侵袭。LC3敲降时,上述指标均降低,提示LC3的激活与ESCC细胞恶性生物学行为的维持密切相关。而Fn感染LC3敲降的ESCC细胞时,并不能引起上述指标增强,提示LC3的敲降阻断了Fn在ESCC细胞中的促癌作用,表明LC3是Fn感染引起ESCC恶性演进过程中的关键调控因子。
研究显示,LC3已成为多种肿瘤的关键治疗靶点[23-25]。本研究发现,ESCC组织中Fn感染率及LC3阳性率分别为39.81%及41.71%,二者具有一致性,提示Fn感染的ESCC细胞中LC3高度激活。Fn感染及LC3高表达患者多为有吸烟、饮酒史的男性患者,提示由于大多数男性患者长期吸烟、饮酒,Fn定植率高,定植部位LC3多为高表达。且随肿瘤分化程度降低,二者阳性率逐渐增高,提示Fn感染及LC3高表达与肿瘤的恶性程度有关。二者阳性组的患者肿瘤浸润程度深、淋巴结转移率高、临床分期多为Ⅲ/Ⅳ期,提示Fn感染及LC3高表达可促进ESCC的恶性演进。二者阳性组的患者5年生存期均缩短,且二者共阳性组的患者5年生存期缩短更显著,提示Fn感染及LC3高表达均可影响ESCC患者生存期,且二者共阳性对患者生存期影响最大。
综上所述,Fn可通过诱导LC3高表达,引发自噬反应,促进ESCC恶性演进。由于病原微生物感染与肿瘤的发生发展是一个多因素的复杂过程,Fn的具体致病机制仍有待进一步探讨,但有效清除Fn并抑制其对ESCC细胞自噬的诱导作用,对延长患者生存期至关重要。
