肌管蛋白相关蛋白14介导的线粒体自噬在慢性阻塞性肺疾病气道炎症中的作用研究
2023-01-10陈海明张贤春齐见旭
陈海明 张贤春 齐见旭
海口市人民医院(海口 570208)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种慢性炎症性疾病,已成为全球第四大常见的死亡原因,并与重大的社会和经济负担相关[1]。反复的有害刺激会诱导混乱的免疫反应并促进受损上皮细胞的炎症过程,导致组织破坏和进行性气流受限[2]。由于各种致病机制之间的相互作用增加了COPD治疗的复杂性,因此单靶点治疗难以达到满意的疗效,亚细胞功能的治疗性修复已成为药物开发的重点[3]。线粒体作为一种分布广泛且具有功能的细胞器,在气道疾病的靶向治疗中引起了越来越多的关注[4]。大量研究表明,线粒体功能障碍与氧化应激、炎症、增殖、凋亡有关,这些都是COPD病理生理学的关键方面[5]。肌管蛋白相关蛋白14(myotubularin related protein 14,MTMR14)是MTM相关蛋白家族的一部分,以往研究表明MTMR14参与多种生物学过程,如细胞凋亡、炎症和自噬[6]。PAN等[7]发现,MTMR14通过抑制PTEN调节的线粒体自噬来预防脑卒中,表明MTMR14参与介导线粒体功能的治疗性修复。此外,最新研究发现,MTMR14作为炎症和肺气肿的调节剂缓解COPD[8]。然而,MTMR14在COPD中的作用机制仍不清楚,尤其是MTMR14调节的线粒体自噬是否影响COPD中的线粒体功能尚未探索。本研究构建了香烟烟雾提取物(cigarette smoke extract,CSE)处理的细胞模型和COPD小鼠模型,探讨MTMR14在COPD病理过程中的作用机制。
1 材料与方法
1.1 一般资料 选择2020年12月至2021年12月在本院胸外科因医疗原因接受手术的参与者(年龄:40~80岁)作为研究对象。参照GOLD 2020标准诊断COPD[9]。根据肺功能和吸烟史将受试者分为两组:对照组和COPD组。排除标准如下:(1)慢性肺部疾病,如肺纤维化、哮喘、支气管扩张;(2)活动性肺结核;(3)肾、肝或心力衰竭;(4)目前接受吸入或口服类固醇治疗。在手术切除期间收集肺组织标本(距病灶5 cm的最小距离)。研究经本院伦理委员会批准同意(伦理批件号:2019-15)。
1.2 材料
1.2.1 细胞 人气道上皮细胞系NuLi-1购自美国典型培养物保藏中心,培养在含有10%胎牛血清的RPMI-1640培养基中,置于37℃含5%CO2的加湿培养箱中。
1.2.2 动物 雄性C57BL/6J小鼠(年龄:10~12周;体质量:25~30 g)购自上海杰思捷实验动物有限公司[生产许可证:[SCXK(沪)2018-0004]。在12:12 h的光/暗光循环下给小鼠喂食无菌水和食物。
1.2.3 试剂和仪器 3R4F研究卷烟购自美国University of Kentucky。 MTMR14、ATG5、ATG7、Beclin1、LC3和GAPDH抗体购自美国CST公司。荧光染料,包括MitoTracker(红色)、LysoTracker(绿色);BCA测定试剂盒,MitoSOX(Molecular Probes)均购自美国Thermo Fisher Scientific公司。Cell Counting Kit-8购自自美国Sigma-Aldrich公司。Lipofectamine 2000购自美国Invitrogen公司。RIPA裂解缓冲液购自瑞士Roche公司。IL-6和IL-8 ELISA试剂盒购自美国R&D Systems公司。H&E染色试剂购自武汉赛维尔生物科技有限公司。线粒体分离试剂盒、ATP测定试剂盒购自上海Beyotime公司。荧光显微镜、IX83显微镜购自日本Olympus公司。Azure C300数字成像系统购自瑞士Axonlab公司。A1R共聚焦显微镜购自日本Nikon公司。自动酶标仪购自美国Bio-Rad公司。管式光度计购自瑞士Tecan Group公司。多模式阅读器购自美国Bio-Tek公司。
1.3 方法
1.3.1 细胞处理 NuLi-1细胞在不同浓度(2%~8%CSE,24 h)和时间点(0~ 48 h,6%CSE)下用CSE刺激。为了考察MTMR14过表达对暴露于CSE的NuLi-1细胞中线粒体自噬、细胞活力、线粒体氧化应激和炎症影响,使用Lipofectamine 2000将MTMR14及其阴性对照Vector转染NuLi-1细胞,然后将这些细胞与6%CSE一起孵育24 h。参照文献方法获得CSE[10]。通过将两支香烟(3R4F)的烟雾收集到含有20 mL培养基的50 mL离心管中获得CSE。使用0.22 μm过滤器对获得的提取物进行灭菌处理,将其视为100%浓度的CSE。用细胞培养基稀释制备工作浓度。
1.3.2 免疫组织化学分析 对照组和COPD组患者的支气管组织切片与3% H2O2在室温下孵育20 min,再与2%牛血清白蛋白一起孵育30 min,然后与MTMR14(1∶100)一抗在4℃下孵育过夜。载玻片与二抗孵育(1∶250、37℃、30 min),并用苏木精复染。通过IX83显微镜分析组织切片并拍摄有代表性的照片。
1.3.3 蛋白质免疫印迹 细胞在RIPA裂解缓冲液中匀浆,并通过BCA测定法定量蛋白质浓度。通过电泳将变性蛋白转移到硝酸纤维素膜上。阻断非特异性结合后,将膜与针对MTMR14(1∶500)、ATG5(1∶500)、ATG7(1∶500)、Beclin1(1∶1 000)、LC3(1∶1 500)或GAPDH(1∶5 000)特异性抗体在4℃下孵育过夜。通过化学发光底物将膜与物种特异性HRP缀合的二抗孵育后,使用Azure C300数字成像系统将蛋白质条带可视化。
1.3.4 线粒体检测和线粒体ROS测量 NuLi-1细胞在4%多聚甲醛中固定30 min,用0.1%Triton X-100渗透30 min,并在在含有Tween-20的磷酸盐缓冲盐水中用5%牛血清白蛋白封闭。将细胞用Lyso Tracker Green(75 nmol/L)染色NuLi-1细胞以观察溶酶体,用MitoTracker Red(250 nmol/L)染色以观察线粒体。通过A1R共聚焦显微镜观察溶酶体和线粒体的共定位。将细胞与5 μmol/L MitoSOX Red在37℃下孵育10 min,并通过荧光显微镜在510 nm激发和580 nm发射波长下测量荧光强度。
1.3.5 细胞活力测定 细胞处理后,每孔加入10 μL CCK-8溶液,将板在37℃下孵育2 h。通过自动酶标仪测定450 nm处的吸光度。
1.3.6 ELISA试验 收获小鼠血清和细胞培养物上清液,然后在4℃下以3 000 r/min离心5 min。采用ELISA试剂盒测定细胞培养物中IL-6和IL-8水平。
1.3.7 小鼠分组处理 将小鼠随机分为4个不同的组:对照+Vector组、CS+Vector组、对照+MTMR14组和CS+MTMR14组,每组7只。COPD小鼠模型参照前人研究[11]建立。将小鼠全身暴露于烟雾(CS)空气中,每天约3 h(10支香烟/45 min/次,每天4次)和每周6 d,总共使用万宝路红香烟2周(焦油:10 mg,一氧化碳:11 mg,尼古丁:0.8 mg)。将所有小鼠在室内空气中再饲养2周。第22天,用PenWu装置将50 μL获自和元生物技术(上海)股份有限公司的MTMR14-Adeno-AAV(MTMR14)经气管内给药(每只小鼠总滴度vg,一次)过表达MTMR14,并使用等量的阴性对照(NC)-AAV作为载体(Vector)对照。从第31天起,将100 μg弹性蛋白在50 μL生理盐水气管内给药(q.o.d.,持续1个月),并在最后一次弹性蛋白给药后24 h处死。对照小鼠在相同时间暴露于无CS的室内空气和用不含弹性蛋白生理盐水气管内给药。
1.3.8 肺苏木精和伊红(H&E)染色 将4%多聚甲醛固定的肺组织包埋在石蜡中。切片(5 μm厚)用H&E染色。为了评估肺损伤的严重程度,考虑了以下5个病理特征:(1)渗出液的存在;(2)嗜中性粒细胞浸润;(3)肺泡内出血/碎片;(4)细胞浸润;(5)细胞增生。这些病理特征中的每一个的严重程度通过0~5的评分来评估,如下:0,不存在/无;1、轻微;2、轻度;3、适中;4、中度;5、重度。
1.3.9 线粒体超氧化物和ATP含量测定 快速取出50 mg左叶肺组织,切成小块,放入预冷的含有1 mmol/L PMSF的分离试剂中。然后将组织均质化并在600×g、4℃下离心5 min。将上清液转移至另一管中,并在11 000×g、4℃下离心10 min。沉淀物含有分离的线粒体,并悬浮在储存缓冲液中。使用MitoSOX(Molecular Probes)测定线粒体超氧化物的产生。用溶解在DMSO中的MitoSOX处理分离的线粒体,最终浓度为5 μmol/L。在黑暗中在37℃下孵育10 min。随后,使用多模式阅读器检测MitoSOX的荧光,激发和发射波长分别为510 nm和580 nm。使用ATP测定试剂盒测定ATP浓度。将上清液添加到ATP测试工作缓冲液中。使用管式光度计测量荧光。
1.4 统计学方法 使用SPSS 20进行统计分析,所有数据均表示为平均值±标准差。使用双侧学生t检验分析两组之间的差异,使用Bonferroni的事后检验进行单向或双向ANOVA以进行多组之间的比较。P<0.05认为差异具有统计学意义。
2 结果
2.1 COPD患者气道上皮细胞中MTMR14表达情况 与对照组织相比,COPD患者气道上皮中MTMR14表达水平降低(图1A)。COPD患者的气道上皮细胞中MTMR14的蛋白表达较对照组降低,和Beclin1的蛋白表达和LC3Ⅱ与LC3Ⅰ的比值均增加(图1B)。

图1 MTMR14在患者气道上皮细胞中的蛋白表达Fig.1 Protein expression of MTMR14 in airway epithelial cells of COPD patients
2.2 CSE对人气道上皮细胞中MTMR14表达以及自噬水平影响 在24 h内暴露于浓度增加的CSE(0~8%)降低了MTMR14的蛋白表达。此外,Beclin1的蛋白质表达和LC3Ⅱ与LC3Ⅰ的比值在CSE处理的细胞中均以浓度依赖性方式在24 h内增加(图2A)。当NuLi-1细胞在48 h内暴露于6%CSE时,MTMR14的蛋白表达以时间依赖性方式降低。暴露于6%CSE在12、24 h上调NuLi-1细胞中Beclin1的蛋白质水平和LC3Ⅱ与LC3Ⅰ的比值,随后在48 h下降(图2B)。

图2 Western blot检测CSE对气道上皮细胞中MTMR14蛋白表达以及自噬水平影响Fig.2 Western blot detection of the effect of CSE on the expression of MTMR14 protein and the level of autophagy in airway epithelial cells
2.3 MTMR14对暴露于CSE的NuLi-1细胞活力和线粒体影响 在对照组细胞中,溶酶体和线粒体位于不同的细胞区室。在6%CSE组中,NuLi-1细胞中以黄色荧光的形式检测到溶酶体和线粒体共定位。用MTMR14预处理减弱了暴露于6%CSE的细胞中的线粒体自噬(图3)。与对照组相比,6%CSE组中细胞活力显著降低(P<0.05),和线粒体ROS、IL-6、IL-8水平显著升高(P < 0.05)。用MTMR14预处理减弱了暴露于6%CSE对细胞活力、线粒体氧化应激和炎症影响(表1)。
表1 MTMR14过表达对暴露于CSE的NuLi-1细胞中细胞活力、线粒体氧化应激和炎症影响Tab.1 Effects of MTMR14 overexpression on cell viability,mitochondrial oxidative stress and inflammation in NuLi-1 cells exposed to CSE ±s

表1 MTMR14过表达对暴露于CSE的NuLi-1细胞中细胞活力、线粒体氧化应激和炎症影响Tab.1 Effects of MTMR14 overexpression on cell viability,mitochondrial oxidative stress and inflammation in NuLi-1 cells exposed to CSE ±s
注:与对照组相比,**P <0.01、***P <0.001;与6%CSE+Vector组相比,#P <0.05、##P <0.01
组别对照组6%CSE组6%CSE+Vector组6%CSE+MTMR14组F值P值细胞活力(%)100.00±3.12 61.15±2.88**58.73±3.26**78.46±2.66#8.481<0.001相对线粒体ROS 1.00±0.06 4.86±0.42***4.53±0.45***1.98±0.25##28.633<0.001 IL-6(pg/mL)204.42±22.17 436.76±30.84***422.13±29.53***288.76±23.76##74.185<0.001 IL-8(pg/mL)255.76±28.32 841.79±53.26***805.71±48.62***471.90±33.68##63.902<0.001

图3 通过LysoTracker标记的溶酶体(绿色)和MitoTracker标记的线粒体(红色)的细胞室共定位来评估线粒体自噬Fig.3 Assessment of mitophagy by intracellular colocalization of LysoTracker-labeled lysosomes(green)and MitoTracker-labeled mitochondria(red)
2.4 MTMR14过表达改善CS诱导的COPD小鼠模型 CS能够引起严重的肺损伤,表现出明显的炎症细胞浸润、间质水肿和充血(图4A)。与对照+Vector组相比,CS+Vector组血清炎症标志物IL-6和IL-8水平明显升高(P <0.05)(图4B-D)。与CS+Vector组相比,CS+MTMR14组小鼠肺损伤减轻,以及IL-6和IL-8水平明显降低(P<0.05)(图4)。
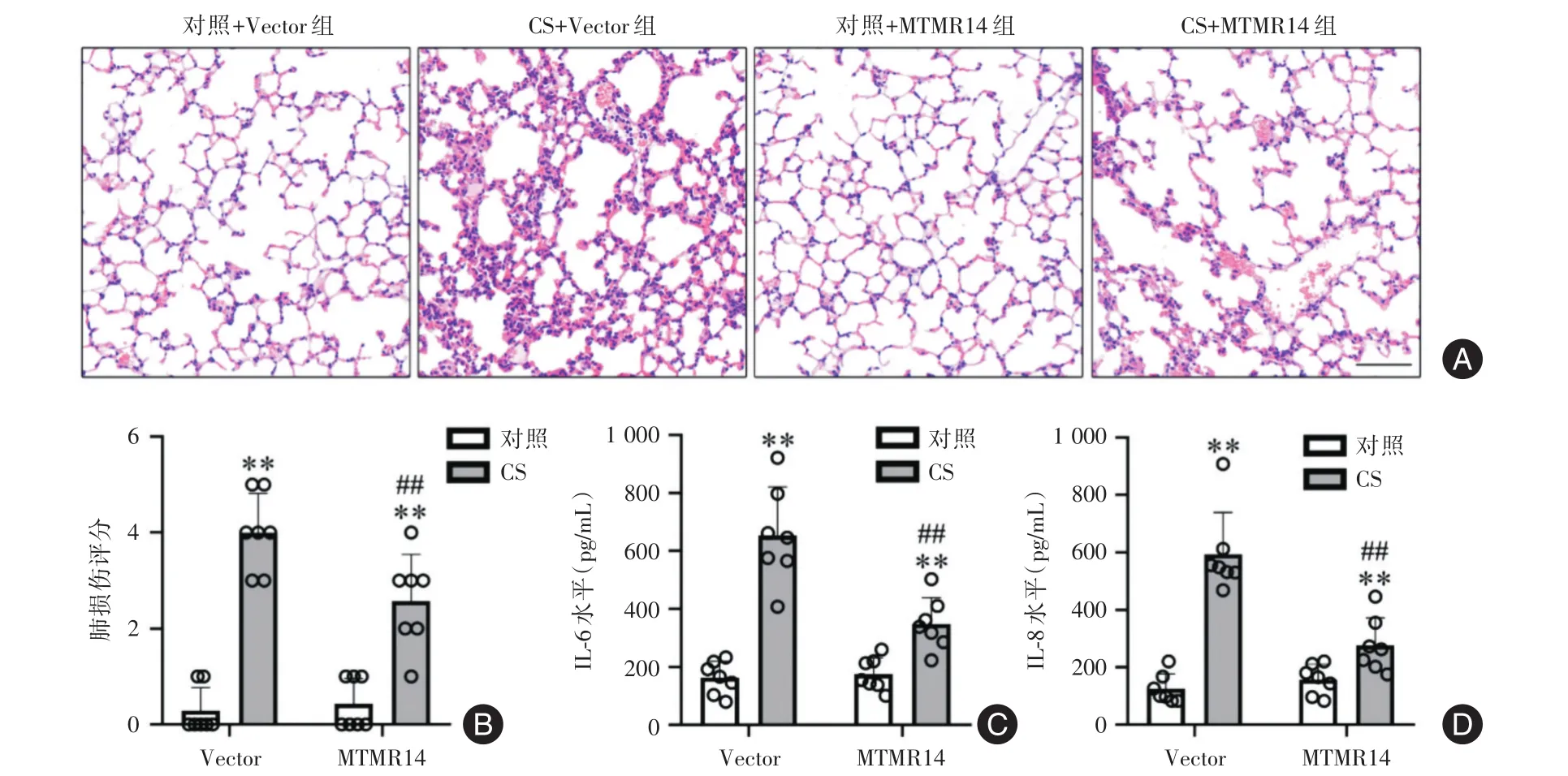
图4 MTMR14过表达改善CS诱导的COPD小鼠模型(n=7)Fig.4 MTMR14 overexpression improves CS-induced COPD mouse model(n=7)
2.5 MTMR14减轻CS模型小鼠肺组织线粒体功能障碍 与对照+Vector组相比,从CS+Vector组小鼠肺中分离出的线粒体显示出其ATP含量显著降低(P<0.05),以及线粒体超氧化物产生增加(P<0.05)。然而,与CS+Vector组相比,从CS+MTMR14组小鼠分离的线粒体ATP含量显著增加(P<0.05),以及线粒体超氧化物产生水平降低(P<0.05)(图5A-C)。
与对照+Vector组相比,从CS+Vector组小鼠肺组织线粒体中LC3Ⅱ/LC3Ⅰ、ATG5和ATG7的蛋白水平升高。CS+MTMR14组线粒体中LC3Ⅱ/LC3Ⅰ、ATG5和ATG7的蛋白水平较CS+Vector组降低(图5D)。
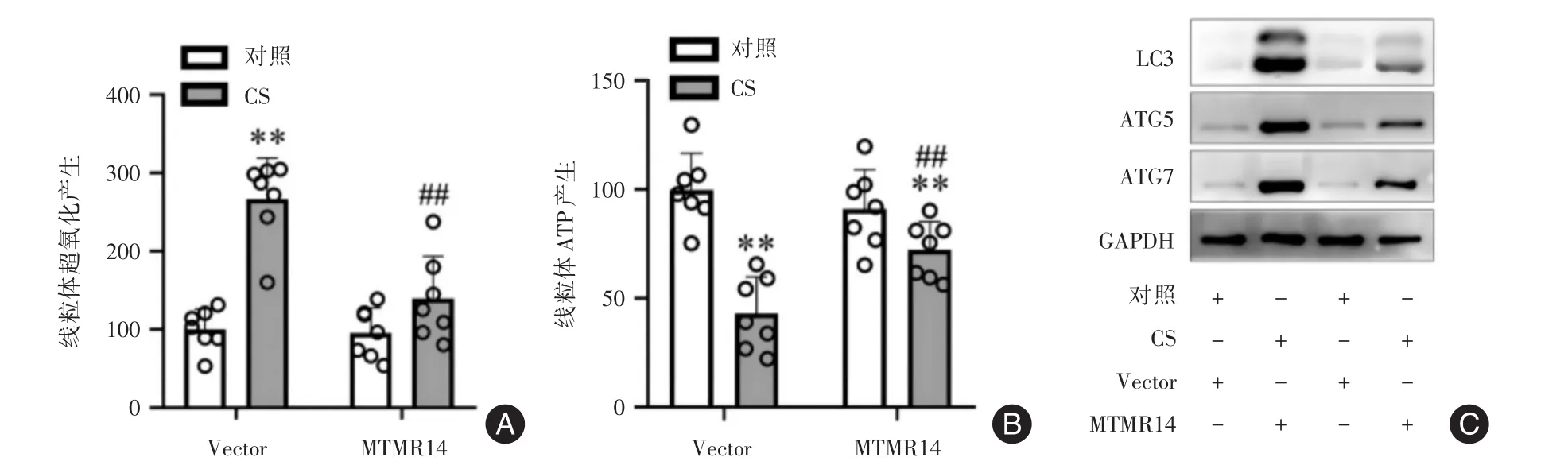
图5 MTMR14减轻CSE模型小鼠肺中的线粒体功能障碍(n=7)Fig.5 MTMR14 attenuates mitochondrial dysfunction in the lungs of CSE model mice(n=7)
3 讨论
对COPD患者支气管活检的研究报告了炎症基因和蛋白的表达增加,以及支气管上皮细胞的结构改变[12-13]。烟雾诱导的炎性细胞因子上调可能与COPD患者的肺功能、疾病严重程度和临床结果相关[14]。线粒体自噬是维持生理细胞功能所必需的,然而在COPD患者中过度的线粒体自噬可能会导致疾病的进展[15]。研究发现,在COPD小鼠和COPD患者中报告了线粒体自噬失调[16]。与线粒体自噬相关,parkin RBR E3泛素蛋白连接酶的过表达足以诱导线粒体自噬并促进CSE暴露的气道上皮细胞中线粒体ROS的产生以及细胞衰老[17]。因此,上调的气道上皮线粒体自噬可能会加剧COPD的进展[18]。本研究测定了COPD患者原发性气道上皮细胞的自噬水平,并发现COPD患者的原发性气道上皮细胞中自噬标志物Beclin1、LC3Ⅱ与LC3Ⅰ的比值显著增加。这些数据支持气道上皮线粒体自噬参与COPD的发病机制。
最近的研究报告了MTMR14参与人类疾病。YANG等[19]研究表明自噬相关基因MTMR14在结直肠癌中下调,通过上调MTMR14可促进结直肠癌细胞凋亡。与此一致,缺乏MTMR14的小鼠表现出高脂饮食诱导的脂质积累和炎症加速[20]。本研究中,MTMR14在COPD患者和CSE刺激的NuLi-1细胞中的表达下调,并且MTMR14过表达部分抑制了CSE诱导的炎症、活力降低和氧化应激。体内研究证实MTMR14在COPD模型小鼠中抑制炎症和肺气肿的发展。这些发现表明,MTMR14通过抑制炎症反应在COPD中发挥保护作用。气道上皮细胞线粒体是炎症小体激活、ROS产生、细胞凋亡和免疫反应的重要贡献者[21-22],所有这些都与COPD相关。因此,气道上皮细胞中的线粒体损伤被认为有助于COPD的发病机制。
线粒体是反应性物种的关键细胞来源,也是能够产生能量的细胞的动力室。线粒体结构的整合、线粒体钙的平衡、线粒体膜电位的稳定以及通过有丝分裂迅速清除受损线粒体,可维持线粒体内稳态和线粒体功能障碍[15]。线粒体功能障碍在调节炎症、氧化应激和凋亡方面起着关键作用,这些与慢性呼吸道疾病的发病机制有关,例如肺纤维化和COPD[23]。越来越多的证据表明,COPD患者的线粒体功能障碍主要表现为ROS增加、线粒体膜电位降低、线粒体结构破坏和线粒体吞噬失衡[24]。本研究证实了这些发现,笔者在COPD小鼠肺组织中分离出的线粒体显示出其ATP含量显著降低,以及线粒体超氧化物产生增加,表明线粒体存在功能障碍。研究发现,CSE诱导的过度线粒体自噬导致炎症和细胞损伤加重,而通过抑制CSE诱导的线粒体自噬改善线粒体功能障碍,延缓细胞衰老,并最终抑制病理性COPD进展[25]。本研究结果表明,MTMR14过表达抑制COPD小鼠肺组织过度线粒体自噬,这一病理改变可能参与改善线粒体功能障碍。
总之,本研究结果提供了MTMR14在COPD中的保护作用的相关证据。MTMR14过表达减轻COPD的炎症和肺气肿,这在一定程度上取决于线粒体功能和线粒体自噬的调节。然而,研究并没有对MTMR14介导的下游通路进行分析。在未来的研究中,将进一步探索MTMR14如何调节线粒体自噬,旨在明确MTMR14在COPD发展中的临床价值和潜在机制。
