锁阳多糖通过激活PI3K/Akt/GSK3β/β-catenin信号通路促进MC3T3-E1细胞成骨分化
2023-01-10胡俊谈荣珍袁忠杨盼盼张楚焌张斌沈云峰
胡俊 谈荣珍 袁忠 杨盼盼 张楚焌 张斌 沈云峰
1南昌市洪都中医院骨伤七科(南昌 330008);2南昌大学第二附属医院内分泌代谢科(南昌 330006)
骨质疏松症(osteoporosis,OP)是一种主要好发于绝经后妇女、常见的系统性骨骼疾病,其特征是骨微结构损伤或骨量减少,最终导致骨脆性增加和骨折风险上升[1]。目前国内40岁以上的人群中被确诊为骨质疏松症占3.2%,65岁以上老年人群的确诊率则达到了惊人的32.0%[2]。所以,骨质疏松症的防治具有重要的社会和经济意义。而目前双磷酸盐类药物作为主要的抗骨质疏松治疗手段,常伴随着患乳腺癌,下颌坏死或不典型股骨骨折等副作用[3]。因此,中药在骨质疏松症中的治疗作用逐渐受到重视,其疗效也被得到越多临床和基础研究的证实[4-5]。
锁阳为具有补肾益精作用的锁阳科植物,多见于新疆、青海、内蒙古等地的,也常作为治疗骨质疏松的中药方剂中的重要组成[6]。虽然锁阳多糖(cynomorium songaricum polysaccharide,CSP)作为锁阳的主要有效成分之一[7],但其促进成骨细胞分化的作用仍未得到充分地阐明,有待进一步深入研究。PI3K/Akt通路是一种在哺乳动物中具有广泛调控作用的通路,对多种细胞的增殖和凋亡都起着重要作用[8-9]。 激活的蛋白激酶B(Akt)可磷酸化糖原合酶激酶3β(GSK3β),并进一步调控Wnt/β-catenin通路,从而对骨代谢过程产生影响[10-11]。本研究目的在于观察CSP对MC3T3-E1细胞成骨分化的影响,并进一步验证CSP是否通过调控PI3K/AKT/GSK3β/β-catenin通路起效。
1 材料与方法
1.1 主要试剂与仪器 从中国科学院上海细胞所细胞库购入的MC3T3-E1细胞株。CSP从宁夏香草生物技术有限公司购入;成骨细胞矿化结节茜素红染液和β-catenin免疫荧光染色试剂盒购自上海碧云天生物技术有限公司;NVP-BEZ235(BEZ)购自Selleck公司;RNA提取试剂盒和逆转录试剂盒购自日本Takara公司;Western Blot抗体购自Cell signaling公司。蛋白免疫印迹所用的电泳仪/电转仪和实时荧光定量PCR仪购自美国Bio-Rad公司。
1.2 方法
1.2.1 MTT比色法检测MC3T3-E1的细胞活性
利用MTT试验来观察不同浓度的CSP(0、25、50、100 μg/mL)对生长期对数期的MC3T3-E1细胞活力的影响。每组设3个复孔。按说明书流程在CSP干预后的第1、3、5、7天,使用酶标仪在490 nm波长下测量吸光度,以定量观察MC3T3-E1的增殖活力。
1.2.2 茜素红染色 将生长至对数期的MC3T3-E1细胞种于24孔板中;24 h后待细胞贴壁,改用成骨诱导培养基(10 mmol/L β甘油磷酸钠、50 μmol/L抗坏血酸、1×10-8mol/L地塞米松)培养,并根据不加CSP、加入100 μg/mL CSP、同时加入100 μg/mL CSP及50 μmol/L BEZ,将细胞分为Con组、CSP组及CSP+BEZ组。每3 d换液1次,干预14 d后对各组细胞进行茜素红染色,显微观察每组的矿化结节情况。
1.2.3 Real-time PCR测定相关成骨分化mRNA的表达水平 在6孔板中,用不含、含100 μg/mL CSP、100 μg/mL CSP 及 50 μmol/L BEZ 的成骨诱导培养基进行培养MC3T3-E1细胞,每3 d换液。待细胞成骨分化14 d后,提取细胞的总RNA,并进行cDNA的逆转录与扩增。Real-time PCR引物序列如下:GAPDH-正义链5'-CAAGAGCACAAGAGGAAGAGAG-3',反义链5'-CTACATGGCAACTGTGAGGAG-3';Runx2-正义链 5'-GCTT-CATTCGCCTCACAAAC-3',反义链 5'-GTAGTGA-CCTGCGGAGATTAAC-3';Osteocalcin-正义链 5'-AAATAGCCCTGGCAGATTCC-3',反义链5'-CAGC-CTCCAGCACTGTTTAT-3';β-catenin-正义链5'-CT-TCACCTGACAGATCCAAGTC-3',反义链5'-CCTTCCATCCCTTCCTGTTTAG-3';Collagen I-正义链 5'-CTAAAGGCGAACCTGGTGAT-3',反义链5'-TCCAGGAGCACCAACATTAC-3'。反应条件设置为:95℃预变性10 min,95℃变性20 s,58℃退火30 s,72℃延伸45 s,共扩增40个循环。通过Ct值计算2-△△Ct结果,将目的基因的结果与GAPDH内参基因结果相除以标准化mRNA的表达水平。
1.2.4 Western Blot检测相关蛋白 干预方式同1.2.2,每组含3组重复。14 d后通过RIPA裂解液提取孔内的蛋白,进行蛋白浓度计算后,配置好10%的蛋白电泳胶后,每孔加入20 μL蛋白样本进行电泳,随后进行转膜、封闭和一抗过夜孵育。其中鼠抗人一抗:Runx2、Osteocalcin、Collagen Ⅰ、PI3K、p-PI3K、Akt、p-Akt、GSK3β、p-GSK3β、βcatenin、β-actin;室温下二抗孵育2 h并用TBST洗膜后,使用ECL曝光液进行曝光,分析条带的曝光强度。
1.2.5 免疫荧光检测β-catenin的表达 待细胞成骨分化14 d后,去除培养基,加入4%多聚甲醛固定细胞15 min,并使用0.1%的曲拉通透膜20 min。每孔细胞经历20 min血清封闭后,加入β-catenin一抗放置于4℃冰箱中过夜。次日加入荧光二抗在室温条件下孵育2 h;经DAPI避光染色2 min后,在暗室内通过荧光显微镜进行拍照。
1.3 统计学方法 使用SPSS 22.0软件进行统计学分析,所有数据均以(±s)表示,两组间计量资料的比较采用独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 CSP浓度对MC3T3-E1细胞增殖的影响
MC3T3-E1细胞在不同浓度的CSP干预7 d后,未见明显细胞毒性;与其他浓度比较,100 μg/mL CSP在1~7 d里,促细胞增殖效果均更加明显(P<0.05)。见图1。

图1 不同浓度CSP对MC3T3-E1增殖影响Fig.1 Effects of CSP at different concentrations on the proliferation of MC3T3-E1
2.2 CSP对MC3T3-E1成骨分化影响 CSP干预14 d后,钙化结节明显增多,面积显著高于对照组(P<0.01),但加PI3K阻断剂后CSP的促进作用明显被减弱(P<0.01)。见图2。

图2 CSP干预14 d对MC3T3-E1成骨分化的影响Fig.2 The effect of CSP for 14 days on osteogenic differentiation of MC3T3-E1
2.3 CSP对相关成骨分化mRNA表达的影响
CSP干预 14 d后,Runx2、β-catenin、Osteocalcin、Collagen I mRNA的表达水平明显高于对照组(P<0.05);但是加入PI3K阻断剂干预后,CSP对成骨相关mRNA表达的促进作用被明显削弱(P<0.05)。见图3。

图3 CSP干预14 d对MC3T3-E1细胞成骨分化标志物的影响Fig.3 The effect of CSP for 14 days on osteoblastic differentiation markers of MC3T3-E1 Cells
2.4 CSP对成骨相关蛋白的影响 CSP干预14 d后,Runx2、Collagen I、Osteocalcin的表达水平明显高于对照组(P<0.05);但是PI3K阻断剂明显逆转CSP对成骨相关蛋白的促进作用(P<0.05)。见图4。
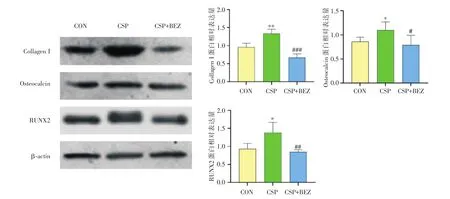
图4 CSP干预14 d对MC3T3-E1细胞成骨分化相关蛋白的影响Fig.4 Effects of CSP at different concentrations on osteogenic differentiation-related proteins of MC3T3-E1 cells
2.5 CSP对PI3K/Akt/GSK3β/β-catenin信号通路相关蛋白表达影响 使用CSP干预14 d后,Akt、GSK3β蛋白表达无明显变化;但PI3K、p-PI3K、Akt、GSK3β、β-catenin蛋白经CSP干预后表达水平均明显增加(P<0.01);而加入BEZ后则明显逆转了上述蛋白水平的增加趋势(P<0.05)。见图5。

图5 CSP干预14 d对PI3K/Akt/GSK3β/β-catenin信号通路相关蛋白的影响Fig.5 The effect of CSP for 14 days on PI3K/Akt/GSK3β/β-catenin signaling pathway related proteins
2.6 CSP对β-catenin蛋白核移位的影响 使用CSP干预14 d后,CSP组的β-catenin蛋白核位移现象明显多于对照组;而CSP+BEZ基本观察不到核位移。见图6。
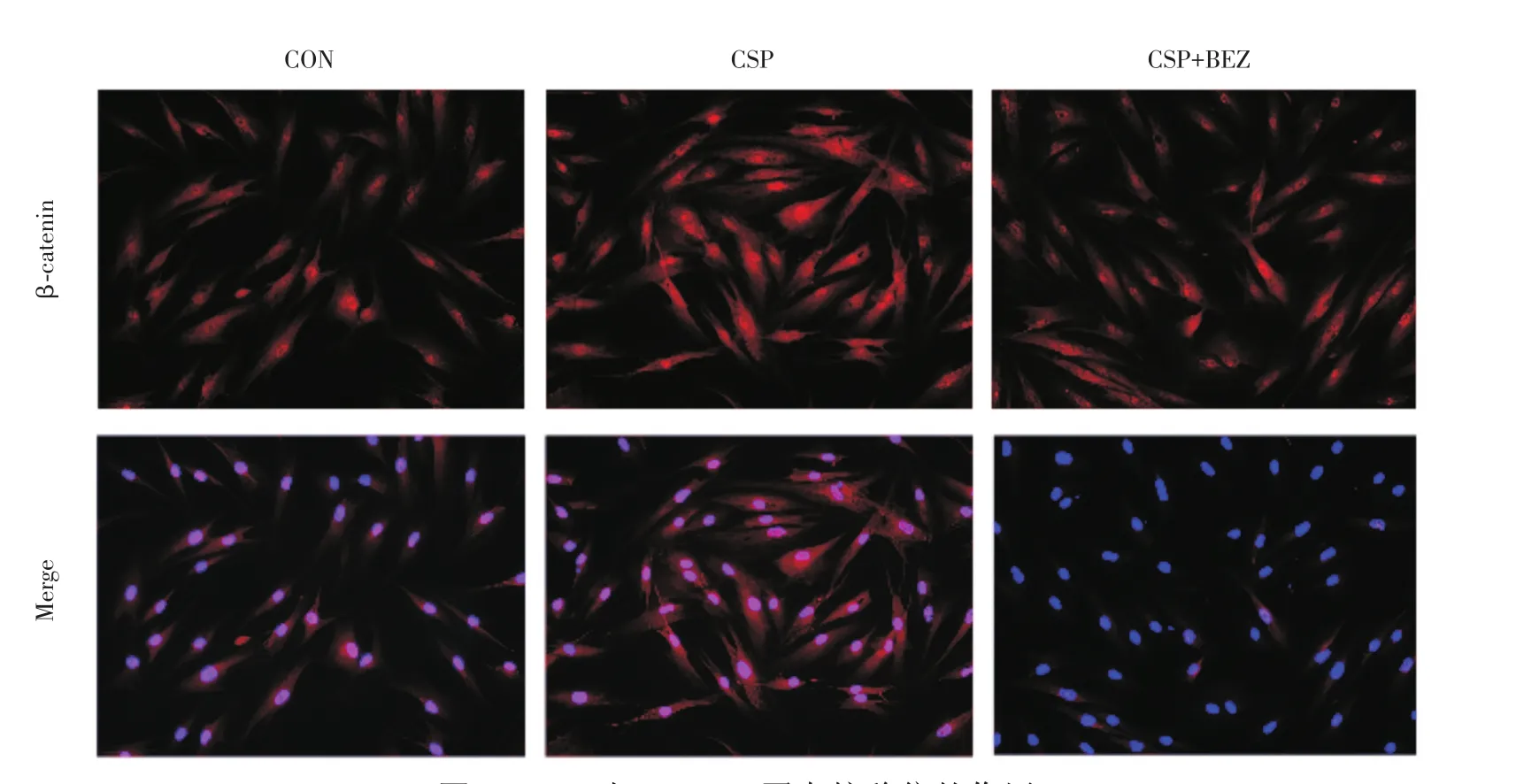
图6 CSP对β-catenin蛋白核移位的作用Fig.6 The effect of CSP on the nuclear translocation of β-catenin protein
3 讨论
本研究经PCR、Western Blot等实验证明CSP可有效促进Runx2、β-catenin、Osteocalcin、CollagenⅠ这些成骨相关的mRNA表达水平,并且可促进β-catenin入核。Runx2在成骨早期阶段表达,对细胞的功能、成骨分化起到重要的调控作用;而Osteocalcin、Collagen I则是钙沉积和成骨分化的重要标志[12-13]。茜素红染色实验也从表型上证明了CSP促进MC3T3-E1细胞成骨分化的作用;CSP对成骨相关蛋白的促进作用也得到Western Blot实验结果验证。Western Blot实验则进一步揭示了这一促进作用背后可能涉及到PI3K/Akt/GSK3β/β-catenin通路;加入PI3K抑制剂后上述作用均被明显逆转,因此反向加强验证了CSP促成骨分化的作用。
既往有研究指出,锁阳乙醇提取物可明显减少去卵巢大鼠的骨丢失,相关分子机制可能与血清成骨标志物ALP、OCN表达增加、破骨标志物TRAP、CTSK表达减少及GSH-PX和SOD、抑制MDA等氧化应激相关酶活性提高有关[14]。CSP也被证实具有改善去卵巢大鼠骨质疏松作用,作用机制可能与其提高雌激素水平、增加OPG/RANKL蛋白比例有关[15]。但未见其在PI3K/Akt通路相关领域的研究,基于此,本研究继续深入CSP促进成骨分化的可能机制。
在细胞增殖、分化、转移、凋亡等重要的过程,PI3K/Akt信号通路均广泛参与,并扮演至关重要的调控角色。新近研究也发现,骨髓间充质干细胞成骨分化的增加也与该通路的激活密切相关[16-17]。另一方面,抑制PI3K/Akt通路会降低ALP、OCN、Osterix、和Runx2的表达水平,因此抑制成骨细胞分化[18]。此外,GSK-3β作为该通路的关键调控靶点之一,Akt能够明显抑制GSK-3β的磷酸化致其失活,降低对β-catenin的降解作用,让更多的βcatenin入核促进下游的促细胞增殖、成骨基因表达[19-20]。提示PI3K/Akt/GSK3β/β-catenin通路在成骨分化过程中至关重要。本研究也发现其参与了CSP的促成骨分化过程。
综上所述,本研究发现CSP促MC3T3-E1细胞成骨分化的机制与其增加成骨相关标志物表达、促进β-catenin入核有关,而其中PI3K/Akt/GSK3β/β-catenin通路起到关键的调控作用,但仍待动物体内实验作进一步验证。
