子宫颈脱落细胞块联合p16/Ki-67双染在意义不明确的非典型鳞状上皮细胞和低级别鳞状上皮内病变的筛查意义
2023-01-10张波杨志敏康子婧康凯夫许萍榕邹倩朱伟王效军
张波 杨志敏 康子婧 康凯夫,4 许萍榕 邹倩 朱伟, 王效军
1广东医科大学附属第三医院(佛山市顺德区龙江医院)病理科(广东佛山 528000);2佛山市南海区第四人民医院病理科(广东佛山 528000);3南方医科大学顺德医院(佛山市顺德区第一人民医院)(广东佛山 528000);4广东医科大学顺德妇女儿童医院(佛山市顺德区妇幼保健院)(广东佛山 528000);5广东医科大学病理学系病理学技术教研室(广东东莞 523808);6广东医科大学公共卫生学院流行病与统计学系(广东东莞 523808)
子宫颈癌(cervical cancer,CC)是女性癌症死亡的第三大主要病因,是女性生殖系统第二大常见肿瘤[1],多数为持续性高危型人乳头瘤病毒(high-risk human papillomavirus,HR-HPV)感染所致。根据国家癌症中心《2020年全国癌症中心年度工作报告》显示,子宫颈癌发病率位于第6位,死亡率位于第8位[2]。子宫颈癌筛查不仅要提高敏感度,还要提高特异度,从而有效准确诊断HPV阳性或细胞学为意义不明确的非典型鳞状上皮细胞(atypical squamous cells of undetermined significance,ASC-US)和低级别鳞状上皮内病变(low-grade squamous intraepithelial lesion,LSIL)的病例。病理活检诊断为有创检查不能成为常规筛查手段,p16/Ki-67可有效区分子宫颈上皮内病变(cervical intraepithelial neoplasia,CIN)并分级,薄层液基细胞学(thinprep cytologic test,TCT)联合p16/Ki-67对诊断高级别鳞状上皮内病变(highgrade squamous intraepithelial lesion,HSIL)特异度更高,但在进一步分流ASC-US病变中针对LSIL染色判读以及子宫颈脱落细胞块(cell block,CB)应用于子宫颈癌筛查相关文献鲜有报道。因此本文针对LSIL精准判读p16/Ki-67双染染色、CB联合p16/Ki-67双染在ASC-US和LSIL分流的应用进行探讨,根据研究数据判定其可行性,为子宫颈癌及癌前病变的早期筛查提供可靠的诊断依据。
1 材料与方法
1.1 材料 收集2020年12月至2022年6月在广东医科大学附属第三医院(佛山市顺德区龙江医院)和佛山市南海区第四人民医院妇科门诊就诊的符合本研究纳入标准的患者500例进行CB制备,以子宫颈活检诊断为最终标准筛选出210例进行常规切片HE染色和p16/Ki-67双染。入组病例年龄19~63岁,平均37岁。其中ASC-US 100例,LSIL 110例。入选标准:(1)TCT筛查报告为ASCUS和LSIL并同时接受DH3(人乳头瘤病毒核酸检测试剂盒)杂交捕获-化学发光法技术行HR-HPV DNA检测;(2)TCT报告取样后1个月内接受阴道镜下活检;(3)制备CB并行p16/Ki-67检测;(4)非妊娠状态;(5)既往宫颈筛查结果正常,无宫颈手术史,无任何其他恶性肿瘤史,无自身免疫性疾病或正在接受免疫抑制治疗;(6)经广东医科大学附属第三医院(佛山市顺德区龙江医院)医学伦理委员会审批(编号:[2020科]院伦审第1411号)。
1.2 方法
1.2.1 TCT制备 按TCT要求取样,采用全自动液基细胞制片染色系统(沉降式)完成子宫颈脱落细胞学制片、巴氏染色。依据2014年新修订的子宫颈细胞学Bethesda分类系统(the bethesda system,TBS)进行细胞学诊断,获取ASC-US和LSIL有效样本。
1.2.2 简易标准化CB制备及HE染色 (1)将TCT制备后剩余子宫颈脱落细胞样本倒入新的细胞保存液,用振荡器震荡2 min,将采样器宫颈刷上的细胞充分震荡入细胞保存液内;(2)将保存液内加入适量伊红染液,2 000 r/min离心5 min,弃去上清;加入95%乙醇3~4 mL震荡均匀,静止2 h;2 000 r/min离心5 min,弃去上清;富集样本后转移至滤纸包埋盒行常规固定、脱水、透明、浸蜡、包埋、制片和HE染色。制备好的CB细胞富集居中色泽鲜明清晰可见,部分病例可表现出类似组织学样结构。
1.2.3 p16/Ki-67双染 CB切片制备后,采用粘附载玻片捞取连续2张切片,65℃烤片1 h,手动脱蜡后采用手工SOP法p16/Ki-67免疫细胞化学双染染色,经过:(1)高压抗原修复;(2)浸入PBS缓冲液;(3)阻断内源性过氧化物酶,滴加过氧化物酶阻断剂50 μL,室温孵育;(4)滴加混合一抗 p16/Ki-67试剂50 μL;(5)滴加混合聚合物二抗试剂(安必平)50 μL,室温孵育;(6)滴加新鲜配制 DAB显色液100 μL,室温孵育;(7)滴加新鲜配制Fast-Red显色液100 μL,室温避光孵育;(8)苏木素染色液复染3~5 s,蒸馏水充分冲洗;(9)PBS缓冲液返蓝;(10)梯度酒精脱水、透明、中性树胶封固。
1.2.4 HR-HPV检测 采用DH3杂交捕获-化学发光法技术对子宫颈脱落细胞行HR-HPV DNA检测(杭州德同生物技术有限公司),包括2种HRHPV型别(HPV16、18型)和12种HR-HPV型别(HPV31、33、35、39、45、51、52、56、58、59、66和68型),具体操作按说明书进行。所有检测都以样本测量值/参考值的比值表示,比值≥1.0,结果为“阳性”;比值<1.0,结果为“阴性”。
1.2.5 阴道镜检查和活检 使用电子阴道镜数字成像系统依据阴道镜操作规范,充分阴道镜检查后,立即在异常病变最严重的部位进行活检,若无异常则常规3、6、9及12点行多点活检,福尔马林固定液固定活检的组织标本送至病理科。
1.2.6 结果判定 (1)细胞学诊断:采用TBS分级系统完成TCT制片及CB的HE染色判读,所有病例均采用双盲并固定2名经验丰富的主治医师及副主任医师分别阅片后共同完成结果判读;(2)子宫颈活检诊断:采用组织学诊断;(3)p16/Ki-67双染判读:笔者前期研究[3]中确定CB在整张载玻片(4张连续切片)发现一个阳性细胞(细胞同时p16和Ki-67特异性细胞质棕色和细胞核红色)即判读为阳性;将单个细胞染色或双染阳性细胞数<5%定义为阴性,最终实验结果中显示LSIL组中CB双染的敏感度低于TCT。本次研究将CB中p16胞质淡黄或浅棕色,或同时具有Ki-67细胞核浅红色颗粒,结合TCT细胞学形态,即可判读为LSIL;p16/Ki-67双染强阳性,结合TCT细胞学形态为HSIL;其余情况均为未见上皮内病变或恶性病变(negative for squamous intraepithelial lesions or malignancy,NILM),见图1。

图1 p16/Ki-67双染判读(×20)Fig.1 The interpretation of p16/Ki-67 dual-staining(× 20)
1.3 统计学方法 诊断以活检组织病理诊断为“金标准”,采用SPSS 22.0及Meta-DiSc1.4软件进行统计学分析,计数资料以率表示,采用χ2检验,以P<0.05为差异有统计学意义。以敏感度、特异度、阳性预测值和阴性预测值来评价HR-HPV、CB及p16/Ki-67双染的筛查、分流应用效果。
2 结果
2.1 LSIL组病例进行p16/Ki-67双染分析判读染色特征 LSIL组细胞p16/Ki-67双染会呈现以下两种情况:p16胞质淡黄色或浅棕色,Ki-67核不染色;p16胞质淡黄色或浅棕色,Ki-67核显示浅红色颗粒状。
2.2 CB、HR-HPV及p16/Ki-67双染三种筛查方法在ASC-US和LSIL中的诊断价值比较 明确LSIL的p16/Ki-67双染表达模式后,在LSIL组对比不同筛查方法的敏感度、特异度、阳性预测值和阴性预测值结果见表1、图2。
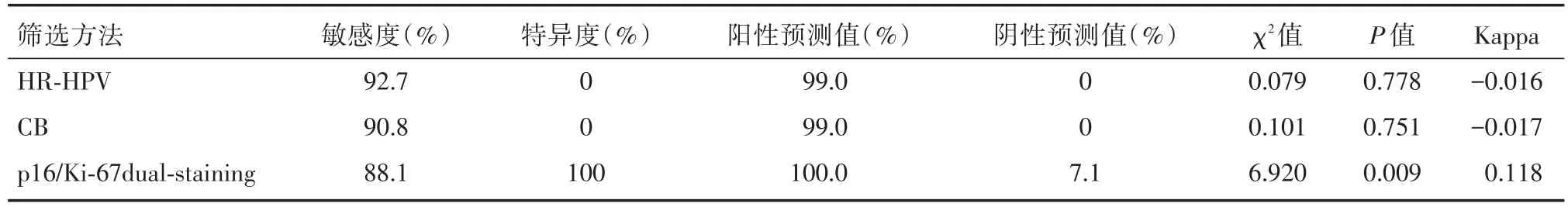
表1 LSIL组中HR-HPV、CB和p16/Ki-67双染结果比较Tab.1 Comparisonof HR-HPV,CB and p16/Ki-67 dual-staining in LSIL group
在ASC-US组进一步分析p16/Ki-67双染结合CB的分流,对比不同筛查方法的敏感度、特异度、阳性预测值和阴性预测值结果见表2、图2。
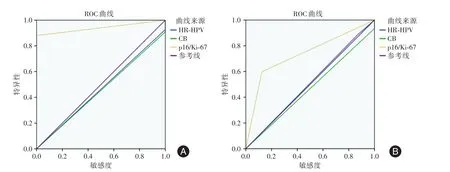
图2 LSIL和ASC-US组中三种筛查方法ROC曲线下面积Fig.2 The area under the ROC curve of the threescreening methods in the LSIL and ASC-US group

表2 ASC-US组中HR-HPV、CB和p16/Ki-67双染结果比较Tab.2 Comparisonof HR-HPV,CB and p16/Ki-67 dual-staining in ASC-US group
按照30岁进行年龄分层,LSIL组及ASC-US组中HR-HPV、CB和p16/Ki-67双染结果比较见表3、4。

表3 LSIL组中HR-HPV、CB和p16/Ki-67双染结果比较Tab.3 Comparisonof HR-HPV,CB and p16/Ki-67 dual-staining in LSIL group
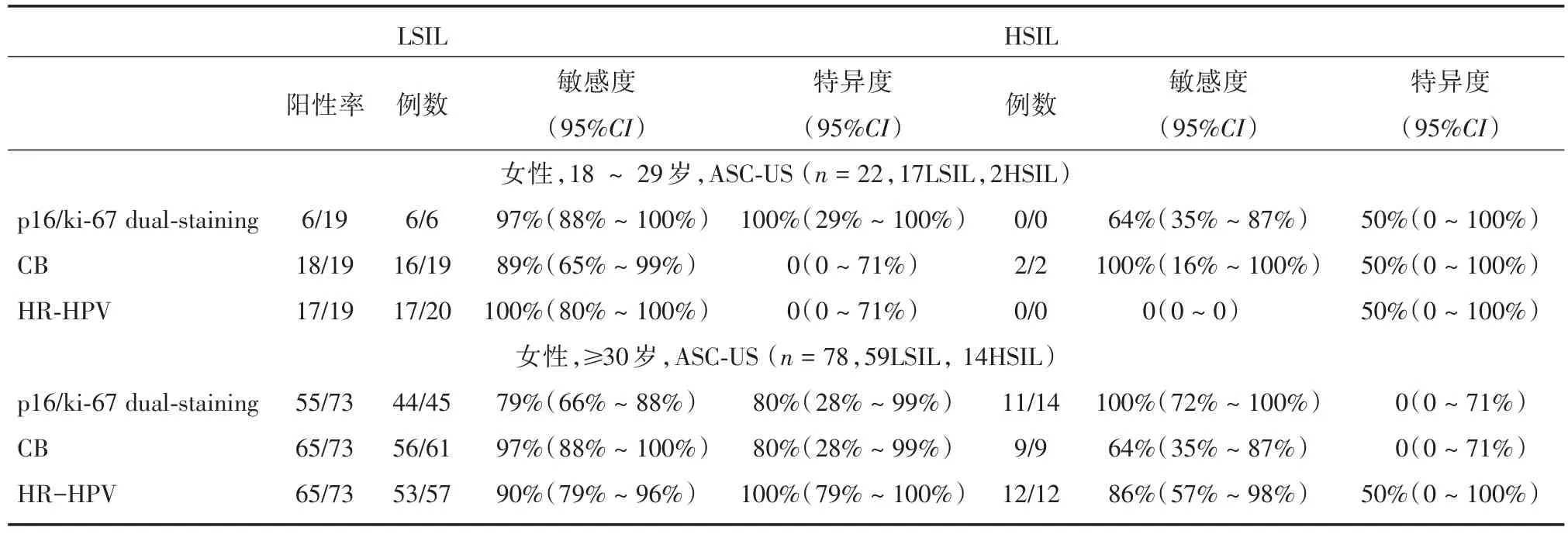
表4 ASC-US组中HR-HPV、CB和p16/Ki-67双染结果比较Tab.4 Comparison of HR-HPV,CB and p16/Ki-67 dual-staining in ASC-US group
3 讨论
HR-HPV联合TCT检测被广泛应用于宫颈癌初筛中,有效提高了敏感性[4],由于假阳性、假阴性或一过性感染等原因,两者的敏感度或特异度均不能满足目前筛查子宫颈癌工作的需求,较早发现并成功阻断HR-HPV持续性感染是预防CIN或子宫颈癌的关键。HPV是一种双链闭环的DNA病毒,基因组包括E6和E7两个主要致癌基因,分别结合机体抑癌基因p53和pRb蛋白并使其降解和失活,发生免疫逃逸,一旦E6和E7蛋白与p53和pRb亲和力较大,病毒在机体持续感染,就会增加致癌风险。HPV病毒的免疫逃逸机制包括蛋白转录、抗原递呈调节、细胞因子调节以及信号通路方面调节等[5-6]。针对以上免疫逃逸机制,目前除了HPV疫苗成为子宫颈癌预防和治疗较有效的方法外,尚无较满意的预测HPV感染的生物学标记[7]。因此,进一步选择特异度和敏感度均较高的筛查方式是目前的工作重点。ASC-US在TCT筛查结果中仅次于NILM,是目前子宫颈癌筛查领域分层管理、减少不必要活检及避免过度治疗的重点关注领域。ASC-US并HPV阳性者推荐阴道镜活检,阴道镜活检是有创检查,尤其对于年龄<30岁或者孕期女性,易导致不必要的过度忧虑。单独检测HR-HPV易造成>10%的宫颈癌漏诊(尤其是腺癌)[8]。CB是一种评估子宫颈样本的重要诊断工具,满意的CB制备难度较大,成为影响病理医师诊断准确性的主要因素[9]。前期研究[10]探讨了一种数控标准化(numerical control standardized,NCS)技术用于子宫颈CB的制备,效果可靠、稳定,在获取细胞量较少的标本类型尤其有优势,但成本偏高,不易在基层病理推广应用。本研究经反复实验总结出一套CB制备流程,制备好的CB细胞集中均匀分布、成本低。FANNY等[11]研究指出,标准化制备的CB联合p16/Ki-67双染等其他生物学标记较TCT诊断准确性更好,可代替宫颈活检对LSIL的进展进行分类。本研究采用CB联合p16/Ki-67双染作为筛查方法,在年龄<30岁组中ASC-US具有较高的敏感度(97%)和特异度(100%),可作为较有效的生物学检测指标替代活检,降低有创检查比例,结论与其相符。本研究在TCT诊断LSIL病例中CB和p16/Ki-67双染比HR-HPV检测具有更好的敏感度(90.8%)和特异度(100%),建议使用两者进行分流。但本研究侧重探讨TCT诊断为LSIL的p16/Ki-67双染判读,降低ASC-US占比,而不是大多数关于诊断HSIL的双染研究[12]。
p16/Ki-67双染是近年来备受关注的免疫细胞化学,p16蛋白是细胞周期依赖性激酶抑制剂,对细胞增殖和分裂起负调节作用,是受同细胞周期调控密切相关的转录活化因子E2F蛋白(E2F transcription factors)活化的下游靶基因,感染子宫颈上皮细胞的HR-HPV的E7蛋白能与pRb蛋白结合并诱导后者降解或失活,致使pRb-E2F复合物中的E2F解离为游离状态,故使其下游的靶基因p16表达上调。以上机制反映出,p16表达上调表明HPV E6和E7癌基因整合到了宿主子宫颈上皮细胞,并促进子宫颈病变的进一步发展,最终导致子宫颈癌变,其阳性表达可早于子宫颈细胞学形态出现变化之前[13]。ZHANG等[14]提出p16在与HPV感染相关的恶性肿瘤中如食管癌、口腔癌、宫颈癌等呈高表达,p16表达与CIN级别具有显著一致性。Ki-67是增殖性细胞核抗原,可作为细胞增殖标志物,在p16/Ki-67双染中,随着子宫颈CIN病变程度的进展其表达也相应增高。正常循环细胞内或者细胞周期仍在正常调控中时p16和Ki-67相互排斥不能同时表达,而双染阳性提示HPV感染导致细胞周期调节失常[15],并且成为区分潜在HSIL的客观依据[12,16]。以上各项研究表明,NILM、LSIL 及HSIL均可出现p16/Ki-67双染阳性表达,随着病变级别升高,双染阳性率占比增加,似乎与上述双染阳性表达机制相悖,而且有研究[12]认为HSIL双染检测仅依据染色结果不依赖于细胞形态特征,可直接根据双染表达情况来判读。但上述NILM和LSIL也可出现双染阳性表达情况,本研究认为p16/Ki-67双染需要结合细胞形态学综合判读,尤其在ASC-US和LSIL中。
综上所述,细胞学和HR-HPV检测提高了子宫颈癌筛查的敏感性,但同时增加了阴道镜转诊数量。p16/Ki-67双染细胞学检查,无论单独还是与其他筛查方法相结合,都可以作为HPV阳性妇女阴道镜检查的一种敏感而有效的检查方法[17-18]。CB技术在子宫颈癌筛查文献中虽报道较少,但文献显示CB技术对比细胞学在阳性检出率上具有独特优势,尤其CB在联合p16/Ki-67双染能够弥补TCT中主观因素导致的漏诊及误诊,具有较高的敏感度和特异度,对于细胞量少的标本具有显著的优势,可进一步完善子宫颈癌筛查分流管理,降低阴道镜转诊率,是一种可靠的子宫颈癌前病变联合筛查方式,具有极其重要的应用及推广价值[1,19]。除了以上各种筛查方法,2016 年针对HPV16和HPV18的二价疫苗被中国食品药品监督管理局(CFDA)推出并批准用于9~ 45岁人群[20]。近年研究[21]显示,人工智能细胞学辅助阅片系统使子宫颈TCT对ASC-US和LSIL具有更高的敏感性,提高工作效率和诊断准确率。赵涌等[22-23]认为,HPV E6/E7 mRNA筛查细胞学诊断为ASC-US、LSIL和不除外高度病变的不典型鳞状上皮细胞(atypical squamous cells cannot exclude high grade intraepithelial lesion,ASC-H)的患者效能优于杂交捕获法检测13种HR-HPV,为宫颈癌筛查的分流提供了思路。研究[24]显示,EB病毒(epstein-barrvirus,EBV)和HPV通过表观遗传调控与各种恶性肿瘤密切相关。研究统计,约有60%的宫颈癌患者癌组织存在EBV感染[25]。据此推断子宫颈癌可能是HPV和EBV协同感染作用的结果。
本研究旨在探究创伤性小的、可取代活检的检测方法来完成宫颈癌筛查,限于样本数量,后续仍需更多的数据来支持和验证本研究结果。通过本研究采用的联合筛查方法,随访部分患者术后3~6个月TCT结果为NILM。综上,下一步结合人工智能细胞学辅助阅片系统进一步探讨更加精准的筛查方法,同时提高HPV疫苗接种率,尽早实现人类消除子宫颈癌的战略目标。
