马铃薯秸秆降解菌的筛选鉴定及其降解能力测定
2022-12-30修志君宋亚迪张冬梅杨春芳张学峰张笑宇
修志君 宋亚迪 张冬梅 杨春芳 张学峰 张笑宇*
(1 内蒙古农业大学园艺与植物保护学院,内蒙古呼和浩特 010020;2 乌兰察布市新时代文明实践指导中心,内蒙古乌兰察布 012000)
自从我国提出禁烧秸秆、推进秸秆综合利用的政策,秸秆利用率大幅提升,玉米、小麦、水稻秸秆利用率较高。马铃薯秸秆通常采用破碎还田,但只是破碎成较小的秸秆,而马铃薯主要种植区气候冷凉、干旱少雨,秸秆降解较慢,且内蒙古西部乌兰察布市大部分地区没有深翻地的耕作习惯,或是在一年播种多茬的地区,秸秆降解也较慢。
我国马铃薯种植面积居世界首位(张烁,2021),2017 年至今播种面积占全球的29.88%以上(徐宁 等,2021)。内蒙古是我国马铃薯的主要种植区,随着马铃薯种植面积的增加秸秆处理问题突显。马铃薯秸秆量大,且大部分病原菌在土壤或土壤中的病残体上越冬,如马铃薯黑痣病(Rhizoctoniaspp.)、马铃薯枯萎病(Fusariumspp.)和马铃薯黄萎病(Verticilliumspp.)等,如果秸秆降解不彻底会影响下茬作物生长又提供了侵染病菌来源,加重了病害的发生(董金皋,2015)。加速秸秆降解,一些病原菌会随着秸秆降解而死亡,能大大减少病害的初侵染来源,减轻病害发生(曹启光 等,2006;赵永强 等,2017;姜珊 等,2021)。另外,秸秆降解能提高土壤有机质含量,改善土壤理化性质,增加土壤肥力和土壤中微生物种群及数量(张琴 等,2012;Chen et al.,2017)。
农作物秸秆作为肥料还田是实现农业废弃物资源化利用的重要途径。由于秸秆富含纤维类物质,其中纤维素、半纤维素和木质素等高分子聚合物结构复杂、性质稳定,自然条件下降解缓慢。微生物能促进秸秆快速降解,是秸秆资源化利用的有效方法。国内外有关秸秆降解菌的筛选及利用研究很多,其中秸秆常温降解菌的报道较多,目前发现真菌—烟曲霉菌Z-3(Aspergillus fumigatus)(陈露露,2019)、细菌—金黄杆菌属(Chryseobacteriumsp.)(戴相群,2016)、放线菌—链霉菌GS-4-21(Streptomyces)(刘晓飞 等,2020)等均具有降解秸秆的能力。关于水稻、玉米和小麦秸秆的降解菌株研究报道较多(Xu &Yang,2010;李晓秀 等,2017;史彬 等,2018),但未见马铃薯秸秆降解菌的报道,因此筛选、鉴定马铃薯秸秆降解菌对冷凉地区和一年多茬种植地区马铃薯秸秆的快速降解、防病和土壤改良具有重要意义。
本试验从马铃薯田间采集土样筛选马铃薯秸秆降解菌,并测定其秸秆降解能力;通过形态学观察、生理生化试验及分子生物学方法对其进行鉴定,以期为促进秸秆快速降解原位还田和我国秸秆生物质资源充分利用提供理论依据和技术支撑。
1 材料与方法
1.1 试验材料
菌源土壤和无病害、无霉变马铃薯秸秆均于2020 年秋季取自内蒙古自治区呼和浩特市武川县马铃薯田。马铃薯秸秆在流动自来水下洗净后,于80 ℃烘箱烘干,剪成3~4 cm 长段备用。
酶活测定试剂盒,购自苏州格雷斯生物技术有限公司。TIAN GEN细菌基因组DNA提取试剂盒(离心柱型),购自天根生化科技(北京)有限公司。
LB 固体培养基、LB 液体培养基、PDA 培养基、高氏1 号培养基、碳源测定基础培养基、氮源测定基础培养基、丙二酸盐试验培养基、甲基红试验培养基、淀粉水解试验培养基、脂肪水解试验培养基、NA 培养基,参照孙彦敏(2019)的方法进行配制。羧甲基纤维素钠培养基:CMC-Na 20 g,NH4NO31 g,KH2PO41.5 g,MgSO4·7H2O 0.5 g,Na2HPO42.5 g,酵母提取粉0.5 g,蛋白胨2.5 g,琼脂15 g,蒸馏水1 000 mL。产酶培养基:蛋白胨3 g,(NH4)2SO43 g,KH2PO41 g,MgSO4·7H2O 0.2 g,NaCl 5 g,蒸馏水1 000 mL。马铃薯秸秆发酵培养基:2 g 马铃薯秸秆,50 mL 营养液。营养液:(NH4)2SO41.4 g,KH2PO42 g,MgSO4·7H2O 0.3 g,CaCl20.3 g,FeSO4·7H2O 7.5 mg,MnSO4·H2O 2.5 mg,ZnSO42 mg,CoCl23 mg,尿素0.3 mg,蒸馏水1 000 mL。
以上培养基及营养液均在121 ℃下灭菌20 min。
1.2 秸秆降解菌的初筛
1.2.1 菌株的分离纯化 称取10 g 土壤样品加入装有90 mL 无菌水的三角瓶中,振荡30 min,静置20 min,取1 mL 上清液进行梯度稀释,稀释至1 ×10-8~1×10-1共8 个浓度;然后各取0.1 mL,分别在LB 固体培养基、PDA 培养基及高氏1 号培养基上涂布分离并倒置于室温条件下培养,待其长出单菌落,挑取不同形态菌株进行纯化,获得纯菌株保存备用。
1.2.2 菌株初筛试验 采用点接种法分别将纯化后的菌株接种至羧甲基纤维素钠培养基上,于室温条件下培养72 h,然后加入1 mg·mL-1刚果红溶液染色30 min,弃去染液,加入1 mol·L-1NaCl 溶液脱色20 min,观察并测量菌落直径(d)及其周围透明圈直径(D),计算D/d 值。
1.3 马铃薯秸秆降解率的测定
将初筛得到的具有纤维素降解能力的菌株接种至LB 液体培养基中,制备浓度为1×107CFU·mL-1的菌悬液,按体积10%的比例接种至马铃薯秸秆发酵培养基中,以不接菌为空白对照,设3 次重复,28 ℃、180 r·min-1恒温振荡培养箱中培养;分别在第0、5、15、25、35 天取样,将不同处理的秸秆残渣用无菌水反复清洗3 次,置于80 ℃烘箱烘干至恒重后称量质量,计算秸秆相对降解率。
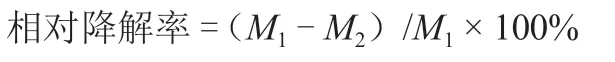
式中,M1为对照秸秆质量,M2为降解后秸秆质量。
1.4 半纤维素及纤维素酶活性测定
制备浓度为1×107CFU·mL-1的菌悬液,按体积比9%的接种量分别将菌悬液接入产酶培养基中,28 ℃、180 r·min-1培养8 d,每隔24 h 取2 mL 待测液,超声破碎15 s,间隔10 s,重复30 次,然后4 ℃、12 000 r·min-1离心10 min,取上清液,使用酶活测定试剂盒进行菌株的半纤维素酶、内切-β-1,4-葡聚糖酶、外切-β-1,4-葡聚糖酶和β-葡萄糖苷酶活性测定。
1.5 菌株鉴定
1.5.1 形态学观察 采用稀释法将菌株涂布于LB固体培养基上,待其长出单个菌落,观察菌落形态、颜色、透明度、边缘整齐程度、表面隆起与凹陷状况。
1.5.2 生理生化特性测定 参照《常见细菌系统鉴定手册》(东秀珠和蔡妙英,2001)和《植病研究法》(董汉松,2012)的方法对菌株的革兰氏染色、碳氮源和丙二酸盐的利用、甲基红试验、淀粉水解、脂肪水解、氧化酶试验和过氧化氢酶试验等生理生化特性进行测定。
1.5.3 分子生物学鉴定 ①通用引物PCR 鉴定。DNA 的提取按照细菌基因组DNA 提取试剂盒(离心柱型)说明书进行,PCR 引物分别为27F 和1492R、7F 和1540R,引物信息详见表1。PCR 反应体系(25 μL):10× PCR Buffer 2.5 μL,dNTP 2 μL,上、下游引物各1 μL,TaqDNA 聚合酶0.25 μL,ddH2O 17 μL。PCR 反应程序:94 ℃预变性5 min;94 ℃变性30 s,退火温度(表1)30 s,72℃延伸1 min,循环34 次;72 ℃延伸10 min。PCR产物用1%琼脂糖凝胶电泳检测,并送至生工生物工程(上海)股份有限公司进行16S rDNA 测序。将所得序列与GenBank 核酸数据库进行比对,选取相似度较高的菌株序列进行分析。

表1 引物名称及序列信息
② 特异性引物PCR 鉴定。所用引物为rpoBF和rpoBR、trpBF 和trpBR(Ainur et al.,2021),引物信息详见表1,PCR反应体系和反应程序同上文。
③多位点序列分析。将4 个基因的PCR 产物通过1%琼脂糖凝胶电泳进行检测,并送至生工生物工程(上海)股份有限公司进行16S rDNA 测序。将得到的4 个基因序列进行拼接,拼接结果与GenBank 核酸数据库进行比对,选取相似度较高的菌株序列进行分析,利用MEGA 7.0 软件进行系统发育树的构建。
1.5.4 生物学特性测定 参照《常见细菌系统鉴定手册》(东秀珠和蔡妙英,2001)的方法对菌株生长适宜温度和pH 进行测定。
2 结果与分析
2.1 秸秆降解菌的分离纯化与初筛
经分离纯化共获得10 株菌株,经过初筛,得到1 株菌株,命名为WXB10。菌株WXB10 在刚果红染色试验平板上出现透明圈,透明圈直径(D)与菌落直径(d)的比值(D/d)为5.53,具有一定的纤维素降解能力(图1)。

图1 菌株WXB10 的刚果红染色试验结果
2.2 菌株WXB10 对马铃薯秸秆的降解作用
由图2 可知,菌株在液态发酵过程中,随着处理时间的延长,马铃薯秸秆质量显著下降。发酵5 d 后秸秆降解速率加快,发酵35 d 时秸秆剩余量为0.85 g,秸秆降解率达到57.73%。

图2 菌株WXB10 对马铃薯秸秆的降解效果
2.3 菌株WXB10 半纤维素及纤维素酶活性测定
由图3 可以看出,随培养时间的延长,菌株WXB10 的半纤维素酶、内切-β-1,4-葡聚糖酶、外切-β-1,4-葡聚糖酶和β-葡萄糖苷酶活性均呈先增长后降低的变化趋势。发酵5 d 时,半纤维素酶活性最高,为32.17 U·mL-1,之后开始下降并趋于稳定。发酵3 d 时,内切-β-1,4-葡聚糖酶活性达到最高,为238.75 U·mL-1。外切-β-1,4-葡聚糖酶和β-葡萄糖苷酶活性均在发酵4 d 时达到最大值,分别为478.48 U·mL-1和4.82 U·mL-1。

图3 菌株WXB10 的半纤维素及纤维素酶活性变化
2.4 菌株WXB10 的鉴定
2.4.1 形态学观察与生理生化特性测定 菌株WXB10 的形态特征见图4,在LB 固体培养基上,单菌落乳白色,表面干燥粗糙,有褶皱,不透明,边缘不规则。
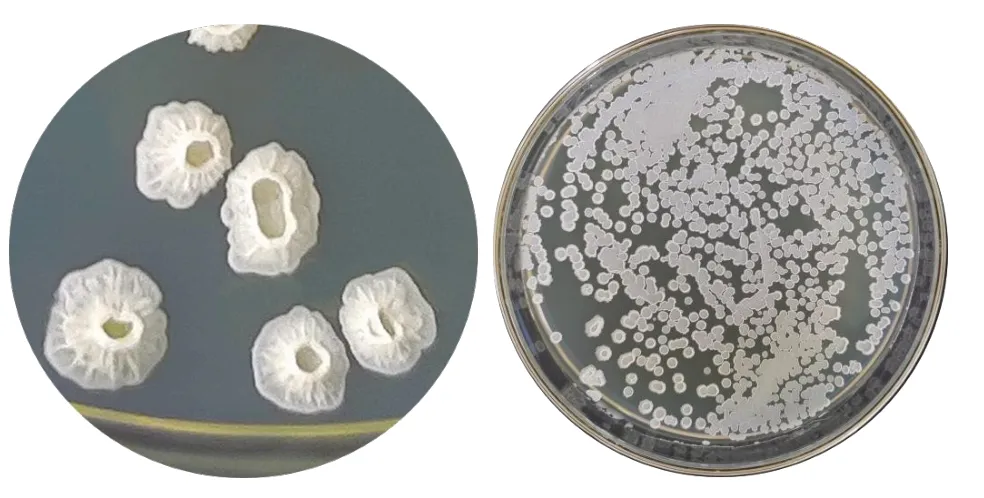
图4 菌株WXB10 的形态特征
生理生化试验结果表明(表2),菌株WXB10为革兰氏阳性菌,可以利用葡萄糖、甘露醇、果糖作为其唯一碳源,硝酸铵、硫酸铵、组氨酸作为其唯一氮源,能水解淀粉和脂肪,利用丙二酸盐,产生过氧化氢酶,不产生氧化酶,甲基红指示剂呈黄色,为阴性。表明,该菌株代谢糖产酸少,或产的酸进一步转化为其他物质。

表2 菌株WXB10 生理生化特性测定结果
2.4.2 分子生物学鉴定 利用试剂盒提取菌株WXB10 的基因组DNA,先采用通用引物进行PCR 扩增,在1 500 bp 和1 465 bp 处有明显条带(图5)。将PCR 产物测序结果利用NCBI 数据库中的Blast 程序比对,结果表明菌株WXB10 与贝莱斯芽孢杆菌(Bacillus velezensis)(MG461457)的同源性达到99.72%,与地衣芽孢杆菌(Bacillus licheniformis)(KF993663)的同源性为97.37%,与暹罗芽孢杆菌(Bacillus siamensis)(KY129717)的同源性达到99.80%。
使用特异性引物进行PCR 扩增,并通过1%琼脂糖凝胶电泳进行检验,分别在949 bp 和1 041 bp处出现条带(图5)。将4 个PCR 产物测序结果拼接,利用NCBI 数据库中的Blast 程序比对,菌株WXB10 与贝莱斯芽孢杆菌的同源性达到99.93%,与地衣芽孢杆菌的同源性为98.92%;利用MEGA 7.0 软件构建系统发育树,菌株WXB10 与贝莱斯芽孢杆菌聚在一类,登录号分别为MG461457、MF471767 和MT114571(图6)。综合形态学观察、生理生化试验和分子生物学鉴定结果,马铃薯秸秆降解菌WXB10 鉴定为贝莱斯芽孢杆菌。
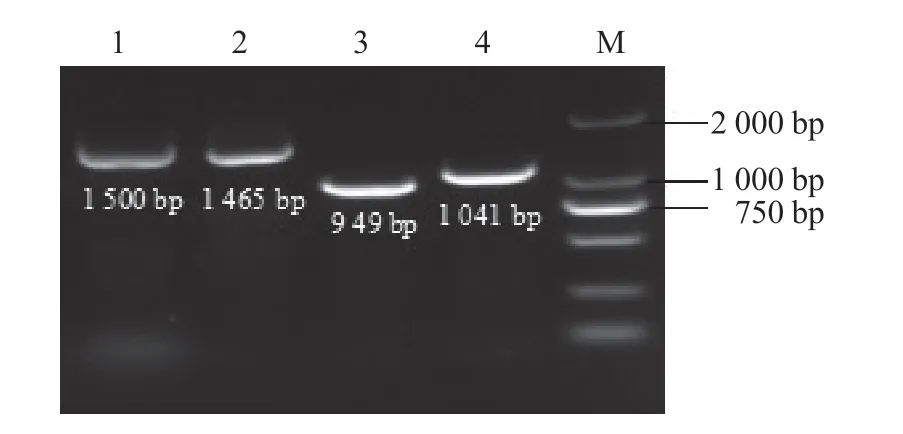
图5 菌株WXB10 的16S rDNA 琼脂糖凝胶电泳检测结果

图6 菌株WXB10 16S rDNA 系统发育树的构建
2.4.3 生物学特性 由图7 可见,菌株WXB10 生长的适宜温度为25~35 ℃,最适pH 值为7。
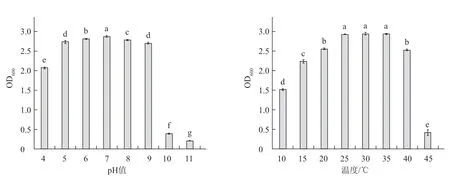
图7 不同温度及pH 值对菌株WXB10 生长的影响
3 结论与讨论
农作物秸秆被认为是地球上最丰富、最廉价的可再生资源之一(Phurt et al.,2020),但我国2019年用于农业生产资源化、减量化和循环化的秸秆仅占总量的30%(单德鑫 等,2019)。马铃薯秸秆携带大量病原菌越冬,导致病害加重,因此秸秆的快速降解在病害控制和土壤改良等方面具有重要意义。筛选马铃薯秸秆高效降解菌,研发秸秆微生物降解技术,是一种将养分归还土壤的简便、节本增效的举措,秸秆在土壤微生物的作用下被分解转化为腐殖质,提高土壤有机碳含量,具有降解效率高、能耗低、安全无污染且合理利用秸秆资源等特点。
本试验从马铃薯田间土壤中分离秸秆降解菌,利用刚果红染色法初筛获得菌株WXB10,具有纤维素降解能力,其透明圈直径与菌落直径的比值为5.53。秸秆液态发酵试验发现菌株WXB10 在发酵5 d 后秸秆降解速率明显加快,可能与3~5 d 半纤维素酶、内切-β-1,4-葡聚糖酶、外切-β-1,4-葡聚糖酶和β-葡萄糖苷酶活性均达到最大值有关;发酵25 d 以后降解速率下降,可能是营养物质消耗,代谢产物积累,酶活性下降,产物抑制等原因导致的;发酵35 d 时马铃薯秸秆降解率达到57.73%,秸秆剩余量为0.85 g。表明,菌株WXB10 具有很好的应用前景。
与本试验结果相似,孙玲等(2019)从腐烂秸秆及其附近土壤中分离得到黄杆菌属CMC-I(Flavobacterium banpakuense)和马赛菌CMC-red(Massilia arvi),室温条件下液态发酵10 d 后玉米秸秆的降解率分别为21.06%和24.14%。陈露露(2019)从常年覆盖秸秆的土壤中分离得到具有高效降解玉米秸秆的烟曲霉菌Z-3(Aspergillus fumigatus),对玉米秸秆静态发酵30 d 后秸秆失重率达26.76%。刘晓飞等(2020)分离得到1 株能够降解纤维素的链霉菌菌株GS-4-21(Streptomyces),28 ℃发酵5 d 后玉米秸秆降解率达到23.54%。以上研究结果表明,不同作物秸秆的纤维素含量不同,菌株的降解能力有所差异。
本试验中,菌株WXB10 的半纤维素酶、内切-β-1,4-葡聚糖酶、外切-β-1,4-葡聚糖酶和β-葡萄糖苷酶活性最高分别为32.17、238.75、478.48 U·mL-1和4.82 U·mL-1。刘晓飞等(2020)从寒地黑土中分离得到的链霉菌菌株GS-4-21 的外切-β-1,4-葡聚糖酶、内切-β-1,4-葡聚糖酶和β-葡萄糖苷酶活性最高分别为12.07、32.94 U·mL-1和30.87 U·mL-1。顾文杰等(2012)从水稻田的土壤及牛场牛粪中筛选出2 株酶活力较高的菌株,其内切-β-1,4-葡聚糖酶活性最高分别为14.00 U·mL-1和18.80 U·mL-1,β-葡萄糖苷酶活性最高分别为6.23 U·mL-1和6.53 U·mL-1。张爽(2018)从土壤中筛选出19 株玉米秸秆降解菌,其中菌株ZS-7 的β-葡萄糖苷酶活性最高为38.704 U·mL-1;菌株ZS-8 的内切-β-1,4-葡聚糖酶活性最高为31.111 U·mL-1。魏如腾(2016)构建高效玉米秸秆降解菌系时发现芽孢杆菌的内切-β-1,4-葡聚糖酶、外切-β-1,4-葡聚糖酶和β-葡萄糖苷酶活性最高为149.38、118.95 U·mL-1和133.97 U·mL-1。本试验筛选出的菌株WXB10 内切-β-1,4-葡聚糖酶和外切-β-1,4-葡聚糖酶活性均高于以上研究,可能是由于本试验采用以马铃薯秸秆为唯一碳源进行复筛,淘汰低降解能力的菌株,得到降解效果稳定具有较高秸秆降解能力的菌株,具有一定的实际意义;但β-葡萄糖苷酶活性均低于以上研究,可能是由于β-葡萄糖苷酶的最适pH 偏酸性,而本试验筛选得到的菌株WXB10 的最适pH 偏中性。
目前研究发现,芽孢杆菌对秸秆有一定的降解效果,如巨大芽胞杆菌(B.cereus)、地衣芽孢杆菌(B.licheniformis)和枯草芽孢杆菌(B.subtillis)(龚昆,2020)。通过形态学观察、生理生化特性测定和分子生物学鉴定,菌株WXB10 被鉴定为贝莱斯芽孢杆菌(B.velezensis),该菌株在温度为10~40℃、pH 值为4~9 范围内均能正常生长。有研究表明,贝莱斯芽孢杆菌在其他领域应用也较为广泛,例如对黄瓜霜霉病(Pseudoperonospora cubensis)具有较好的保护作用和一定的治疗作用,且持效期较长(肖倩 等,2021)。李苗苗等(2020)通过对峙试验证明贝莱斯芽孢杆菌GY1 对棉花立枯病(Rhizoctonia solani)和番茄晚疫病(Phytophthora infestanse)等多种真菌病原菌都有抑制作用。Liu等(2019)通过对贝莱斯芽孢杆菌HC6 代谢产物的研究,发现其产生的3种脂肽对曲霉属(Aspergillussp.)、镰刀菌属(Fusariumsp.)和李斯特菌属(Listeriasp.)等多类植物病原菌有抑制作用。本试验初步研究了菌株WXB10 对马铃薯秸秆的降解作用,在应用条件、生防效果及菌剂制备等方面还需进一步研究。
