微泡菌ALW1重组β-半乳糖苷酶的异源表达和酶学性质
2022-10-09唐桂均李鹤宾朱艳冰姜泽东倪辉李清彪陈艳红
唐桂均,李鹤宾,朱艳冰,3,姜泽东,3,倪辉,3,李清彪,3,陈艳红,3*
(1.集美大学海洋食品与生物工程学院,福建厦门 361021)(2.厦门医学院药学系,福建厦门 361023)(3.福建省食品微生物与酶工程重点实验室,厦门市食品生物工程技术研究中心,福建厦门 361021)
β-半乳糖苷酶(β-galactosidase,EC 3.2.1.23)又称乳糖酶(Lactase),是一种重要的生物催化剂[1],归属于不同糖苷水解酶(Glycoside Hydrolases,GH)家族:GH1、GH2、GH35、GH42和GH59[2]。β-半乳糖苷酶不仅可以通过水解乳糖中的β-1,4-D-半乳吡喃糖苷键以达到降解乳糖的作用,还可以通过转糖苷生成具有益生作用的低聚半乳糖(GOS)[3,4]。
乳糖是乳品中重要的碳水化合物,它是以单体分子形式存在于乳品中的双糖。人体无法直接吸收双糖分子,双糖摄入后,需分解成单糖才可被吸收利用。β-半乳糖苷酶可降解乳制品中的乳糖为半乳糖和葡萄糖,有利于人体的吸收,同时避免乳制品(如冰淇淋和某些类型的奶酪)在冷藏条件下形成乳糖结晶[5,6],保证乳制品质量。在工业生产中常利用β-半乳糖苷酶水解乳糖,具有反应产物单一、不污染奶源,以及不破坏其他成分等优点,因此该酶在食品行业具有重要的应用价值。此外,β-半乳糖苷酶还可以与葡萄糖氧化酶联合使用制备生物传感器,用于测定牛奶等乳制品中乳糖的含量[7],也可以用于乳清中乳糖的水解,从而减缓乳清排放后对水造成的污染[8]。
β-半乳糖苷酶在植物、微生物及动物体中较为常见,大部分β-半乳糖苷酶来源于微生物[8,9]。来源于微生物的β-半乳糖苷酶具有高产、低成本、酶源广等优点。在工业应用中,β-半乳糖苷酶存在着稳定性差、酶活力不高等问题。因此,研究不同微生物来源的β-半乳糖苷酶,筛选具有优良特性的酶具有重要意义[10]。不同来源的β-半乳糖苷酶具有不同的酶学特性,包括最适反应温度、最适反应pH、温度稳定性、pH稳定性等,这也决定了酶的不同用途。例如,黑曲霉来源的β-半乳糖苷酶在酸性条件下具有好的稳定性和酶活力,可用于治疗乳糖不耐症[11];丝状真菌来源的β-半乳糖苷酶在碱性条件下酶活力良好,常用于面包发酵[12]。
在先前的研究中,从腐烂海带中分离出海洋微泡菌ALW1[13],并进行了该菌株的基因组测序,发现一个预测编码β-半乳糖苷酶的基因(GenBank收录号:Mw366919)。本研究对来自微泡菌的β-半乳糖苷酶进行克隆、表达和纯化,并对其酶学性质进行研究,为微泡菌ALW1的β-半乳糖苷酶的应用奠定基础。
1 材料与方法
1.1 主要材料
4-硝基苯基-β-D-吡喃半乳糖苷(pNP-Gal)、4-硝基苯基-β-D-葡萄糖醛酸苷(pNP-Glu)、4-硝基苯基-β-D-吡喃葡萄糖苷(pNPG)、4-硝基苯基-α-L-吡喃岩藻糖苷(pNP-α-L-F)、4-硝基苯基-β-D-吡喃岩藻糖苷(pNP-β-D-F)、4-硝基苯基-β-D-吡喃甘露糖苷(pNPM)和4-硝基苯基-β-D-吡喃木糖苷(pNP-xyl),Sigma-Aldrich公司;Ni-NTA agarose,GE Healthcare Life Sciences公司。
1.2 主要仪器与设备
Epoch2T酶标仪,美国博腾仪器有限公司;Avanti™J-25冷冻离心机,美国Beckman公司;Unic3-18K冷冻离心机,Sigma-Aldrich公司;超声破碎仪,上海虔钧科学仪器有限公司;JS-680C凝胶成像系统,上海昕瑞有限公司。
1.3 β-半乳糖苷酶的序列分析
利用DNAMAN软件对β-半乳糖苷酶的基因序列进行分析,使用ExPASy中的ProtParam分析β-半乳糖苷酶的理论分子量和pI,使用SignalP 5.0分析β-半乳糖苷酶的信号肽。利用BLAST对GenBank数据库进行同源性搜索,使用ClustalX2程序生成蛋白质序列的比对。在碳水化合物活性酶(Carbohydrate-Active Enzyme,CAZy)数据库中搜索、下载来自不同家族的典型β-半乳糖苷酶的基因序列,利用ClustalX2和MEGA7.0软件构建β-半乳糖苷酶的系统发育树。
1.4 β-半乳糖苷酶的基因工程表达菌株构建
以微泡菌ALW1的基因组DNA为模板,使用PCR技术对β-半乳糖苷酶基因进行扩增。利用DNA回收试剂盒进行纯化后,使用EcoRI和SalI分别对目的基因和表达载体pET-28a(+)进行双酶切反应。目的基因和表达载体使用DNA回收试剂盒纯化后进行连接反应,将连接产物转化至E. coliDH5α中。转化后的细胞均匀涂布于含50 μg/mL卡那霉素的LB固体培养基上,37 ℃培养16 h。经菌落PCR验证后,对插入的序列进行测序分析,将测序成功的重组质粒转化至E. coliBL21中,获得含有β-半乳糖苷酶基因重组表达质粒的E. coliBL21(DE3)基因工程菌株。
1.5 β-半乳糖苷酶的表达和纯化
将含微泡菌β-半乳糖苷酶基因的E. coliBL21(DE3)按1%(V/V)的接种量接种到250 mL LB培养基(含50 µg/mL卡那霉素)中,37 ℃、180 r/min培养至OD600为0.8时,加入25 μL IPTG(0.5 mol/L),在18 ℃、180 r/min条件下诱导表达20 h。将发酵液在4 ℃、8 000 r/min条件下离心10 min,收集菌体沉淀,用10 mL缓冲液(50 mmol/L NaH2PO4、300 mmol/L NaCl、15 mmol/L咪唑,pH 8.0)重悬菌体,冰浴条件下对菌体进行超声破碎,然后在4 ℃、10 000 r/min条件下离心20 min,收集上清液,即为粗酶液。参照GE Healthcare Life Sciences公司的Ni-NTA使用说明书纯化重组蛋白。利用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分析目的蛋白的纯度及其分子量大小。蛋白质浓度的测定参照Bradford法[14],使用凝胶过滤层析法确定β-半乳糖苷酶的天然分子量[15]。
1.6 β-半乳糖苷酶的活力测定
以pNP-Gal为底物测定β-半乳糖苷酶的活力。配制2.5 mmol/LpNP-Gal底物溶液(溶于50 mmol/L柠檬酸-Na2HPO4缓冲液,pH值4.5)。90 µL底物溶液中加入10 µL酶液(0.1 mg/mL),在30 ℃反应10 min后,立即加入200 μL 1 mol/L Na2CO3溶液终止反应,在405 nm处测定吸光度值。每组做三个平行,以灭活的酶液作为空白组。β-半乳糖苷酶的酶活力单位定义为:在上述条件下,每分钟释放1 μmolpNP所需的酶量为1个酶活力单位(U)。
1.7 重组β-半乳糖苷酶的酶学性质研究
1.7.1 酶的底物特异性
用50 mmol/L柠檬酸-Na2HPO4缓冲液(pH值4.5)配制2.5 mmoL/L的不同人工底物溶液,包括4-硝基苯基-β-D-吡喃半乳糖苷、4-硝基苯基-β-D-葡萄糖醛酸苷、4-硝基苯基-β-D-吡喃葡萄糖苷、4-硝基苯基-α-L-吡喃岩藻糖苷、4-硝基苯基-β-D-吡喃岩藻糖苷、4-硝基苯基-β-D-吡喃甘露糖苷和4-硝基苯基-β-D-吡喃木糖苷,按1.6的方法测定酶对不同底物的活力,研究酶的底物特异性。
1.7.2 温度对酶活力和稳定性的影响
将β-半乳糖苷酶在不同温度下(15、20、25、30、35、40和45 ℃)反应10 min,测定酶的活力,研究酶的最适反应温度。为探究β-半乳糖苷酶的温度稳定性,将酶置于不同温度(4、15、20、25、30和35 ℃)下放置2 h,每隔30 min取样,测定酶的残余活力。以未经处理的酶活力定为100%。
1.7.3 pH对酶活力和稳定性的影响
用50 mmol/L不同pH值的缓冲液分别配制2.5 mmol/L的pNP-Gal底物溶液,在不同pH条件下测定酶的活力,研究酶的最适反应pH。为探究β-半乳糖苷酶的pH稳定性,将酶分别置于不同pH值的缓冲液中,在25 ℃下放置60 min后,测定酶的残余活力。以未经处理的酶活力定为100%。
1.7.4 酶的动力学参数的测定
用50 mmol/L柠檬酸-Na2HPO4缓冲液(pH值4.5)配制不同浓度(2.5、5、10、15、20、25 mmol/L)的pNP-Gal底物溶液。将β-半乳糖苷酶分别与不同浓度的底物反应,测定酶的活力。利用Lineweaver-Burk双倒数作图法,计算重组β-半乳糖苷酶的最大反应速率(Vmax)与底物亲和常数(Km)。
1.8 化学添加剂对酶稳定性的影响
将β-半乳糖苷酶分别与不同金属离子(K+、Ca2+、Mg2+、Ba2+、Zn2+、Cu2+、Mn2+、Al3+和Fe3+)或其他化学试剂(Triton X-100、吐温20、吐温80、SDS、CTAB、β-ME、DTT、EDTA、尿素)混合,使化学添加剂达到不同的指定终浓度。酶与化学试剂25 ℃温育30 min后,加入pNP-Gal底物,测定酶的残余活力。以未添加化学试剂处理的酶活力定为100%。
1.9 β-半乳糖苷酶的三维建模及酶与pNP-Gal底物的分子对接
在PDB蛋白数据库获取模板,利用Modeller 9.18构建β-半乳糖苷酶的三维结构,pNP-Gal的三维结构在NCBI中的PubChem下载pdb文件。应用AutoDock进行酶与底物的分子对接,选择构象最佳的对接结果,使用Discovery Studio 2019软件进行分析和图像显示。
2 结果与讨论
2.1 β-半乳糖苷酶的序列分析
微泡菌β-半乳糖苷酶基因的长度为141 9 bp,编码472个氨基酸的蛋白质。该蛋白质的理论分子量和pI分别为52.8 ku和5.29,该β-半乳糖苷酶不含有信号肽。蛋白序列的同源性分析表明,微泡菌β-半乳糖苷酶与来源于Actinoalloteichus hymeniacidonis(AOS64332.1)、Amycolatopsis albispora(AXB42219.1)、AActinoplanessp. N902-109(AGL19093.1)和Amycolatopsis albispora(AXB41531.1)的β-半乳糖苷酶分别具有51%、50%、49%和48%的相似性。蛋白质序列比对分析显示,β-半乳糖苷酶含有GH1家族的β-半乳糖苷酶典型的氨基酸序列NEP(185-187位氨基酸)和ENG(370-372位氨基酸),其中Glu186预测为酸碱催化残基,Glu370预测为亲核催化残基;差异序列主要集中于蛋白质中间区域及C末端(图1)。采用系统进化分析来确定微泡菌β-半乳糖苷酶所属家族。利用碳水化合物活性酶家族(CAZy)数据库中5个糖苷水解酶(GH)家族的16个特征性β-半乳糖苷酶构建了系统发育树(图2)。该酶与来自Acidilobussp. 7(AMD30575.1)和Acidilobus saccharovorans345-15(ADL19795.1)的β-半乳糖苷酶在同一分支,它们是GH1家族的代表成员。这些结果表明,本研究中微泡菌β-半乳糖苷酶归属于GH1家族。

图1 微泡菌β-半乳糖苷酶与其他β-半乳糖苷酶蛋白序列的比对分析Fig.1 Alignment of β-galactosidase from Microbulbifer sp.with other β-galactosidase protein sequences
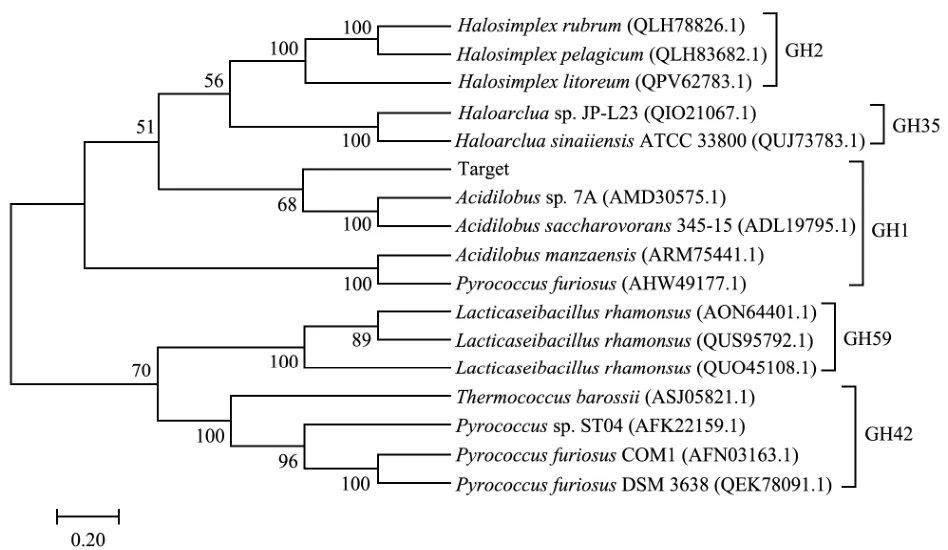
图2 β-半乳糖苷酶的系统发育分析Fig.2 Phylogenetic analysis of β-galactosidase
2.2 β-半乳糖苷酶的表达和纯化
pET-28a(+)表达质粒插入外源基因后,可表达出带有多聚组氨酸标签的重组蛋白。含有微泡菌β-半乳糖苷酶基因的E. coliBL21(DE3)经IPTG诱导表达和纯化后,SDS-PAGE分析显示,与经IPTG诱导表达的含pET-28a(+)阴性菌(图3,泳道1)相比,经IPTG诱导表达的含重组质粒的阳性菌在蛋白理论分子量大小的位置附近有明显的蛋白表达条带(图3,泳道2),说明有目的蛋白表达。β-半乳糖苷酶大量诱导表达后,利用超声进行菌体破碎,上清过Ni-NTA Agarose亲和层析柱,获得重组β-半乳糖苷酶,重组酶的分子质量约为64 ku(图3,泳道3)。使用Sephacryl S-200凝胶过滤层析法测定纯化的重组酶分子量为64.6 ku。这些结果表明,微泡菌β-半乳糖苷酶是单亚基蛋白质。

图3 β-半乳糖苷酶基因在大肠杆菌中的表达Fig.3 Expression of β-galactosidase gene in E. coli
2.3 微泡菌β-半乳糖苷酶的酶学性质
2.3.1β-半乳糖苷酶的底物特异性
根据酶与不同底物反应生成pNP的含量不同来研究β-半乳糖苷酶的底物特异性。如表1所示,相比于4-硝基苯基-β-D-吡喃半乳糖苷,微泡菌β-半乳糖苷酶对4-硝基苯基-β-D-吡喃葡萄糖苷、4-硝基苯基-α-L-吡喃岩藻糖苷的相对酶活力分别为153.79%和158.16%,对4-硝基苯基-β-D-葡萄糖醛酸苷、4-硝基苯基-α-L-吡喃岩藻糖苷、4-硝基苯基-β-D-吡喃甘露糖苷、4-硝基苯基-β-D-吡喃木糖苷无活力。结果表明,微泡菌β-半乳糖苷酶对具有立体化学偏好的芳基-β-糖苷具有特异性作用。
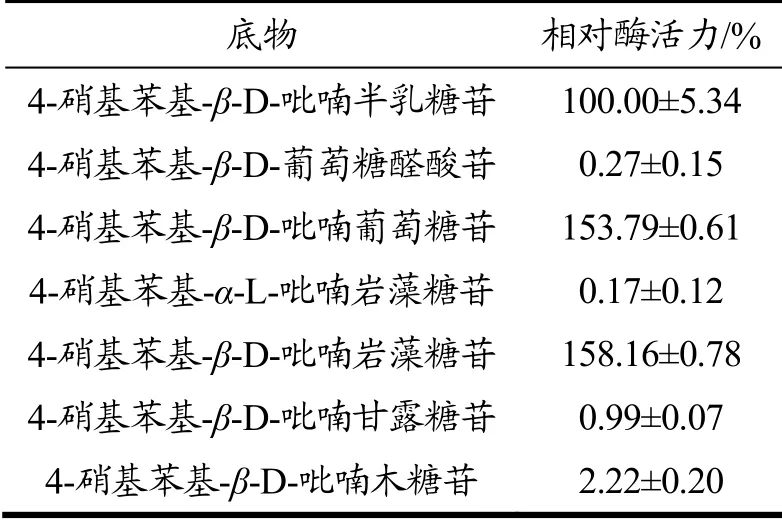
表1 β-半乳糖苷酶的底物特异性Table 1 Substrate specificity of β-galactosidase
2.3.2 温度对β-半乳糖苷酶活力和稳定性的影响
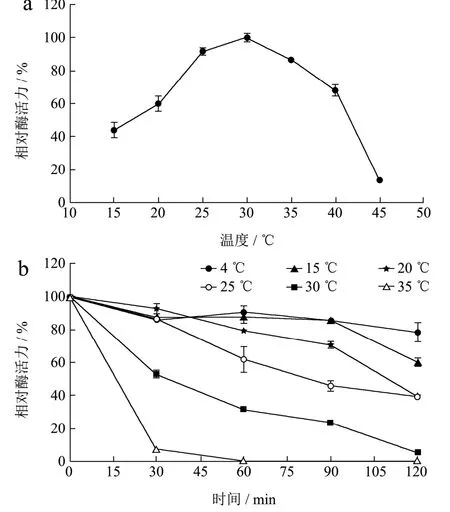
图4 温度对β-半乳糖苷酶活力和稳定性的影响Fig.4 Effect of temperature on the activity and stability of β-galactosidase
温度对微泡菌β-半乳糖苷酶活力的影响结果(图4a)显示,β-半乳糖苷酶的最适温度为30 ℃,在20~40 ℃之间相对活性保持在60%以上,在45 ℃时,相对活性急剧下降至13.75%。温度对β-半乳糖苷酶稳定性的影响结果(图4b)显示,随着时间变化,酶的稳定性呈下降趋势。温度≤25 ℃时,酶活力下降较慢,在4 ℃和25 ℃放置2 h后,酶分别具有78.26%和38.35%的相对酶活力。温度为30 ℃和35 ℃时,酶活力下降显著,在30 ℃和35 ℃放置30 min后,相对酶活力迅速分别降至53.05%和7.58%。目前商业β-半乳糖苷酶大多为中温酶,而乳品加工中许多工艺以及贮运均在低温下进行[16]。朱五二等[17]研究的盐单胞菌S62来源低温β-半乳糖苷酶生成低聚半乳糖的最适反应温度为40 ℃。Turkiewicz等[18]的研究中,Pseudoalteromonassp.22b来源的低温β-半乳糖苷酶最适反应温度为40 ℃。与上述报道的低温β-半乳糖苷酶相比,本研究中微泡菌β-半乳糖苷酶的最适反应温度相对较低,且在低温条件下仍能保留较高的酶活力,因此本研究的β-半乳糖苷酶在乳品加工中具有应用潜力。
2.3.3 pH对β-半乳糖苷酶活力和稳定性的影响
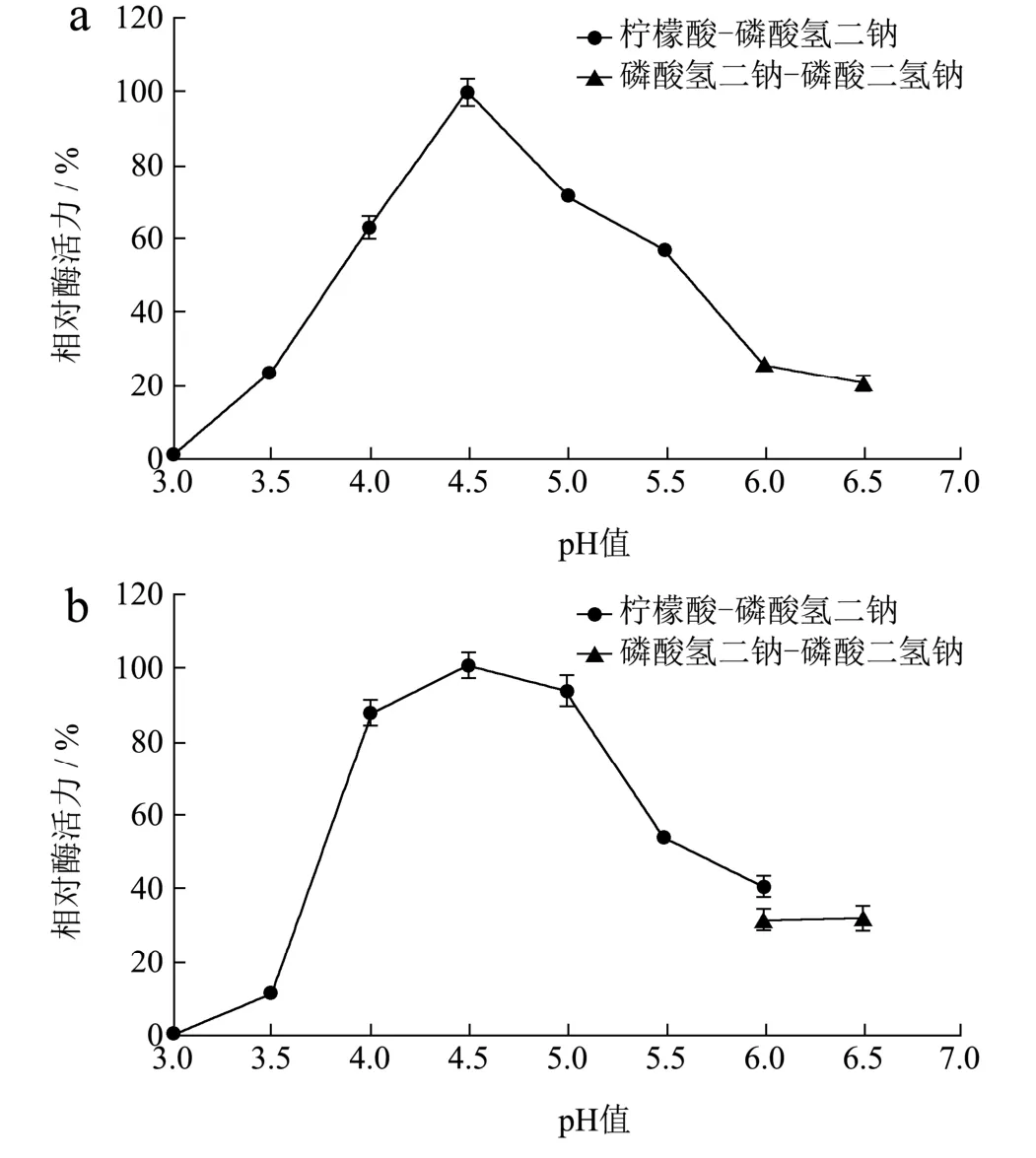
图5 pH对β-半乳糖苷酶活力和稳定性的影响Fig.5 Effect of pH on the activity and stability of β-galactosidase
pH对微泡菌β-半乳糖苷酶活力的影响如图5a所示。β-半乳糖苷酶的最适pH为4.5,pH值在4.0~5.5时,相对酶活力在55%以上。为探究β-半乳糖苷酶的pH稳定性,在不同pH条件下对酶处理1 h。结果表明(图5b),β-半乳糖苷酶在pH值4.0~5.0范围内具有良好的稳定性,残余酶活力在80%以上。在以往的报道中,Erwiniasp. E602来源β-半乳糖苷酶[19]的最适反应pH值为7.0,在pH 4.0下处理1 h后的残余酶活力为55%;Paracoccus marcusiiKGP来源β-半乳糖苷酶[20]的最适反应pH为8.0,在pH 4.0下处理30 min后无酶活力。而本研究中微泡菌β-半乳糖苷酶的最适pH相对较低,且在酸性条件下具有优良的稳定性。
2.3.4β-半乳糖苷酶的动力学参数
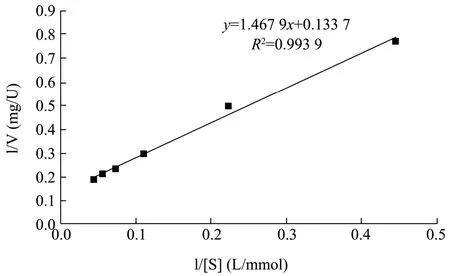
图6 β-半乳糖苷酶作用于pNP-Gal的双倒数曲线Fig.6 The lineweaver-burk of β-galactosidase acting on pNP-Gal
以pNP-Gal为底物,研究微泡菌β-半乳糖苷酶的动力学参数。当β-半乳糖苷酶与不同浓度的pNP-Gal进行反应后,通过计算反应初速度绘制出双倒数曲线(图6),计算出微泡菌β-半乳糖苷酶的Km和Vmax分别为10.98 mmol/L和7.48 U/mg,高于来自Akkermansia muciniphila[21]的β-半乳糖苷酶的Km和Vmax。
2.3.5 不同来源β-半乳糖苷酶的酶学性质比较
不同来源β-半乳糖苷酶的酶学性质见表2,可以看出,相较于其他来源的酶,本研究中微泡菌来源β-半乳糖苷酶的最适反应温度较低,而且酶的温度稳定性不高;该酶在酸性条件下起作用,并在pH值4.0~5.0的条件下具有优良的耐酸性,使其更适用于酸性乳清和干酪的水解。动力学参数比较分析显示,微泡菌来源β-半乳糖苷酶具有较高的Km值,该酶的Vmax值高于Lactobacillus plantarumFMNP01和Akkermansia muciniphila来源的β-半乳糖苷酶,低于Erwiniasp. E602、Paracoccus marcusiiKGP和Lactobacillus curieaeM2011381来源的β-半乳糖苷酶。

表2 不同来源β-半乳糖苷酶的酶学性质Table 2 Enzymatic properties of β-galactosidases from different sources
2.4 化学添加剂对β-半乳糖苷酶稳定性的影响
金属离子能通过调节催化过程或酶的结构对酶活力产生影响[24]。将微泡菌β-半乳糖苷酶利用不同金属离子处理后,测定酶的剩余活力。由图7可得,测试的金属离子(包括K+、Ca2+、Mg2+、Ba2+、Zn2+、Cu2+、Mn2+、Al3+和Fe3+)对β-半乳糖苷酶活力存在不同程度的抑制作用。其中,10 mmol/L的K+、Ca2+、Mn2+处理后,β-半乳糖苷酶保留80%的相对酶活力;Zn2+和Cu2+处理后,β-半乳糖苷酶几乎丧失其酶活力,这与来自Alteromonassp. ML117和Akkermansia muciniphila的β-半乳糖苷酶的研究结果相似[21,25]。
其他化学添加剂对微泡菌β-半乳糖苷酶稳定性的影响结果如表3所示。β-半乳糖苷酶对非离子型去垢剂吐温80和低浓度的吐温20具有良好的稳定性,当吐温20浓度为1%时,酶活力提高到157.09%;非离子型去垢剂Triton X-100对酶活力具有抑制作用。离子型去垢剂SDS和CTAB存在时,β-半乳糖苷酶几乎丧失活性。还原试剂DTT对β-半乳糖苷酶活力具有促进作用;低浓度的β-ME还原试剂对酶活力没有影响,但高浓度下呈现中等抑制作用。金属螯合剂EDTA对β-半乳糖苷酶表现出中等抑制作用,表明它可能是一种对二价阳离子有一定要求的金属酶,而对于来自Bacillus subtilis的β-半乳糖苷酶[26],EDTA则不会影响其活力。变性剂尿素强烈抑制β-半乳糖苷酶的活力,2.5 mol/L尿素处理后,酶的活力完全丧失。
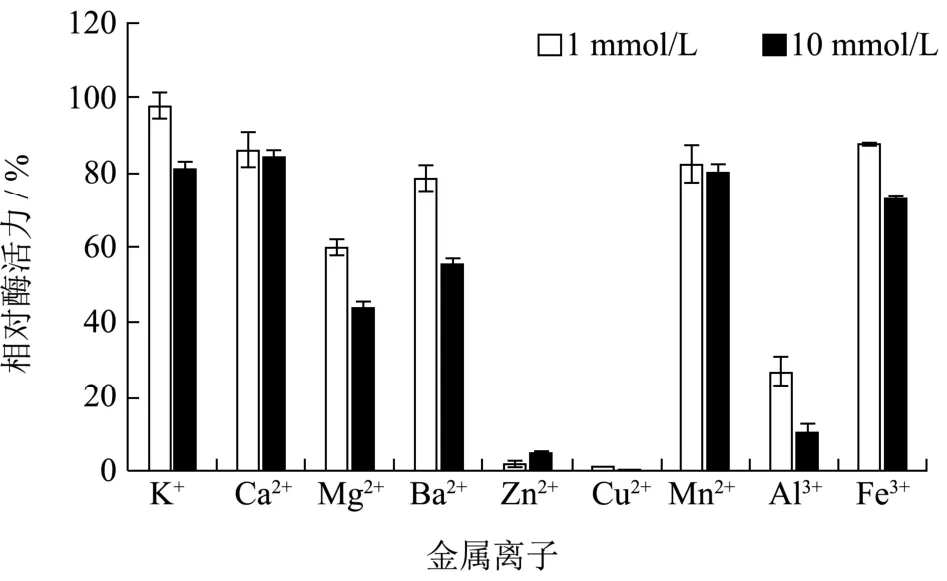
图7 金属离子对β-半乳糖苷酶稳定性的影响Fig.7 Effects of metal ions on the stability of β-galactosidase

表3 其他化学添加剂对β-半乳糖苷酶稳定性的影响Table 3 Effects of other chemical reagents on the stability of β-galactosidase
2.5 β-半乳糖苷酶的三维结构及酶与底物的相互作用
将微泡菌ALW1的β-半乳糖苷酶进行三维建模,在PDB数据库中进行同源搜索,模板的PDB登入号为1UYQ,氨基酸残基的范围为24-471,与模板序列相似度为42.9%。微泡菌β-半乳糖苷酶的三维结构中观察到糖苷水解酶GH1家族典型的(α/β)8桶结构域,其中催化残基Glu186和Glu370被标记(图8a)。
为进一步从分子水平上认知β-半乳糖苷酶与底物相互作用模式,利用分子对接研究了pNP-Gal在活性位点处的作用模式。pNP-Gal与β-半乳糖苷酶的分子对接结果如图8b所示,酸/碱催化残基Glu186和亲核催化残基Glu370在糖环两侧,Tyr314、Thr315、Glu370和Glu431与pNP-Gal形成氢键(图8b,绿色线条),Tyr314还与底物形成Pi-Pi T型作用力(图8b,紫色线条)。

图8 微泡菌β-半乳糖苷酶的三维结构(a)及酶与底物的分子对接(b)Fig.8 The tertiary structure of β-galactosidase from Microbulbifer sp. (a) and molecular docking of β-galactosidase and pNP-Gal substrate (b)
3 结论
本研究将来自微泡菌ALW1菌株的β-半乳糖苷酶进行表达和纯化,研究其酶学性质。微泡菌β-半乳糖苷酶归属于GH1家族,在温度低于25 ℃时具有良好的温度稳定性,在酸性条件(pH值4.0~5.5)下表现出较好的稳定性。β-半乳糖苷酶对还原试剂DTT、一些非离子型去垢剂(吐温80和吐温20)显示良好的稳定性。分子对接提供了微泡菌β-半乳糖苷酶与pNP-Gal底物相互作用模式的深入了解,对微泡菌β-半乳糖苷酶的应用奠定理论基础。
