黄瓜枯萎病拮抗菌Burkholderia gladioli L1-3的分离鉴定及防病促生效果
2022-12-30李亚莉岳宏忠张东琴段艳巧
李亚莉 侯 栋 岳宏忠 张东琴 段艳巧
(甘肃省农业科学院蔬菜研究所,甘肃兰州 730070)
黄瓜枯萎病又叫死秧病、蔓割病、萎蔫病,是一种土传性病害,其病原菌为尖孢镰孢菌黄瓜专化型(Fusarium oxysporumf.sp.cucumerinum Owen)。尖孢镰孢菌可以通过根毛及植株伤口处侵染,使黄瓜根茎部维管束变褐腐烂,病原菌进一步侵染繁殖后,可使整株枯萎死亡(曹云娥 等,2020)。化学农药的大量使用以及长期使用同种农药,致使病菌产生抗药性,根际土壤中的有益微生物数量减少;同时化学农药的大量使用还会对环境造成污染,危害人、畜健康(Wang et al.,2020)。培育抗病黄瓜新品种是防治枯萎病较安全的一种措施,但由于品种选育需要较长时间,实际生产中的抗病黄瓜品种并不多见。嫁接技术在黄瓜枯萎病的防治上应用最广泛,但由于嫁接需要一定的技术,人工成本较高,且砧木对接穗果实风味有一定的影响,在一定程度上限制了嫁接技术的发展。常年种植同一种作物易使根际土壤微生物环境被破坏,有害微生物数量增加,土传病害越来越严重(贾红梅等,2020;刘会芳 等,2021)。利用有益拮抗微生物防治土传病害,对环境无污染,对人畜无害,符合现代农业发展趋势。
本试验从甘肃省兰州、武威、靖远等地22 块多年连作黄瓜的枯萎病发生地块采集土样,采用平板对峙法从分离纯化的细菌中筛选拮抗菌株,基于形态特征、生理生化特性及基因序列分析进行菌株鉴定;然后测定拮抗菌株的抑菌谱,并通过盆栽试验评价其对黄瓜枯萎病的防病促生效果,以期为蔬菜病害生物防治提供参考。
1 材料与方法
1.1 试验材料
供试黄瓜品种为甘丰袖玉,由甘肃省农业科学院蔬菜研究所提供。
供试病原菌为尖孢镰孢菌黄瓜专化型(Fusarium oxysporumf.sp.cucumerinum Owen)、辣椒腐霉菌(Pythium spinosum)、辣椒灰葡萄孢菌(Botrytis cinerea)、辣椒立枯丝核菌(Rhizoctonia solani)、辣椒疫霉菌(Phytophthora capsici)、茄链格孢(Alternaria solani)、尖孢镰孢菌甜瓜专化型(Fusarium oxysporumf.sp.melonis)、尖孢镰孢菌西瓜专化型(Fusarium oxysporumf.sp.niveum)、尖孢镰孢菌十字花科专化型(Fusarium oxysporumSch1.f.sp.conglutinans),由中国农业科学院蔬菜花卉研究所、北京市农林科学院蔬菜研究所、甘肃省农业科学院植物保护研究所和本所提供。
1.2 试验方法
1.2.1 拮抗菌株的分离鉴定 2021 年3 月,从甘肃省兰州、武威、靖远等地22 块多年连作黄瓜的枯萎病发生地块采集土样,每份100 g,采集深度10~20 cm;分别装入无菌自封袋,带回本所实验室,保存于-80 ℃的恒温冰箱,用于拮抗菌的分离。
采用土壤稀释法分离细菌。分别将22 份土样充分混匀,随机称取10 g,加入90 mL 无菌水,置于摇床28 ℃、180 r·min-1振荡30 min,此时菌悬液浓度为1×10-1g·mL-1;然后取1 mL 菌悬液,加入9 mL 无菌水,配制成浓度为1×10-2g·mL-1的菌悬液;依次类推,配制成浓度分别为1×10-3、1×10-4、1×10-5、1×10-6、1×10-7g·mL-1的菌悬液。分别取浓度为1×10-5、1×10-6、1×10-7g·mL-1的菌悬液0.2 mL,加入牛肉膏蛋白胨平板中,迅速混匀、倒置,每个浓度3 皿;28~30 ℃恒温培养2~3 d,将单菌落划线培养至纯,保存于20%甘油中,放置于-80 ℃的恒温冰箱保存。
拮抗菌株的筛选采用平板对峙法。在PDA 平板中央接种直径7 mm 的拮抗菌菌饼,在距离拮抗菌菌饼2 cm 处接种病原真菌菌饼,以仅接种病原真菌菌饼为对照,每处理3 次重复,每重复3 皿;于28~30 ℃恒温箱中培养3~5 d,当对照长满整个平板后,测定抑菌带宽度(抑菌圈直径),筛选抑菌效果好的细菌菌株。初筛采用抑菌带法,复筛采用抑菌圈法。
采用形态特征观察、生理生化特性测定和多基因系统发育树分析的方法,对拮抗菌株进行鉴定。将拮抗菌株在牛肉膏蛋白胨培养基上划线,28 ℃恒温培养1~2 d,观察菌落颜色和形态,利用透射电镜观察菌体形态,同时参考《常见细菌系统鉴定手册》(东秀珠和蔡妙英,2001)的方法,对拮抗菌株进行革兰氏染色、生长温度等生理生化试验。使用细菌DNA 提取试剂盒提取拮抗菌株的基因组DNA。根据目标基因设计引物gyrB-F(5′-AGAGTTTGATCCTGGCTCAG-3′)和gyrB-R(5′-GGTTACCTTGTTACGACTT-3′)(Sharga &Lyon,1998)。PCR 扩增体系(50 μL)为:DNA 模板4 μL,上、下游引物各2 μL,mix 25 μL,ddH2O 17 μL。PCR 扩增程序为:94 ℃预变性3 min;94 ℃变性30 s,60 ℃退火1 min,72 ℃延伸45 s,35 个循环;最后72 ℃延伸10 min。扩增产物采用1%琼脂糖凝胶电泳检测,16S rDNA测序工作由甘肃科美意生物科技有限公司完成。将所测菌株的16S rDNA 序列上传Ezbiocloud 网站进行比对,构建系统发育树,分析与模式菌的亲缘关系。
1.2.2 拮抗菌株的抑菌谱测定 采用平板对峙法测定拮抗菌株对辣椒腐霉菌、辣椒灰葡萄孢菌、辣椒立枯丝核菌、辣椒疫霉菌、茄链格孢、尖孢镰孢菌甜瓜专化型、尖孢镰孢菌西瓜专化型、尖孢镰孢菌十字花科专化型等重要蔬菜作物病原菌的抑菌效果。以培养皿中心不接种拮抗菌株的平板为对照,每处理3 次重复,每重复3 皿,28~30 ℃恒温培养2~3 d,测定抑菌圈直径,计算抑菌率。

1.2.3 拮抗菌株对黄瓜枯萎病的防效试验 菌剂制备。将拮抗菌株接种于50 mL 液体LB 培养基中,28 ℃恒温摇床220 r·min-1振荡培养2 d,4 ℃冰箱保存备用。施用前用无菌水调节拮抗菌剂浓度为1×108cfu·mL-1。
黄瓜枯萎病菌菌悬液制备。将保存备用的尖孢镰孢菌进一步活化,待PDA 培养基布满菌丝后,倒入适量无菌水刮取菌丝,经双层纱布过滤除去菌丝,滤液用无菌水稀释为浓度1×106个·mL-1的孢子悬浮液。
2021 年9 月,挑选无病虫害的饱满黄瓜种子催芽,待胚根长约1 cm 时充分浸没在黄瓜枯萎病菌菌悬液中30 min,捞出后播种于直径8 cm 的花盆中,每盆1 株;育苗基质由山东聊城鲁亿育苗基质有限公司与山东齐鲁大学联合研发,有机质含量35%~45%,腐殖酸含量15%~25%,pH 值5.5~6.5。播种后穴施5 mL 拮抗菌剂,以不施用拮抗菌剂为对照(CK1),以清水浸泡种子、不施用拮抗菌剂为空白对照(CK2);每处理150 株,3 次重复。常规育苗管理,播种后30 d 调查黄瓜枯萎病发病情况,并测定幼苗根系活力、叶绿素含量、脯氨酸(Pro)含量、过氧化物酶(POD)和超氧化物歧化酶(SOD)活性等指标。
黄瓜枯萎病发病程度及分级标准参考方中达(1998)的标准:0 级,根、茎、叶生长正常;1 级,1/4 以下根、茎变黄,植株稍有矮化;2 级,1/4~1/2根、茎变黄,下部叶片叶脉褪色;3 级,1/2~3/4根、茎变黄,茎基部纵裂;4 级,3/4 以上根、茎变黄或植株直接枯萎死亡。
发病率=发病株数/调查总株数× 100%
病情指数=∑(病级株数×代表级数)/(调查总株数×最高级值)× 100
防治效果=(对照病情指数-处理病情指数)/对照病情指数× 100%
采用红四氮唑(TTC)还原法测定根系活力,采用丙酮提取法测定叶绿素含量,采用考马斯亮蓝G-250 染色法测定可溶性蛋白质含量,采用紫外分光光度法测定POD、SOD 活性和Pro 含量(李小方和张志良,2016)。
1.3 数据处理
利用Microsoft Excel 2010 和SPSS 20.0 软件对试验数据进行统计及差异显著性分析。
2 结果与分析
2.1 细菌的分离及拮抗菌株的筛选
从22 份土样中分离得到205 株细菌菌株,通过平板对峙法初筛获得抑菌带宽度大于1 mm 的拮抗菌株107 株,占比为52.20%。其中,抑菌带直径大于4 mm 的菌株55 株,大于5 mm 的菌株38株。采用抑菌圈法继续对抑菌带宽度大于5 mm 的38 株拮抗菌株进行复筛,获得抑菌圈直径大于18 mm 的菌株22 株,大于20 mm 的菌株6 株(表1、图1)。

表1 拮抗菌株对黄瓜枯萎病菌的抑制作用
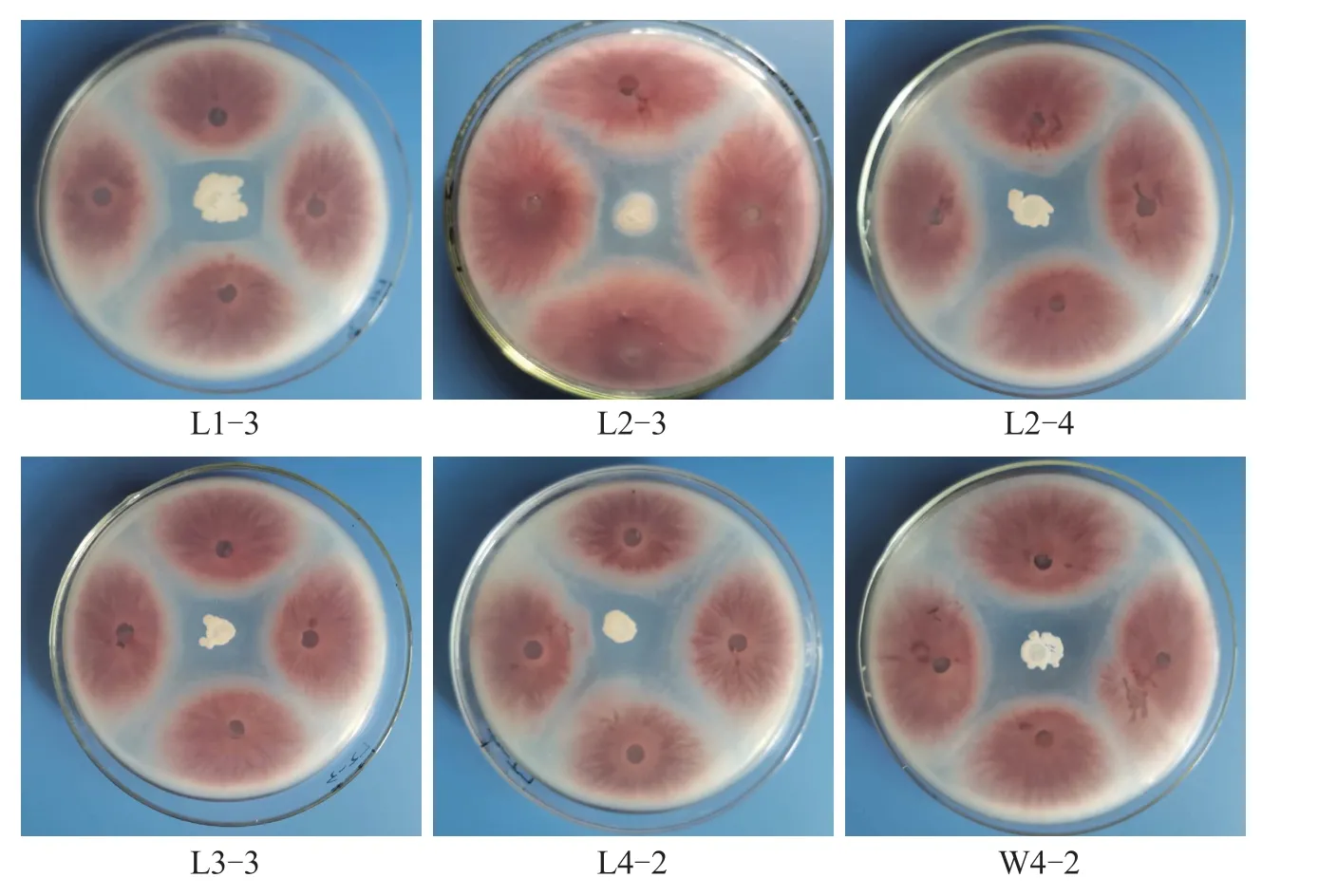
图1 拮抗菌株对黄瓜枯萎病菌的平板拮抗作用
2.2 拮抗菌株的鉴定
2.2.1 分子生物学鉴定 将拮抗菌株L1-3、L2-3、L2-4、L3-3、L4-2、W4-2 的16S rDNA序列在Ezbiocloud 网站上进行比对,显示与模式菌株Burkholderia gladioliNBRC 13700T相似性最高,相似系数分别为99.50%、99.01%、99.80%、99.42%、99.43%、99.29%。下载相关序列构建系统发育树(图2),本试验获得的6 株拮抗菌株均与Burkholderia gladioliNBRC 13700T聚在同一分支内,可初步鉴定这6 株拮抗菌株均为唐菖蒲伯克霍尔德氏菌(Burkholderia gladioli)。

图2 6 株拮抗菌株的16S rDNA 系统发育树
2.2.2 形态学观察及生理生化特性测定 通过分子生物学鉴定,拮抗菌株L1-3、L2-3、L2-4、L3-3、L4-2、W4-2 均为唐菖蒲伯克霍尔德氏菌,选择其中拮抗效果较好的菌株L1-3 进行形态学观察和生理生化特性测定。结果表明,L1-3 的菌落浅黄色,圆形,表面光滑、湿润、稍凸起,边缘整齐;菌体短杆状,两端钝圆,单个或成对排列;26~37 ℃条件下均能生长,为革兰氏阴性好氧菌。
2.3 拮抗菌株L1-3 的抑菌谱测定
由表2、图3 可知,菌株L1-3 对8 种主要蔬菜作物病原菌都有一定的拮抗作用,抑菌圈直径均大于21 mm,抑菌率为23.74%~38.23%;其中,菌株L1-3 对辣椒疫霉菌和辣椒灰葡萄孢菌的拮抗作用较强,抑菌圈直径分别达35.33 mm 和31.02 mm,抑菌率分别为38.23%和34.08%。表明菌株L1-3 具有广谱的拮抗作用,可将其应用于多种植物病害的生物防治。
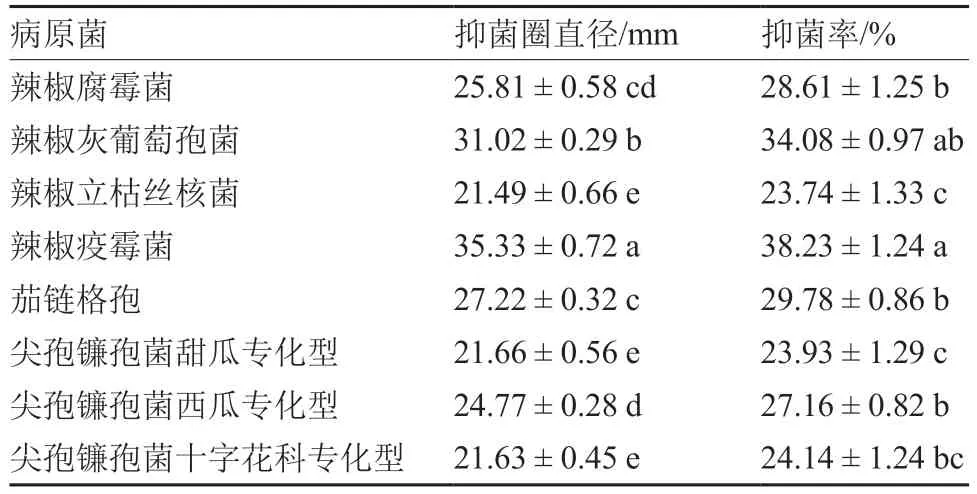
表2 拮抗菌株L1-3 对8 种主要蔬菜作物病原菌的抑制作用
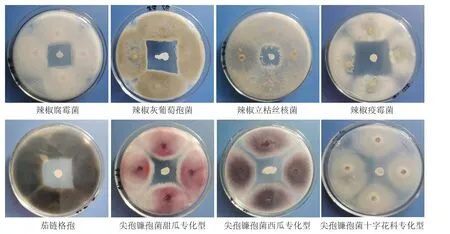
图3 拮抗菌株L1-3 对8 种主要蔬菜作物病原菌的平板拮抗作用
2.4 拮抗菌株L1-3 对黄瓜枯萎病的防治效果
从图4 可以看出,接种黄瓜枯萎病菌后施用L1-3 菌剂的黄瓜幼苗叶片肥大,叶色变深,根系较对照(CK1)增多,与空白对照(CK2)接近。由表3、4 可知,施用L1-3 菌剂对黄瓜枯萎病的防治效果达64.71%,黄瓜幼苗的根系活力、叶绿素含量、POD 和SOD 活性均显著高于对照(CK1),且根系活力、可溶性蛋白质含量、POD 和SOD 活性、Pro 含量均与空白对照(CK2)差异不显著。

图4 拮抗菌株L1-3 对黄瓜枯萎病的防治效果
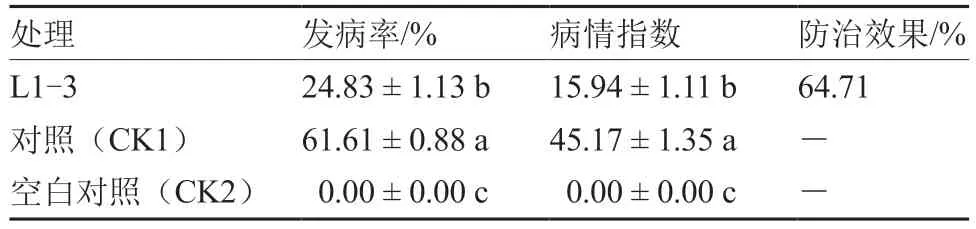
表3 拮抗菌株L1-3 对黄瓜枯萎病的防治效果
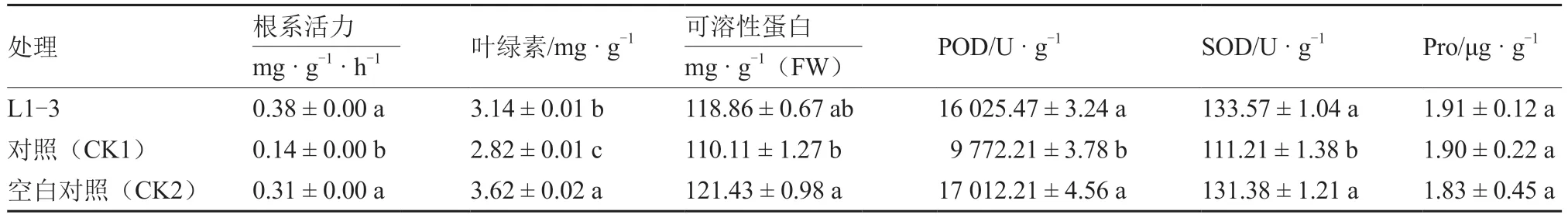
表4 拮抗菌株L1-3 对黄瓜幼苗的促生效果
3 讨论与结论
伯克霍尔德氏菌是近年来在植物根际土壤中发现的一类有益微生物(Paungfoo et al.,2016;Mullins et al.,2019),能够在至少30 种植物的根系中大量定殖,具有多种促生功能(Kim et al.,2012;宫安东 等,2019)。伯克霍尔德氏菌在根际环境中能够产生多种抗菌次生代谢产物,可诱导植物获得系统抗病性,抑制病原菌的生长,促进植物生 长(Wang et al.,2011;Depoorter et al.,2016;许萌杏 等,2021)。此外,伯克霍尔德氏菌还具有降解多种有害物质的特性(Simonetti et al.,2018)。
近年来从根际土壤中分离出的一批伯克霍尔德氏菌属细菌对植物病原菌具有广谱的拮抗作用。唐滢等(2020)研究表明,伯克霍尔德氏菌Z1 对香梨腐烂病原菌迂回壳囊孢菌、西瓜腐皮镰刀菌、辣椒炭疽病菌、油菜核盘菌及水稻立枯丝核菌有较强的拮抗作用。许萌杏等(2021)研究表明,洋葱伯克霍尔德氏菌JX-1 对尖孢镰孢菌苦瓜专化型、簇生长蠕孢菌、高粱茎点霉和立枯丝核菌等病原真菌具有不同程度的抑制作用。孙正祥等(2021)、吴丽娟等(2022)研究表明,伯克霍尔德氏菌YZU-S230 和JP2-270 对水稻纹枯病菌、稻瘟病菌、马铃薯晚疫病菌、草莓灰霉病菌、番茄斑枯病菌、小麦赤霉病菌和多种作物枯萎病菌有广谱的拮抗作用。本试验从黄瓜连作土壤中分离出的唐菖蒲伯克霍尔德氏菌L1-3 对尖孢镰孢菌甜瓜专化型、尖孢镰孢菌西瓜专化型、尖孢镰孢菌十字花科专化型、辣椒腐霉菌、辣椒灰葡萄孢菌、辣椒立枯丝核菌、辣椒疫霉菌、茄链格孢均具有较强的拮抗作用,表明菌株L1-3 具有广谱的拮抗作用,可将其应用于这些蔬菜病害的生物防治。
前人研究表明,伯克霍尔德氏菌可通过生物固氮作用促进甘蔗生长(Paungfoo et al.,2014)。接种双向伯克霍尔德氏菌或卡瑞苯西思伯克霍尔德氏菌,可以促进籽粒苋的生长,使籽粒苋吸收氮素的能力提高,地上部和根部的氮含量增加(Parra-Cota et al.,2014)。伯克霍尔德氏菌在营养不良的氧化土中,能够显著促进菜豆生长(de Oliveira-Longatti et al.,2015)。热带伯克霍尔德氏菌MTo-293 能够在番茄根部定殖且蔓延到植物各个器官,促进番茄生长(Bernabeu et al.,2015)。接种伯克霍尔德氏菌,可以提高水稻对磷素的吸收,促进水稻生长(Stephen et al.,2015;Khan et al.,2017)。吡咯伯克霍尔德氏菌JK-SH007 能够产生嗜铁素,进而促进黄瓜幼苗生长(闵莉静 等,2019)。在根部及叶片中定殖花园伯克霍尔德氏菌,可以提高甘蔗幼苗的单株鲜质量和干质量、株高、叶绿素含量;在根部接种伯克霍尔德氏菌MYSP113,甘蔗根部的过氧化物酶和超氧化物歧化酶活性显著提高(Malviya et al.,2019,2020)。本试验结果表明,与对照(CK1)相比,唐菖蒲伯克霍尔德氏菌L1-3 可以显著提高黄瓜幼苗叶绿素含量、根系活力、过氧化物酶和超氧化物歧化酶活性。
施俊凤等(2018)研究表明,采前喷施洋葱伯克霍尔德氏菌菌悬液,可抑制草莓果实表面的病原菌,降低果实腐烂率。Sandania 等(2019)研究了伯克霍尔德氏菌对辣椒炭疽病的生防作用,结果表明伯克霍尔德氏菌对辣椒炭疽病菌的芽孢萌发抑制率达100%,菌丝肿胀增厚、畸形;辣椒种子接种炭疽病菌后进行伯克霍尔德氏菌剂处理,幼苗存活率显著高于对照。本试验中,唐菖蒲伯克霍尔德氏菌L1-3 对黄瓜枯萎病的防治效果达64.71%。
综上所述,本试验首次筛选获得的唐菖蒲伯克霍尔德氏菌(Burkholderia gladioli)L1-3 除对黄瓜枯萎病菌有较强的拮抗作用外,还对多种蔬菜病原菌有较强的拮抗作用。推测菌株L1-3 可产生多种抑菌物质,或产生的抑菌物质具有较强的抑菌作用,关于菌株L1-3 及其抑菌物质的功能需进一步研究。盆栽试验结果表明,菌株L1-3 对黄瓜枯萎病的防效达64.71%,并且黄瓜幼苗叶绿素含量、根系活力、过氧化物酶和超氧化物歧化酶活性显著高于对照(CK1),表明菌株L1-3 在植物病害生物防治中具有一定的开发潜力,下一步将对菌株L1-3 的抑菌机理、发酵工艺和生防产品的研发进行深入研究。
