混凝土自修复菌Bacillus sp.芽孢生产和萌发条件的优化
2020-01-06张金龙李秋伟
罗 顺,刘 冰,张金龙,李秋伟,邓 旭
1)深圳大学生命与海洋科学学院,广东深圳 518055;2)深圳信息职业技术学院交通与环境学院,广东深圳 518172
混凝土是被广泛应用的建筑材料,服役过程中由于自然环境和外界压力的影响,表面和内部容易出现裂缝,破坏建筑结构,缩短建筑物的使用年限.1973年,BOQUET等[1]研究发现,众多土壤微生物具有成矿能力,受此启发,GOLLAPUDI等[2]利用细菌诱导碳酸钙的方式对建筑材料渗漏现象进行控制,开启了混凝土的微生物自修复研究.在混凝土出现裂缝时,微生物通过呼吸代谢产生CO2,在碱性条件下形成CO32-,与环境中的Ca2+反应生成CaCO3沉积在裂缝表面,从而填补裂缝[3].
混凝土内部是高压、缺氧、缺水的胁迫环境,水化过程中pH值甚至高达13,对微生物的生长极为不利.BUNDUR等[4]将巴氏芽孢八叠球菌(Sporosarcinapasteurii)的营养细胞混入混凝土中,7 d后细菌存活率为0.1%,若同时混入营养物质,细菌存活率也仅为3%.为了提高细菌的存活率,研究者开始尝试将细菌以芽孢的形式预埋入混凝土中.相比于营养细胞,芽孢的抗逆能力强,尤其是能抵抗水泥水化过程中的强碱性环境和剪切力,有利于在混凝土中存活.当混凝土开裂时,外界氧气和水分进入,促使芽孢萌发成营养细胞,修复裂缝.目前用于混凝土裂缝自修复的细菌基本上都属于芽孢菌属,如科氏芽孢杆菌(Bacilluscohnii)、巴氏芽孢八叠球菌(S.pasteurii)、枯草芽孢杆菌(Bacillussubtilis)[5]和球形芽孢杆菌(Bacillussphaericus)等.NAIN等[5]研究发现,经过28 d的修复,巨大芽孢杆菌(Bacillusmegaterium)使混凝土试块抗压强度提高22.5%,枯草芽孢杆菌(B.subtilis)使混凝土试块抗拉强度提高25.3%.LORS等[6]研究了嗜碱芽孢杆菌(Bacilluspseudofirmus)对混凝土裂缝的修复效果,通过提供外源乳酸钙能使裂缝宽度减小155 ~ 179 μm.由此可见,利用微生物修复混凝土裂缝具有很好的应用前景.
要实现混凝土裂缝的微生物自修复,首先需要将足够数量的芽孢预置入混凝土;当裂缝出现时,芽孢还要萌发生长成营养细胞后才能诱导碳酸钙的形成.芽孢的生产和萌发受多种环境因素如温度、pH值、金属离子以及营养条件的影响,目前这方面的研究主要集中在食品、医药等领域,对于应用于混凝土自修复的矿化微生物鲜有涉及.本研究拟系统考察影响混凝土自修复细菌芽孢产量及萌发的主要因素,从而探明提高芽孢产率和萌发效率的优化途径,为实现混凝土裂缝的微生物自修复提供实验参考.
1 材料与方法
1.1 实验材料
1.1.1 菌种
一株嗜碱芽孢杆菌Bacillussp.,命名为B8,由深圳市福田区红树林沉积土筛选获得.
1.1.2 培养基
1)菌种活化培养基(1 L).其中,牛肉膏3 g;蛋白胨10 g;碳酸钠9.54 g;碳酸氢钠0.84 g.
2)芽孢发酵培养基(1 L).其中,氯化钾0.476 g;磷酸二氢钾0.02 g;氯化钙0.17 g;六水合氯化镁0.2 g;一水合硫酸锰0.01 g;硝酸铵0.3 g;酵母粉1 g;60%L-乳酸钠1.87 g(单独灭菌);碳酸钠5.3 g或碳酸氢钠4.2 g(单独灭菌).
3)芽孢萌发培养基(1 L).其中,肌苷2.682 g;氯化钠11.688 g;3-(环己氨基)-1-丙磺酸22.132 g.
1.2 实验方法
1.2.1 菌种活化培养
从4 ℃冰箱中取出菌种,用接种环刮取菌苔接入到50 mL培养基中,置于30 ℃、150 r/min条件下振荡培养18 h,备用.
1.2.2 芽孢发酵培养
将活化菌悬液稀释,按体积分数1%接种到50 mL芽孢发酵培养基中,于30 ℃、150 r/min条件下振荡培养48 h,检测芽孢产量.
1.2.3 芽孢浓度检测
芽孢产量用芽孢浓度表征,具体过程为:取2 μL 待检芽孢悬浮液滴加在细菌计数板中心计数区,随机选取n个小格采用“计上不计下,计左不计右”的原则记录芽孢数量,计算芽孢浓度,为
其中,S为芽孢浓度;N为芽孢总数;n为格子数.
1.2.4 芽孢发酵的单因素优化
1)接种量.将活化后的菌悬液稀释成1×107、1×108、1×109和2×109mL-14个浓度,按1%的体积比接种到对应的锥形瓶(250 mL)中,每瓶装有50 mL芽孢发酵培养基,接种后的芽孢初始浓度分别为1×105、1×106、1×107和2×107mL-1.
2)碳源.选取葡萄糖、D-果糖、蔗糖、麦芽糖、甘露糖和淀粉6种糖类和甲酸钠、乙酸钠、草酸钠、海藻酸钠、D-葡萄糖酸钠和L-乳酸钠6种有机酸盐作为碳源,质量浓度为1 g/L,进行碳源种类筛选;获得优势碳源后,设置质量浓度为0.5、1.0、2.0、3.0、4.0和5.0 g/L进行碳源浓度优化.
3)氮源.选取硝酸钠、硝酸铵、尿素、牛肉膏、蛋白胨和酵母粉作为氮源,质量浓度为1 g/L,进行氮源种类筛选;获得优势氮源后,设置质量浓度为0.5、1.0、2.0、3.0、4.0和5.0 g/L进行氮源浓度优化.
4)金属离子.Mg2+和Mn2+分别来源于六水合氯化镁和一水合硫酸锰,其中,Mg2+质量浓度为0.06、0.12、0.24、0.36和0.48 g/L,Mn2+质量浓度为1.6、3.2、4.8、6.4和8.0 mg/L.
1.2.5 正交实验
在单因素实验的基础上,以芽孢浓度为考察指标,通过正交实验对接种量、淀粉、酵母粉、Mg2+和Mn2+的用量进行优化,每个因素选取3个水平,如表1.

表1 B8芽孢发酵培养基正交实验设计
1.2.6 制备芽孢悬浮液
利用优化后的培养基生产芽孢,在4 ℃、7 000 r/min的条件下离心10 min,去掉上清液,用无菌水洗涤再离心,重复10次.用灭菌的去离子水配置芽孢悬浮液,浓度为4×109mL-1,保存在4 ℃冰箱中,备用.
1.2.7 芽孢萌发检测
在490 nm波长下,随着芽孢萌发率增加,光密度值逐渐下降.实验中,利用光密度值的变化,判断芽孢萌发状态,并在相差显微镜下利用细菌计数板检测未萌发芽孢数,计算芽孢萌发率.具体过程如下:将芽孢悬浮液(浓度4×109mL-1)置于60 ℃水浴10 min,取200 μL至10 mL离心管中,再取1.8 mL芽孢萌发培养基至离心管中,摇匀后取200 μL至96孔板中,用多功能酶标仪每隔30 min测量1次D(490);将装有芽孢的离心管置于30 ℃、150 r/min的条件下震荡培养,待萌发稳定后检测未萌发芽孢数(参照1.2.3),计算芽孢萌发率,为
其中,G为芽孢萌发率;S为未萌发芽孢浓度;S0为初始芽孢浓度.
1.2.8 芽孢萌发条件优化
1)萌发剂.分别选取L-丙氨酸、L-组氨酸、L-苏氨酸、L-精氨酸、L-色氨酸、L-甘氨酸、L-谷氨酸、L-天冬酰胺和肌苷为萌发剂,质量浓度均为3 g/L,进行萌发剂种类筛选.获得优势萌发剂后,设置浓度为0.05、0.10、0.20、0.50、1.00、2.00和5.00 g/L进行萌发剂浓度优化.
2)pH值.将芽孢萌发体系的初始pH值分别调节为7、8、9、10、11、12和13,待萌发稳定后计算芽孢萌发率.
3)金属离子.芽孢的萌发也需要金属离子的参与,菌株筛选自金属离子种类多、含量高的滨海湿地,因此,以海水中金属离子的含量为依据,探究了Na+、K+、Mg2+、Ca2+和Mn2+5种主要金属离子对芽孢萌发的影响.在芽孢萌发体系中分别加入Na+、K+、Mg2+、Ca2+和Mn2+,质量浓度分别为10.500、0.400、0.030、0.600和0.011 g/L.其中,系列1只加金属离子,不加萌发剂,系列2同时添加金属离子和萌发剂,随后探究对芽孢萌发具有影响作用的金属离子的浓度效应.待芽孢萌发稳定后,计算萌发率.
以上所有实验均重复3次.
2 结果与讨论
2.1 芽孢生产条件优化
2.1.1 接种量
接种量不同,芽孢产量有明显差异.如图1,接种量为1×107mL-1时,培养48 h后芽孢浓度为2.37×108mL-1,而且随着培养时间增加,芽孢浓度基本保持稳定.接种量为1×105mL-1和1×106mL-1时,最终芽孢浓度都在1×108mL-1以下;接种量为2×107mL-1时,48 h芽孢浓度超过3.5×108mL-1,但进一步延长培养时间,部分芽孢萌发生长成营养细胞,芽孢浓度反而下降.接种量是芽孢产量的影响因素之一,严涛等[7]研究表明,接种量为4%时,凝结芽孢杆菌BC01(Bacilluscoagulans)产孢率可达65.1%,但继续增大接种量则产孢率急剧下降.这可能是因为接种量过大导致营养细胞生长过快,环境中有害代谢产物积累过多所致.

图1 接种量对芽孢产量的影响
2.1.2 碳源
如图2显示了不同碳源对芽孢产量的影响.其中,CK为对照组.由图2可见,以淀粉为碳源产芽孢效果最好.随着淀粉质量浓度的增加,芽孢浓度呈先增后降趋势.淀粉质量浓度为0.5 g/L时,芽孢浓度最高,为3.76×108mL-1.由此可见,高浓度的淀粉不利于芽孢生成.左肖肖等[8]研究也表明,可溶性淀粉是枯草芽孢杆菌(B.subtilis)芽孢生产的最适碳源,添加量为0.5%(质量分数)时,芽孢浓度为6×106mL-1,之后再增加淀粉含量,芽孢产量反而下降,与本研究一致.这可能是因为加入高浓度淀粉为细菌营养细胞的生长繁殖提供了充足的碳源,营养胁迫的限制减小,导致芽孢萌发,从而芽孢产量下降.此外,淀粉实惠易得,因此本实验选取淀粉作为B8芽孢生产的碳源.

图2 不同碳源和淀粉浓度对芽孢产量的影响
2.1.3 氮源
本研究实验结果表明,以酵母粉为氮源芽孢产率高于其他种类氮源,且随着酵母粉质量浓度的增加,芽孢浓度呈先增后降趋势(图3).酵母粉浓度为2 g/L时,芽孢浓度最大,为4.34×108mL-1.在芽孢生产工艺中,酵母粉是一种常见的氮源,如在侧孢芽孢杆菌C5(B.laterosporusC5)生产过程中,以酵母膏为氮源效果最佳[9].冯鑫等[10]研究表明,以酵母浸粉为氮源,使酸土脂环酸芽孢杆菌芽孢产量提高了12.81倍.左肖肖[8]等对枯草芽孢杆菌的研究发现,加入酵母膏的浓度为0.2%(质量分数)时,芽孢量为6.1×107mL-1,浓度增加到1.2%时,芽孢量下降到1.7×106mL-1.由此可见,低浓度酵母粉有利于芽孢生产.
2.1.4 金属离子
Mg2+和Mn2+是影响芽孢生产的主要金属离子,随着离子浓度的增加,芽孢浓度呈先增后降的趋势(图4).Mg2+质量浓度为0.24 g/L时,芽孢浓度最大,为2.94×108mL-1;Mn2+质量浓度为4.8 mg/L时,芽孢浓度最大,为1.88×108mL-1.可见,Mg2+和Mn2+的浓度过低或过高都不利于芽孢形成.Mg2+和Mn2+是细菌生长和芽孢生成所需的微量元素,Mg2+能激活多种代谢酶,影响Na+和Ca2+等离子的转运,Mn2+则是L-阿拉伯糖异构酶和超氧化物歧化酶等关键酶的辅助因子.然而,在芽孢生产过程中,不同菌种所需Mg2+和Mn2+的含量存在差异.董佩佩等[11]对一株凝结芽孢杆菌(B.coagulans)产芽孢培养基进行优化发现,所需MgSO4的最优质量浓度为0.49 g/L.吴迎奔等[9]对侧孢芽孢杆菌C5研究发现,添加0.2 g/L的 MnSO4有助于芽孢形成.冯鑫[10]等的结果表明,在酸土脂环酸芽孢杆菌(A.acidoterrestris)芽孢生产过程中,MgSO4质量浓度低于0.34 g/L时,芽孢数和芽孢形成率皆随MgSO4质量浓度增加而增加,高于0.34 g/L时,芽孢数略有下降;加入0.24~0.48 g/L MnSO4能促进芽孢生成,而质量浓度高于0.48 g/L时,对芽孢生成有抑制作用,结果与本研究一致.

图4 金属离子对芽孢产量的影响
2.1.5 正交实验优化
基于单因素实验,通过正交实验对接种量、淀粉、酵母粉、Mg2+和Mn2+的用量进行优化.结果表明,各因素对B8芽孢产量的影响大小为:酵母粉>接种量> Mn2+>淀粉> Mg2+,所得优化组合为:A3B3C3D3E2,即接种量为1×107mL-1,淀粉质量浓度为5 g/L,酵母质量粉浓度为5 g/L,Mg2+质量浓度为0.48 g/L,Mn2+质量浓度为4.8 mg/L,在此优化组合下,所得芽孢浓度为1.54×109mL-1,高于正交实验各个组合.方差分析结果表明,接种量对芽孢产量有显著影响(P<0.05),酵母粉质量浓度对芽孢产量有极显著影响(P<0.01),其他组分对芽孢产量的影响无统计学意义(P>0.05).因此,在芽孢生产过程中,要严格控制接种量和酵母粉的使用量.
2.2 芽孢萌发
2.2.1 萌发时间
如图5所示,随着萌发时间的增加,D(490)逐渐下降,芽孢萌发率逐渐增加,在4 h时萌发趋于稳定,芽孢萌发率超过85%.通常芽孢萌发所需的时间较短,且不同菌种的芽孢之间存在差异.SHARMA等[12]研究发现,科氏芽孢杆菌(B.cohnii)芽孢在3 h时,萌发率可达98%,而嗜碱芽孢杆菌(B.pseudofirmus)芽孢在20 h时才开始萌发,经过10 h才萌发完全.本实验所用的B8芽孢萌发比较迅速,3 ~ 4 h就能萌发完全.芽孢萌发时间与不同菌种芽孢内膜所含的营养萌发受体量有关,萌发受体量多,芽孢萌发就快,萌发受体量少,芽孢萌发所需时间长,甚至能使芽孢进入深休眠状态[13].此外,芽孢萌发速率与所用萌发剂、无机盐、环境pH值和热处理等有关.

图5 芽孢萌发率和D(490)随萌发时间的变化
2.2.2 萌发剂
芽孢萌发的萌发剂大多为氨基酸类,本研究对9种萌发剂进行了考察,发现肌苷和L-丙氨酸能较好地促使芽孢萌发,其他几种氨基酸促萌发效果较差(图6).对肌苷质量浓度作进一步考察发现,在0~0.1 g/L随着质量浓度的增加,芽孢萌发率迅速升高;在0.1~2.0 g/L,芽孢萌发率增加变缓;肌苷浓度高于2.0 g/L时,芽孢萌发率几乎不再增加.可见,适宜的肌苷质量浓度为2.0 g/L.不同菌种的芽孢所需萌发剂的种类和用量存在差异.如科氏芽孢杆菌DSM6307(B.cohniiDSM6307)芽孢的最适萌发剂为肌苷,最适浓度为15 mmol/L,浓度过高反而抑制芽孢萌发[14].GOUNINA-ALLOUANE等[15]发现,利用1~100 mmol/L的L-丙氨酸或0.01~10.00 mmol/L的肌苷能促使蜡状芽孢杆菌(Bacilluscereus)迅速萌发.除了糖类、氨基酸和嘌呤核苷等营养萌发因子,非营养萌发因子以及高压、热处理等物理因素也能诱导芽孢萌发.

图6 不同萌发剂和肌苷浓度对芽孢萌发的影响
2.2.3 pH值
环境条件是影响芽孢高效萌发的因素之一,如图7,随着pH值的增加,芽孢萌发率呈先增后降的趋势.pH值为10时,芽孢萌发率最高,为86.25%;pH值为9和11时,萌发率分别为74.38%和65.63%,相对较高;pH值低于8或高于12时,芽孢萌发率急剧下降.因此,芽孢萌发适宜的pH值范围为9~11.不同菌种的生长环境不同,导致其芽孢萌发所需的pH值也存在差异.VERCAMMEN等[16]研究发现,在800 MPa的高压下、pH值为4的缓冲液能促使凝结芽孢杆菌LMG6326(B.coagulansLMG6326)芽孢萌发.SETLOW等[17]研究表明,pH值为7.3~7.5时,枯草芽孢杆菌(B.subtilis)芽孢开始萌发.本实验所研究的菌株B8筛选于碱性环境,因此在碱性条件下更有利于该菌株芽孢的萌发.
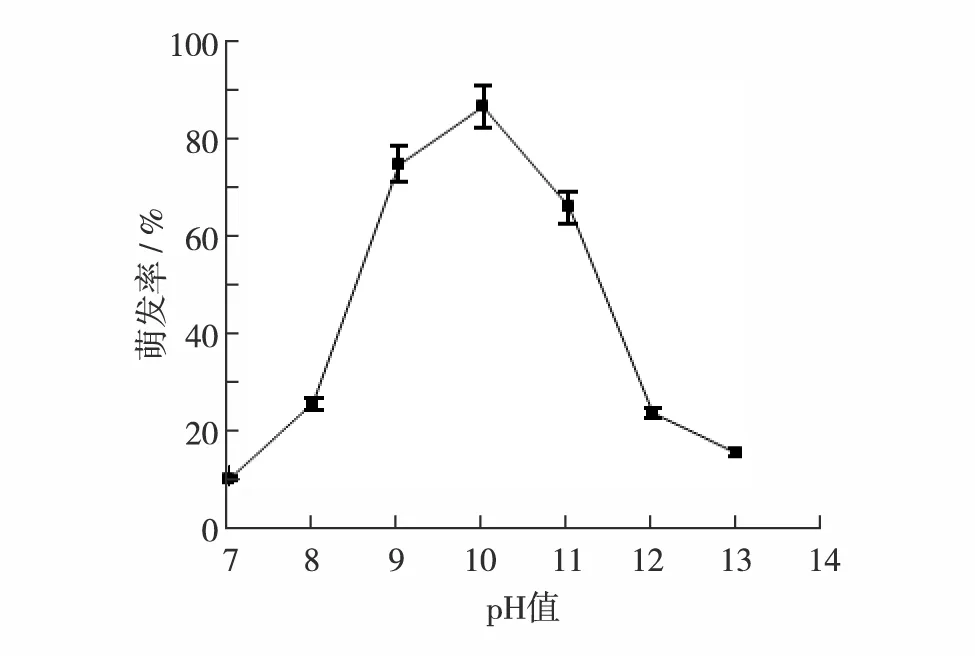
图7 pH值对芽孢萌发的影响
2.2.4 金属离子
图8显示了不同金属离子对芽孢萌发的影响.由图8可见,不加肌苷的系列中,芽孢几乎不萌发,可见芽孢萌发必须要有萌发剂的参与.但除肌苷外,一些金属离子也会对萌发过程产生影响.在加入肌苷的系列中,Na+的存在使芽孢萌发率高达75.42%;加入K+、Mg2+和Mn2+芽孢萌发率分别为30%、34.67%和32%,与对照组的32.67%相近;而加入Ca2+芽孢萌发率仅为6%,芽孢几乎不萌发.可见Na+能促进芽孢萌发,但Ca2+严重抑制芽孢萌发,而K+、Mg2+和Mn2+对芽孢萌发无明显影响.进一步考察肌苷存在时不同Na质量浓度对芽孢萌发的促进作用.如图8,随着Na+质量浓度的增加,芽孢萌发率呈先增后减的趋势.Na+质量浓度在0~3 g/L时,芽孢萌发率迅速升高;在3~24 g/L时,芽孢萌发率缓慢下降;当质量浓度高于24 g/L时,芽孢萌发率迅速下降.其中,Na+质量浓度为3 g/L时,芽孢萌发率最大,为89.17%;质量浓度为0.6 g/L和24.0 g/L时,也具有较高的萌发率,分别为77.29%和73.75%.由此可见,B8芽孢对Na+质量浓度的耐受范围较宽,在0.6~24.0 g/L皆能保持较高的萌发率.

图8 不同金属离子对芽孢萌发的影响
在混凝土内部环境中,Ca2+的含量较高(如普通水泥中,CaO的质量分数高达50%~55%),这将对芽孢萌发造成严重抑制.芽孢如果不能萌发并生长为营养细胞,就无法诱导碳酸钙的生成,从而大幅降低微生物自修复的效率,因此,必须采取措施解除Ca2+对芽孢萌发的抑制作用.由图8可知,Na+对芽孢萌发具有明显的促进作用,因此本研究利用Na+的促进作用来抵消Ca2+的抑制作用.如图9,在含有0.6 g/L的Ca2+体系中加入10.6 g/L的Na+,芽孢萌发率从对照组的6.00%左右上升到30.67%,而加入K+、Mg2+和Mn2+的芽孢萌发率分别为5.33%、4.00%和6.67%,与对照相近,对芽孢萌发无促进作用.由此可见,Na+确实能在一定程度上解除Ca2+对芽孢萌发的抑制.从文献调研的情况来看,这是首次证实Na+具有消除Ca2+对芽孢萌发抑制的作用.

图9 含Ca2+体系中,共存金属离子对芽孢萌发的影响
在确定Na+能有效解除抑制后,进一步考察了不同质量浓度Na+的抑制解除效果.如图9,在含有0.6 g/L的Ca2+体系中,随着Na+质量浓度增加,芽孢萌发率呈先增后减的趋势.当Na+质量浓度为24.0 g/L时,芽孢萌发率最高达到82.71%,基本恢复到无Ca2+抑制的水平,表明在此质量浓度时,Ca2+对芽孢萌发的抑制作用被完全解除.
芽孢萌发过程通常伴随有H+和K+等一价阳离子从芽孢内核释放,这可能与芽孢内膜上的离子转运蛋白有关.SOUTHWORTH等[18]研究发现,在蜡状芽孢杆菌(B.cereus)芽孢中存在一种Na+和K+的反向转运蛋白GerN,外界Na+内流促使H+、K+释放,促进芽孢萌发,在其他种属的细菌芽孢中也可能存在类似的离子转运蛋白.SHARMA等[12]研究表明,嗜碱芽孢杆菌(B.pseudofirmus)芽孢萌发需要Na+存在,在萌发体系中加入0.10 mol/L NaCl,芽孢萌发率高达99%,加入0.05 mol/L NaCl,芽孢萌发率为82%,不添加NaCl,芽孢不萌发.本实验中,Na+能促进B8芽孢的萌发,也可能是芽孢内膜上存在相关离子转运蛋白,通过Na+内流促使内核中其他阳离子外排,伴随着内核吸水,促进萌发.
在芽孢形成过程中,内核生成2,6-吡啶二羧酸(pyridine-2,6-dicarboxylic acid, PDA),会吸收Ca2+,以1∶1结合生成螯合物Ca2+-PDA,而芽孢萌发伴随着Ca2+-PDA的释放,当外界存在Ca2+时,会抑制Ca2+-PDA的释放,进而抑制萌发[13].本实验表明,当环境中存在Na+时,相关离子转运通道可能被开启,使内核中H+和K+等离子释放的同时可能也导致了Ca2+-PDA释放,引起内核吸水,从而解除Ca2+的抑制作用,最终促使芽孢萌发.
结 语
在B8芽孢生产过程中,接种量和酵母粉含量对芽孢产量有显著影响,优化后各组分为:接种量1×107mL-1、淀粉5 g/L、酵母粉5 g/L、Mg2+0.48 g/L和Mn2+4.8 mg/L,所得芽孢浓度为1.54×109mL-1,产量大幅度提高.碱性环境能保证B8芽孢高效萌发,肌苷能刺激芽孢快速萌发,Na+促进芽孢萌发,Ca2+抑制萌发;高质量浓度Na+能缓解Ca2+的抑制作用,促进芽孢萌发.
