我国不同产地党参指纹图谱分析比较
2022-12-13黄延盛张欣刘耀军胡流云王长虹王峥涛黄晓君
黄延盛,张欣,刘耀军,胡流云,王长虹,王峥涛,黄晓君
(1.无限极(中国)有限公司,广东 广州 510623;2.上海中药标准化研究中心,上海 201203;3.南昌大学食品科学与技术国家重点实验室,中国-加拿大食品科学与技术联合实验室,江西省生物活性多糖实验室,江西 南昌 330047)
党参属(Codonopsis)隶属桔梗科(Carnpanulaceae),全属共40余种,我国有39种。野生党参主要分布于西南各省区,栽培党参则主产于西北、华北地区[1]。本属植物党参 [Codonopsis pilosula(Franch.)Nannf.]、素花党参[C.pilosula var.modesta(Nannf.)L.T.Shen]及川党参(C.tangshen Oliv.)为2010版《中国药典》收录品种,其干燥根作为党参入药,具有补中益气、健脾益肺功效[2-4],可用于治疗脾肺虚弱、气短心悸、食少便溏、虚喘咳嗽、内热消渴等症[5-6]。党参属大多种类的根部均具有药用价值,一些种类如管花党参(C.tubulosa Kom.)、球花党参(C.subglobosa Srnith.)、灰毛党参(C.canescens Nannf.)、新疆党参[C.clematidea(Schrenk)Clarke.]等在临床上也作为党参使用。现代研究表明,党参多糖具有保护胃黏膜、调节人体免疫、改善胃肠炎症等作用[7-9]。
在《中国药典》2010年版(一部)中,党参只有醇溶性浸出物、薄层定性鉴别等指标,无法全面评价和控制党参质量。有研究以薄层扫描法测定党参中甾类或三萜类成分来控制党参质量,但甾类或三萜类成分不是党参特有成分,缺乏专属性。现有关于党参甙I的研究,主要集中在山西产党参,缺乏对多产地品种进行系统全面研究,难以成为表征党参质量的指标[10]。苍术内酯III只存在于党参(C.pilosula)中,素花党参(C.Pilosula var.modesta)和川党参(C.tangshen)中则不含有此成分,而在菊科、金粟兰科中有分布,不能全面准确反映《中国药典》收录的党参类种类的质量。党参炔苷在党参类种间、产地间相差悬殊。通过党参指纹图谱,可对不同品种和不同产地党参的质量进行快速定性分析。此外,对党参中黄酮类、氨基酸和微量元素的含量以及挥发油的组分和含量进行测定,同样因缺乏专属性或尚未建立稳定可靠的方法也不能作为党参定性、定量的依据[11-12]。因此建立一种有效的方法来控制党参质量显得尤为重要[13]。
党参的指纹图谱[14]已有众多报道,主要集中在党参炔苷(lobetyolin)、苍术内酯 III(atractylenolide III)等成分,而且多采用高效液相色谱仪(high performance liquid chromatography,HPLC)进行指纹图谱的建立,分析时间一般在60 min以上,很少采用超高速液相色谱仪(ultra performance liquid chromatography,UPLC)进行党参指纹图谱分析[15-16]。本研究通过超高速液相色谱仪[17]对不同产地不同品种党参进行指纹图谱分析,在党参指纹图谱的基础上,生成具有9个特征峰的党参特征图谱,采用相似度分析、主成分分析对特征图谱进行评价。通过对主要产地和品种党参指纹图谱的分析及比较,为后续选择适宜品种党参作为食品或加工原料提供参考。
1 材料与方法
1.1 材料与试剂
35批党参主要来源于甘肃、贵州、山西、湖北、重庆党参主产区,经上海中药标准化研究中心吴立宏研究员鉴定,其性状与2015年版《中国药典》所规定的党参一致,鉴定为正品。具体信息见表1。
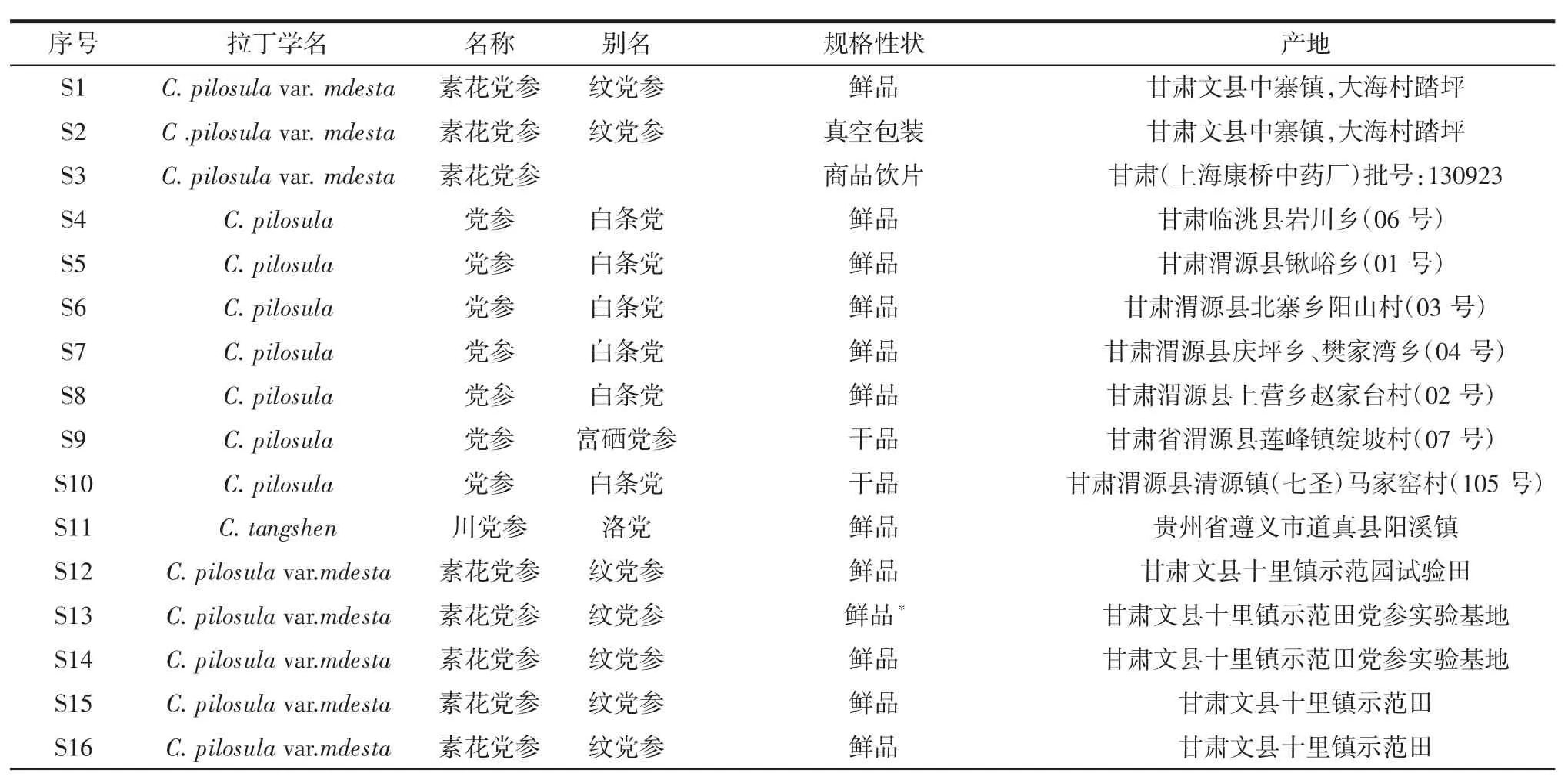
表1 党参信息汇总Table 1 Information of Codonopsis pilosula

续表1 党参信息汇总Continue table 1 Information of Codonopsis pilosula
乙酸乙酯、甲醇(均为分析纯):国药集团化学试剂有限公司;乙腈、甲醇、甲酸(均为色谱纯):美国Fisher公司;紫丁香苷标准品、阿魏酸标准品、苍术内酯III标准品(纯度均≥98%):上海中药标准化研究中心;党参炔苷标准品(纯度≥98%):成都瑞芬思生物科技有限公司。
1.2 仪器与设备
KQ-250DB数控超声波清洗仪:江苏昆山市超声仪器有限公司;DFT-50型手提式高速粉碎机:温岭市林大机械有限公司;RE-56旋转蒸发仪:上海爱朗仪器有限公司;PB203-N电子天平:上海分析仪器厂;PBL-M型离心机:上海菲恰尔分析仪器有限公司;METTLER200型电子天平:瑞士METTLER TOLEDO公司;Waters ZQ 2000型单四极杆质谱仪(Masslynx V4.1色谱工作站包,Waters Acquity PDA二极管阵列检测器)、Acquity UPLCHSS T3 C18色谱柱(1.8 μm,2.1 mm×100 mm):美国Waters公司。
1.3 方法
1.3.1 样品前处理
党参共35份样本,从每份样本中挑选200 g无霉变、外观良好的党参用粉碎机粉碎,过3号筛备用。
1.3.2 党参主要成分测定
1.3.2.1 标准液的配制
分别称取紫丁香苷、阿魏酸、党参炔苷、苍术内酯III 4 种党参标准品 6.32、10.12、8.14、9.67 mg,使用纯化水溶解后分别定容于25 mL容量瓶中作为贮备液,贮备液浓度分别为紫丁香苷0.252 8 mg/mL、阿魏酸0.404 8 mg/mL、党参炔苷0.325 6 mg/mL、苍术内酯III 0.386 8 mg/mL。吸取适量上述4种标准品贮备液于50 mL容量瓶中,作为稀释一系列不同浓度标准溶液的原液。
1.3.2.2 进样前处理
精密称取党参粉末置于100 mL具塞锥形瓶中,加入20 mL乙酸乙酯,超声辅助提取(功率250 W、频率40 kHz)30 min后过滤,收集乙酸乙酯提取液,置于25 mL梨形烧瓶中,减压浓缩至干;沉淀再加80%甲醇溶液,超声辅助提取(功率250 W、频率40 kHz)50 min;收集醇提液,置于同一25 mL梨形烧瓶中,减压浓缩至干,加甲醇溶解并转移至5 mL容量瓶中,过0.22 μm滤膜,取续滤液进样至UPLC,进样量5 μL。
1.3.2.3 色谱条件
流动相:乙腈(A)-0.1%甲酸水(B)。梯度洗脱:0~14 min,0.5%~20%(A);14 min~18.5 min,20%~30%(A);18.5 min~23 min,30%~50%(A);23 min~30 min,50%~98%(A);30 min~32 min,98%(A);32 min~34 min;98%~0.5%(A)。流速0.2 mL/min、柱温30℃、检测波长240nm。
1.4 数据分析
采用国家药典委员会颁布的“中药色谱指纹图谱相似度评价系统”(2004A版)软件对35批的指纹图谱进行相似度分析。采用SIMCA13.0统计学分析软件进行主成分分析。
2 结果与分析
2.1 党参指纹图谱检测方法建立
选取色谱图中12个具有代表性且分离度良好的色谱峰,其中3个色谱峰为已确认的紫丁香苷、党参炔苷、苍术内酯III,其余9个色谱峰以出峰时间(6.38、6.67、8.19、13.75、15.72、16.18、17.64、17.87、19.27 min)为标记对象。
2.1.1 稳定性试验结果
取 S12 样品分别于 0、1、2、4、8、12、24、36 h 进样检测。以党参炔苷色谱峰(7号峰)为参照峰,计算各共有峰的相对保留时间、相对峰面积,结果见表2。
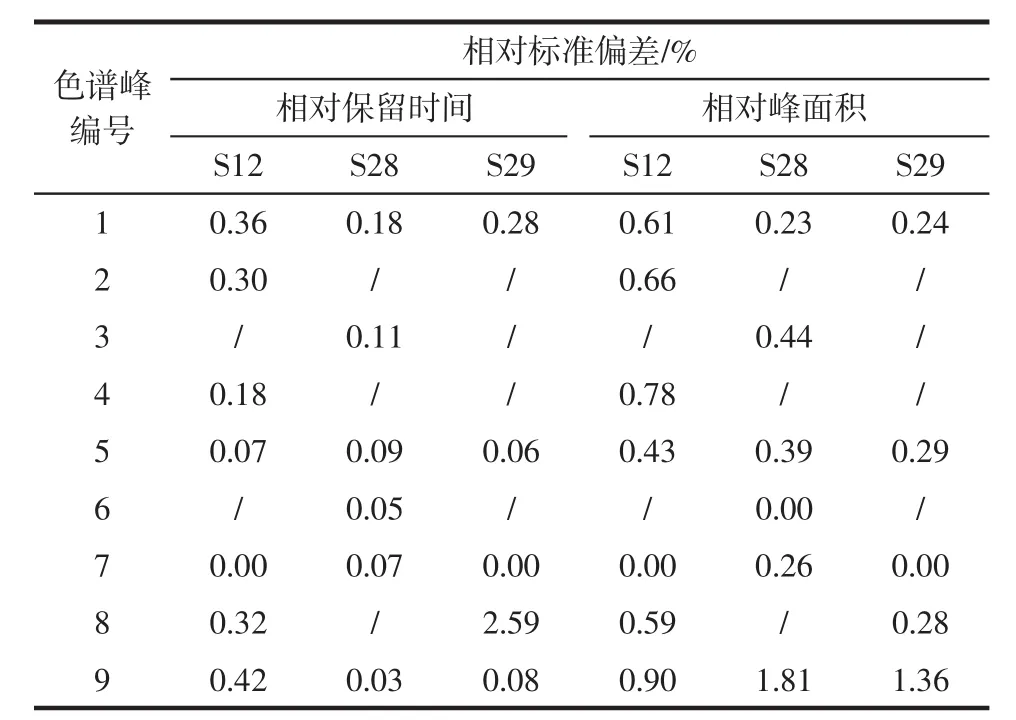
表2 素花党参(S12)、川党参(S28)、党参(S29)稳定性试验相对保留时间、相对峰面积Table 2 Relative retention schedule and peak area of stability experiment of Codonopsis pilosula var.mdesta(S12),C.tangshen(S28)and Codonopsis pilosula(S29)
由表2可知,各共有峰的相对保留时间、相对峰面积的相对标准偏差(relative standard deviation,RSD)均小于3%(n=6)。表明供试品溶液稳定性良好。
2.1.2 精密度试验结果
分别取供试品溶液S12、S28、S29,连续进样6次,记录色谱图。以党参炔苷(7号峰)为参照峰,计算各共有峰的相对保留时间、相对峰面积,结果见表3。

表3 素花党参(S12)、川党参(S28)、党参(S29)精密度试验相对保留时间、相对峰面积Table 3 Relative retention schedule and peak area of precision experiment of Codonopsis pilosula var.mdesta(S12),C.tangshen(S28)and Codonopsis pilosula(S29)
由表3可知,各共有峰的相对保留时间、相对峰面积RSD均小于3%(n=6),表明仪器精密度良好。
2.1.3 重复性试验结果
分别精密称取6份S12、S28、S29党参样品粉末,按1.3.2.2方法制备样品溶液。液相进样检测,记录色谱图。以党参炔苷色谱峰(7号峰)为参照峰,计算各共有峰的相对保留时间、相对峰面积,结果见表4。
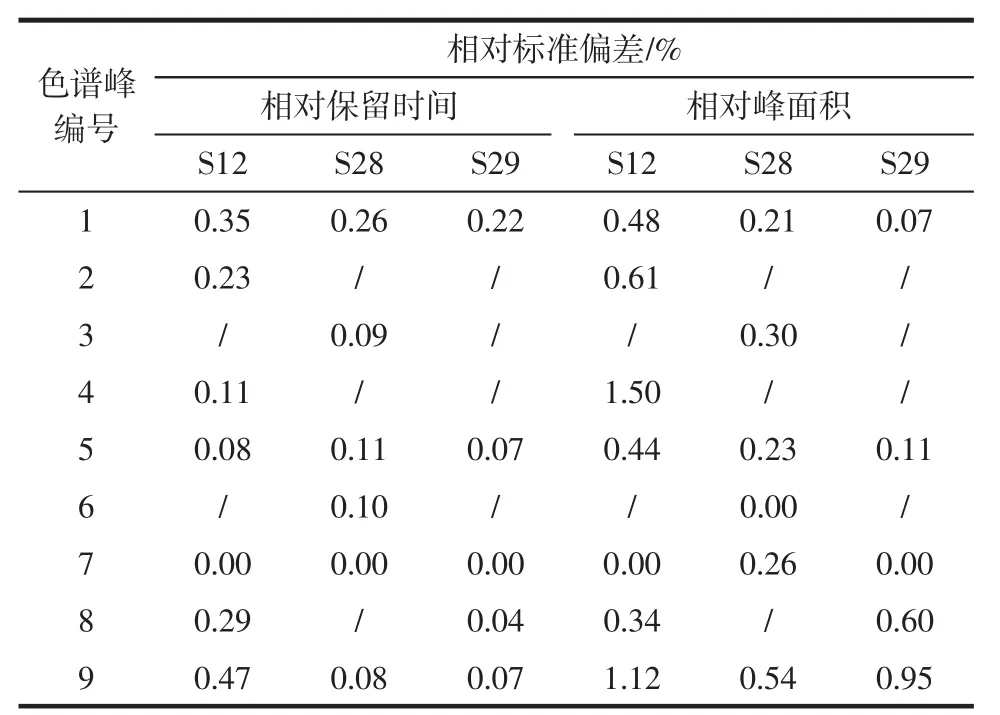
表4 素花党参(S12)、川党参(S28)、党参(S29)重复性试验相对保留时间、相对峰面积Table 4 Relative retention schedule and peak area of replication experiment of Codonopsis pilosula var.mdesta(S12),C.tangshen(S28)and Codonopsis pilosula(S29)
由表4可知,各共有峰的相对保留时间、相对峰面积RSD均小于3%(n=6),表明检测方法重复性良好。
2.2 相似度分析
2.2.1 素花党参、川党参和党参相似度分析
采用中位数法,以S12为参照谱,生成素花党参对照指纹图谱;以S28为参照谱,生成川党参对照指纹图谱,以S29为参照谱,生成党参对照指纹图谱。素花党参对照指纹图谱中确定7个特征峰,生成素花党参特征图谱。川党参对照指纹图谱中确定6个特征峰,生成川党参特征图谱。党参对照指纹图谱中确定5个特征峰,生成党参特征图谱,具体结果见图1。
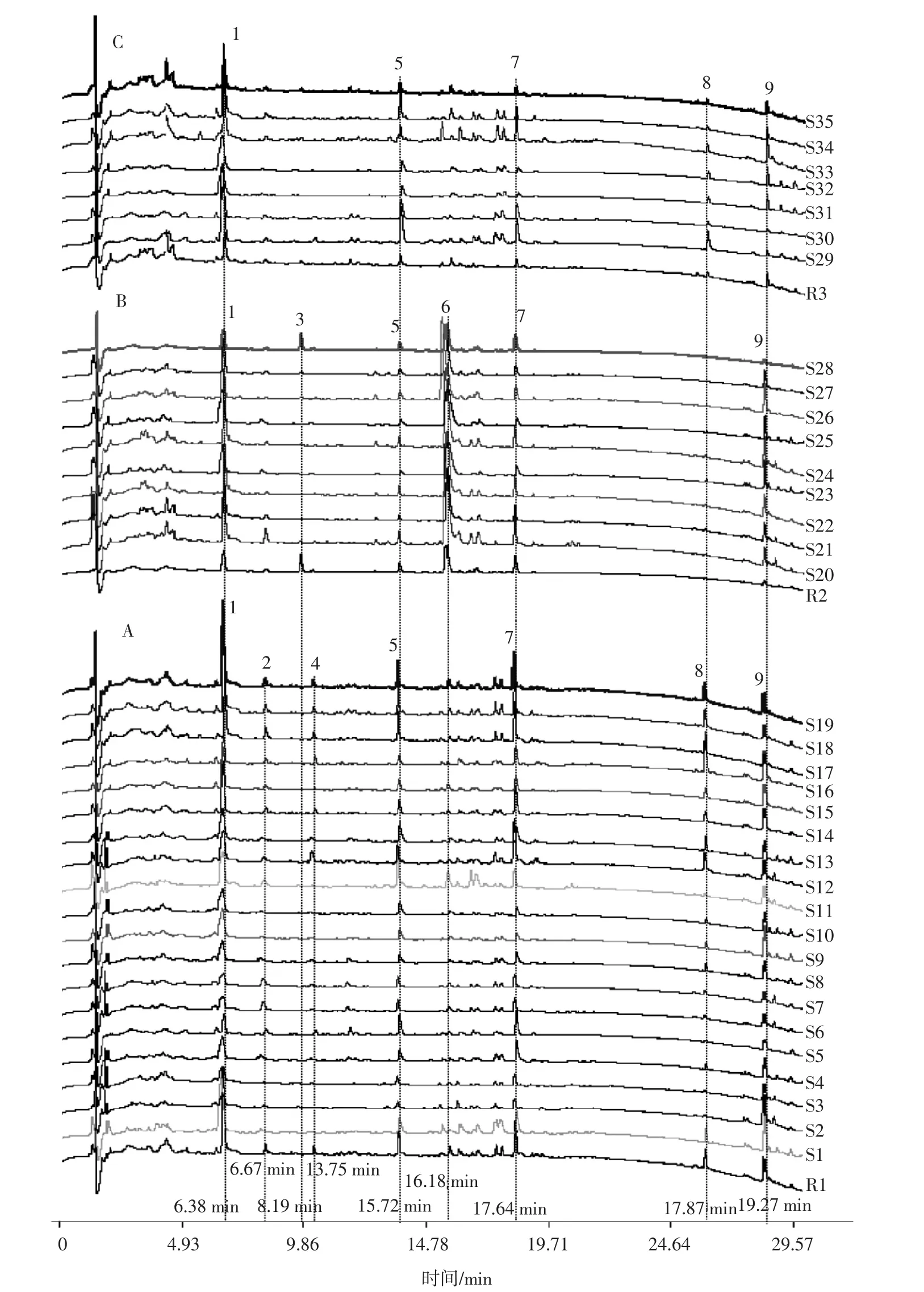
图1 相似度分析图谱Fig.1 Similarity analysis atlas
以S12为参照谱,对35批党参样品的指纹图谱进行相似度分析,结果见表5。

表5 35批样品相似度分析结果Table 5 Similarity analysis results of 35 batches of samples

续表5 35批样品相似度分析结果Continue table 5 Similarity analysis results of 35 batches of samples
由表5可知,3种党参整体相似度在0.35~0.85,35批样品相似度差异较大,说明3种党参指纹图谱之间差异较大,有必要分别对其进行相似度分析。
2.2.2 素花党参(C.pilosula.var.modesta)相似度分析
以S12为参照谱,对19批党参样品色谱图进行相似度分析,19批素花党参整体相似度范围在0.36~0.87,存在较大种间差异,原因可能是19批样品产自不同产地[18]。甘肃省文县的素花党参(S1、S2),甘肃省渭源县不同村落的白条党参(S4~S10),指纹相似度均在0.6~0.7之间,证明产自同一产区指纹相似度较高;样品S13和S14产自同一党参实验基地,使用壮根灵的14号样品相似度(0.65)较未使用壮根灵13号样品相似度(0.52)高,说明使用壮根灵对党参的生长有促进作用。
鉴于19批素花党参批间一致性较差,因此对19批素花党参进行批间主成分分析,19批样品的偏最小二乘法判别分析(partial least squares discrimination analysis,PLS-DA)见图 2。
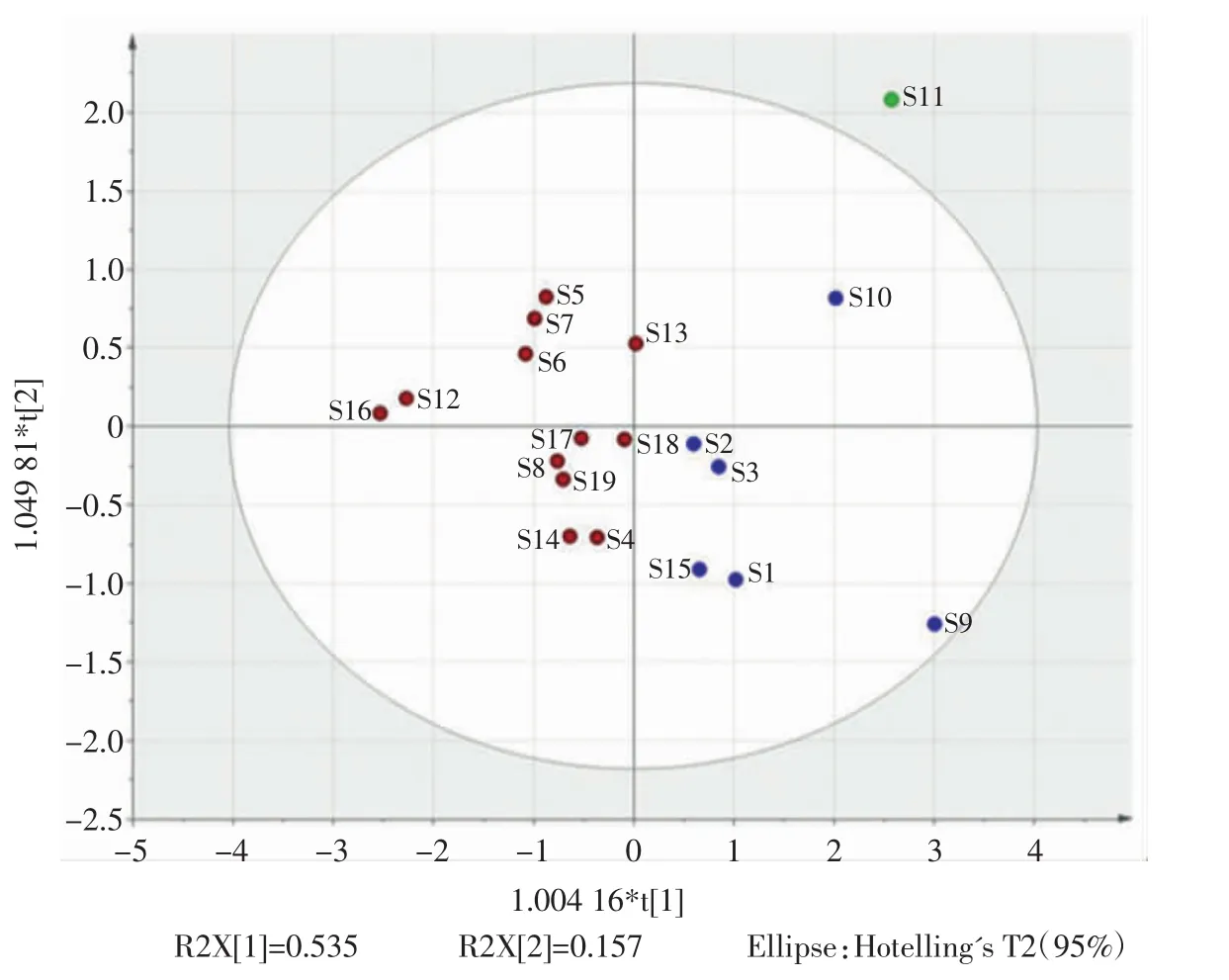
图2 素花党参样品主成分分析PLS-DA图Fig.2 Principal component analysis(PLS-DA)of Codonopsis pilosula var.mdesta
由图2可知,19批素花党参主要被分为3组,产自贵州省遵义市阳溪镇的S11样品进行了单独分类,其余的样品分居Y轴两侧,较密集区域多产自甘肃省渭源县党参十里镇示范园试验田及农民专业合作社;也有产自甘肃省渭源县不同村落的白条党,如S5、S6、S7、S8,说明素花党参也存在组内差异,这是造成素花党参间整体相似度不高的主要原因。
2.2.3 川党参(C.tangshen)相似度分析
以S20为参照谱,对9批川党参色谱图进行相似度分析,9批川党参的整体相似度不高,取值在0.47~0.80。S20~S24产自湖北省恩施板桥镇的不同村落,S25、S26分别为来自重庆巫山的庙党,其中S25为主根,S26为须根,二者在7号峰的含量上存在差异,须根(S26)为主根(S25)的两倍左右,说明此物质多集中于须根生长;S27、S28分别为产自湖北省恩施市的精装白条党参和精装毛条党参;其中3号峰为S28独有,含量约为0.12 mg/g,较其他色谱峰含量适中。川党参的另一个特点是苍术内酯III的含量较素花党参低,生长年限4~5年的川党参几乎不含苍术内酯III,只有生长年限为2年的样品S23含有极少的苍术内酯III(低于千分之一),这说明苍术内酯III不是川党的特征峰,含量与生长年限也有一定的相关性,生长年限越久,苍术内酯III含量越低。
相似度分析结果表明:川党作为党参基源的一种党参,与其他品种党参区别明显,有必要对其分别进行质量控制。所建立的特征图谱对其具有鉴别意义[19]。
图3为9批川党参成分的主成分分析。
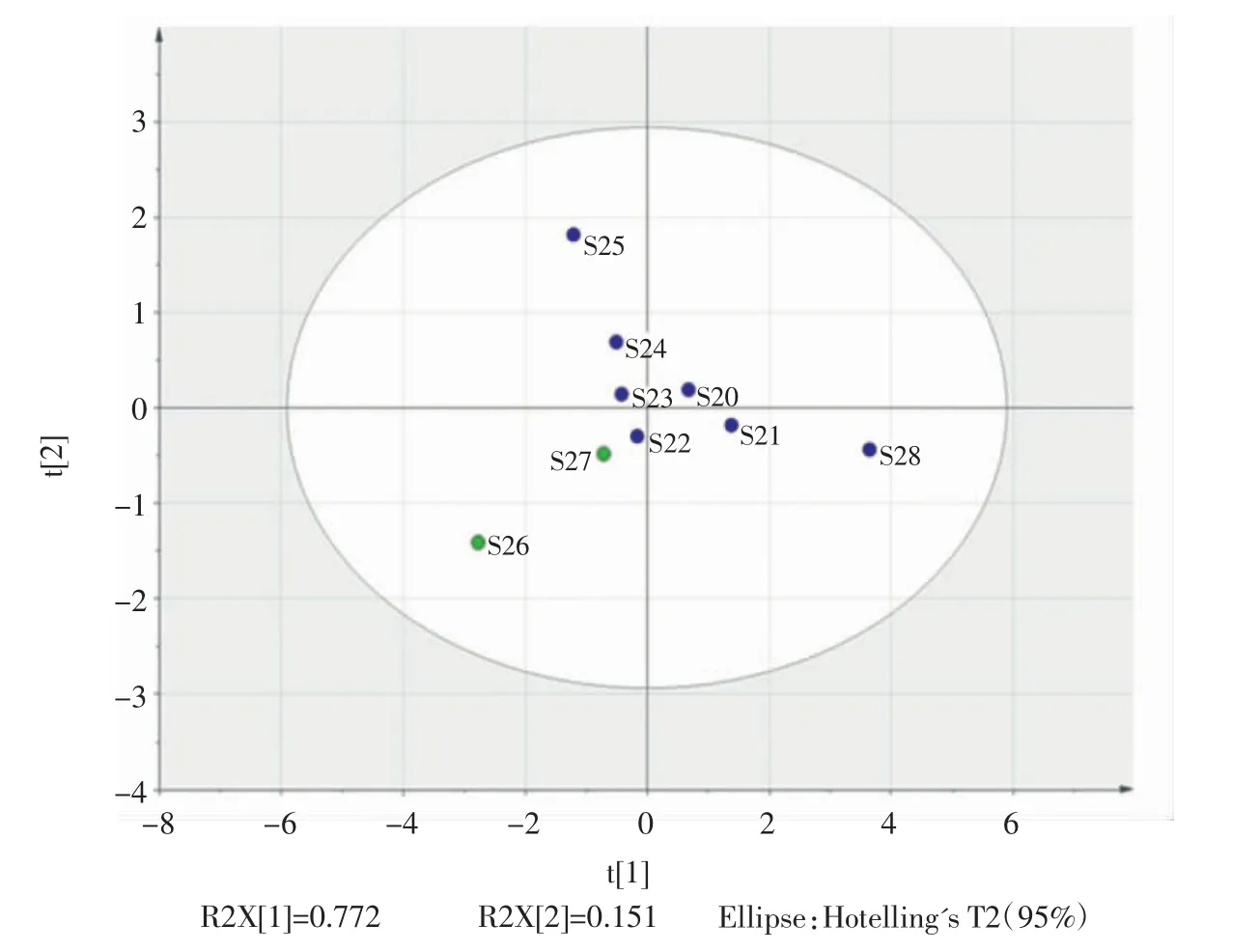
图3 川党参样品主成分分析PLS-DA图Fig.3 Principal component analysis(PLS-DA)of C.tangshen
由图3可知,9批川党参被聚为2类,其中样品S26为产自重庆巫山的庙党,S27为湖北恩施的精装白条党,其余批次主要来自湖北恩施的板党,一致性较好,被聚为一组。
2.2.4 党参(C.pilosula)相似度分析
以S29为参照谱,对7批党参进行相似度分析,7批党参的整体相似度不高,取值在0.48~0.79。样品S29~S32产自同一产地,S29和S30为对照,未施农药S29苍术内酯III的含量超过施过农药S30的3倍,推测农药的使用对苍术内酯III的含量也有一定的影响,农药的使用量越大,苍术内酯III的含量越低。S33为野生党参,此样品色谱信息最为丰富,因此相似度也最低,仅为 0.48(S29为参照谱)。党参(C.pilosula)指纹图谱与素花党参(C.pilosula.var.modesta)指纹图谱较为相似,主要差异是素花党参存在2号峰和4号峰(丁香苷),并且这两个物质在素花党参中含量也相对较少,因此仅以相似度分析很难区分党参(C.pilosula)和素花党参(C.pilosula.var.modesta),需进一步进行聚类分析和主成分分析[20]。
对7批产自山西省陵川县以及贵州威宁的党参(C.pilosula)进行主成分分析,结果见图4。
由图4可知,样品S33和S35在进行数据分析分析时缺少色谱信息,而未被纳入数据分析中,因此缺少分组信息。可以发现产自山西的这几批党参(C.pilosula)被分为了两类,其中S29和S30为一组对照组,二者一致性较好,其余批次党参(C.pilosula)较离散。

图4 党参样品主成分分析PLS-DA图Fig.4 Principal component analysis(PLS-DA)of Codonopsis pilosula
2.3 主成分分析
以 35批党参(C.pilosula)、素花党参(C.pilosula.var.modesta)、川党参(C.tangshen)样品为研究对象,以党参炔苷为参照峰,将各特征峰相对峰面积作为原始数据矩阵,结果见图5。
由图5A可知,35批样品主要聚为3类,川党参(C.tangshen)均位于 X 轴左侧,而党参(C.pilosula)和素花党参(C.pilosula.var.modesta)均位于X轴右侧,党参(C.pilosula)居Y轴右上方,素花党参(C.pilosula.var.modesta)居 Y 轴右下方;9批川党参(C.tangshen)分布较为紧密,只有28号样品较为离散,究其原因是28号样品有一独特的3号色谱峰,被归到了素花党参(C.pilosula.var.modesta)的区域;素花党参(C.pilosula.var.modesta)较为离散,样品种间差异较大;S16(十里镇)离其余素花党参较远。7批党参(C.pilosula)分布也较为离散,其中33号样品偏离较远,原因在于33号样品是35批中唯一一批野生党参,其1、5、7、9号特征峰较同批次的党参(C.pilosula)含量高;并且色谱保留时间在14 min~20 min的色谱信息非常丰富,这与指纹相似度结果一致。由图5B可知,6号峰、1号峰、5号峰的VIP值均大于1.0。其中,6号峰为川党(C.tangshen)参特征峰,1号峰和5号峰为三者共有峰,这些峰对党参(C.pilosula)、素花党参(C.pilosula.var.modesta)、川党参(C.tangshen)的分类具有显著性。
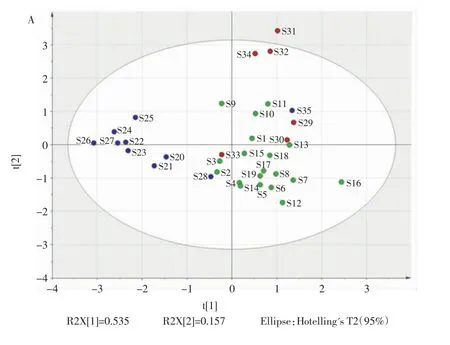

图5 党参样品主成分分析结果Fig.5 Principal component analysis of Codonopsis pilosula
3 结论
本文对我国主要党参产区(甘肃、贵州、山西、湖北、重庆)的不同品种(党参C.pilosula;素花党参C.pilosula var.mdesta;川党参C.tangshen)党参分别建立了3种基源党参的指纹图谱。同时对3种基源党参的相似度进行了研究分析。结果表明,3种基源党参的相似度跨度范围均较大,说明在不同产地的同一品种党参化学成分含量及种类变化较大。主成分分析表明,湖北恩施产川党参分布较为集中,批间一致性较好。而党参和素花党参批间差异较大,这和种植范围广有一定的关系。通过对主要产地和品种党参指纹图谱的分析及比较,为后续选择适宜品种党参作为食品或加工原料时提供一定的理论参考。
