猪流行性腹泻病毒N蛋白单克隆抗体的制备与鉴定
2022-12-07庞俊增李林岳王亚楠范国英李任峰王自良
韩 笑,庞俊增,李林岳,王亚楠,范国英,李任峰,王自良
(河南科技学院动物科技学院,河南新乡 453003)
由猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)引起的猪流行性腹泻(Porcine epidemic diarrhea,PED)是一种急性、高度接触性猪肠道传染病,病猪以呕吐、水样腹泻和脱水为主要特征,新生仔猪的发病率和病死率可达100%[1-2]。PED最早发生于欧洲[3],我国于1984年首次报道,2010年之前以散发为主[4]。自2010年12月开始,PEDV变异毒株在全球多个国家暴发流行,给世界养猪业造成了巨大的经济损失[5]。而且,随着病毒的不断演化,PEDV的防控形势变得越来越严峻[6]。
PEDV属于冠状病毒科(Coronaviridae)冠状病毒属(Coronavirus)成员,是一种直径约为90 nm~120 nm、有囊膜的单股正链RNA病毒[7]。PEDV的基因组长度约为28 kb,至少包含7个开放阅读框,编码4种结构蛋白,分别为纤突蛋白(spike,S)、核衣壳蛋白(nucleocapsid,N)、膜蛋白(membrane,M)和囊膜蛋白(envelope,E),以及3种非结构蛋白(复制酶1a、1b和ORF3)[8-9]。其中,N蛋白为病毒形成螺旋状衣壳提供了结构基础,能够介导细胞免疫。而且,在PEDV感染的早期,猪体内即可检测到高水平的抗N蛋白抗体[10]。因此,N蛋白可以作为PEDV早期检测的重要靶点[11]。本研究开展了PEDV N蛋白的抗原表位分析,研制了基于N蛋白抗原表位的单克隆抗体,为研究N蛋白的生物学功能以及建立PEDV免疫学检测方法奠定了基础。
1 材料与方法
1.1 材料
1.1.1 细胞系、实验动物 骨髓瘤细胞(NS0)由河南科技学院动物病毒病防控重点实验室保存;雌性Balb/c小鼠,购自郑州大学医学院实验动物中心。
1.1.2 主要试剂 弗氏完全佐剂、弗氏不完全佐剂、牛血清白蛋白(bovine serum albumin,BSA)、钥孔血蓝蛋白(keyhole limpet hemocyanin,KLH)、3,3′,5,5′四甲基联苯胺(3,3′,5,5′-tetramethylbenzidine,TMB)显色底物缓冲液、聚乙二醇1500融合剂(polyethylene glycol 1500,PEG1500)、次黄嘌呤-氨基蝶呤-胸苷培养基添加剂(hypoxanthine-aminopterin-thymidine,HAT)、次黄嘌呤和胸腺嘧啶核苷混合物培养基添加剂(hypoxanthine & thymidine,HT),美国Sigma-Aldrich公司产品;RPMI-1640培养基,北京索莱宝公司产品;胎牛血清,美国BI公司产品;辣根过氧化物酶标记的羊抗小鼠IgG(goat anti mouse IgG-horseradish peroxidase,GaMIgG-HRP)、山羊抗小鼠IgG-异硫氰酸荧光素结合物(goat anti mouse IgG-fluorescein isothiocyanate,GaMIgG-FITC)、单克隆抗体亚类鉴定试剂盒,北京中杉金桥公司产品。
1.1.3 主要仪器 MK3酶标仪,美国Thermo公司产品;TI-DH光学显微镜,日本Nikon公司产品;Galaxy S+型CO2细胞培养箱,Biotech公司产品。
1.2 方法
1.2.1 PEDV N蛋白B细胞表位的生物信息学分析 从NCBI蛋白质数据库中获得PEDV(CH/HNQX-3/14,GenBank登录号:KR095279)N蛋白的氨基酸序列。采用DNA Star Protean软件并结合IEDB(http://www.tools.ideb.org.main/)在线工具对N蛋白的亲水性(hydrophilicity)、抗原性(antigenicity)、表面可及性(surface accessibility)、二级结构等进行分析,将可信度较高的氨基酸片段确定为PEDVN蛋白的优势B细胞表位[12-13]。多肽合成由上海吉尔生物公司在ABI 433型多肽合成仪上完成。
1.2.2 小鼠免疫 将人工合成的表位多肽与KLH偶联制备免疫原,并与弗氏完全佐剂乳化后,以0.02 mg/只的剂量皮下多点注射6周龄~8周龄雌性Balb/c小鼠。间隔3周,用弗氏不完全佐剂乳化相同剂量的免疫原进行加强免疫。第3次免疫后7 d断尾采血获得每只小鼠的多抗血清。用间接酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)检测抗表位多肽抗体滴度。选择抗体滴度最高的小鼠,在细胞融合前3 d尾静脉注射0.1 mg不含弗氏佐剂的免疫原进行加强免疫。
1.2.3 细胞融合 参考Kohler和Milstein建立的细胞融合技术[14]。选用PEG1500作为促融剂,以1∶5的比例将状态良好的骨髓瘤细胞NS0与小鼠脾脏中的B细胞融合。融合细胞悬浮在预热的HAT培养基中,接种于96孔板,并在37 ℃、体积分数为5%的CO2培养箱中培养。每天检查细胞生长和集落形成情况。待集落长到孔底面积的二分之一左右时,通过间接ELISA测定其上清液中抗体滴度。选取抗体分泌水平较高的阳性细胞株,采用有限稀释法进行亚克隆,筛选能够稳定分泌单克隆抗体的阳性杂交瘤细胞株。
1.2.4 间接酶联免疫吸附试验筛选抗体 将合成的表位多肽与鸡卵白蛋白(ovalbumin,OVA)偶联后用碳酸盐缓冲液(carbonate buffer solution,CBS)稀释至2 μg/mL,加入到96孔酶标板(50 μL/孔),4 ℃过夜,用洗涤液[含有0.5 mL/L吐温-20的磷酸盐缓冲液(phosphate buffered solution,PBST)]洗板5次,每孔加入150 μL 30 mg/mL BSA置于37 ℃封闭1 h,用PBST洗板5次,每孔加入50 μL细胞上清或腹水,同时设立无抗体阴性对照孔,37 ℃孵育30 min。PBST洗板5次后,加入1∶5 000稀释的辣根过氧化物酶标记的羊抗小鼠IgG,37 ℃孵育30 min,PBST洗板5次,每孔加入50 μL TMB底物显色液,室温避光显色5 min,加入50 μL浓度为2 mol/L的硫酸终止液,利用酶标仪在450 nm下测定吸光值。
1.2.5 免疫荧光分析 待96孔培养板中的单层Vero细胞长至70%左右,以每孔10 μL的剂量接种PEDV,37 ℃孵育40 min后加入200μL含20 mL/L胎牛血清的DMEM维持液。在感染病毒48 h后,弃去培养上清,用PBS洗涤5遍,然后用40 mg/mL多聚甲醛室温固定15 min,PBS洗5遍后,每孔加入50 μL 10 mL/L triton X-100室温孵育15 min,加入30 mg/mL的BSA溶液室温封闭1 h。用PBS洗涤后加入阳性杂交瘤细胞上清,37 ℃孵育1 h,PBS洗涤5次,避光加入1∶200 PBS稀释的GaMIgG-FITC结合物,37 ℃孵育40 min,PBS洗涤5次,于荧光显微镜下观察。
1.2.6 小鼠腹水的制备 采用体内诱导腹水法生产PEDV单克隆抗体[15]。取8周龄~10周龄的雌性Balb/c小鼠腹腔注射0.5 mL无菌石蜡油,7 d后腹腔注射杂交瘤细胞(约2×106/只)。待小鼠腹部隆起,收集腹水并在4 ℃下以10 000 r/min离心30 min去除油脂,通过辛酸硫酸铵沉淀法纯化抗体。
1.2.7 抗体稳定性及亚类鉴定 杂交瘤细胞株经过6次冻存、复苏传代,使用1.2.4 ELISA方法检测不同批次细胞上清抗体OD值,以确定杂交瘤细胞的稳定性。用小鼠单克隆抗体亚类鉴定试剂盒鉴定单克隆抗体的亚类和型。操作如下:首先将50 μL/孔2 000倍稀释的单克隆抗体添加到酶标板中,37 ℃孵育15 min。PBST洗涤5次后,每孔加入50 μL HRP标记的羊抗鼠IgG1、IgG2a、IgG2b、IgG3和κ链、λ链抗体,并在37 ℃孵育25 min,根据上述ELISA方法确定单克隆抗体的亚类和型。
1.2.8 抗体亲和力分析 用Batty饱和法测定单抗的亲和常数K(aff)[16]。将1 μg/mL和2 μg/mL的抗原分别包被于96孔板中,将抗体倍比稀释,采用1.2.4间接ELISA法测定吸光值。以抗体浓度作为横坐标,吸光值为纵坐标,绘制相应曲线。亲和常数K(aff)通过公式K(aff)=(n-1)/2(n[Ab']t-[Ab]t)计算,其中n=[Ag]t/[Ag']t,[Ag]t和[Ag']t分别表示不同抗原浓度,[Ab]t和[Ab']t分别表示不同浓度抗原对应的抗体浓度。
2 结果
2.1 PEDV N蛋白B细胞表位预测分析
利用DNA Star软件中的Protean对N蛋白的亲水性、柔韧性、抗原性指数和表面可及性进行分析,结合N蛋白二级结构分析结果,选取综合得分最高的区域作为候选表位,最终确定PEDVN蛋白的B细胞优势表位为40-53 aa(PTNKGNKDQQIGYW)的肽段,将该表位命名为EP001(表1)。
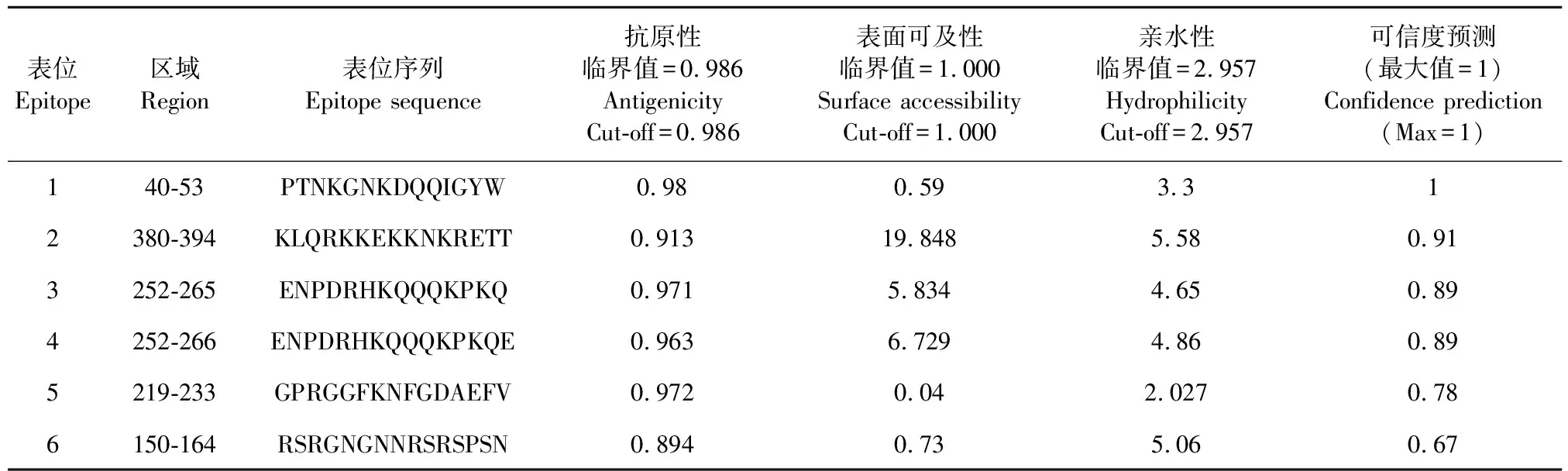
表1 PEDV N蛋白表位分析结果
2.2 小鼠血清抗体效价测定
将表位多肽EP001与KLH偶联作为免疫原,乳化后免疫接种小鼠,通过间接ELISA方法检测小鼠血清效价。如图1所示,4只小鼠产生的抗体效价均达到1∶1.28×104以上,其中3号小鼠的抗体效价相对较高,选择3号小鼠用于细胞融合。

图1 小鼠血清抗体效价检测结果
2.3 细胞上清液和腹水中抗体水平的测定
细胞融合10 d左右观察杂交瘤细胞克隆的生长情况,本研究中细胞融合率为85.16%。用有限稀释法对生长良好、抗体水平较高的细胞株进行3次亚克隆,筛选出杂交瘤细胞株9C4。通过间接ELISA检测杂交瘤细胞分泌抗体水平,9C4培养上清和腹水效价分别为3.2×102和5.12×104。
2.4 免疫荧光分析
将PEDV接种于铺有Vero细胞的96孔板中,48 h后进行免疫荧光分析。将杂交瘤细胞上清作为第一抗体,使用GaMIgG-FITC结合物作为第二抗体,结果显示,9C4细胞株分泌的抗体与PEDV反应显示明显的绿色荧光,与未感染PEDV的Vero细胞无荧光信号,表明单克隆抗体9C4能够与PEDV发生特异性反应(图2)。

A.9C4与感染PEDV的Vero细胞产生荧光信号;B.9C4与未感染PEDV的Vero细胞无荧光信号
2.5 杂交瘤细胞株稳定性和亚类的鉴定
将杂交瘤细胞株9C4经过6次冻存、复苏,测得的OD值均在1.6左右(图3),表明该杂交瘤细胞株分泌单克隆抗体的能力具有良好的遗传稳定性。此外,对抗体的亚类及型分析结果显示,该细胞株产生的抗体为IgG2b亚类,轻链为κ型(图4)。

图3 9C4单克隆抗体稳定性测定

图4 9C4单克隆抗体亚类和型的鉴定
2.6 腹水单克隆抗体亲和力测定
采用间接ELISA测定腹水单克隆抗体(9C4)的亲和力。结果显示,该抗体与抗原结合达到50%饱和所需的浓度为0.32 μg/mL。计算该抗体的相对亲和力指数为1.88×107(moL/L),表明其具有较好的亲和性(图5)。

图5 9C4单克隆抗体亲和常数分析
3 讨论
单克隆抗体在PEDV的检测和治疗方面发挥重要作用,其制备方法在不断发展和进步。传统上采用PEDV全病毒作为免疫原研制其单克隆抗体。如丁壮等[17]将纯化的PEDV免疫接种小鼠制备出PEDV特异性单克隆抗体,但PEDV分离困难,培养周期长,纯化工艺复杂,大多数实验室难以应用。随着分子生物学技术的发展,采用重组蛋白作为抗原制备单克隆抗体的技术逐渐成熟,主要包括原核表达系统和真核表达系统。其抗原制备具有成本低,耗时短的特点。但该技术目前仍存在表达蛋白稳定性差、易受表达系统影响以及蛋白纯化困难等问题。相比于传统抗体分子,纳米抗体稳定性好,与抗原结合力强,免疫原性低。王天宇等[18]用原核表达、纯化PEDV S1蛋白,免疫双峰驼后,通过构建噬菌体抗体展示文库,成功筛选出能与PEDV发生特异性结合的纳米抗体。纳米抗体在PEDV的检测、治疗以及致病机制研究方面具有广阔的应用前景[19]。
采用生物信息学方法分析病毒抗原表位,并利用合成表位多肽制备抗体已经成为当前研制病毒抗体的重要方法[20]。其中,筛选最佳表位多肽是制备抗体的关键。汪伟等[21]以人工合成猪圆环病毒2型(Porcine circovirus virus type 2,PCV2)Cap蛋白表位多肽作为抗原免疫Balb/c小鼠,利用淋巴细胞瘤杂交技术获得了1株稳定分泌抗PCV2 Cap蛋白的杂交瘤细胞株。Wang A P等[22]设计了基于非洲猪瘟病毒(African swine fever virus,ASFV)p54蛋白N末端结构域多肽,将其与BSA偶联后作为免疫原,筛选出6株能与p54蛋白结合的单克隆抗体,其中5株能与HLJ/18毒株发生特异性反应,并阐明了位于表位中的5FFQPV9为结合抗体的核心位点。以上研究表明基于合成表位制备单克隆抗体是可行的,随着计算机信息技术和人工智能算法的发展,抗原表位预测的准确性将大大提高,基于合成表位的抗体制备技术将成为未来研制克隆抗体的重要途径。
本研究采用生物信息学工具分析PEDV N蛋白的抗原表位,将合成表位多肽和载体蛋白KLH偶联制备免疫原。采用杂交瘤技术筛选出1株稳定分泌PEDV抗体的杂交瘤细胞株,为下一步建立PEDV免疫学检测方法奠定了基础。
